1株产纤维素酶细菌的内切-β-葡聚糖苷酶的分离纯化及其酶学性质
郭建华, 蒋海娇, 郭宏文, 邹东恢, 王 燕
(齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006)
纤维素酶在饲料工业、食品工业、洗涤工业及纺织工业中具有广泛的利用前景。大多数细菌所产纤维素酶与真菌来源的酶性质不同,某些方面具有真菌酶不可替代的作用,因此细菌纤维素酶在工业生产中的地位逐渐提高。其中,产纤维素酶的芽孢杆菌逐渐成为近年研究热点。自1960年来,对纤维素酶的分离纯化开展了广泛的科学探索。微生物所产纤维素酶是由多种酶组分组成的复杂酶系统,将酶从系统中分离纯化出来是精确研究它们的前提。酶的分离纯化技术有多种,一是可根据蛋白质热稳定性差异进行分离纯化;二是利用酶蛋白溶解特性的不同进行分离纯化,可利用盐分级沉淀或利用双水相体系进行分离纯化,如Liu等利用响应面法优化了双水相体系(ATPS)对贝莱斯芽孢杆菌所产的纤维素酶的分离纯化工艺;三是利用电泳和液相色谱技术分离纯化,主要作用是检测酶蛋白的分子量和纯度;四是利用分子筛凝胶色谱、离子交换色谱等色谱层析分离纯化,如江小妹等采用Q-琼脂糖凝胶FF阳离子交换层析和葡聚糖G-100凝胶层析对团头鲂肠道菌株MA35所产的内切型纤维素酶进行分离纯化,酶的比活力由22.3 U/mg提高至 30.6 U/mg。实际研究工作中,一般要采用多种分离技术对纤维素酶进行分离纯化。Clare等利用4 mol/L蔗糖溶液透析、Q-Sepharose FF离子交换色谱和苯基Sepharose CL-4B疏水作用色谱对球形芽孢杆菌CE-3产生的纤维素酶进行纯化,利用SDS-PAGE电泳检测酶的分子质量。王婷婷等利用(NH)SO分级沉淀、DEAE Sepharose Fast Flow阴离子交换层析和Phenyl Sepharose 6 Fast Flow疏水层析,从文蛤(L.)中分离纯化出1种纤维素酶,分离纯化后的纤维素酶比活力达到40.33 U/mg,纯化倍数达13.12。目前为止,在纤维素酶分离纯化方面,存在着纯化倍数较低、回收率低、纯化不完全等问题,同时很多分离纯化技术仅能局限于实验室层面,影响对酶的特性的研究及其应用。针对来源和种类众多的纤维素酶体系的各个组分,研究开发分离纯化手段是提高纯化倍数和提高回收率等问题的关键所在。
本研究以选育得到1株产纤维酶细菌的突变菌株为试验菌株,利用硫酸铵盐析、疏水相互作用色谱、离子交换层析及分子筛凝胶色谱从其发酵液中分离纯化内切--葡聚糖苷酶(CMC酶),测定分离纯化后的酶的纯度、分子量及部分酶学特性,以期为菌株所产纤维素酶的应用提供实验基础。
1 材料与方法
1.1 试验菌株
菌株DM-4,笔者所在实验室从白酒酒醅中选育得到,经鉴定该菌为枯草芽孢杆菌()。试验于2020年6—10月在齐齐哈尔大学食品与生物工程学院实验室进行。
1.2 实验方法
1.2.1 培养基 种子培养基:牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,pH值7.5~7.6,121 ℃下灭菌30 min。
发酵培养基:麸皮(过80目筛)2.54%,蛋白胨0.92%,KHPO0.50%,NaCl 0.50%,硫酸镁0.02%,pH值为6.0~6.5,121 ℃下灭菌30 min。
1.2.2 酶液的制备 将菌株DM-4接种在种子培养基上,置于恒温摇床内,温度37 ℃、转速 180 r/min 条件下培养12 h作为种子。将种子液以5%接种量接种至发酵培养基内,温度37 ℃、转速231 r/min发酵36 h。将发酵液倒入离心管内,于温度4 ℃、转速5 000 r/min条件下离心10 min,得到粗酶液。
1.2.3 内切型--葡聚糖酶(CMC酶)活力的测定 内切型--葡聚糖酶(CMC酶)活力的测定见参考文献[12]。
1.2.4 蛋白质含量的测定 280 nm()光吸收法:利用试验用缓冲溶液将分光光度计调至零;利用分光光度计检测样品在280 nm波长下的吸光度。
或采用Folin-酚法测定,见参考文献[13]。
1.2.5 内切--葡聚糖苷酶的分离纯化
1.2.5.1 硫酸铵盐析 将酶液装入8个试管内(每管5 mL),放入冰水浴中,向管内缓慢加入粉末硫酸铵,使硫酸铵饱和度分别为20%、30%、40%、50%、60%、70%、80%和90%。4 ℃放置12 h,离心后测定酶液CMC酶活。
取300 mL离心除去菌体粗酶液,缓缓加入粉末硫酸铵至分级盐析沉淀条件下限,4 ℃放置12 h,离心后测定清液体积。向清液中缓缓加入粉末硫酸铵至分级沉淀条件的上限,4 ℃放置12 h。离心弃上清,将沉淀溶于30 mL 0.1 mol/L柠檬酸0.2 mol/L NaHPO缓冲液(pH值7.0)中。
1.2.5.2 透析脱盐 将透析袋剪成约20 cm长度,放入碳酸氢钠(2%)和EDTA(1 mmol/L)混合溶液中,加热沸腾10 min。清洗干净放入EDTA(1 mmol/L)溶液中加热沸腾10 min,降温后浸在乙醇溶液(20%)中冰箱4 ℃存放。
取1 000 mL烧杯加入蒸馏水,加入搅拌转子,将烧杯放在磁力搅拌器上,把复溶酶液倒入透析袋内,止水夹夹住末端,装进烧杯内在4 ℃低温下进行脱盐。每2 h换水,将BaCl溶液滴入烧杯内,若无沉淀出现,则脱盐过程结束,后利用聚乙二醇(分子量20 000)将酶液浓缩。
1.2.5.3 Sephadex G-25 凝胶色谱分离 通过Sephadex G-25 凝胶色谱层析对盐析并脱盐后的酶液脱色和交换缓冲液。柱型:2.6 cm×30 cm,洗脱液:0.02 mol/L PBS 缓冲液(pH值7.0,硫酸铵饱和度30%);流速:2 mL/min,每管6 mL。检测每个管内液体的吸光度及CMC酶活力,混合具有活性的液体。
1.2.5.4 Phenyl-Sepharose HP 疏水相互作用色谱分离 柱型:2.6 cm×15 cm;起始缓冲液:0.02 mol/L PBS 缓冲液(pH值7.0,硫酸铵饱和度30%);洗脱液:0.02 mol/L PBS缓冲液(pH值为7.0);流速:2 mL/min。上样后起始缓冲溶液恒流洗至吸光度()接近于0,再用起始缓冲溶液和等体积洗脱液进行线性梯度洗脱;每管收集6 mL。检测每个管内液体的吸光度及CMC酶活力,混合具有活性的液体。
1.2.5.5 CM-Sepharose FF 弱阳离子交换色谱分离 将Phenyl-Sepharose HP分离收集的液体透析脱盐,再利用CM-Sepharose FF进一步分离纯化。
吸附pH值的确定:准备6个小烧杯,每个烧杯放入1 mL处理好的CM-Sepharose FF,采用浓度为0.02 mol/L PBS(pH值分别为5.0、5.5、6.0、6.5、7.0和7.5)5 mL漂洗树脂10次,每个烧杯内PBS高出约1 cm,每个烧杯内移入1 mL酶液,混匀,静置约10 min,取上清液检测其残留酶活,计算酶活残留率(%),确定最佳吸附pH值。
柱型:2.6 cm×15 cm;起始缓冲液:0.02 mol/L PBS缓冲液(pH值为5.5、6.0);流速:2.0 mL/min;上样后用起始缓冲液冲洗至接近于0,按照NaCl浓度递增方向采用起始缓冲液和等体积含NaCl 0.8 mol/L(0.5 mol/L)的洗脱液进行梯度洗脱;每管收集6 mL。检测每个管内液体的吸光度及CMC酶活力,混合具有活性的液体。
1.2.5.6 Superdex 75 凝胶色谱分离 将离子交换色谱后处理后的液体,透析脱盐浓缩后通过Superdex 75进一步分离提纯。柱型:Superdex 75 16/60 预装柱;洗脱液:0.02 mol/L PBS缓冲液(0.5 mol/L NaCl,pH值7.0);洗脱液体积:120 mL;流速:1.0 mL/min;每管收集1 mL。检测每个管内液体的吸光度及CMC酶活力,混合具有活性的液体。
1.2.5.7 纯度检测及分子量的测定 利用SDS-PAGE电泳检测酶的纯度。
1.2.6 内切--葡聚糖苷酶酶学特性测定
1.2.6.1 最适作用温度及热稳定性测定 取分离提纯后的酶液稀释后,在温度30、35、40、45、50、55、60、65、70 ℃的水浴条件下测定CMC酶活力。
将上述酶液置于40、50、60、70、80 ℃的水浴中,每隔20 min检测CMC酶活力,计算残留率(%)。
1.2.6.2 最适作用pH值及pH稳定性测定 采用pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5的醋酸-醋酸钠溶液制备羧甲基纤维素钠溶液(1%)作为底物,取纯化后的酶液适当稀释后,检测CMC酶活力。
取纯化后酶液适当稀释后分成6份,分别加入双倍体积的pH值为4.0、5.0、6.0、7.0、8.0及9.0醋酸-醋酸钠溶液,放入40 ℃水浴中,每20 min检测CMC酶活1次,计算残留率(%)。
1.2.6.3 酶的反应动力学常数和的测定 将纯化后酶液利用醋酸-醋酸钠溶液(pH值7.5)稀释30倍,取1 mL加入1 mL采用醋酸-醋酸钠溶液制备不同浓度的CMC-Na溶液(pH值7.5),使酶液进反应时底物浓度分别为10、8、6、4、2 g/L,反应温度和pH值设在最适条件下。每种底物浓度分别于0、5、10、15、20、25 min采用DNS法测定还原糖含量。绘制还原糖含量与时间的变化曲线,进行二次回归求得,利用L-B法作图计算和。
2 结果与讨论
2.1 酶的分离纯化
2.1.1 硫酸铵沉淀 利用不同饱和度硫酸铵进行沉淀试验确定盐析条件,由表1可知,随硫酸铵饱和度增加,上清中残余酶活逐渐降低,当硫酸铵饱和度达70%时,上清液中的残留酶活已降至1.02%。因此,确定硫酸铵的饱和度沉淀区间为20%~70%。沉淀采用缓冲液溶解后,再充分透析脱盐。
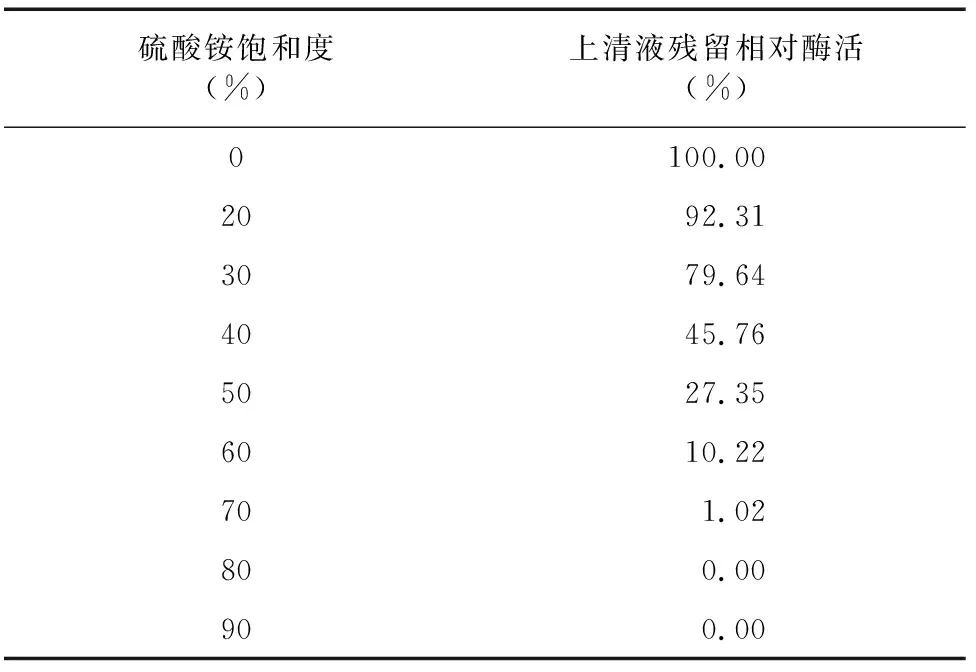
表1 硫酸铵不同饱和度的上清液酶活残留率
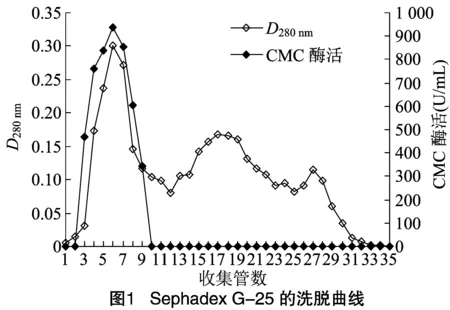
2.1.2 Sephadex G-25凝胶分离 本研究采用分子量范围为100~5 000 u Sephadex G-25,对经20%~70%饱和度硫酸铵处理的酶脱色和初步分离,洗脱曲线。由图1可知,洗脱时CMC酶组分首先被洗脱下来,可推测菌株DM-4所产CMC酶的分子量 > 5 000 u。酶的活性峰和蛋白峰相对应,提示Sephadex G-25凝胶去除色素和分离较小的杂质蛋白效果理想。
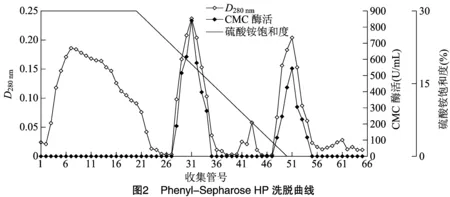
2.1.3 Phenyl-Sepharose HP 疏水相互作用色谱分离结果 经过Sephadex G-25凝胶分离后,收集的活性组分过度到硫酸铵饱和度为30%缓冲体系,进行下一步Phenyl-Sepharose HP分纯。由图2可知,恒洗过程中疏水性较弱的杂质去除了很多。在硫酸铵饱和度线性降低的梯度洗脱过程中分离出2个CMC酶活性组分,命名为CMC酶Ⅰ和CMC酶Ⅱ。CMC酶Ⅰ在梯度洗脱中期被洗脱下来,其活性较高,CMC酶Ⅱ在梯度洗脱结束时被洗脱下来,说明CMC酶Ⅱ 疏水性强于酶Ⅰ。
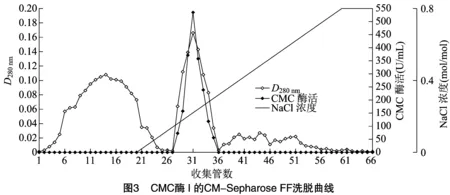
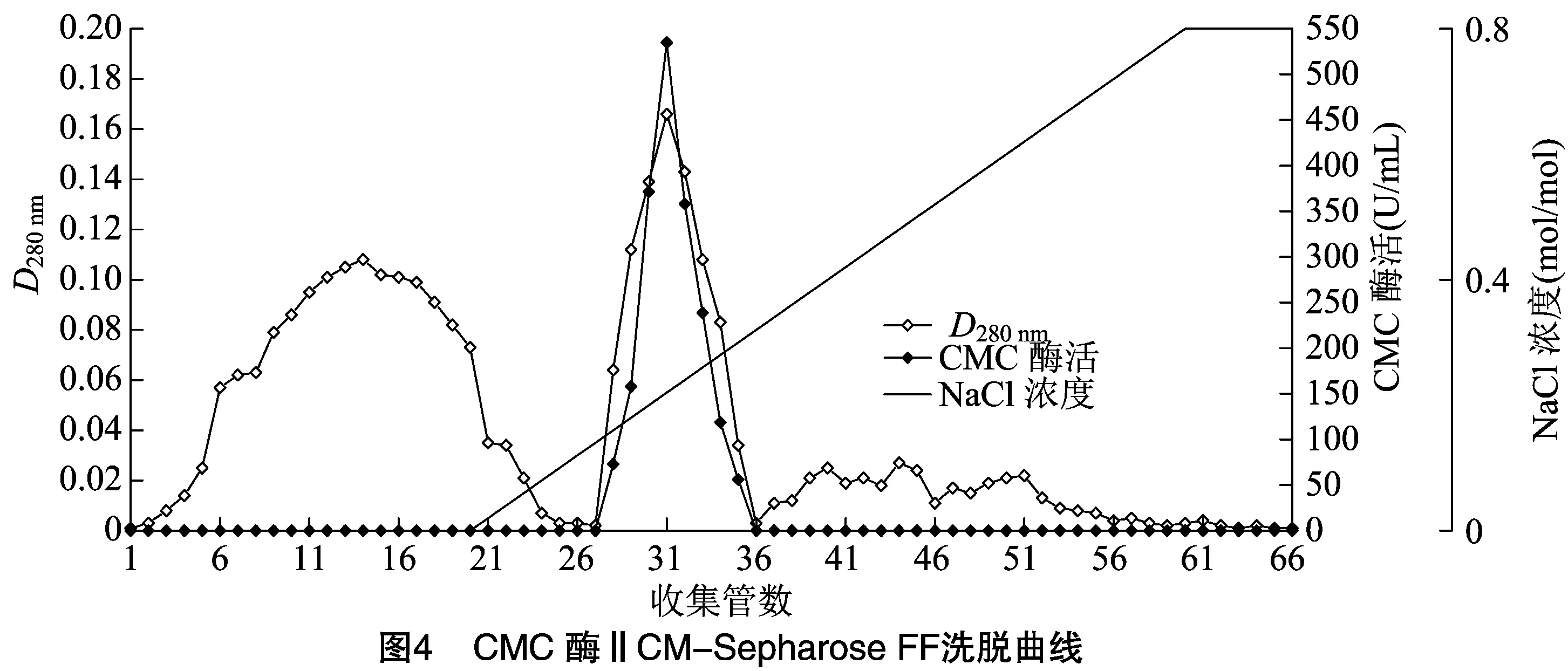
2.1.4 CM-Sepharose FF 弱阳离子交换色谱分离 利用CM-Sepharose FF将经疏水相互作用分纯收集到的CMC酶Ⅰ和CMC酶Ⅱ活性组分再次分纯。由表2、表3可知,CMC酶Ⅰ和CMC酶Ⅱ分别在pH值5.5和pH值6.0时吸附效果最好,因此,起始缓冲液pH值分别确定为pH值5.5和pH值6.0。经多次试验比较后,对CMC酶Ⅰ选择 0.8 mol/L NaCl溶液为洗脱液,对CMC酶Ⅱ选择0.5 mol/L NaCl溶液为洗脱液。
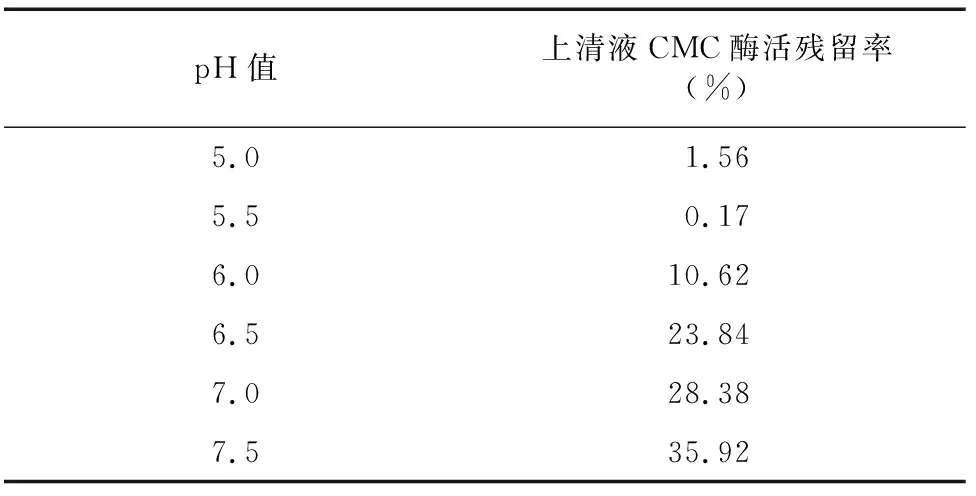
表2 不同pH值缓冲液树脂对CMC酶Ⅰ吸附效果
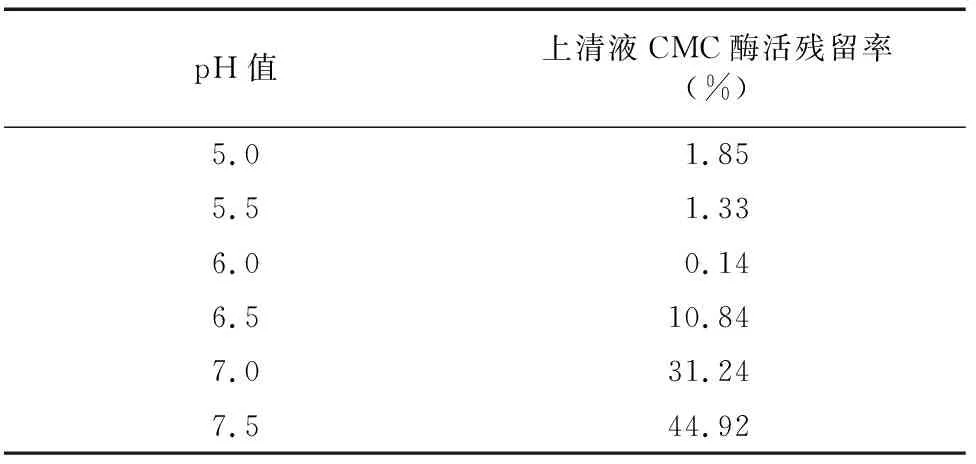
表3 不同pH缓冲液树脂对CMC酶Ⅱ吸附效果
由图3和图4可知,在各自优化条件下,CMC酶Ⅰ和CMC酶Ⅱ均能很好地与填料结合,在恒洗阶段,活性组分未被洗脱,而杂蛋白在恒洗阶段被大量洗脱。梯度洗脱时酶活性组分被洗脱下来,并且酶活性峰与蛋白峰基本对应。
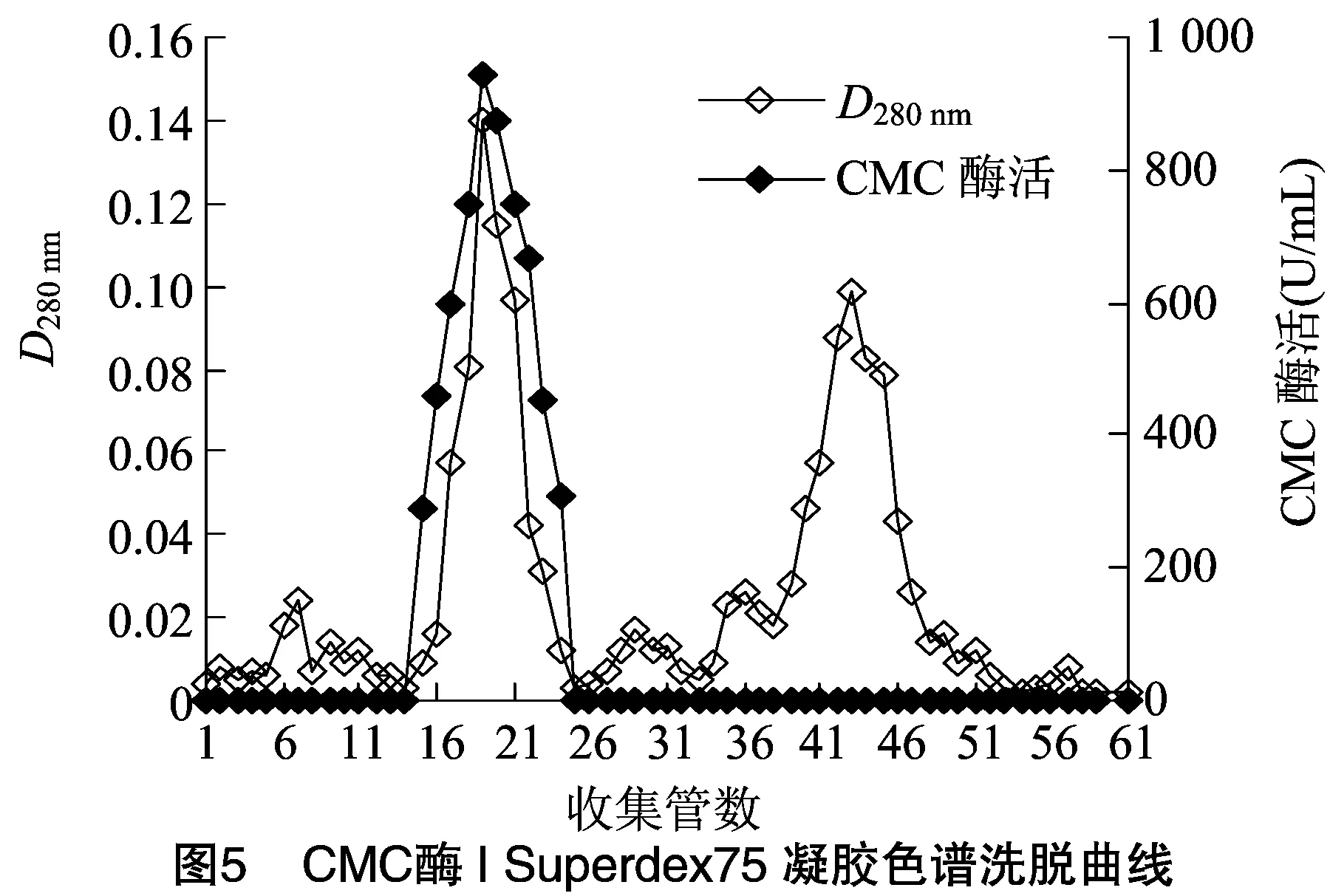
2.1.5 Superdex 75凝胶过滤色谱分离 将CMC酶Ⅰ和CMC酶Ⅱ活性组分脱盐浓缩后,进行Superdex 75分离。由图5、图6可知,在洗脱过程CMC酶蛋白峰与其他蛋白峰分开,并且与活性峰完全对应, 说明CMC酶Ⅰ和CMC酶Ⅱ均已达比较理想的纯化效果,分别将CMC酶Ⅰ和CMC酶Ⅱ的活性组分收集,-20 ℃保存备用。
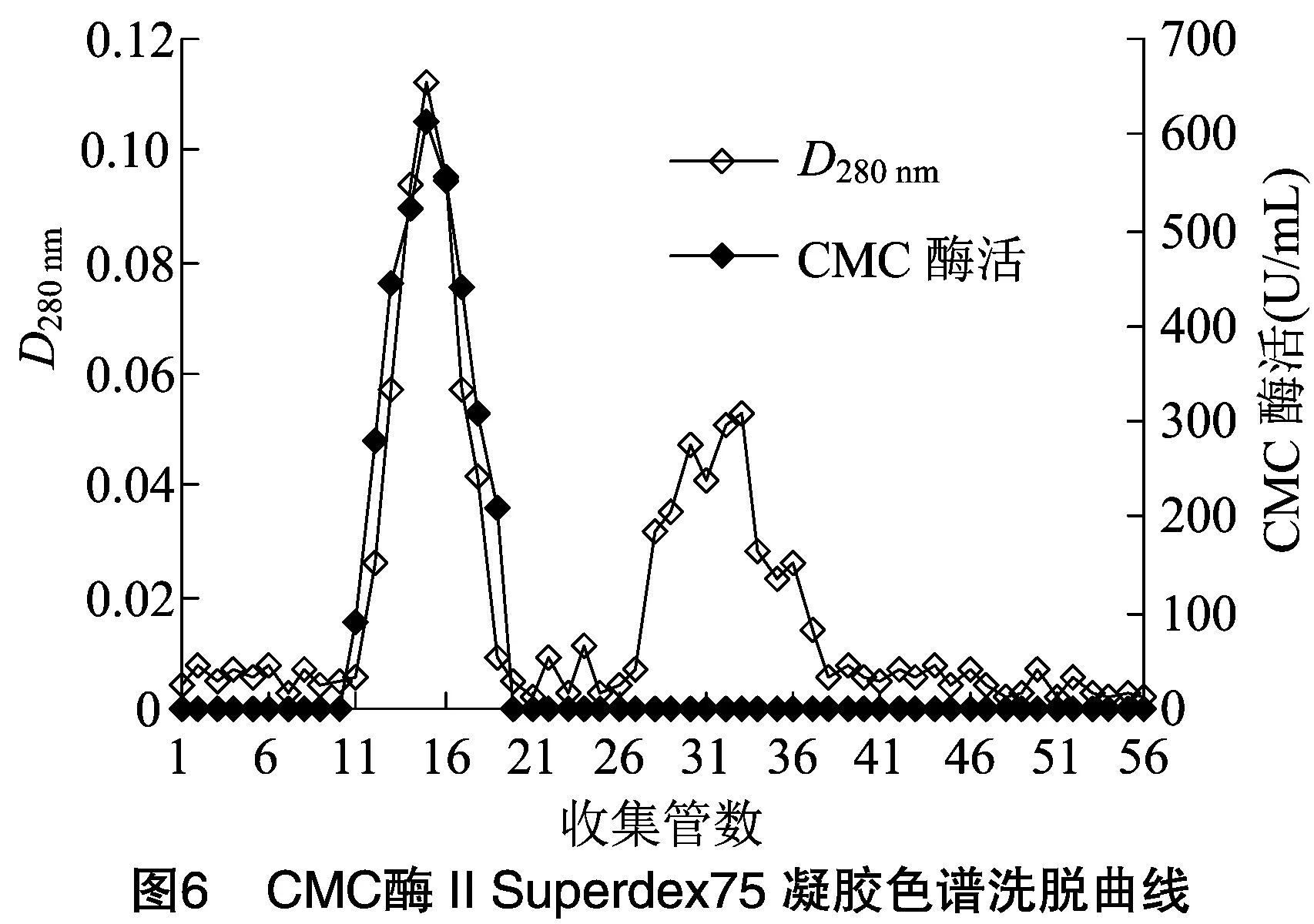
2.1.6 CMC酶Ⅰ和CMC酶Ⅱ分离纯化回收后的结果 由表4、 表5可知, 经Phenyl-Sepharose HP疏水相互作用色谱处理后,CMC酶Ⅰ和CMC酶Ⅱ比活力分别达960.82、717.19 U/mL,纯化倍数为 19.33倍和14.43倍,提示 Phenyl-Sepharose HP疏水相互作用色谱分离是适合用于菌株DM-4所产内切纤维素酶的一种分离手段。经CM-Sepharose FF处理后,纯化倍数进一步提高,最后经过Superdex 75处理后,纯化倍数分别达45.94倍和32.27倍。
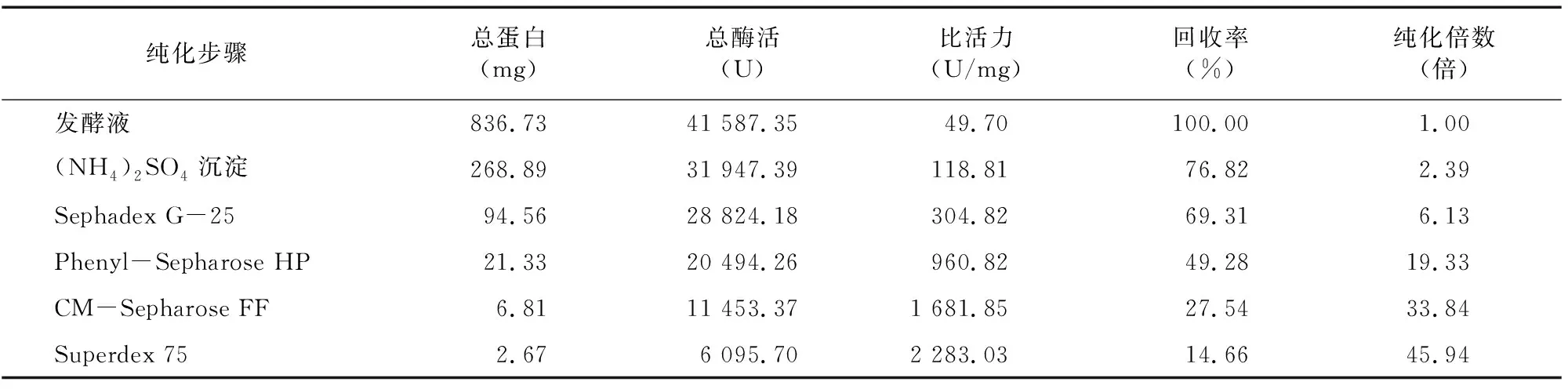
表4 CMC酶Ⅰ纯化结果
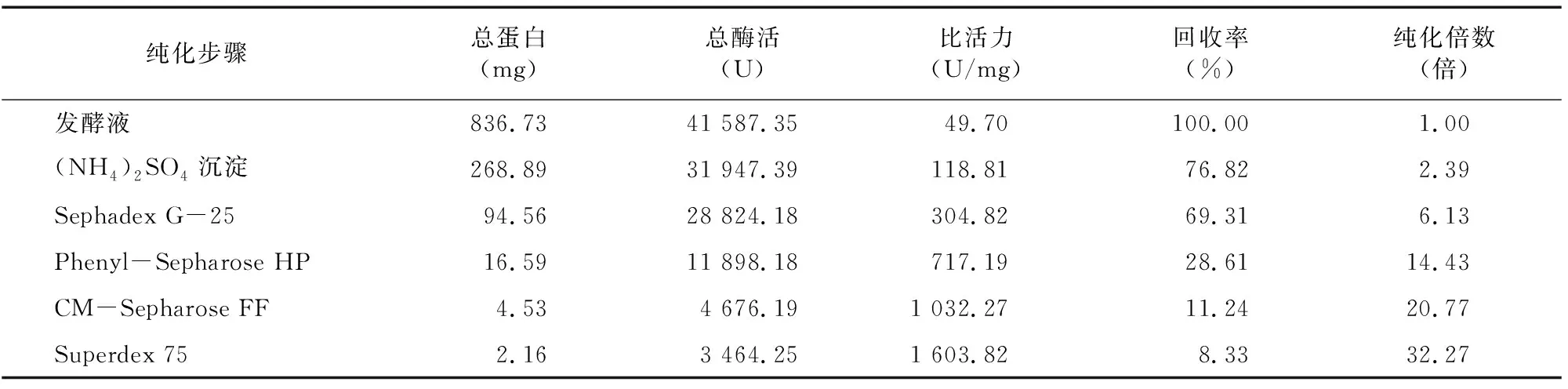
表5 CMC酶Ⅱ纯化结果
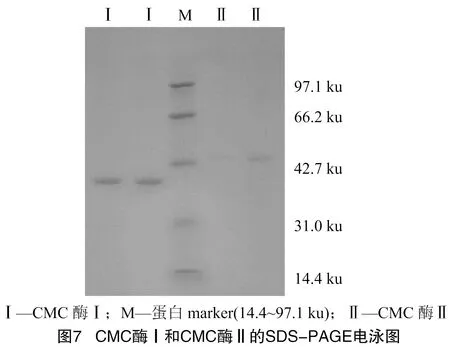
2.1.7 CMC酶纯度检验及分子量检测 利用 SDS-PAGE 电泳检测CMC酶纯度及其相对分子质量,由图7可知,经分离纯化得到CMC酶Ⅰ及CMC酶Ⅱ均已达电泳级别纯度。由图8可知,利用Mark中蛋白分子量的对数和迁移率绘制蛋白分布曲线。根据CMC酶Ⅰ和CMC酶Ⅱ的相对迁移率大小及分布曲线,计算得到CMC酶Ⅰ分子量约38.99 ku,CMC酶Ⅱ分子量约45.53 ku。
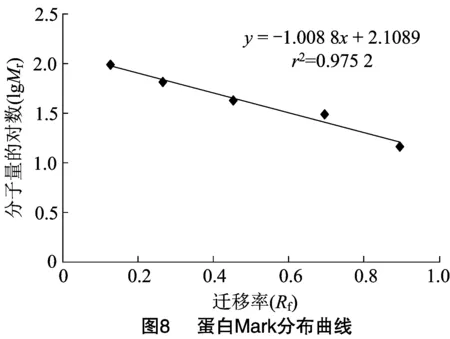
这与其他学者分离纯化出的细菌内切纤维素酶具有一些差别,如Aa等从枯草芽胞杆菌中纯化的CMC酶分子量为70 ku。Allardyce等从某细菌中获得的2种CMC酶分子量分别为53 ku和 52 ku。Yan等从蜡样芽孢杆菌中获得的CMC酶分子量为51.3 ku。Lo等纯化出得活性CMC酶分子量约35.8 ku。Zakaria等从枯草芽胞杆菌菌株KU-1获得的CMC酶分子量为39~40 ku。
2.2 菌株所产内切-β-葡聚糖苷酶的酶学性质
2.2.1 酶最适作用温度及热稳定性检测 将纯化后的CMC酶Ⅰ和CMC酶Ⅱ适当稀释后,于不同温度条件分别检测其活力大小。由图9可知,CMC酶Ⅰ在60 ℃反应条件下表现出最高活力,CMC酶Ⅱ 在55 ℃反应条件下表现出最高活力。
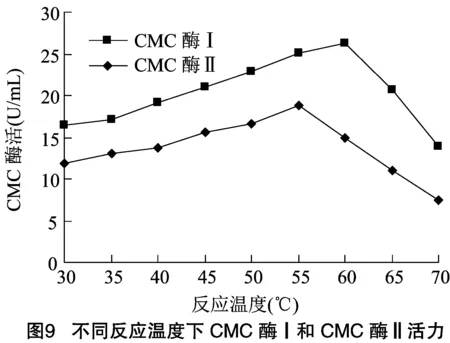
经差异显著性检测,55 ℃与60 ℃时,CMC酶Ⅰ的酶活不具有显著差异(<0.05),55 ℃与其他温度下酶活差异显著(<0.01);CMC酶Ⅱ在55 ℃时酶活与其他温度下均具有显著差异(<0.01)。因此,确定CMC酶Ⅰ最适作用温度范围为55~60 ℃,CMC酶Ⅱ为55 ℃。
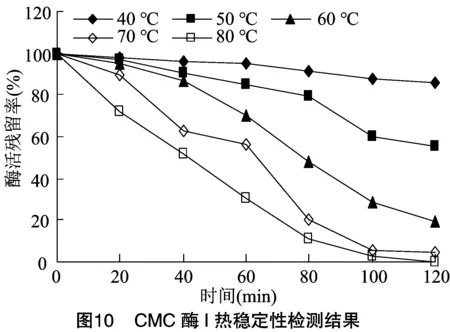
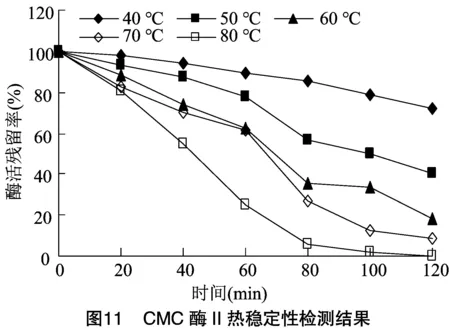
将纯化稀释后的CMC酶Ⅰ和CMC酶Ⅱ分别放置在不同温度水浴中,每20 min取样检测酶活,计算残留率。由图10、图11可知,当温度低于70 ℃时,在60 min前,CMC酶Ⅰ和CMC酶Ⅱ残留率均大于50%,稳定性良好。当温度升高至80 ℃后,随时间延长酶活残留降低很快,直至完全丧失活力,但在80 ℃保温60 min后,仍具有25%以上的残留率,提示CMC酶Ⅰ和CMC酶Ⅱ耐温性较强。本研究所分离的2种纤维素酶的最适温度和耐热性与吴石金等和Xu等获得的CMC酶具有相似性。
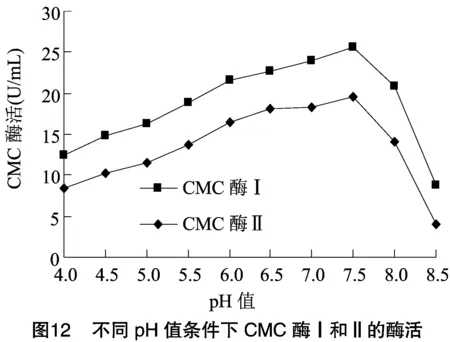
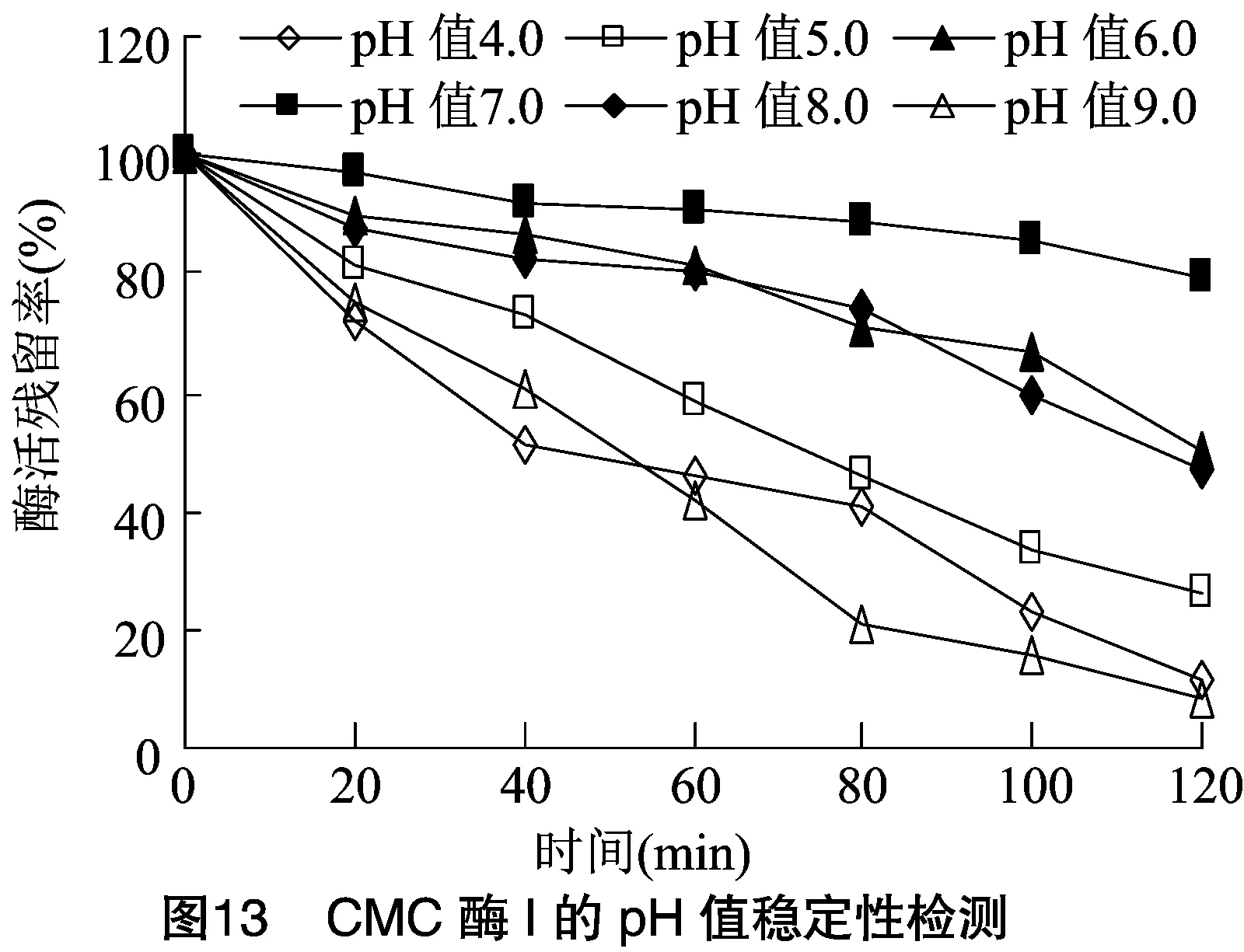
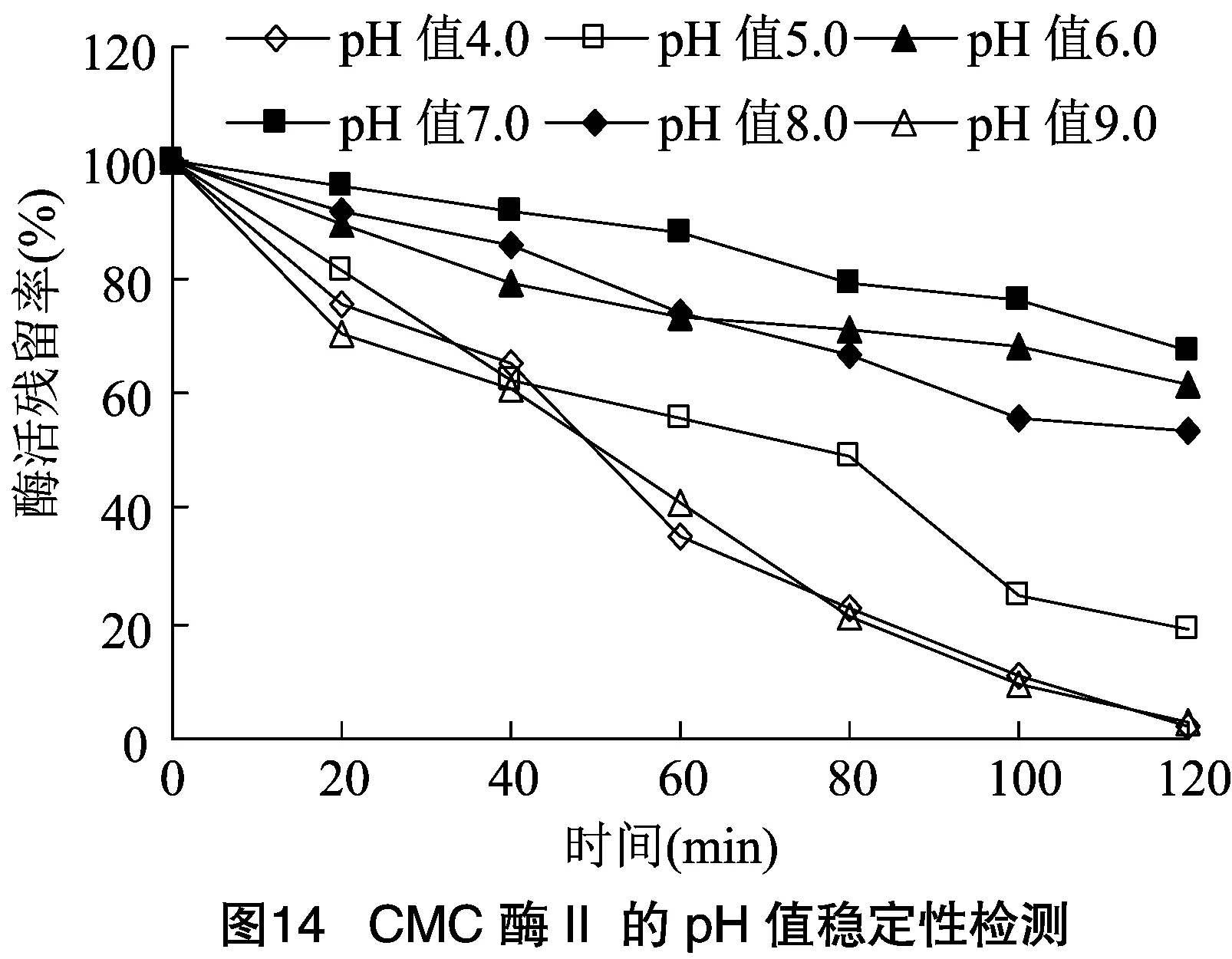
2.2.2 酶的最适作用pH值及酶的pH值稳定性 将分离纯化的CMC酶Ⅰ和CMC酶Ⅱ适当稀释,于不同pH值反应体系中检测酶活力大小。由图12可知,CMC酶Ⅰ和CMC酶Ⅱ在pH值为7.5时均具有最大酶活力,可确定pH值7.5是2种酶最适作用pH值。由图13、图14可知,2种酶在pH值为6.0~8.0范围内均具有良好稳定性,而在其他pH值条件下,酶活下降速度很快,与其他研究者试验结果相似。根据本试验结果可初步确定此次分离的CMC酶为中性纤维素酶。
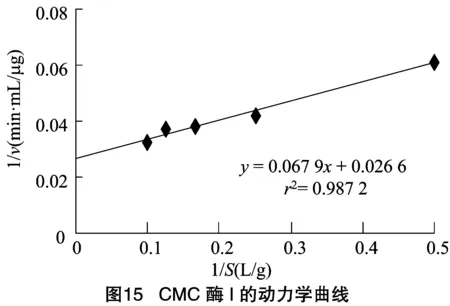
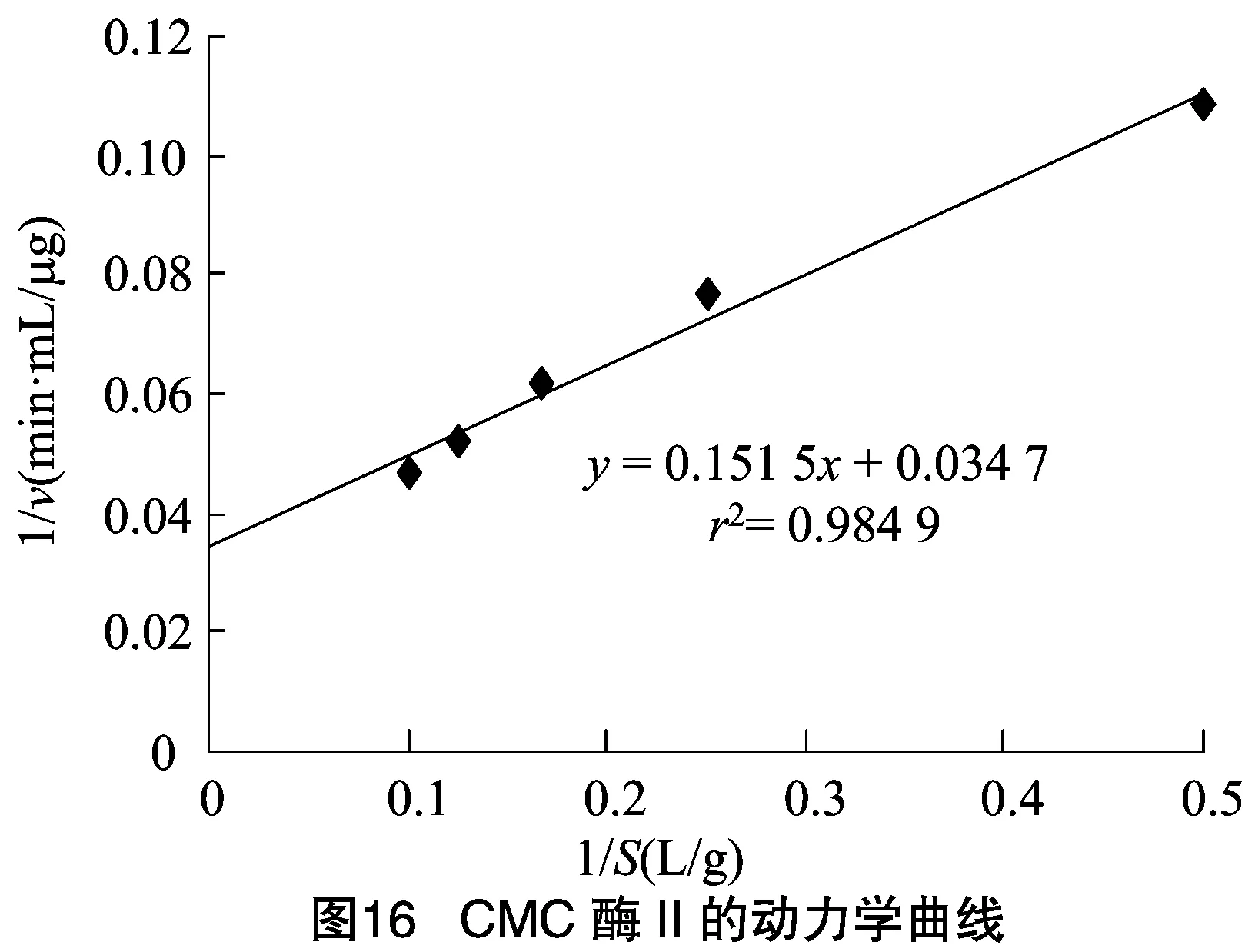
2.2.3 CMC酶的反应动力学常数和的测定 由图15、图16可知,求得CMC酶Ⅰ的米氏常数为2.55 g/L,为37.59 μg/(min·mL)。CMC酶Ⅱ的米氏常数为4.37 g/L,为 28.82 μg/(min·mL)。来源于不同细菌的内切--葡聚糖苷酶的动力学常数常会有些区别,如Au等从枯草芽胞杆菌中得到的CMC酶为4 g/L,为0.42 mg/(min·mL);Yan等从蜡样芽孢杆菌中获得的CMC酶的为2.12 g/L,为 5.37 μg/(min·mL)。
3 结论
经分离纯化,获得2个酶活组分CMC酶Ⅰ和CMC酶Ⅱ,其纯化倍数分别为45.94倍和32.27倍,回收率分别为14.66%和8.33%。经电泳检测,CMC酶Ⅰ和CMC酶Ⅱ分子量分别约为38.99 ku和45.53 ku。经凝胶电泳检测,获得2个酶活组分CMC酶Ⅰ和CMC酶Ⅱ均能达电泳级纯度,提示利用盐析沉淀、凝胶层析、疏水层析和弱阳离子交换色谱能够对菌株DM-4所产内切--葡聚糖苷酶具有良好的分离纯化效果。酶学性质显示,CMC酶Ⅰ最适作用温度为55~60 ℃,CMC酶Ⅱ为55 ℃。当温度低于70 ℃时,2种酶均对热稳定。2种酶作用最适pH值为7.5,在pH值为6.0~8.0范围内两者均具有良好稳定性。Ca和Mg对CMC酶Ⅰ和CMC酶Ⅱ有激活作用。CMC酶Ⅰ的米氏常数为2.55 g/L,为37.59 μg/(min·mL)。CMC酶Ⅱ的米氏常数为4.37 g/L,为 28.82 μg/(min·mL)。酶学性质表明,菌株DM-4所产的2种CMC酶组分均有中性偏碱性纤维素酶,这与大多数霉菌来源的纤维素酶有所不同。
本研究在实验室水平上将细菌菌株DM-4所产CMC酶组分进行了分离纯化,研究其酶学性质,获得良好的分离纯化结果,但将其应用于工业化生产,还需要进行分离纯化技术的深入研究和开发。

