戊唑醇在黄花菜上的残留行为及膳食风险评估
唐树怀, 代雪芳, 邓毅书, 浦恩堂, 易永永, 李佳妮, 刘 祎
(1.云南农业大学资源与环境学院,云南昆明 650201; 2.云南省农业科学院农业环境资源研究所,云南昆明 650205;3.云南农业大学建筑工程学院,云南昆明 650201)
黄花菜(Baroni)为百合科萱草属多年生草本植物,是我国多地重要的经济特色作物。2018年我国黄花菜种植面积约60.34万hm,产量约58.48万t。由黄花菜萱草柄锈菌引起的黄花菜锈病,发生危害逐年加重,严重影响黄花菜的产量和品质,成为黄花菜最严重的锈病、叶枯病、叶斑病三大病害之一,严重时可导致绝收,极大地制约了黄花菜产业健康发展。戊唑醇是目前防治黄花菜锈病的特效药,其结构式见图1,是一种高效、广谱、内吸性三唑类杀菌农药,主要通过抑制病原真菌体内麦角甾醇的脱甲基化,破坏真菌细胞膜的结构和功能,干扰细胞正常的新陈代谢,导致菌体生长停滞、繁殖率下降,甚至死亡。具有保护、治疗、铲除三大功能,杀菌谱广、持效期长。由于其活性高、防治效果好、性价比高,在生产中相比同类产品优势明显,被大量使用。随着戊唑醇使用量的增加,其残留问题也越来越受到人们的重视。
目前,国内外已有对作物小麦、香蕉、玉米、苹果、水稻、黄瓜等关于戊唑醇的消解和残留行为的研究。鲜见戊唑醇在黄花菜上的残留方法、消减动态和最终残留研究的报道,因此开展戊唑醇在黄花菜上的检测方法、黄花菜中戊唑醇的消解动态及其残留规律、确定其半衰期的研究,提出合理的施药建议,旨在为戊唑醇在黄花菜上的安全使用提供依据,对在农业生产中安全合理使用戊唑醇,减少农药残留带来的危害具有一定的理论和应用价值。
1 材料与方法
1.1 试验药剂、试剂与仪器
试验药剂:430 g/L戊唑醇悬浮剂,购于拜耳作物科学(中国)有限公司;戊唑醇标准品(98.5%),购自Dr.Ehrenstorfer GmbH公司。
试验试剂:乙腈、甲醇,色谱纯,购自Thermo Fisher Scientific公司;甲酸,优级纯,购自上海麦克林生化科技有限公司;氯化钠,硫酸镁,分析纯,购自国药集团化学试剂有限公司;Cleanert C,40~60 μm,购自上海安谱实验科技股份有限公司;超纯水,购自广州屈臣氏食品饮料有限公司。
仪器:Blixer®6V.V 7 L样品切碎机(法国Robot公司);Waters I-Class ACOUITY 超高效液相色谱仪,Waters Xevo TQD 三重四级杆串联质谱,美国Waters公司;PL602-S电子天平,精度为0.01 g,上海越平公司;50、100、200、1 000、10 000 μL精密移液枪,Transferpette®S公司;TARGIN® VX-Ⅲ 多管涡旋振荡仪,北京踏锦科技有限公司;LXJ-IIB 低速大容量多管离心机,上海飞鸽公司;ME104E 电子分析天平,精度0.000 1 g,梅特勒-托利多公司;SIGMA 1-14台式小型离心机,德国希格玛电子有限公司;KQ-700B超声仪,广州越特科学仪器有限公司;不同规格的移液管、容量瓶。
1.2 田间试验设计
根据参考文献[10-11],2019年消解动态田间试验分别在浙江、湖北2地进行;最终残留田间试验分别在吉林、山东、浙江、湖北、湖南、四川6地进行。430 g/L戊唑醇悬浮剂用于防治黄花菜锈病按有效成分推荐用量77.5~129.0 g a.i./hm进行,在黄花菜抽薹现蕾期,通过喷雾方式施药3~4次,施药间隔7 d,安全间隔期7~10 d,具体见表1。

表1 430 g/L戊唑醇悬浮剂在黄花菜上的田间试验设计
1.3 样品采集、制备与保存
1.3.1 样品采集 按棋盘式分布取样,采集12点以上(不少于2 kg)生长正常、无病害的含苞待放的黄花菜花蕾样本2份,分别用于制备鲜黄花菜和干黄花菜样品。所采集的样品分别装入样品袋中包扎妥当并标记,带回实验室处理。小区边行和每行距离两端0.5 m内不采样。
1.3.2 鲜黄花菜样品制备与保存 将田间采集的新鲜黄花菜样本中的1份在采后8 h内剪成1 cm以下的小段或切碎,混匀后,用四分法分别取200 g新鲜的黄花菜样品2份,正样和副样分别装入样品容器中,贴好标签后,低温(≤-18 ℃)保存。
1.3.3 干黄花菜样品制备与保存 将田间采集的鲜黄花菜花蕾样本中的另一份运到实验室后,称质量记录,按当地常规加工工序,制成黄花菜花蕾干样。[一般情况下,将刚采摘的新鲜黄花菜花蕾立即装筛,装筛时留适当空隙以使蒸气分布均匀,装筛后用蒸锅蒸,蒸至变色(蒸锅内蒸气温度上升到70~80 ℃,维持5~7 min)即可,黄花菜蒸变色出锅后,冷却晾晒至干],称质量记录干黄花菜质量,计算并记录鲜干比,分别取100 g晒干的黄花菜样品2份,正样和副样分别装入样品容器中,贴好标签后,低温(≤-18 ℃)保存。
1.4 戊唑醇含量的分析
1.4.1 样品的前处理
1.4.1.1 提取 鲜黄花菜:称取5 g黄花菜(鲜)样品,置于50 mL带盖离心管中,准确加入25 mL乙腈,涡旋提取10 min,加入5 g NaCl和2 g MgSO再涡旋混匀1 min,3 000 r/min离心5 min,取上清液待净化。
干黄花菜:称取2 g黄花菜(干)样品于50 mL带盖离心管中,先加5 mL水浸润5 min,再准确加入20 mL乙腈,涡旋提取10 min,加入5 g NaCl和2 g MgSO再涡旋混匀1 min,3 000 r/min离心5 min,取上清液待净化。
1.4.1.2 净化 取1.5 mL“1.4.1.1”节的待净化液至称有50 mg C填料的2 mL离心管中,涡旋振荡 1 min 10 000 r/min离心3 min,上清液过 0.22 μm 有机系滤膜后转移至进样瓶中,待UPLC-MS/MS测定。
1.4.2 检测条件 色谱柱:Acquity UPLC® HSS C色谱柱(2.1 mm×50 mm,1.7 μm);柱温:35 ℃;流速:0.4 mL/min;进样体积:1 μL;梯度洗脱条件见表2。

表2 戊唑醇UPLC梯度洗脱条件
离子源:电喷雾离子源ESI;扫描方式:正离子源;毛细管电压:3.55 kV;锥孔电压:29 V;离子源温度:150 ℃;脱溶剂温度:350 ℃;脱溶剂气流量:800 L/h;锥孔气流量:50 L/h;检测方式:多重反应监测(MRM);质谱测定参数见表3。

表3 戊唑醇质谱测定参数
1.4.3 标准曲线 准确称取戊唑醇标准品0.010 4 g,用乙腈溶解定容至10 mL,配制成1 024 μg/mL的标准母液。使用时采用乙腈分别稀释配制成100、10、1 μg/mL标准液。之后用基质空白溶液将标准液逐级稀释配得0.001、0.002、0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.000 μg/mL系列基质标准溶液, 在“1.4.2”节条件下进行测定,以基质标准溶液浓度与监测离子峰面积作标准曲线。
1.4.4 添加回收率试验 分别在鲜黄花菜和干黄花菜空白对照样品中添加0.01、0.10、1.00、5.00 mg/kg和0.01、0.10、1.00、5.00、50.00 mg/kg浓度的戊唑醇标准溶液,每档重复5次,放置1 h让溶剂挥发,按“1.4.1”节和“1.4.2”节分析方法提取净化和检测。
1.5 膳食摄入风险评估
依据卫生部2002年发布的《中国不同人群消费膳食分组食谱》或权威参考资料中的膳食结构数据,结合残留化学评估推荐的规范残留试验中值和已制定的最大残留限量(),计算该农药的国家估算每日摄入量(),通过与毒理学评估推荐的每日允许摄入量()进行比较,计算风险概率(),和的计算公式如下:
=∑[×];
(1)
=(×)×100%。
(2)
其中:表示农药在某种作物中的残留中值,mg/kg;表示一般人群该作物的消费量,kg;表示我国的人均体质量,kg;表示风险概率;表示我国人均体质量对农药的每日允许摄入量,mg/kg。
根据《食品中农药残留风险评估指南》,在计算时,如果无合适的值,可直接采用相应的值代替。当>100%时,认为该农药残留对一般人群健康存在不可接受的慢性风险,比值越大,风险越高。
2 结果与分析
2.1 前处理方法的优化
2.1.1 提取溶剂的优化 由于戊唑醇的分子结构存在极性较大的官能团(羟基、三唑环)。根据相似相溶原理,总体来说所用提取溶剂极性越大,提取效率越高,根据戊唑醇的此理化性质,选择甲醇、乙腈2种有机溶剂来比较不同的提取剂对戊唑醇回收率的影响。采用乙腈作为提取剂时,黄花菜中戊唑醇的回收率为96%,采用甲醇提取时,回收率为92%,乙腈的提取效果优于甲醇,因此本试验选择乙腈作为提取黄花菜中戊唑醇的溶剂。
2.1.2 提取时间的优化 提取时间的长短对戊唑醇的回收率会产生影响,提取时间不够,会导致回收率偏低,提取效果差,而提取时间过长,则对回收率的提高不明显。因此,提取时间对戊唑醇的回收率有很大的影响。本研究根据“2.1.1”节中确定的乙腈为提取剂,设定了4个(5、10、15、20 min)提取时间,在4个提取时间对黄花菜中戊唑醇的回收率进行测定,戊唑醇的回收率分别为95%、97%、97%、97%。结果表明,涡旋提取10 min时,戊唑醇的总体回收率就达已经97%并趋于稳定,因此,选择 10 min 作为黄花菜中戊唑醇的提取时间。
2.1.3 提取体积的优化 提取剂体积会影响戊唑醇回收率,提取剂用量不足,会导致提取不完全,回收率偏低,增大提取剂用量对戊唑醇回收率的增效不大且浪费溶剂,选取最适的提取剂体积对戊唑醇的回收率影响大。本研究根据“2.1.1”和“2.1.2”节的优化条件,筛选了4个(15、20、25、30 mL)提取剂用量,对黄花菜中戊唑醇的回收率进行研究,提取剂体积为15、20、25、30 mL时,戊唑醇的回收率分别为88%、90%、96%、92%。结果表明,鲜黄花菜提取剂体积为25 mL的时候回收率最好,为97%;使用15、20 mL溶剂时回收率不足,30 mL时增效不大且浪费溶剂;干黄花菜提取剂体积为20 mL时,回收率最好为96%,使用15 mL溶剂时回收率不足,25、30 mL时,增效不大且浪费溶剂。因此,选择 25 mL 作为鲜黄花菜中戊唑醇的提取剂体积,20 mL为干黄花菜中戊唑醇的提取剂体积。
2.1.4 净化方法的优化 试验选取鲜黄花菜基质样本,做了3个戊唑醇标准溶剂(0.01、0.10、1.00 mg/kg)添加水平下不同净化方式的添加回收对比试验,每个浓度3次重复;选取干黄花菜基质样本(0.1、1.0、5.0 mg/kg)添加水平下不同净化的添加回收对比试验,每个浓度3次重复。由图2、图3可知,固相萃取和分散固相萃取的分离和纯化效果,其中,分散固相萃取为A、B、C、D、E组(DSPE,A:50 mg C,B:50 mg PSA,C:50 mg GCD,D:50 mg PSA+150 mg MgSO,E:50 mg PSA+50 mg C);固相萃取为F、G组(SPE,F:NH柱,G:Florisil柱)。

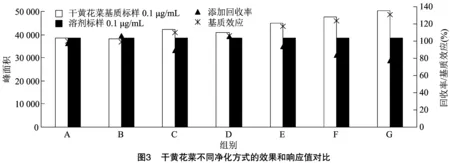
对比不同净化方式的添加回收率及响应值(峰面积)发现,鲜黄花菜和干黄花菜中均是分散固相萃取较固相萃取的净化效果更好,主要体现在更低的基质效应(基质标峰面积越接近溶剂标表示基质效应越低)。样品中存在的杂质会影响目标物在质谱检测中的电离效率,表现为信号增强或信号减弱,基质效应可间接反映样品中的干扰物情况。因此,基质效应越低表明净化效果越好。但戊唑醇在固相萃取柱上不易被洗脱,回收率不高,且该方法操作繁琐、耗材贵,需要使用更多的有机溶剂。DSPE方法中选用C作为吸附剂时,鲜黄花菜和干黄花菜中均取得了较为满意的回收率,且净化效果最好,基质效应不明显,保证了检测的准确度,因此选取50 mg C作为净化剂,该方法操作简便、耗时少,有机溶剂用量少,在目标峰处无杂质干扰。
2.2 标准曲线与灵敏度
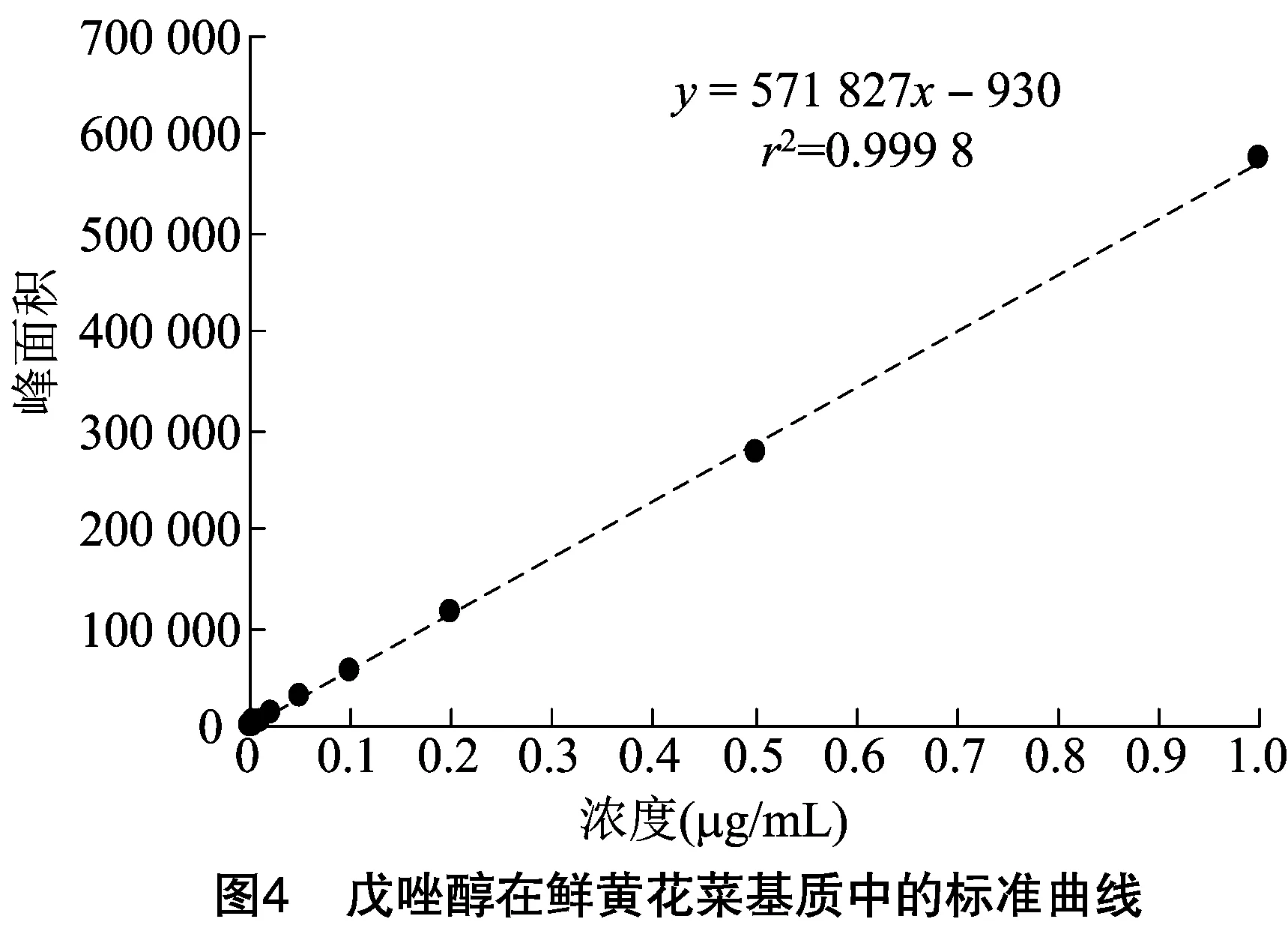
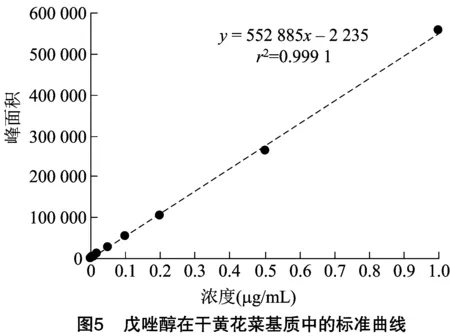
由图4、图5可知,在供试质量浓度0.001~1.000 mg/kg范围内,戊唑醇在黄花菜基质中线性关系良好,鲜黄花菜基质的线性方程为=571 827-930,=0.999 8;干黄花菜基质的线性方程为=552 885-2 235,=0.999 1。其中,为相应的峰面积,为基质准溶液浓度。仪器灵敏度采用戊唑醇的最小检出量(LOD)为1.0×10ng。
2.3 方法的准确度与精密度
由表4可知,戊唑醇在鲜黄花菜中添加浓度为0.01~5.00 mg/kg时,平均回收率在87%~96%之间,相对标准偏差在1%~9%之间;在干黄花菜中添加浓度为0.01~50.00 mg/kg时,平均回收率在88%~98%之间,相对标准偏差在2%~8%之间,表明戊唑醇在黄花菜中的添加回收率和相对标准偏差均符合残留试验的要求。
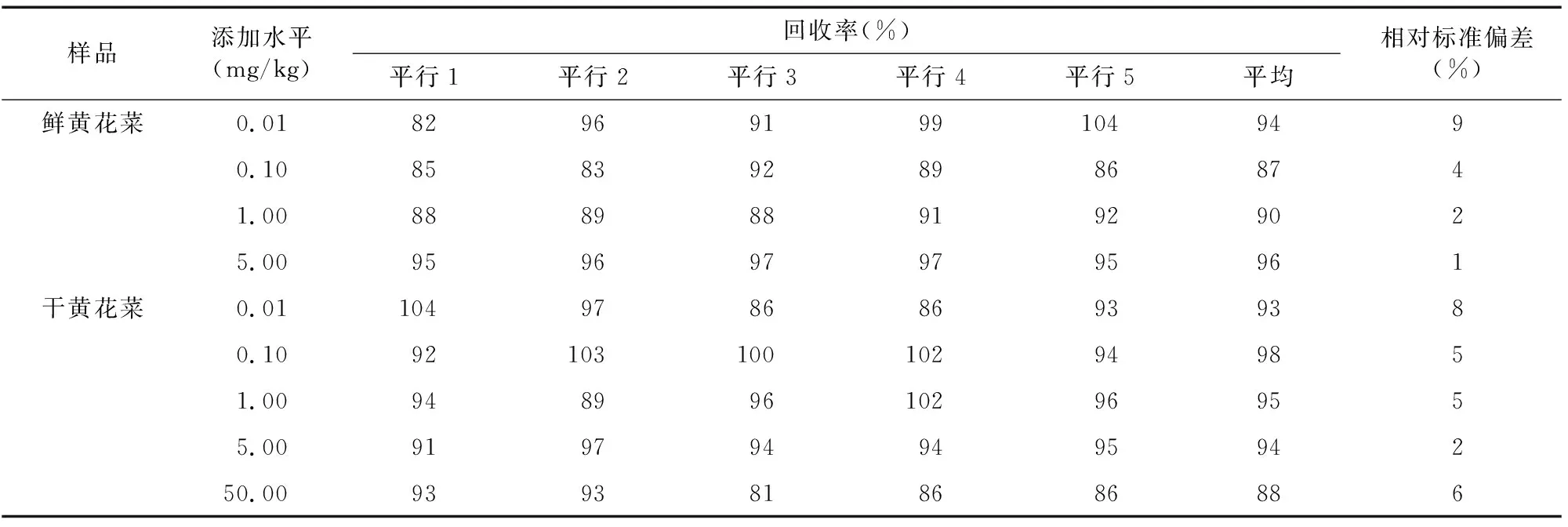
表4 戊唑醇在黄花菜中的添加回收率相对标准偏差(n=5)
2.4 消解动态试验
2019年,在浙江和湖北2地进行黄花菜消解试验,430 g/L戊唑醇悬浮剂以193.5 g a.i./hm的剂量于黄花菜抽薹现蕾期喷雾施药1次,施药后定期采集黄花菜花蕾样本分析检测。由表5可知,戊唑醇在浙江试验点黄花菜样本中的原始沉积量为 2.91 mg/kg,3 d降解51.5%,10 d降解96.7%,降解方程为=3.458 8e-0.353,=0.977 8,半衰期为 2.0 d;戊唑醇在湖北试验点黄花菜样本中的原始沉积量为2.01 mg/kg,3 d降解37.3%,10 d降解95.6%,降解方程为=2.561 7e-0.308,=0.972 2,半衰期为2.3 d。结果表明,随着采收间隔期的延长,两地黄花菜中戊唑醇的残留量均逐渐降低,属易降解农药(图6)。
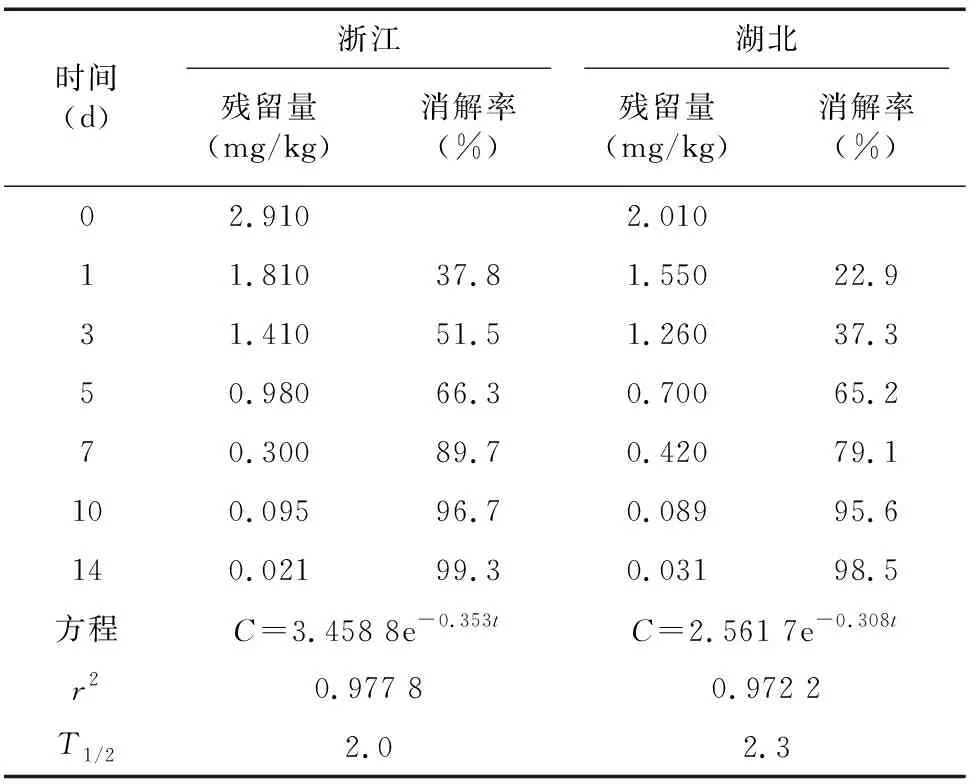
表5 戊唑醇在黄花菜中的消解动态
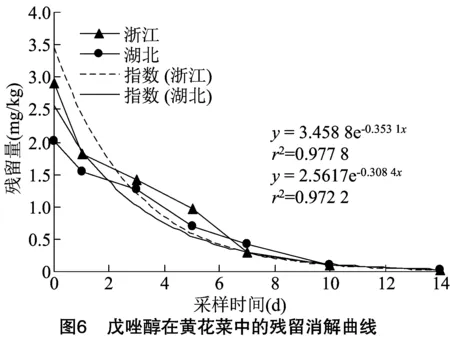
2.5 最终残留试验
由表6、表7可知,2019年分别在吉林、山东、浙江、湖北、四川、湖南进行戊唑醇在黄花菜上的最终残留试验,430 g/L戊唑醇悬浮剂分别以其推荐剂量129 g a.i./hm和1.5倍推荐剂量193.5 g a.i./hm在黄花抽薹现蕾期喷雾施药3~4次,施药间隔为 7 d,于末次施药后2 h、3 d、5 d、7 d、10 d采集2份黄花菜花蕾样品,1份用于制备鲜黄花菜终残样品,1份用于制备干黄花菜终残样品,测定黄花菜中戊唑醇残留量。
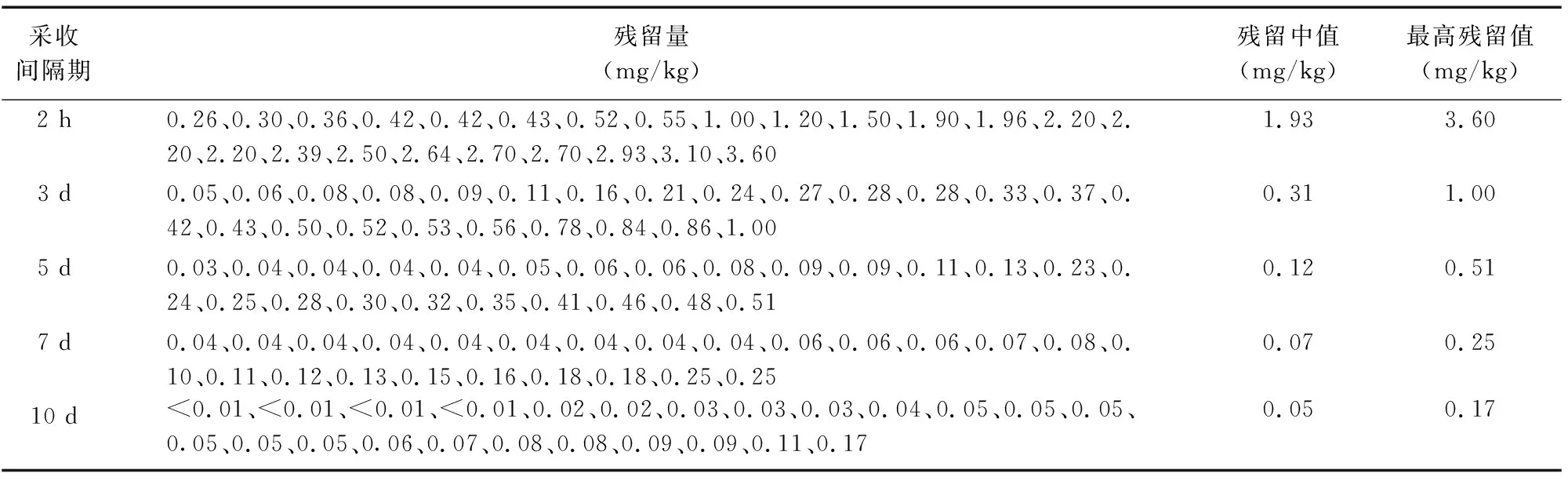
表6 戊唑醇在鲜黄花菜上的最终残留量
由表6可知,鲜黄花菜样品中戊唑醇最终残留量为<0.01~3.60 mg/kg,采收间隔期为2 h、3 d、5 d、7 d、10 d时,其最高残留量分别为3.60、1.00、0.51、0.25、0.17 mg/kg,残留量中值分别为1.93、0.31、0.12、0.07、0.05 mg/kg。随着采收间隔期的延长,戊唑醇在鲜黄花菜中的残留量有明显下降,戊唑醇在鲜黄花菜中的残留量随着施药剂量的增加而增加。
由表7可知,距末次施药后2 h,戊唑醇在6个试验点干黄花菜中的残留量为9.57~58.67 mg/kg,距末次施药后3 d为0.10~8.10 mg/kg,5 d为 0.10~4.57 mg/kg,7 d为0.10~2.00 mg/kg,10 d 为0.04~1.10 mg/kg。采收间隔期为2 h、3 d、5 d、7 d、10 d时,其最高残留量分别为58.67、8.10、4.57、2.00、1.10 mg/kg,残留量中值分别为21.34、3.62、2.00、0.97、0.34 mg/kg。结果表明,随着采收间隔期的延长,戊唑醇在干黄花菜中的残留量明显下降,随着施药剂量的增加,戊唑醇在干黄花菜中的残留量增加。
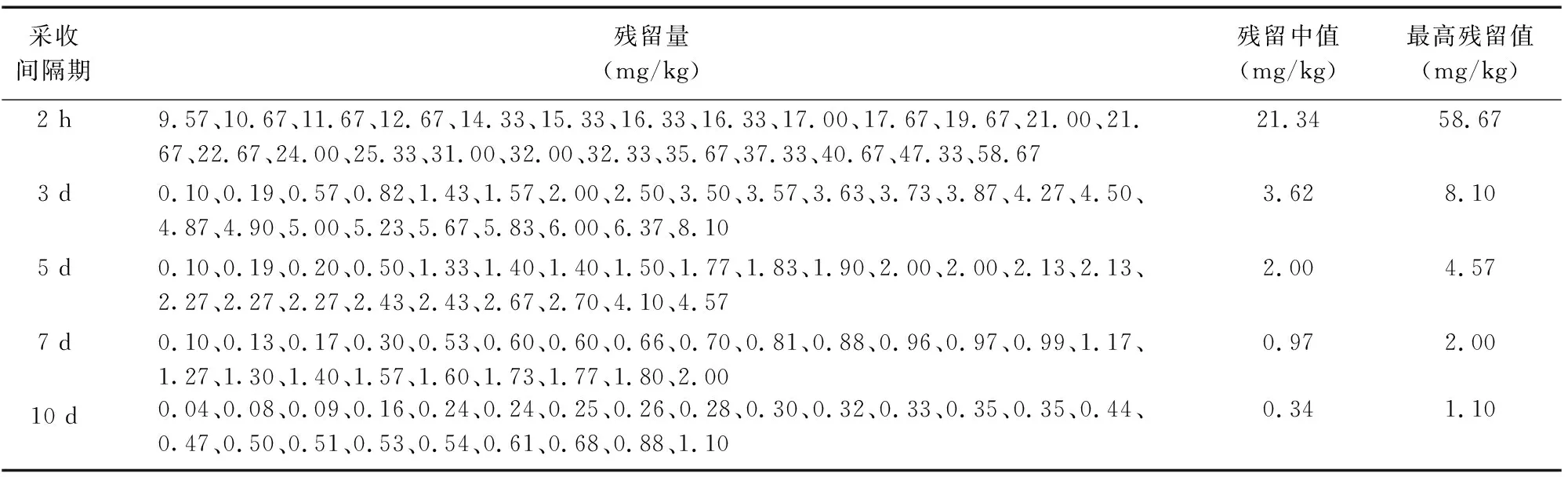
表7 戊唑醇在干黄花菜上的最终残留量
与鲜黄花菜中戊唑醇残留量为(<0.01)~3.60 mg/kg 相比,干黄花菜中戊唑醇残留量为 0.04~58.67 mg/kg,高于鲜黄花菜,是由于含水量的减少使戊唑醇在黄花菜中的浓度发生了富集。
2.6 膳食风险评估结果
根据《食品安全国家标准 食品中农药最大残留限量》,戊唑醇的ADI值为0.03 mg/kg。根据戊唑醇在中国的登记使用情况,以及居民人均膳食结构调查数据,结合本研究得到的残留试验中值进行风险评估,评估结果见表8、表9。遵循风险最大化的原则及生产实际,选用距采收期3 d的黄花菜中戊唑醇残留中值数据0.31 mg/kg(鲜黄花菜)和3.62 mg/kg(干黄花菜),评估中各类作物的MRL值来源于中国人民共和国国家标准GB 2763—2019《食品安全国家标准:食品中农药最大残留限量》。
由表8、表9可知膳食风险评估结果,鲜黄花菜中戊唑醇的国家估算每日摄入量为0.696 2 mg,占戊唑醇每日允许摄入量1.89 mg的36.8%,即风险商为36.8%,干黄花菜中戊唑醇的国家估算每日摄入量为1.3 043 mg,占戊唑醇每日允许摄入量 1.89 mg 的69.0%,即风险商为69.0%,均低于100%,说明采用430 g/L戊唑醇悬浮剂按照推荐剂量在黄花菜上施用,其在鲜黄花菜和干黄花菜中的残留量对消费者的慢性膳食摄入风险较低,不会对一般人群的健康产生不可接受的风险。

表8 鲜黄花菜中戊唑醇膳食摄入风险评估结果

表9 干黄花菜中戊唑醇膳食摄入风险评估结果
3 讨论
试验中出现戊唑醇在浙江和湖北2地黄花菜中的原始沉积量存在较大差异的情况,在浙江试验点的原始沉积量为2.91 mg/kg,而湖北的原始沉积量为2.01 mg/kg,当天浙江绍兴的最高气温为 26 ℃,湖北天门的最高气温为30 ℃,因此,出现浙江黄花菜中戊唑醇原始沉积量大于湖北的原因可能是湖北当天的高温加速了黄花菜中戊唑醇的降解。
浙江试验点黄花菜中戊唑醇3 d降解51.5%,而湖北试验点降解37.3%,浙江的降解速度明显高于湖北,根据田间试验记录,浙江绍兴在施药后3 d有中雨,而湖北没有降雨。因此,黄花菜中戊唑醇前3 d降解率浙江大于湖北的原因是否有可能是由于降雨导致的。Liu等的研究也提出了农药的消解过程取决于当地的气候环境和作物种类等多种因素,但导致戊唑醇在浙江和湖北2地黄花菜中的沉积量和施药3 d后的降解率存在较大差异的具体原因还需进一步研究。
4 结论
本研究建立了戊唑醇在黄花菜上的超高效液相色谱-串联三重四极杆质谱分析检测方法,方法的灵敏度、准确度和精密度均符合农药残留分析的要求。开展了430 g/L戊唑醇悬浮剂在黄花菜上的消解动态和最终残留试验,结果表明,戊唑醇在黄花菜上消解速度很快,消减半衰期为2.0~2.3 d。低剂量(129.0 g a.i./hm)和高剂量(193.5 g a.i./hm)施药3~4次,施药间隔7 d,采收间隔期2 h、3 d、5 d、7 d、10 d时,采收的鲜黄花菜中戊唑醇的残留量为 <0.01~3.60 mg/kg,干黄花菜中戊唑醇的残留量为0.04~58.67 mg/kg。
膳食风险评估结果表明,鲜黄花菜和干黄花菜中戊唑醇的分别为0.696 2、1.304 3 mg,风险商分别为36.8%和69.0%,均<100.0%,对一般人群健康不会产生不可接受的风险。建议在使用 430 g/L 戊唑醇悬浮剂防治黄花菜锈病时,最高制剂用药量0.03 mL/m(129 g a.i./hm),最多施药4次,安全间隔期3 d。

