泛素结合酶UBE2G2基因调控胞内布鲁氏菌存活的作用
印双红,张俊波, 张孟琴, 易 萌, 易彩霞, 蔡春连, 毛 宏, 易继海, 李志强, 陈创夫
(1.铜仁学院大健康学院,贵州铜仁 554300; 2.铜仁学院农林工程与规划学院,贵州铜仁 554300;3.贵州省梵净山地区生物多样性保护与利用重点实验室,贵州铜仁 554300;4.铜仁学院材料与化学工程学院,贵州铜仁 554300; 5.石河子大学动物科技学院,新疆石河子 832000;6.商丘师范学院生物与食品学院,河南商丘 476000)
布鲁氏菌病是一种广泛分布的人畜共患传染病。动物感染布鲁氏菌后表现为关节炎、流产、胎膜发炎、空怀和睾丸炎等症状。人可以通过吸入气溶胶化的细菌或通过摄取和接触被污染的动物组织而感染。人感染布鲁氏菌后会导致反复发烧、关节炎和心内膜炎等全身性疾病。目前,布鲁氏菌的持续性感染的分子机制尚不清楚。
泛素蛋白酶体途径具有降解真核细胞内蛋白质的作用,调节着大多数蛋白的降解,是维持细胞稳态所必需的。蛋白酶体降解途径主要包括靶蛋白的泛素化和泛素化靶蛋白在蛋白酶体内的降解。靶蛋白的泛素化主要需要3种酶协同完成,包括E1活化酶、E2结合酶和E3连接酶。E2结合酶以一个多基因家族形式存在,人类基因组中已发现40多个泛素结合酶。E2结合酶一般具有1个 16~18 ku大小的催化中心,包含具有催化活性的半胱氨酸残基。然而,E2结合酶在布鲁氏菌感染过程中的作用机制尚不清楚。本研究以泛素结合酶UBE2G2为研究对象,检测其在胞内布鲁氏菌繁殖中的作用机制。
1 材料与方法
1.1 试验材料
Opti-MEM培养基,购自GIBCO公司;LDH检测试剂盒,购自碧云天生物技术公司;LipofectamineRNAiMAX转染试剂、Lipofectamine 2000 和总RNA提取试剂Trizol,均购自Invitrogen公司;布鲁氏菌M5-90、小鼠巨噬细胞RAW264.7和pLVX-puro载体,由贵州省梵净山地区生物多样性保护与利用重点实验室保存。该试验于2019年4月至2020年10月在贵州省梵净山地区生物多样性保护与利用重点实验室完成。
1.2 UBE2G2基因过表达细胞的构建
1.2.1 过表达质粒pLVX-puro-的构建 利用NCBI网站下载小鼠的基因序列(GenBank登录号为NM_019803.3),送华大基因公司合成序列,将目的基因序列与pLVX-puro载体连接构建过表达质粒pLVX-puro-,将该重组质粒转化至大肠杆菌DH5α中,于37 ℃振荡培养1 h,7 000 r/min离心3 min,将沉淀菌体涂布于含有氨苄青霉素(100 g/mL)的固体平板中,于 37 ℃ 培养16 h,提取质粒并进行PCR扩增和酶切验证。
设计pLVX-puro载体和pLVX-puro-的共同检测引物,F:5′-C A C G C T G T T T T G A C C T C C A T-3′,R:5′-G G A T G T G G A A T G T G T G C G A G-3′。质粒pLVX-puro和pLVX-puro-的PCR体系为20 μL:2×ESMasterMix 10.0 μL,pLVX-puro-(pLVX-puro) 1.0 μL,上下游引物各1.0 μL,ddHO 7.0 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 20 s,57 ℃ 40 s,72 ℃ 40 s,循环30次;72 ℃ 7 min。质粒pLVX-puro-双酶切验证体系为40 μL:RⅠ限制性内切酶 2.0 μL,HⅠ限制性内切酶2.0 μL,质粒pLVX-puro-20.0 μL,10×H Buffer 4.0 μL和ddHO 12.0 μL。
1.2.2 过表达效果的检测 参照文献[7]中的方法,用6孔板培养细胞,培养液用10%胎牛血清的Opti-MEM培养基,待细胞密度为1×10个/mL时,将细胞培养基更换为无血清的Opti-MEM培养基,将细胞分为磷酸盐缓冲液(PBS)对照组、pLVX-puro 空质粒组和pLVX-puro-过表达质粒组。取2支灭菌的EP管,一个管加入 10 μL Lipofectamine 2000和240 μL Opti-MEM;另一个管加入15 μL质粒(pLVX-puro或pLVX-puro-)或15 μL PBS和235 μL Opti-MEM,室温静置4 min,将上述2个管中的液体混合,室温静置15 min,然后将其加入至6孔板中,培养4 h后加入含胎牛血清的Opti-MEM培养基,培养48 h后收集细胞,利用实时荧光定量PCR(qRT-PCR)分析基因过表达情况。从NCBI网站下载和内参基因序列(GenBank登录号分别为NM_019803.3和 NM_008084.3),设计引物(表1),引物序列由华大基因公司合成。以为内参,qRT-PCR分析的表达水平,反应体系为20 μL:荧光染料10 μL,模板cDNA 2 μL,上下游引物各1 μL,ddHO 6 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 7 min。试验将PBS处理的细胞作为对照组。每组细胞设置3次重复,采用2-ΔΔ法分析基因的相对表达量。
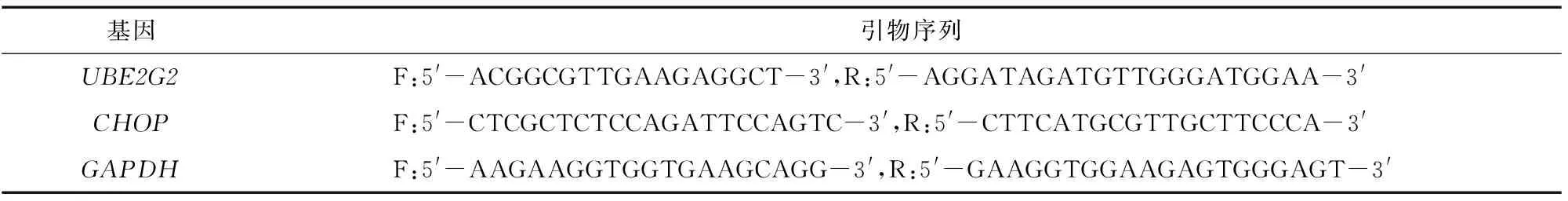
表1 UBE2G2、CHOP和GAPDH基因的qRT-PCR引物
1.3 UBE2G2沉默表达细胞的构建
1.3.1 小干扰RNA(siRNA)的合成 由上海吉玛制药技术有限公司设计并合成基因干扰片段,包括3对阳性siRNA序列(-83-siRNA、-253-siRNA和-456-siRNA)和1对阴性siRNA序列(表2)。

表2 UBE2G2基因的siRNA序列
1.3.2 沉默效果的检测 参照文献[7]中的方法,按照“1.2.2”节的方法培养细胞,将细胞分为PBS对照组、阴性siRNA组、-83-siRNA干扰组、-253-siRNA干扰组和-456-siRNA干扰组。取2个EP管,个管分别加125 μL Opti-MEM,然后一个管加入7 μL Lipofectamine RNAiMAX,另一个管加入12.5 μL siRNA(-83-siRNA、-253-siRNA、-456-siRNA或阴性siRNA),室温孵育5 min,将上述2个管中的液体混匀,室温孵育15 min,然后将其加入细胞液中,培养4 h后加入含20%胎牛血清的Opti-MEM培养基;培养48 h后,利用qRT-PCR分析基因沉默表达情况。
1.4 UBE2G2沉默或过表达对细胞活性的影响
采用MTT比色法检测细胞活性。将-83-siRNA和pLVX-puro-质粒分别转染细胞,培养细胞至对数生长期,消化细胞,加入含胎牛血清的Opti-MEM培养基,将悬浮细胞接种于96孔板中。弃去上清液,加入二甲基亚砜(DMSO),测量490 nm处的吸光度。试验设正常培养的细胞为对照组,重复3次。
1.5 羊种布鲁氏菌M5-90感染对相关基因表达的影响
从NCBI网站下载基因序列(GenBank登录号为NM_007837.4),设计基因的引物(表1)。用qRT-PCR分析M5-90感染对过表达和沉默表达基因的细胞中基因表达量的影响。
用M5-90感染细胞,培养24 h收集细胞。利用qRT-PCR分析的表达水平,具体方法见“1.2.2”节。试验以PBS处理的细胞为对照组。
取转染pLVX-puro-和-83-siRNA的细胞,用M5-90感染转染的细胞,培养24 h收集细胞。利用qRT-PCR检测的表达水平,具体方法见“1.2.2”节。试验同时设正常细胞及转染pLVX-puro空质粒、阴性siRNA、PBS处理的细胞为对照组。
1.6 UBE2G2沉默或过表达对细胞内布鲁氏菌存活的影响
取“1.5”节中5组细胞,37 ℃培养1.5 h,添加含有庆大霉素(50 μg/mL)细胞培养基孵育40 min,更换无庆大霉素的培养基,培养24 h,用TritonX-100裂解细胞,室温放置15 min后将裂解液涂布固体平板,统计细菌数量,试验重复3次。
1.7 UBE2G2沉默或过表达对细胞乳酸脱氢酶(LDH)水平及相关细胞因子的影响
取M5-90感染的PBS对照组、pLVX-puro空质粒组、pLVX-puro-过表达质粒组、阴性siRNA对照组、-83-siRNA干扰组共5组细胞,检测LDH水平、白介素-18(IL-18)水平和γ-干扰素(IFN-γ)水平,试验重复3次。
1.8 统计学分析
试验所得数据均利用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),结果以“平均值±标准差”表示。
2 结果与分析
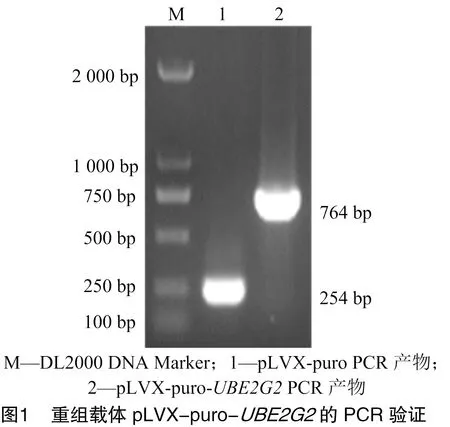
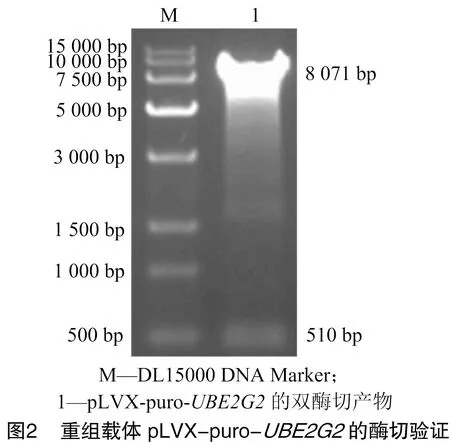
2.1 质粒pLVX-puro-UBE2G2构建的验证
由图1可知,pLVX-puro质粒经引物pLVX-puro-F/pLVX-puro-R PCR扩增获得大小为 254 bp 的条带,pLVX-puro-质粒经PCR扩增可获得的764 bp的条带。由图2可知,质粒pLVX-puro-经双酶切获得大小为510 bp的目的基因条带,结果与预期值相符。结果表明,pLVX-puro-构建成功。
2.2 过表达载体pLVX-puro-UBE2G2过表达效果的验证
由图3可知,转染pLVX-puro-UBE2G2组细胞的表达量极显著高于PBS对照组(<0.01);转染pLVX-puro组细胞的的表达量与PBS对照组无明显变化。结果表明,pLVX-puro-质粒可过表达。

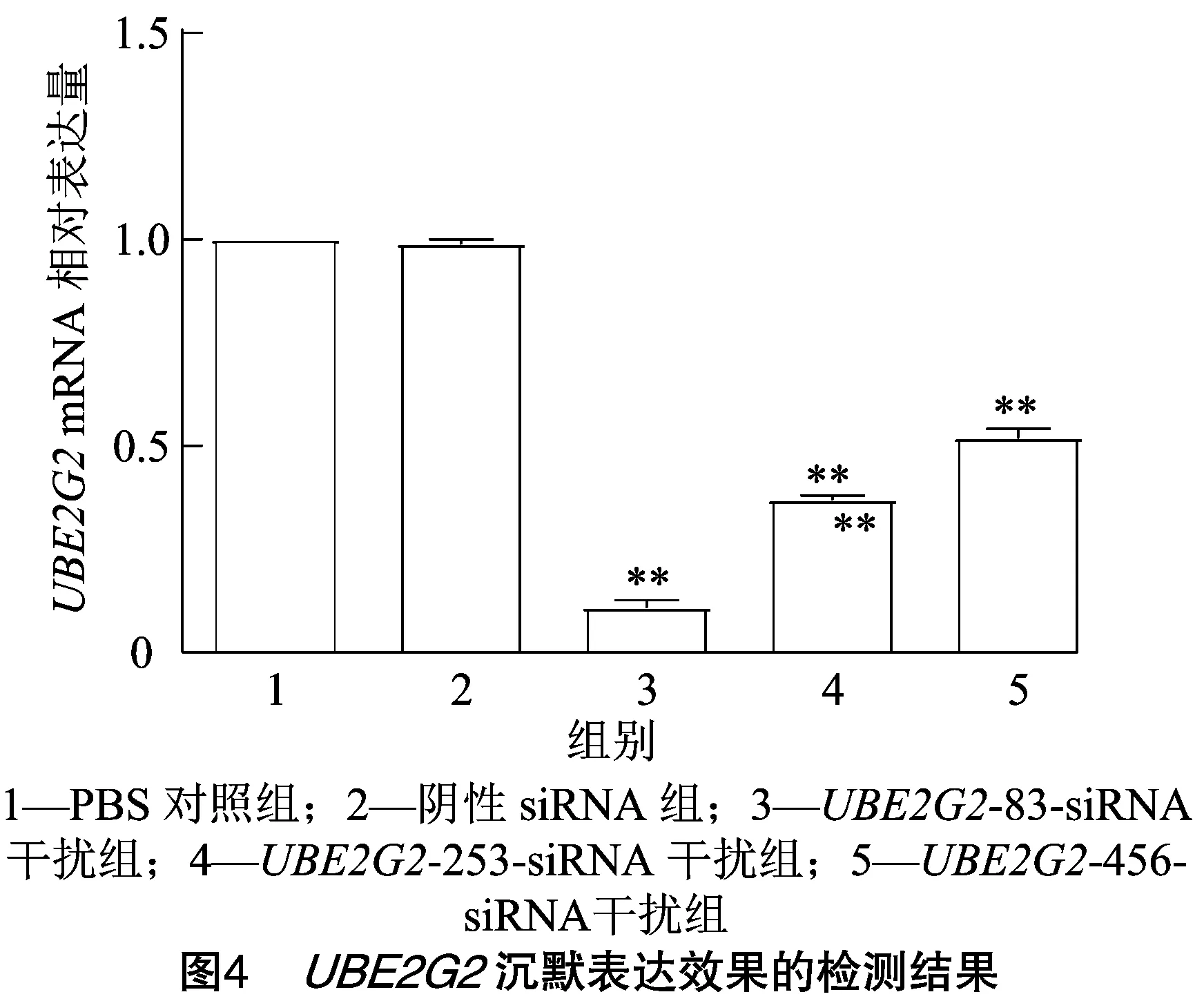
2.3 siRNA干扰UBE2G2基因效果的验证
由图4可知,-83-siRNA、-253-siRNA和-456-siRNA干扰组细胞基因的表达量均极显著低于PBS对照组(<0.01),干扰效率分别为89%、63%、48%。结果表明,的最佳干扰片段为-83-siRNA。
2.4 沉默或过表达UBE2G2基因对细胞活性的影响
由图5可知,-83-siRNA干扰组、pLVX-puro-过表达质粒组的细胞活性均在90%以上。结果表明,沉默或过表达基因不影响细胞活性。

2.5 布鲁氏菌感染对UBE2G2和CHOP基因相对表达量的影响
由图6可知,M5-90感染组细胞基因的表达量极显著高于PBS对照组(<0.01)。结果表明,M5-90感染可诱导细胞的表达。
由图7可知,与PBS对照组细胞相比,pLVX-puro-过表达组细胞中的表达量显著降低(<0.05);-83-siRNA干扰组细胞中的表达量显著升高(<0.05);pLVX-puro空质粒组与阴性siRNA对照组细胞中的表达量均无明显变化。结果表明,沉默和过表达分别可提高和抑制M5-90介导的细胞中的表达。
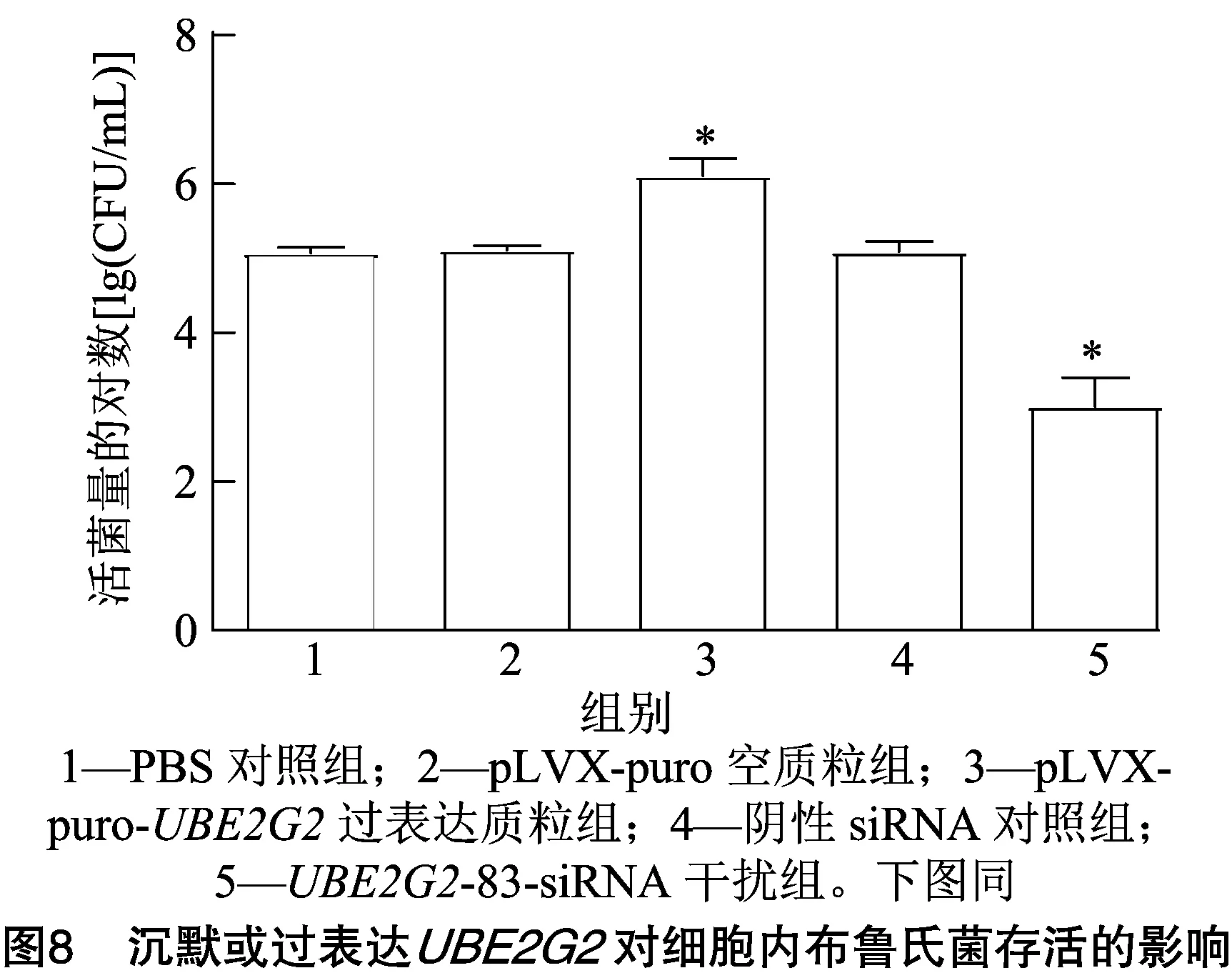
2.6 沉默和过表达UBE2G2基因对胞内布鲁氏菌存活的影响
由图8可知,转染-83-siRNA片段的细胞内布鲁氏菌(M5-90)菌株数量显著低于PBS对照组(<0.05),转染pLVX-puro-质粒的细胞内M5-90菌株数量显著高于PBS对照组(<0.05)。结果表明,沉默和过表达分别可抑制和促进胞内M5-90菌株的存活。
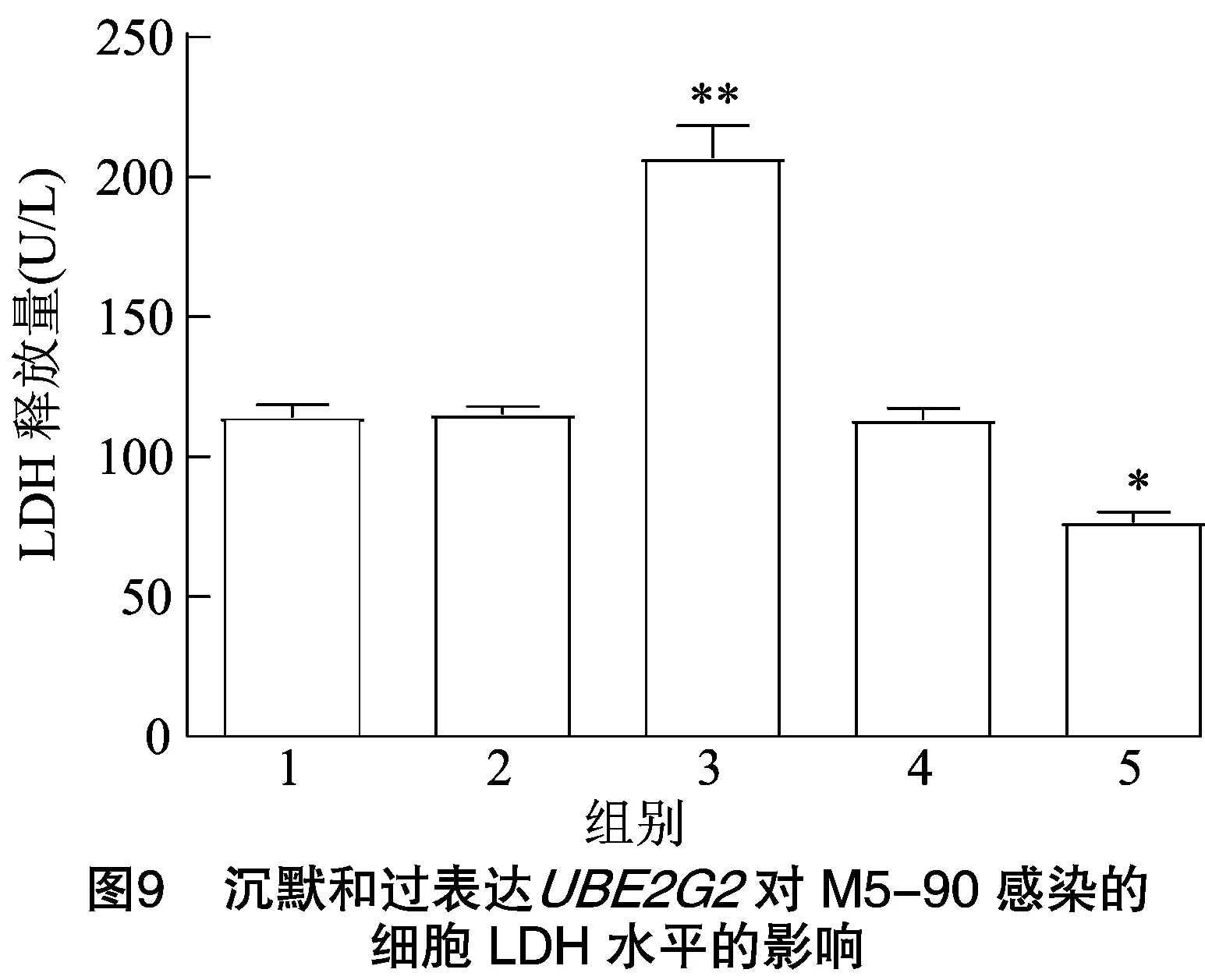
2.7 沉默和过表达UBE2G2基因对M5-90感染细胞的LDH、IL-18和IFN-γ水平的影响
2.7.1 LDH水平 由图9可知,与PBS对照组相比,pLVX-puro-质粒组细胞的LDH水平极显著升高(<0.01),-83-siRNA干扰组细胞的LDH水平显著降低(<0.05);pLVX-puro空质粒组与阴性siRNA组细胞的LDH水平均无明显变化。结果表明,沉默和过表达分别可抑制和提高M5-90介导的细胞中LDH水平。
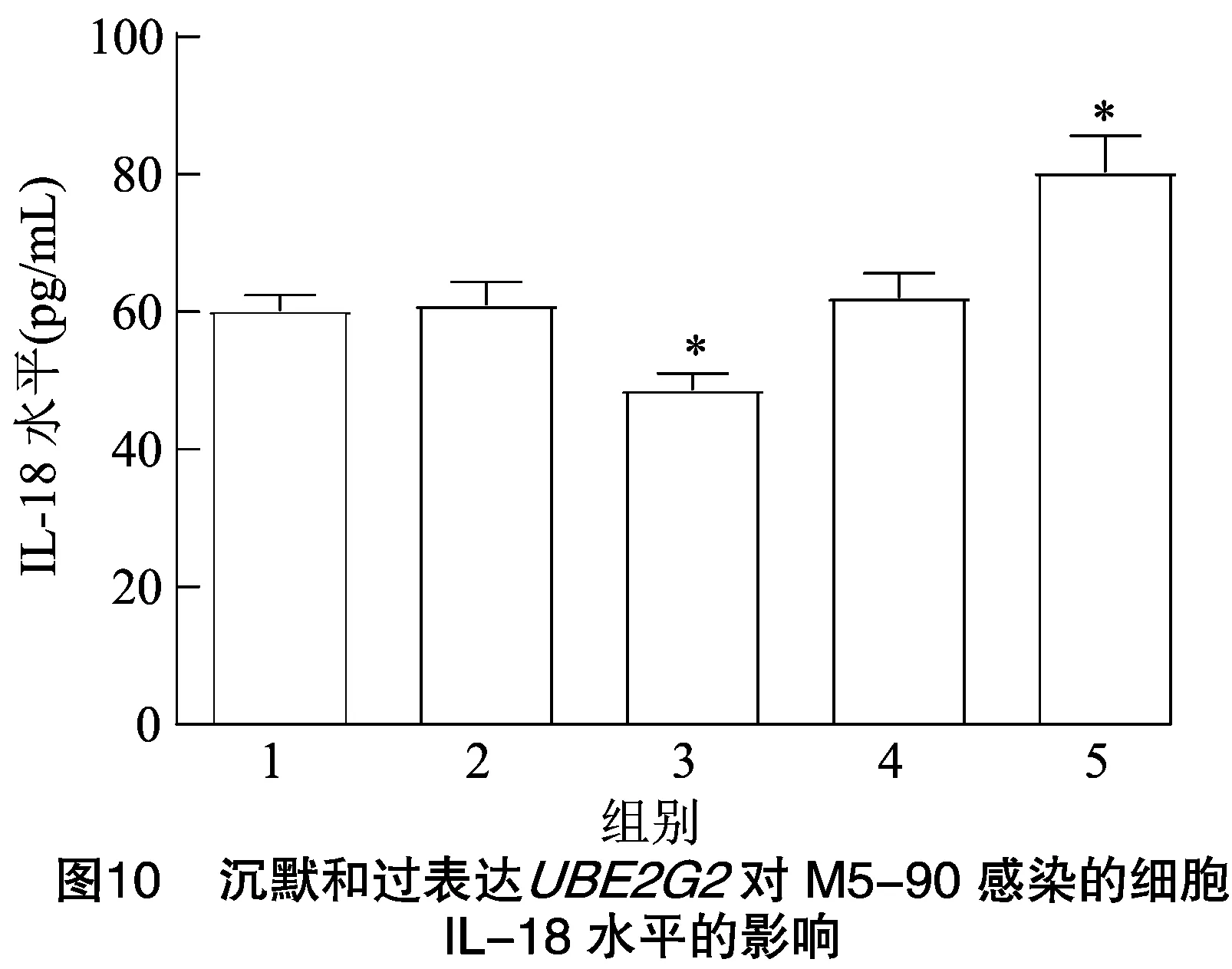
2.7.2 IL-18水平 由图10可知,与PBS对照组相比,pLVX-puro-质粒组细胞的IL-18水平显著降低(<0.05);-83-siRNA干扰组细胞的IL-18水平显著升高(<0.05);pLVX-puro空质粒组与阴性siRNA组细胞的IL-18水平均无明显变化。结果表明,沉默和过表达分别可提高和抑制M5-90介导的细胞中IL-18水平。
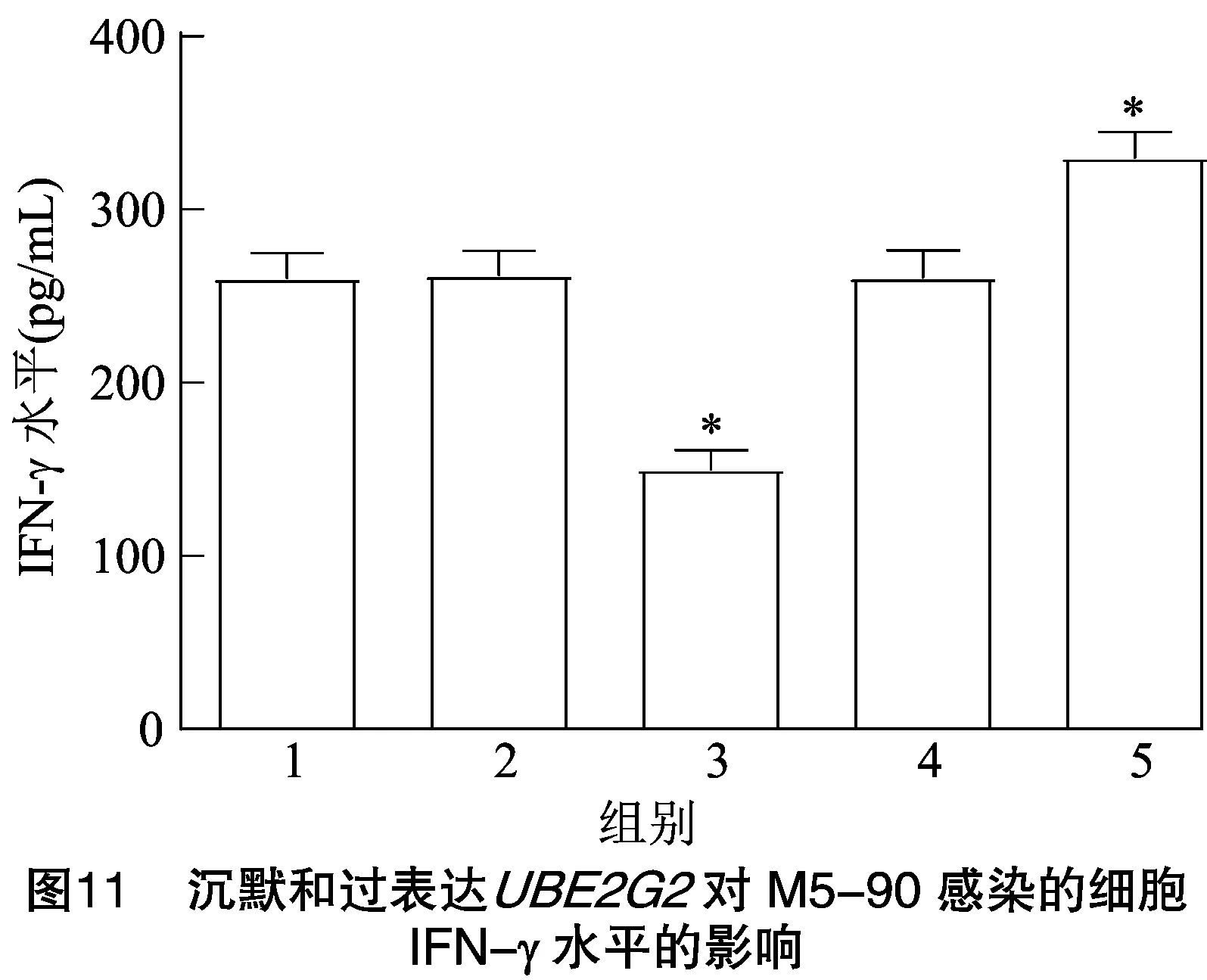
2.7.3 IFN-γ水平 由图11可知,与PBS对照组相比,pLVX-puro-质粒组细胞的IFN-γ水平显著降低(<0.05);-83-siRNA干扰组细胞的IFN-γ水平显著升高(<0.05);pLVX-puro空质粒组与阴性siRNA组细胞的 IFN-γ 水平均无明显变化。结果表明,沉默和过表达分别可提高和抑制M5-90介导的细胞中 IFN-γ 水平。
3 讨论与结论
泛素主要参与细胞周期、胞吞作用和细胞程序性死亡等细胞过程。泛素蛋白酶体系统参与病毒感染、存活、释放与免疫逃逸等各个阶段。研究表明,沉默泛素结合酶UBE2J1可显著降低登革病毒(DENV)感染,而过表达UBE2J1可增强DENV感染。细胞泛素蛋白酶体系统也参与了细胞内布鲁氏菌的存活。研究表明,布鲁氏菌S2感染巨噬细胞可诱导泛素及蛋白酶体的表达;功能增强后的泛素蛋白酶体系统可抑制布鲁氏菌S2的早期感染;而在感染后期,利用抑制剂乳胞素抑制细胞蛋白酶体功能,可抑制细胞内布鲁氏菌S2的存活能力,因此推测泛素蛋白酶体功能被抑制后可促进巨噬细胞自体吞噬系统的活化,从而提高了巨噬细胞的杀菌能力。笔者所在课题组前期研究发现,在胞内布鲁氏菌繁殖中发挥正调控作用,本研究结果表明,M5-90感染可诱导细胞中的表达,且可调控胞内M5-90菌株的存活,因此,与功能相似。
细胞因子IL-18具有在机体中防御各种传染病调节细胞免疫的作用。IL-18在清除病毒过程中发挥作用。干扰素INF-γ是细胞分泌的糖蛋白,可活化自然杀伤(NK)细胞和诱导细胞主要组织相容性复合物Ⅰ(MHCⅠ)的表达,增强宿主的免疫力。IFN-γ是反映宿主细胞免疫水平的主要巨噬细胞活化因子。INF-γ是抗布鲁氏菌感染的细胞因子。本研究表明,沉默和过表达分别可提高和抑制M5-90介导的细胞中IL-18和IFN-γ水平。因此,可调控布鲁氏菌介导的细胞中IL-18水平和IFN-γ水平。
内质网在机体抵抗胞内病原感染过程中至关重要。布鲁氏菌侵入细胞后隐藏于膜结合隔室内,该隔室被称为布氏小体。由于布氏小体在感染细胞周期中具有内体性质,因此将其称为内体布氏小体,该内体布氏小体与内质网结构持续相互作用,获得与内质网膜相关的标记物;内质网中含菌小泡被称为复制性布氏小体,该复制性布氏小体具有内质网的结构和功能特征,表明内体布氏小体转化为内质网衍生的细胞器。内质网为布鲁氏菌在细胞内的繁殖提供了有利的场所。布鲁氏菌在感染的细胞内与内质网相互作用,可表现出免疫逃避和细胞凋亡抑制的功能。是细胞凋亡转录因子,当内质网应激超过自身的应答能力时,诱导的高表达,引发细胞凋亡。本研究表明,沉默和过表达分别可提高和抑制M5-90介导的细胞中的表达。笔者推测沉默可通过诱导M5-90介导的细胞中的表达促进细胞发生凋亡,从而抑制胞内 M5-90 菌株的存活;因此,可能通过的表达来调控胞内布鲁氏菌的存活。

