枸杞鲜果采后主要病原菌分离鉴定及不同品种枸杞抗病性评价
李晓莺, 朱丽珍, 张曦燕, 闫亚美, 刘兰英, 米 佳, 禄 璐, 何 军
(1.宁夏农林科学院枸杞科学研究所,宁夏银川 750002; 2.宁夏大学农学院,宁夏银川 750021)
枸杞(L.)是茄科枸杞属多年生落叶小灌木,广泛分布于我国西北干旱和半干旱地区,作为一种传统药物已被广泛使用了数千年。枸杞作为宁夏最具地方特色的优势产业,在促进农业效益、农民增收致富中起着决定性作用。枸杞果实中含有丰富的活性物质,主要包括枸杞多糖、维生素、类黄酮、多酚等物质,是理想的药食资源,在增强免疫力、防衰老、抗氧化、降血糖血脂等方面具有显著功效。目前,枸杞浆果干制是其主要的加工方式,但制干过程中会导致大量活性成分的流失。枸杞鲜果的各种营养成分含量均比干果的高,营养价值优于干果,导致近年来能够使活性成分得以最大程度保留的鲜果枸杞需求日益增大。
枸杞鲜食不仅能更加充分地发挥其清除自由基、促进代谢的功效,而且也可以降低氨基酸、类胡萝卜素等功能性成分的流失。但是由于枸杞鲜果皮薄肉嫩,水分含量高,采后容易受致腐病原真菌的侵染,常温条件下果实放置2~4 d 就会变色、变味,腐烂指数逐步上升。放置8~10 d,果实腐烂指数迅速增加,甚至完全失去食用价值。但是,目前鲜果市场主要面对的难题是采后加工、运输和贮藏期间造成的腐烂而导致的重大经济损失。据相关调查研究表明,在发达国家鲜果采摘后损失率一般在 25%以上,发展中国家则在 50%以上。而造成果实采后腐烂的最主要致腐菌为病原真菌,主要包括青霉属、链格孢属、曲霉属和木霉属等。因此,如何控制枸杞采后腐烂已成为解决鲜果枸杞产业发展的关键问题之一。
目前对导致鲜食枸杞腐烂现象的研究较少,通过研究发现,果实病害与其枸杞品种自身的抗性相关,现在枸杞的栽培品种品系很多,主要还是以宁杞系列枸杞为主。李捷研究发现,在接种致病力强菌尖孢镰孢菌后,抗病能力依次表现为(枸杞属美洲野生种)>(枸杞属美洲野生种)>宁夏枸杞=中国枸杞>黑果枸杞>宁杞2号>宁杞1号>宁杞5号。研究者通过室内和田间的炭疽病抗病性鉴定发现,宁杞1号和截萼枸杞是相对较抗病的品种,进而说明不同枸杞品种的抗病性存在差异。此外,大量研究表明,鲜果自身携带的生物源能诱导抗性因子的产生,这类常应用于果实采后病害生物防治的微生物生物因子主要包括细菌、酵母菌、类酵母菌和木霉等。张小彦等在健康枸杞植株根际土壤样品中筛选出对枸杞根腐病菌具有抑制效果的菌株,其中最高抑菌率可达到52%,该研究结果可为有效利用微生物拮抗作用防治枸杞根腐病提供理论依据。
本研究通过分离、鉴定枸杞鲜果在贮藏保鲜过程中产生的病原菌种类,为延长枸杞鲜果的贮藏期提供科学依据;同时,通过回接的方式对不同主栽枸杞品种的抗病性展开研究,为筛选适合鲜食枸杞的品种提供理论依据;进一步在研究过程中筛选拮抗菌,对延长鲜果枸杞产业链,增加农民收入,促进枸杞产业的发展具有重要意义。
1 材料与方法
1.1 试验材料
供试果实为头茬枸杞鲜果,采自宁夏农林科学院园林场,品种为宁杞1号、宁杞5号、宁杞7 号。挑选大小、色泽较均一,表面无明显病虫害和机械损伤且带果柄的果实放入4 ℃冷藏保鲜备用。
1.2 仪器与设备
试验仪器主要有超净工作台(SW-GJ-2FD型,上海坤权生物科技有限公司)、高压灭菌锅(YXQ-LS-100SⅡ型,上海博迅实业有限公司)、智能人工气侯培养箱(ZRX-258E型,杭州钱江仪器设备有限公司)、荧光显微镜及DIC微分干涉仪[BX51型,奥林巴斯(中国)投资有限公司]、植物图像分析仪(LA-S 杭州万深探测科技有限公司)、超纯水机(AXLK-181型,北京思普特科技有限公司)。
1.3 试验时间与地点
1.3.1 试验时间与地点 试验于2021年6月在宁夏农林科学院枸杞科学所枸杞贮藏保鲜加工实验室进行。
1.4 试验方法
1.4.1 培养基的选择 采用马铃薯葡萄糖琼脂培养基 (PDA 培养基)培养枸杞的病害组织。称取6.0 g马铃薯粉,20.0 g葡萄糖,20.0 g琼脂粉,加入1 000 mL蒸馏水中,调节pH值为5.4~5.8;115 ℃高压灭菌 20 min,倒入培养皿中,备用。
1.4.2 病原菌分离与纯化 选取在冰箱保鲜7 d后呈明显发病症状的枸杞鲜果,先用75%乙醇溶液表面消毒后,移入超净台,用无菌镊子去除表层菌丝,挑取4~6块直径约2 mm的内部腐烂组织,分别用无菌水漂洗后转移至同一PDA 培养基上并均匀分布,26 ℃条件下培养1 d。待菌株长出菌丝,立即转接到新的PDA 平板上,继续重复此操作3次,直至获得菌株的纯培养。观察分离培养基平板上菌落的形态,包括形状、色泽、大小、菌丝特征。将单菌落的病原菌制片后,用复红染色后在10、20、40 倍目镜及100倍油镜下观察菌丝形态、孢子形状,记录观察结果并拍照。
1.4.3 病原菌基因组精细图测序分析 提取高质量基因组DNA,利用Nanodrop、Qubit和0.35%琼脂糖凝胶电泳进行纯度、浓度和完整性质检;BluePippin全自动核酸回收系统回收大片段DNA;文库构建(SQK-LSK109连接试剂盒):包括DNA损伤修复和末端修复,磁珠纯化;接头连接,磁珠纯化;Qubit文库定量;上机测序4个步骤。测序结果在国家生物技术信息中心(https://www.ncbi.nlm.nih.gov)的数据库中比对,将病原菌鉴定到种,明确其分类地位。
1.4.4 不同枸杞品种对病原菌的抗病性研究 分别挑选宁杞1号、宁杞5号、宁杞7 号的优级鲜果,用2%次氯酸钠溶液浸泡2 min 后用灭菌蒸馏水冲洗,转入超净台内晾干,用无菌移液枪枪头分别刺伤果实。再用移液枪吸取无菌水在5种菌株上吸打后,分别接种到宁杞1号、宁杞5号、宁杞7 号的伤口处。将接种后的果实置于培养皿中保湿培养。每个处理5个果实,重复3次,定期观察接种处是否有致病性及病害症状表现。用LA-S植物图像分析仪进行果实病斑损害的分析,并对损害面积进行统计。
2 结果与分析
2.1 枸杞鲜果采后病害的发病症状
常温条件下,采收1~2 d后果表就可观察到菌丝,冷藏保存条件下5~7 d可观察到。通过对不同果实发病症状的观察,可将果实主要发病症状分为4类,4类病斑的果实发病症状见图1、表1。对不同枸杞品种果实发病情况进行了调查,结果见表1。


表1 枸杞果实发病症状及不同品种发病情况调查
2.2 枸杞鲜果采后主要病原菌的分离与鉴定
根据发病症状,选择不同症状特点的病斑进行病原菌的分离和鉴定,共分离到4株真菌菌株和1株细菌菌株,其中不同真菌菌株的菌落和孢子形态描述见图2、图3、表2。本研究对这5类菌株的形态学初步鉴定结果见表2。
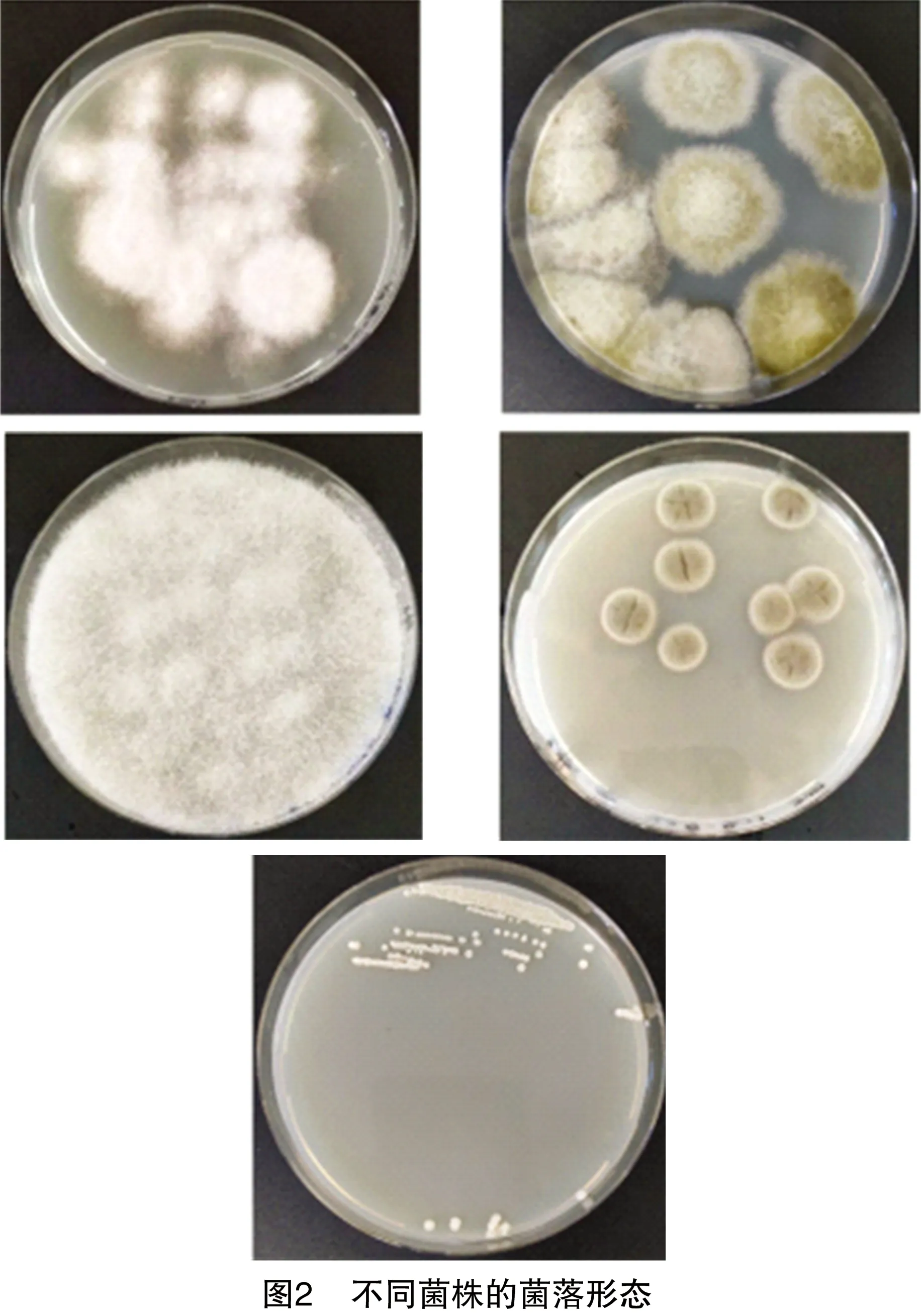
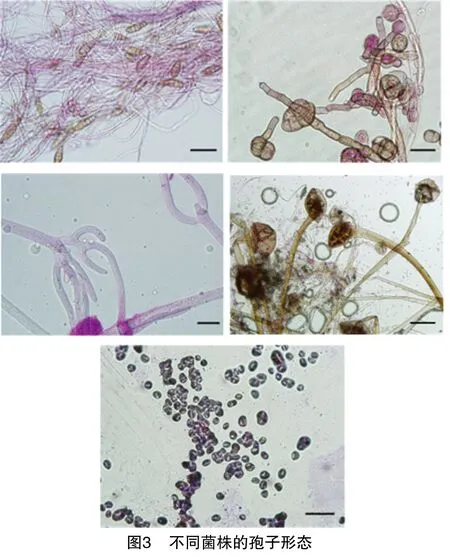

表2 枸杞不同菌株的菌落和孢子形态描述
2.3 病原菌的分子生物学鉴定
2.3.1 基因组测序分析 根据上述试验和分析,由于Ⅳ类病斑具有明显的结构特征,霉菌上研究较多(未送样),Ⅴ类病斑有拮抗微生物潜力,因此选择4类研究相对较少的菌株进行送样测序,分别是Ⅰ类、Ⅱ类、Ⅲ类、Ⅴ类菌株,将4类菌株送到北京百迈克生物科技有限公司进行病原菌基因组精细图测序分析。使用NECAT软件进行组装,最后采用Pilon软件利用二代数据进一步对组装基因组进行纠错,得到最终准确度更高的基因组。4类菌送样编号分别为RO1、RO2、RO3、RO4。最后统计结果如表3所示。
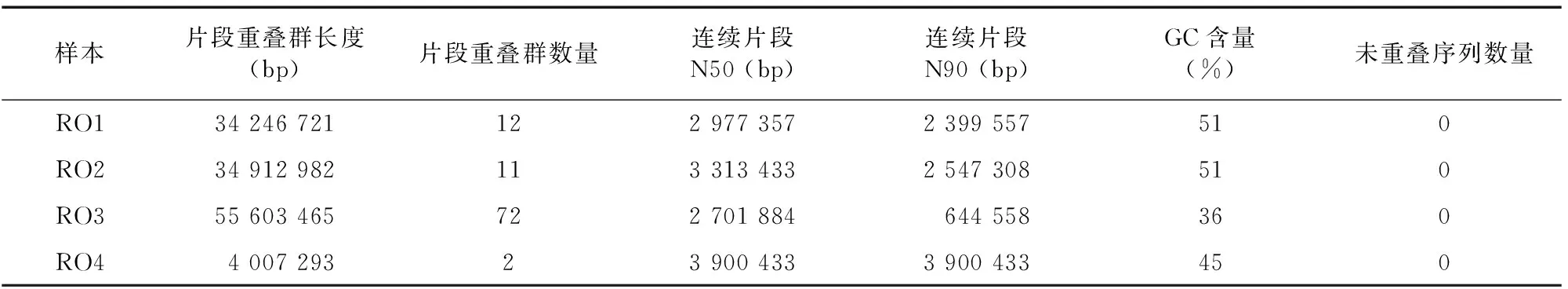
表3 基因组组装结果统计
由于物种间重复序列的保守性相对较低,针对特定的物种进行重复序列的预测时需要构建特定的重复序列数据库。因此,借助LTR_FINDER v 1.05、MITE-Hunter、RepeatScout v1.0.5、PILER-DF v2.4等软件,基于结构预测和从头预测的原理构建该真菌基因组的重复序列数据库,用PASTEClassifier对数据库进行分类,再与Repbase的数据库合并作为最终的重复序列数据库,最后利用 RepeatMasker v4.0.6软件基于构建好的重复序列数据库对该真菌进行重复序列的预测,得到 472 549 bp 的重复序列,重复序列比例为1.38%(表4)。
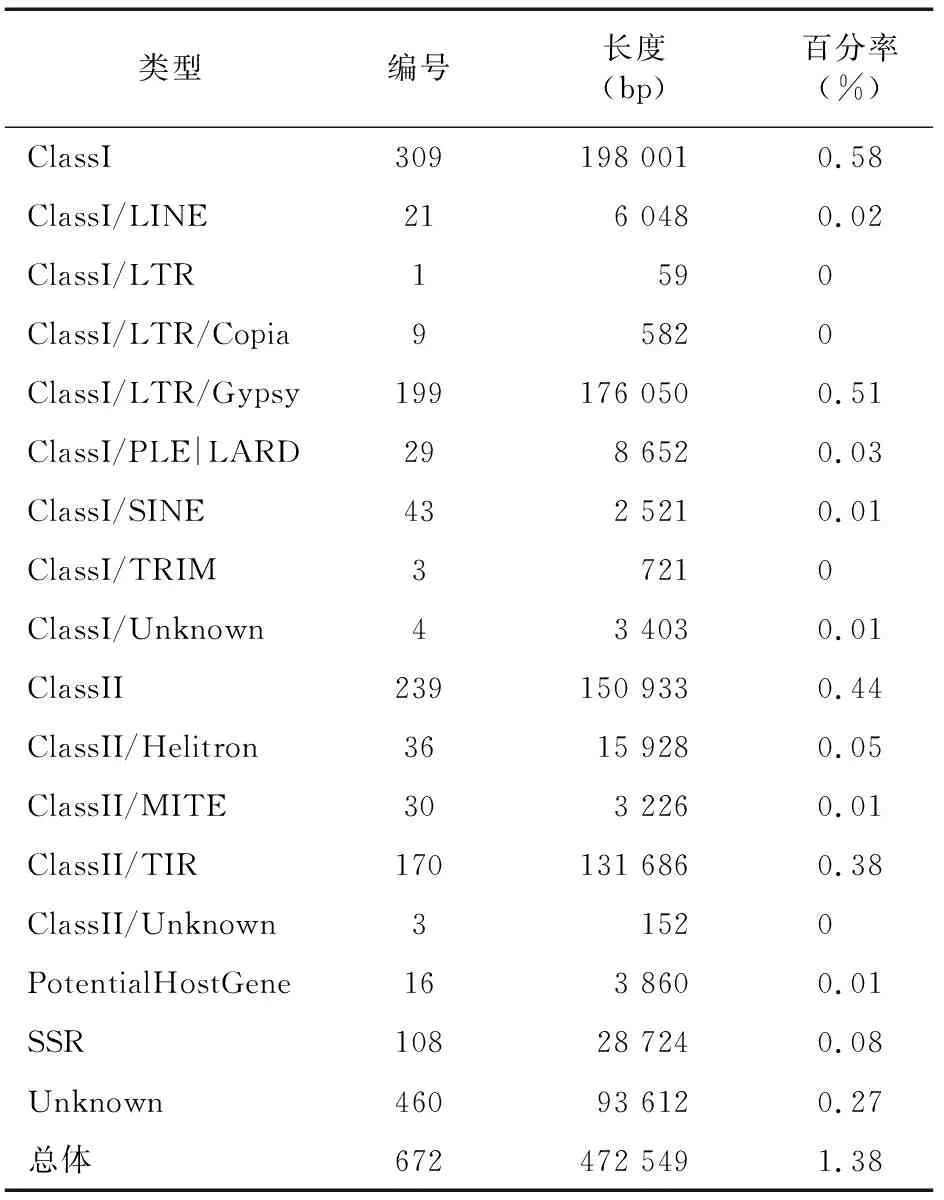
表4 重复序列预测结果统计
通过重复序列预测统计编码蛋白基因的数量、平均长度,以及内含子、外显子的数量和平均长度进一步确定基因组组分。确定Ⅰ类、Ⅱ类、Ⅲ类菌为真菌菌株,Ⅴ类菌为细菌菌株。其中3类真菌菌株的基因基本信息见表5。4个菌株经基因组测序后,获得4个菌株的Contig重叠区,经重叠分析就可以得到完整的染色体基因组序列。

表5 基因基本信息统计
2.3.2 病原菌的分子鉴定 进一步从GenBank数据库中选择4个菌株及其近缘种的rDNA-ITS序列,与供试菌株构建系统发育树。
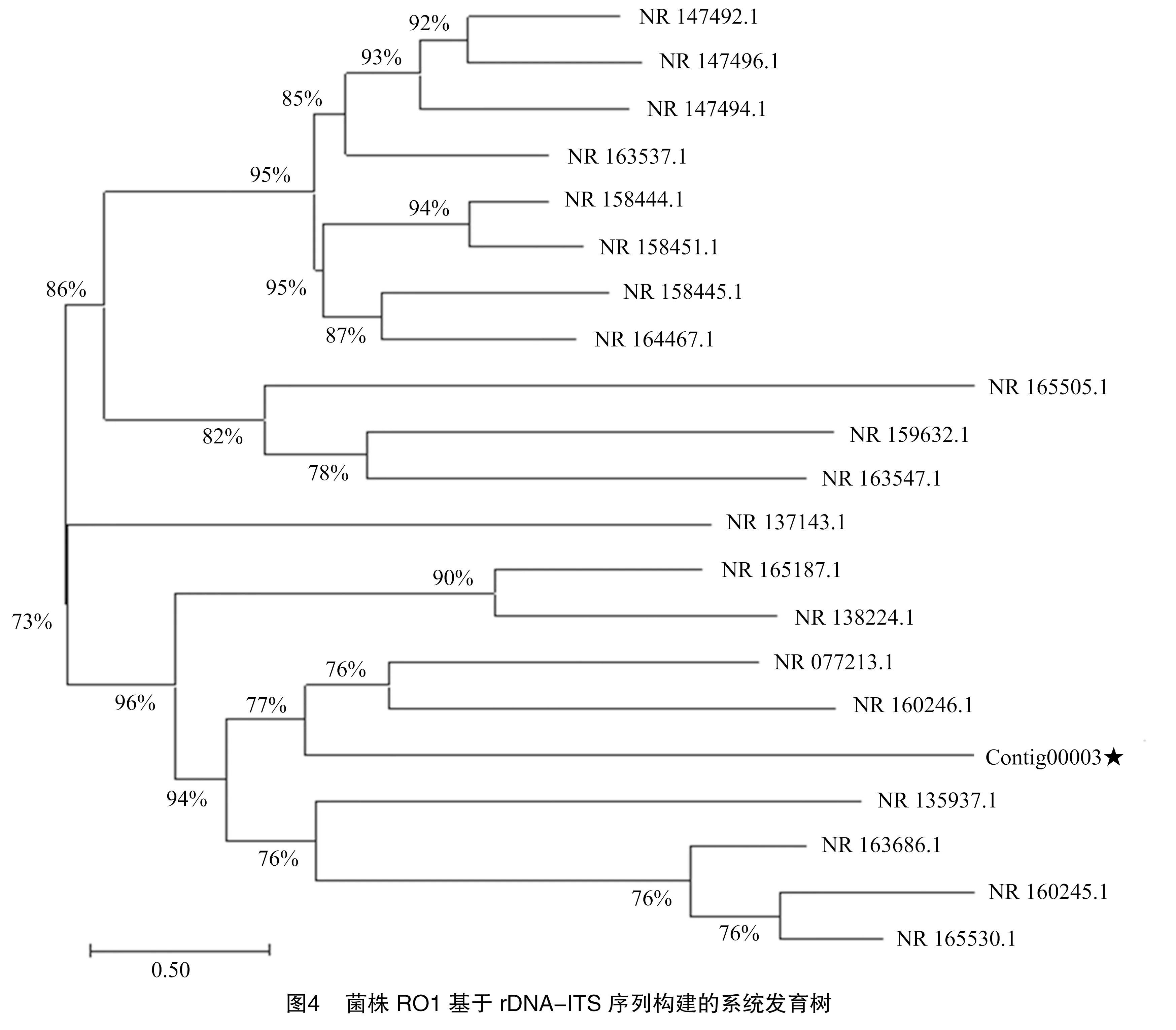
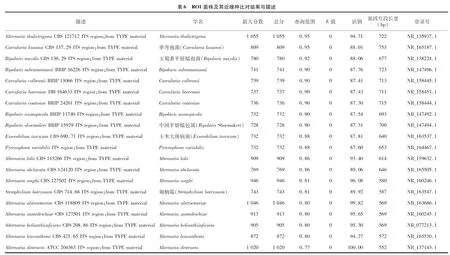
将Ⅰ类菌基因序列测序结果Contig00003在NCBI上通过 BLAST比对,与同源性相近的20个登录号序列建立系统发育树,与链格孢霉属的和对应登录号分别为NR 160246.1和NR 077213.1同源性较高,位于系统发育树的同一分支,聚为一类(图4、表6)。鉴定结果与形态学鉴定结果一致,结合形态鉴定结果,最终确定Ⅰ类病原菌为链格孢霉属,具体种名还有待进一步明确。
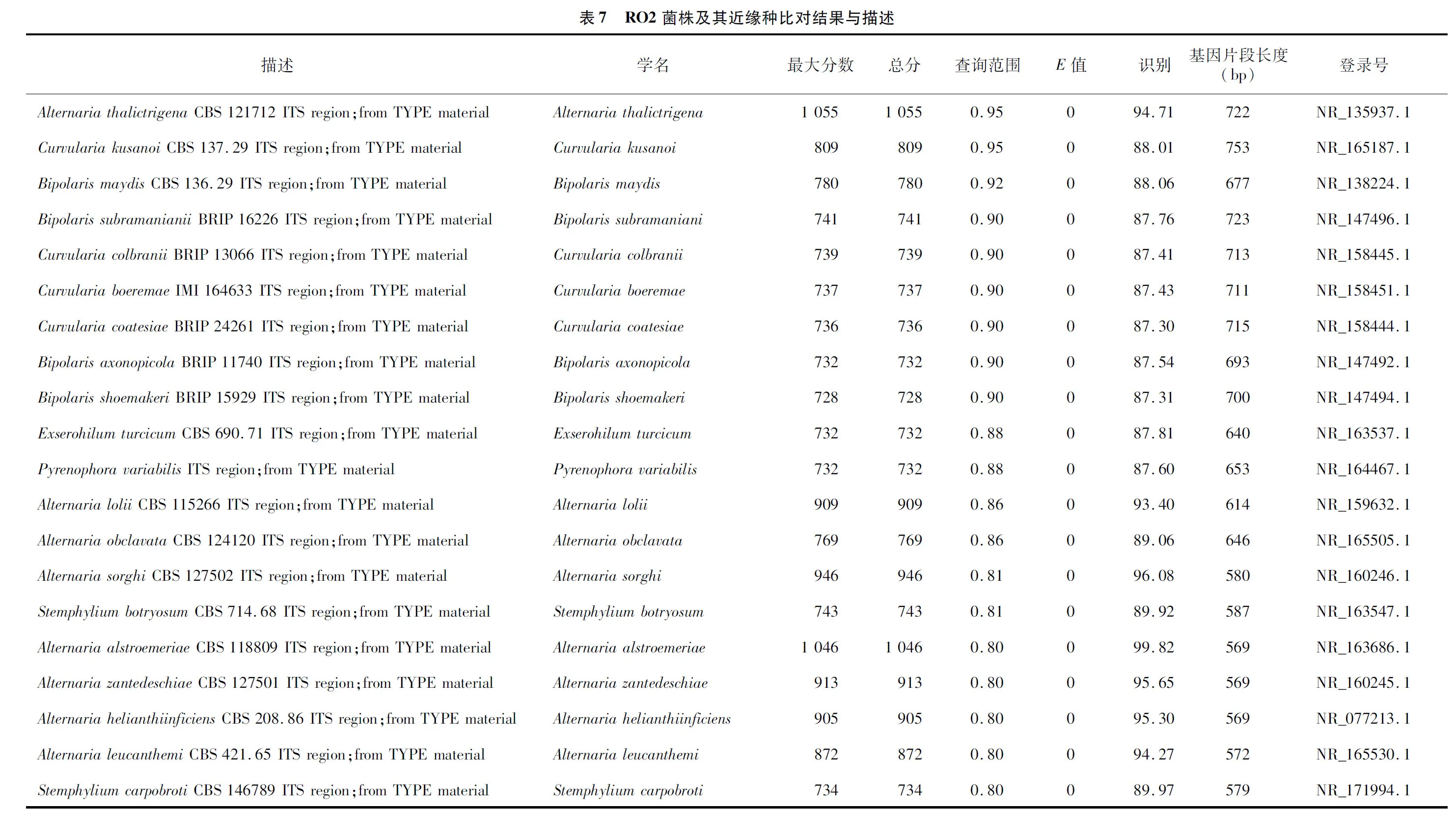
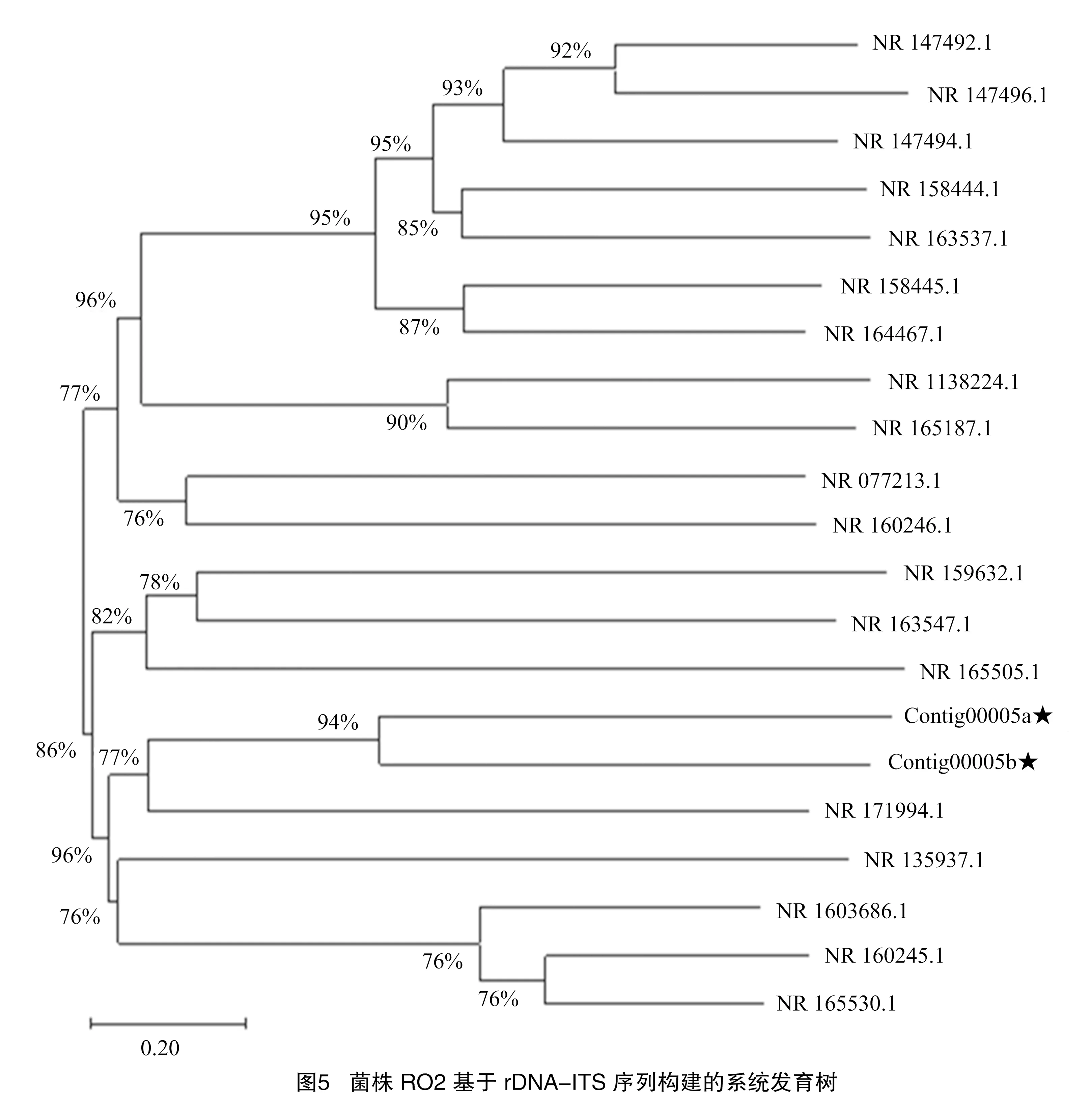
将Ⅱ类菌基因序列测序结果Contig00005a和Contig00005b在NCBI上通过 BLAST比对,与同源性相近的20个登录号序列建立系统发育树,与葡柄霉属的对应登录号为NR 171994.1同源性较高,位于系统发育树的同一分支,聚为一类(表7、图5)。鉴定结果与形态学鉴定结果一致, 结合形态鉴定结果, 最终确定Ⅱ类病原菌为葡柄霉属,具体种名还有待进一步明确。
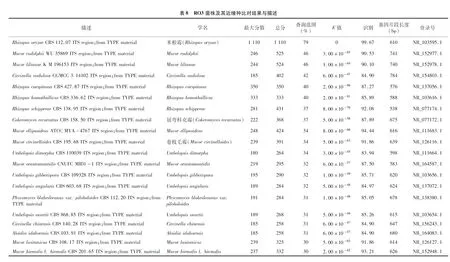
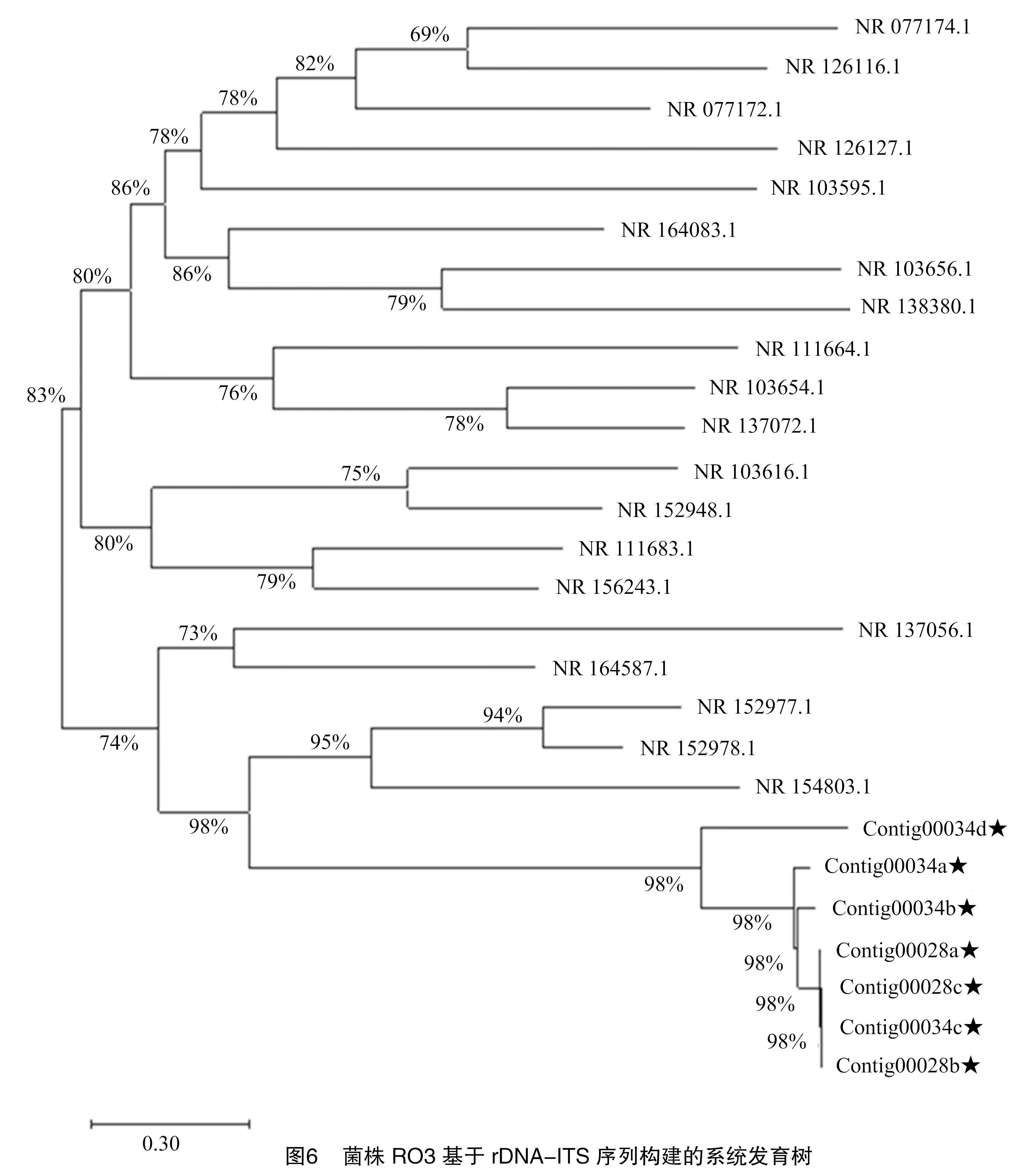
将Ⅲ类菌基因序列测序结果Contig00034a、Contig00034b、Contig00034c、Contig00034d、Contig00028a、Contig00028b、Contig00028c在NCBI上通过 BLAST比对,与同源性相近的20个登录号序列建立系统发育树,与卷毛霉属的和毛霉属的、对应登录号分别为NR 154803.1,NR 152977.1,NR 152978.1同源性较高,位于系统发育树的同一分支,聚为一类(表8、图6)。鉴定结果与形态学鉴定结果一致,结合形态鉴定结果,最终确定Ⅲ类病原菌为毛霉属,具体种名还有待进一步明确。
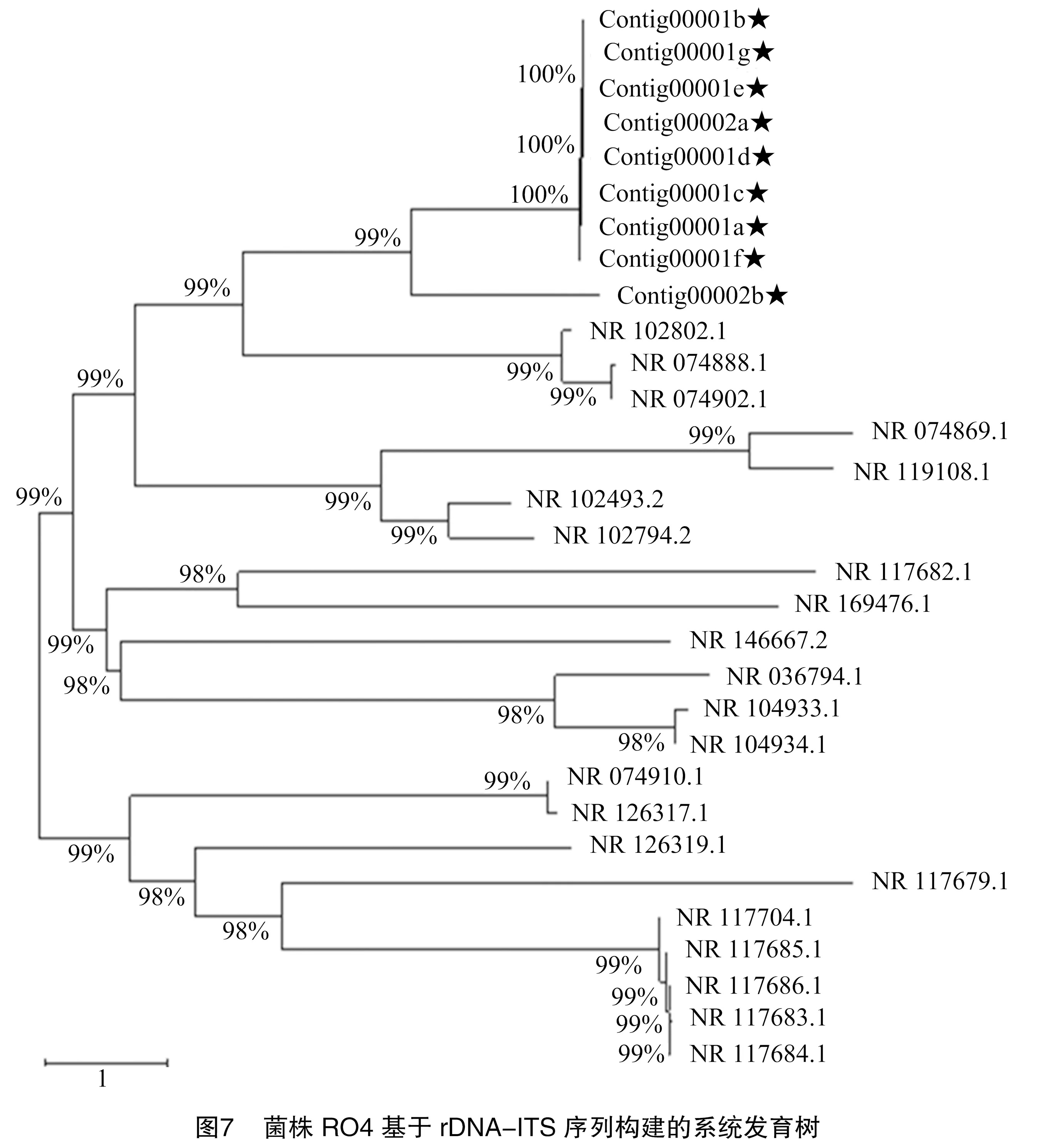
将Ⅴ类菌基因序列测序结果Contig00001a、Contig00002a、Contig00001b、Contig00001c、Contig00001d、Contig00001e、Contig00001f、Contig00001g和Contig00002b在NCBI上通过 BLAST比对,与同源性相近的20个登录号序列建立系统发育树,与杆菌的z3032和ATCC 35469对应登录号分别为NR 102802.1和NR 074888.1,以及沙门菌的NR 074902.1同源性较高,位于系统发育树的同一分支,聚为一类(表9、图7)。鉴定结果与形态学鉴定结果一致,结合形态鉴定结果,最终确定Ⅴ类病原菌为杆菌和沙门菌属的近缘菌,具体种名还有待进一步明确。

2.4 病原菌致病性测定及不同枸杞品种鲜果对病害响应
将分离纯化的菌种回接到健康枸杞上,Ⅰ、Ⅱ、Ⅲ、Ⅳ等 4类病原菌均有发病,且表现出和腐烂枸杞病害相一致的典型症状;Ⅴ类菌无发病症状。从接种发病的枸杞上再进行分离纯化培养,性状与原来的微生物相同,得到与原来一样的接种菌,依照科赫氏法则(Koch’s Rule),可知分离的Ⅰ、Ⅱ、Ⅲ、Ⅳ这4种病原菌是该品种枸杞采后病害的主要致病菌,Ⅴ类菌为非致病菌(表10)。

表10 不同真菌菌株回接枸杞后发病情况统计
用LA-S植物图像分析仪进行果实病斑损害的分析,并对损害面积进行统计,统计结果见表11。
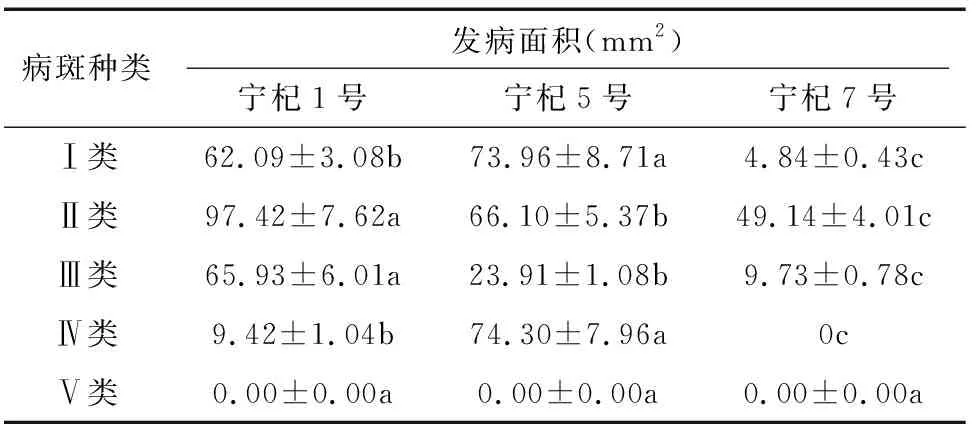
表11 不同真菌菌株回接枸杞后发病面积统计
通过对相同回接方式,相同回接时间后不同枸杞受损面积进行分析发现,宁杞7号具有明显的抗病害潜力(图8、表11)。其中, Ⅰ类病斑抗性,宁杞7号>宁杞1号>宁杞5号;Ⅱ类病斑抗性,宁杞7号>宁杞5号>宁杞1号;Ⅲ类病斑抗性,宁杞7号>宁杞5号>宁杞1号;Ⅳ类病斑抗性,宁杞7号>宁杞1号>宁杞5号。Ⅴ类菌株在任何枸杞上均无发病症状。

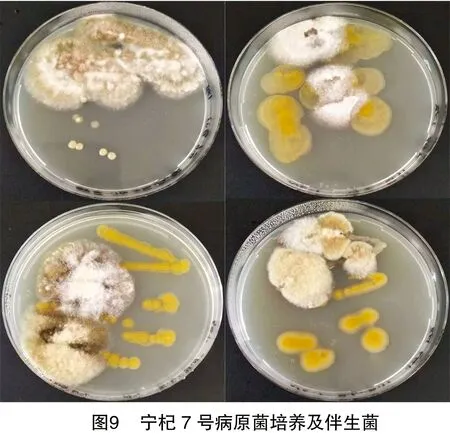
通过对不同枸杞品种鲜果上病原菌的分离对比,除了发现宁杞7号具有明显的抗病害潜力外,还发现Ⅴ类菌株在3个枸杞品种中无病害症状,但在果实分离病害时发现,宁杞7号的所有病害均伴随Ⅴ类病斑(图9)。因此,考虑该菌株是否具有拮抗病害微生物的能力,可为病害拮抗菌的筛选和生物防治提供基础;另外,考虑宁杞7号是否含有影响该类菌株的营养物质,导致该类菌株的富集,最终影响宁杞7号抵抗病害的能力。
3 结论与讨论
枸杞采后腐烂是鲜果主要病害之一,其中病原真菌是果实采后腐烂的主要致腐菌,病原真菌主要包括链格孢属、匍柄霉属、毛霉属、曲霉属、芽枝霉属、镰孢属、青霉属、根霉属等。本研究利用组织分离法从发病的果实病斑处分离得到了5株菌株,通过形态学、分子测序和菌株回接试验确定4株为真菌菌株和1株为细菌菌株。
Ⅰ类病斑对应的链格孢属真菌作为果实采后常见的潜伏侵染病原菌,是半知菌暗色丝孢菌中重要的一类,主要通过产生毒素和代谢物等致病因子诱发果实腐烂等病害的发生。本研究发现,链格孢属真菌在自然发病条件下至少有2 个种和能引起枸杞鲜果的采后腐烂,与王晓等的研究结果相符。Ⅱ类病斑对应的匍柄霉属,是链格孢属的近似属,亦作为一种独立的真菌类群广泛分布于植物组织中,是浆果类采摘后腐烂的主要病原菌。Ⅲ类菌经形态学和分子生物学鉴定为毛霉菌,多在高温、高湿度以及通风不良的条件下快速孳生,加速鲜果腐烂进程。目前在鲜果上的研究较少,但根据枸杞鲜果采后病原菌的发病情况观察,该类菌在鲜果采后腐烂进程中发挥重要作用。Ⅳ类病原菌在枸杞及其他浆果植物上研究较多,真菌形态具有明显特征,曲霉属黑曲霉菌,亦是枸杞果实腐烂部位的主要分离菌株。黑曲霉能导致水分较高的食物、果蔬等发生霉腐变质,且有可能产生致癌性的黄曲霉毒素,对人体危害性大。此外,真菌还会产生次级代谢产物及其他真菌毒素,对人类和农场牲畜都具有高度毒性。随着人们生活水平和食品安全意识的提高,果蔬微生物安全控制越发受到重视,枸杞无论是鲜食还是加工干制都需要严格控制微生物生长,通过分离鉴定出鲜枸杞的主要致病微生物,为采取有效措施抑制微生物生长提供了理论依据,也为今后枸杞及制品安全流通提供了技术保障。
笔者进一步对枸杞三大主要栽培种进行了抗病性鉴定,发现宁杞7号具有明显抗四大真菌病害的优势。尽管对宁杞7号抗病性研究较少,但本研究也进一步验证了李捷的研究,即不同枸杞品种的抗病性存在差异。此外,在果实分离病害时发现,具有明显抗病优势的宁杞7号在健康果和病害果实上均分离出Ⅴ类菌株,且回接该菌株后在任一枸杞品种上均无发病症状。之前也有关于杆菌类作为生防菌株的相关报道,Obagwu等首次报道了分离自柑橘果实表面的枯草芽孢杆菌可有效地抑制柑橘青绿霉病。冯玉衡筛选出2株沙福芽孢杆菌能够抑制马铃薯黑痣病和枯萎病的发生,徐同伟等筛选出一株芽孢杆菌用于抑制烟草黑胫病。何文琪等从莲雾上分离得到一株对莲雾软腐病病原菌具有明显拮抗效果的芽孢杆菌菌株,可以作为抑制莲雾软腐病的潜在生防菌。因此,考虑Ⅴ类菌株亦具有拮抗病害微生物的能力,可以作为抑制枸杞鲜果腐烂病害的潜在生防菌,可为今后枸杞鲜果采后腐烂病害拮抗菌的筛选和生物防治提供基础。

