碳负载二元氮化物的合成及其电催化二氧化碳还原性能的研究
侯朋飞,白建明,康 鹏
(1.华电重工股份有限公司,北京 100070; 2.天津大学 化工学院,天津 300350;3.中国科学院理化技术研究所 光化学转换与功能材料重点实验室,北京 100190)
通过可再生能源驱动CO2转化为有价值的燃料或者化工原料是实现CO2资源化利用最具有应用前景的途径[1-3]。其中,CO是最主要的C1产物[4]。尽管电催化CO2还原前景可期,但仍需付出巨大的努力才能推动该领域的发展,实现规模化应用。开发出性能优异的催化剂,是目前亟需解决的问题[5]。
CO2还原的电催化剂种类繁多并且合成策略多样[6]。过渡金属氮化物因其优异的催化性能和独特的电子结构,在电催化能源转化领域广泛应用[7]。调控材料组分和氮掺杂策略是提高材料催化性能的有效途径[5,8]。Kim D等[5]合成了不同结构的AuCu合金,可将CO2高效的还原为CO。Sarfraz S等[1]合成了Cu-Sn二元金属催化剂,在液相电解中可以将CO2电催化还原为CO,并且CO法拉第效率超过90%。Yin Z等[9]制备了钙钛矿型Cu3N立方纳米材料,其中粒径约25 nm的Cu3N纳米颗粒在-1.6 V(vs. RHE)时可将CO2高效的转化为乙烯,法拉第效率超过60%。Zhang M等[10]制备了氮掺杂N-Ta2O5/C纳米材料,在-0.73 V(vs. RHE)时可将CO2高效的转化为CO。
笔者前期研究了不同过渡金属氮化物电催化还原CO2的性能,但二元氮化物用于电催化CO2的研究较少。本文通过程序升温法制备具有Ni4N立方相的Ni3Cu-C和Ni3Zn-C二元过渡金属氮化物。通过X射线衍射、透射电镜、X射线光电子能谱等方法分析样品的物理化学特性,在传统的液相电解中探究样品对电催化CO2还原反应的催化性能。
1 实验部分
1.1 主要试剂及仪器
六水合硝酸镍(≥98.0%),西陇化工股份有限公司,分析纯;三水合硝酸铜(99%),阿拉丁试剂(上海)有限公司,分析纯;六水合硝酸锌(99.99%),阿拉丁试剂(上海)有限公司,分析纯;导电炭黑(Vulcan XC-72R,记作C),卡博特公司;无水乙醇(≥99.7%),北京化工厂;碳酸氢钠(99.95%),西陇化工股份有限公司,分析纯;N,N-二甲基甲酰胺(≥99.5%),北京化工厂,分析纯。
1.2 二元氮化物制备
通过程序升温控制法在氨气气氛中合成NiCu和NiZn样品,以Ni3Cu-C样品为例详述材料合成方法,具体步骤如下:(1)3 mmol镍盐和1 mmol铜盐和1 g导电炭黑加入含有100 mL乙醇的烧杯中,超声处理0.5 h,并在常温下搅拌1天;(2)将上述步骤中的烧杯置于85 ℃的油浴中蒸干,然后在120 ℃的烘箱中干燥,研磨待用;(3)将适量的Ni3Cu-C前驱体放于瓷舟,置于管式炉中,在氨气气氛中(氨气流速为100 mL·min-1)以5 ℃·min-1的升温速率从室温加热至反应温度600 ℃,并保持3 h,随后以3.3 ℃·min-1的冷却速率冷却至300 ℃后自然冷却至室温,得到的样品收集待用。Ni2Cu2-C、NiCu3-C和Ni3Zn-C样品制备采用的是相同的方法,只是所加入的金属盐比例不同。
1.3 二元氮化物表征
样品X射线衍射谱(XRD)在德国Bruker公司DAVINCI D8 ADVANCE衍射仪上采集,衍射源Cu Kα,λ=1.54 184 nm,2θ=10°~90°,步长为0.1°;样品形貌通过透射电镜图像(TEM)和高分辨透射电镜图像(HRTEM)获得,电子显微镜分别为JEOL JEM-2100和JEOL JEM-2100F,工作电压200 kV。镍基材料表面元素组分及化学价态分析通过X射线光电子能谱(XPS)在Kratos Analytical Axis UltraDLD光谱仪上获得,衍射源为单色X射线Al Kα射线(1486.6 eV)。所有元素结合能的峰位置均参考284.8 eV处的C 1s峰。Quantachrome Autosorb-1-C-TCD分析仪(BET);Varian 710-OES电感耦合等离子体发射光谱仪(ICP-AES);电化学测试采用上海辰华仪器有限公司CHI660E电化学工作站;气体样品测试采用美国SRI公司SRI 8610C气相色谱;液相还原产物采用德国Bruker公司AVANCE 400核磁分析仪等。
1.4 电化学测试
电化学测试使用H型电解池,采用标准的三电极电解体系,对电极和参比电极分别为铂丝和饱和甘汞电极(SCE)。工作电极是表面负载有催化剂的玻碳电极,其制备过程如下:10 mg催化剂和50 μL 质量分数5%的Nafion溶液分散到0.95 mL乙醇中,随后超声处理1 h,形成均匀的分散液。取5 μL均匀的分散液分散于直径3 mm的玻碳电极上,室温下干燥待用。循环伏安曲线(CVs)在Ar或CO2饱和的0.5 mol·L-1NaHCO3电解液中进行测试,扫描速率为100 mV·s-1。饱和甘汞参比电极测得的电位,通过方程E(vs.RHE)=E(vs. SCE)+0.245V+0.0591×pH转换为相对于可逆氢电极(RHE)的电位。在恒电位电解前,电解液中先通0.5 h高纯度CO2,以除去电解液中溶解的空气并对电解液进行CO2饱和,而后在密封条件下电解1 h。电解池工作电极侧顶部空间的气相产物通过气相色谱(GC)进行产物检测。液相产物通过核磁方法进行检测,通过测试液相产物的氢谱,用DMF做内标,对产物浓度进行标定。
2 结果与讨论
2.1 XRD分析
图1为合成的不同二元氮化物的XRD图。Ni3Cu-C和Ni3Zn-C样品仅检测到与Ni4N相(JCPDS no.36-1300)匹配的衍射峰。Ni2Cu2-C和NiCu3-C样品中检测到与Ni4N相和Cu相(JCPDS no.04-0836)匹配的两组衍射峰。随着镍含量的减少,Cu相逐渐增多,Ni4N相逐渐减少。与Ni3Cu-C的XRD衍射峰相比,Ni3Zn-C样品的衍射峰均向2θ值偏大的方向偏移,这是因为Zn的原子半径较大,使得晶面间距增加。
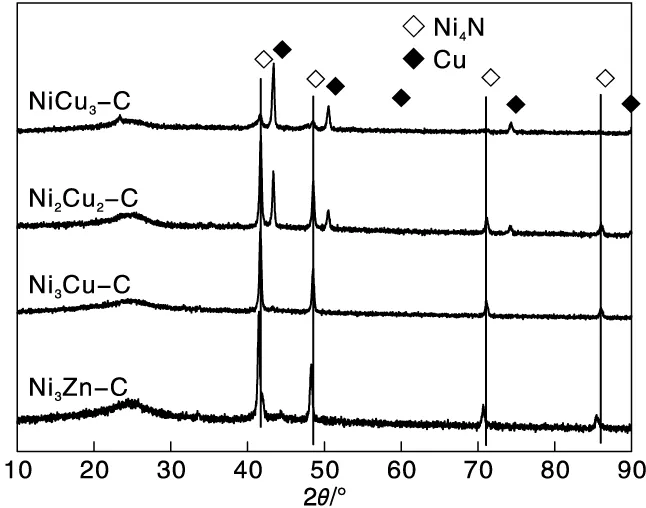
图1 NiCu3-C,Ni2Cu2-C,Ni3Cu-C和Ni3Zn-C样品的XRD图Figure 1 XRD patterns of NiCu3-C,Ni2Cu2-C,Ni3Cu-C and Ni3Zn-C samples
2.2 形貌分析
对合成的不同二元氮化物进行形貌分析,结果如图2所示。

图2 不同二元氮化物样品的TEM和HRTEM照片Figure 2 TEM and HRTEM images of different binary nitride samples
图2a~b分别是Ni3Cu-C的TEM和HRTEM照片,从图中可以看出Ni3Cu纳米颗粒均匀的分散在导电炭黑上,形貌呈近似椭球形,其颗粒粒径为(16~30) nm。图2b中显示的晶格条纹约为0.349 nm,介于(100)晶面(0.375 nm)和(110)晶面(0.265 nm)之间,表明Cu取代Ni4N相中Ni原子,导致相应的晶面间距增大。图2c~d分别是Ni2Cu2-C和NiCu3-C的TEM照片,纳米颗粒都是均匀分布在导电炭黑上,其形貌与Ni3Cu-C材料类似,均呈椭球形,颗粒粒径分布也非常相似。图2e~f是Ni3Zn-C的TEM和HRTEM照片,Ni3Zn纳米颗粒部分呈立方型,部分呈椭圆形,其粒径分布为(10~20) nm。图2f中显示的晶格条纹约0.365 nm,略大于铜镍二元氮化物中的晶面。由于Zn原子的半径略大于Cu原子,所以其晶格间距有所增大,与XRD分析的结果相一致。
表1是通过ICP-AES测得的不同二元氮化物中金属元素质量分数及物质的量比。尽管所测元素比例与合成时的投料比相差较大,但也可以通过二元氮化物不同镍铜物质的量比的变化,推测出其催化性能的变化趋势。由于Zn属于低熔点金属,在600 ℃下挥发量较多,使得n(Ni)∶n(Zn)增加。通过氮气等温吸附-脱附曲线测得NiCu3-C,Ni2Cu2-C,Ni3Cu-C和Ni3Zn-C样品比表面积分别为134.7 m2·g-1、138.7 m2·g-1、138.4 m2·g-1和139.6 m2·g-1,表明这四种材料具有相似的结构。
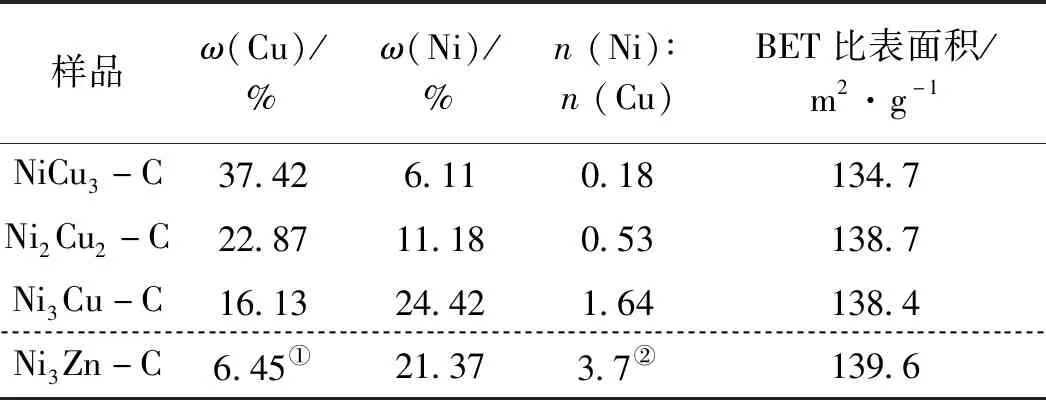
表1 不同二元氮化物样品中的金属元素含量及物质的量比和比表面积Table 1 Metal element content,molar ratio and specific surface area of different binary nitride samples
2.3 XPS分析
通过XPS分析Ni3Cu-C样品的表面化学组成和元素价态,结果如图3所示。
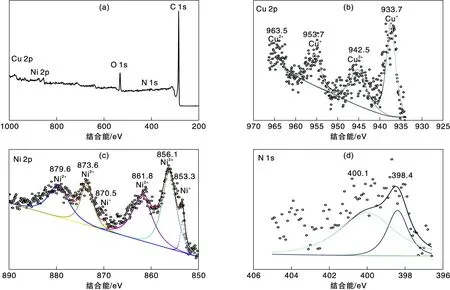
图3 Ni3Cu-C样品的XPS谱图Figure 3 XPS spectra of Ni3Cu-C sample
图3a是Ni3Cu-C样品的全谱,从图可见,样品存在Ni、Cu、O、N和C元素峰。图3b是Cu的高分辨XPS谱图,结合能位置在933.7 eV和953.7 eV的两个峰,属于Ni3Cu-C样品中Cu+物种的特征峰,而结合能位置在942.5 eV和963.5 eV的两个峰,分别对应Ni3Cu-C样品中Cu2+[11-12]物种的特征峰。图3c是Ni元素的高分辨XPS谱图,结合能位置在853.3 eV和870.5 eV的两个峰,分别属于Ni 2p3/2和Ni 2p1/2,对应于Ni4N相中的Ni+[11,13-14],结合能位置在856.1 eV,861.8 eV,873.6 eV和879.6 eV的四个峰,属于Ni 2p3/2和Ni 2p1/2的卫星峰,对应于Ni4N中的Ni2+[11,13-14]。图3d是Ni4N材料中N元素的高分辨XPS谱,可以拟合出2个不同位置的峰,在398.4 eV和400.1 eV处的特征峰,分别对应于Ni-N和C-N[13-14]。
2.4 电催化性能分析
图4a分别是4个样品在CO2饱和的0.5 mol·L-1NaHCO3电解液中的循环伏安曲线(CVs)。对于NiCu3-C样品,分别在0.46 V和0.15 V展现出两个主要的还原峰,分别对应于Cu2+→Cu+和Cu+→Cu0的还原峰[15-17]。在0.8 V出现一个属于Cu的氧化峰[16]。对于Ni2Cu2-C和Ni3Cu-C样品,CO2饱和的0.5 mol·L-1NaHCO3电解液中的CVs仅存在一个主要的还原峰,对应于Cu2+→Cu0的还原峰。而Ni3Zn-C样品的CV曲线没有明显的氧化还原峰。相同电位下Ni3Zn-C的电流密度远大于NiCu基样品,表明该材料具有更好得到催化性能。图4b是相应的Ar饱和的0.5 mol·L-1NaHCO3电解液中的CV曲线,与CO2中的结果类似。
通过控制电位电解方法,测试了4个样品在CO2气氛下进行液相电解产物的分布。图4c是4个样品电解产物中CO法拉第效率随施加电位的分布情况。如图所示,CO是二元氮化物催化剂CO2还原的主产物,并且除氢气之外未检测到其它气相或者液相产物。对于NiCu基材料,随着Cu含量的降低,CO选择性逐渐增加。由于NiCu3-C和Ni2Cu2-C样品中存在Cu单质相,在所选的电解条件下,Cu单质相的主要产物是氢气,因而导致产物中氢气法拉第效率升高,CO最大法拉第效率分别为42.4%和49.7%。而在Ni3Cu-C样品中,仅含有Ni4N相,CO最大法拉第效率达54.5%。Ni3Cu-C样品的催化性能在三个CuNi样品中具有最佳催化性能。前期的研究表明氮掺杂碳载体电催化CO2还原性能小于5%[8],这表明CO的选择性主要来源于Ni4N立方相材料。Ni3Zn-C样品上CO法拉第效率随施加电位呈先增加后下降的火山曲线分布。当电位为-0.63 V(vs. RHE)时,CO法拉第效率达到最大值,为68.1%,催化性能优于NiCu基样品。图4d是四个样品所对应的CO分电流密度。在选定电压范围内,CO分电流密度随施加电位的增加而增加。Ni3Zn-C样品CO分电流密度高于NiCu样品,其最大值为8.9 mA·cm-2。
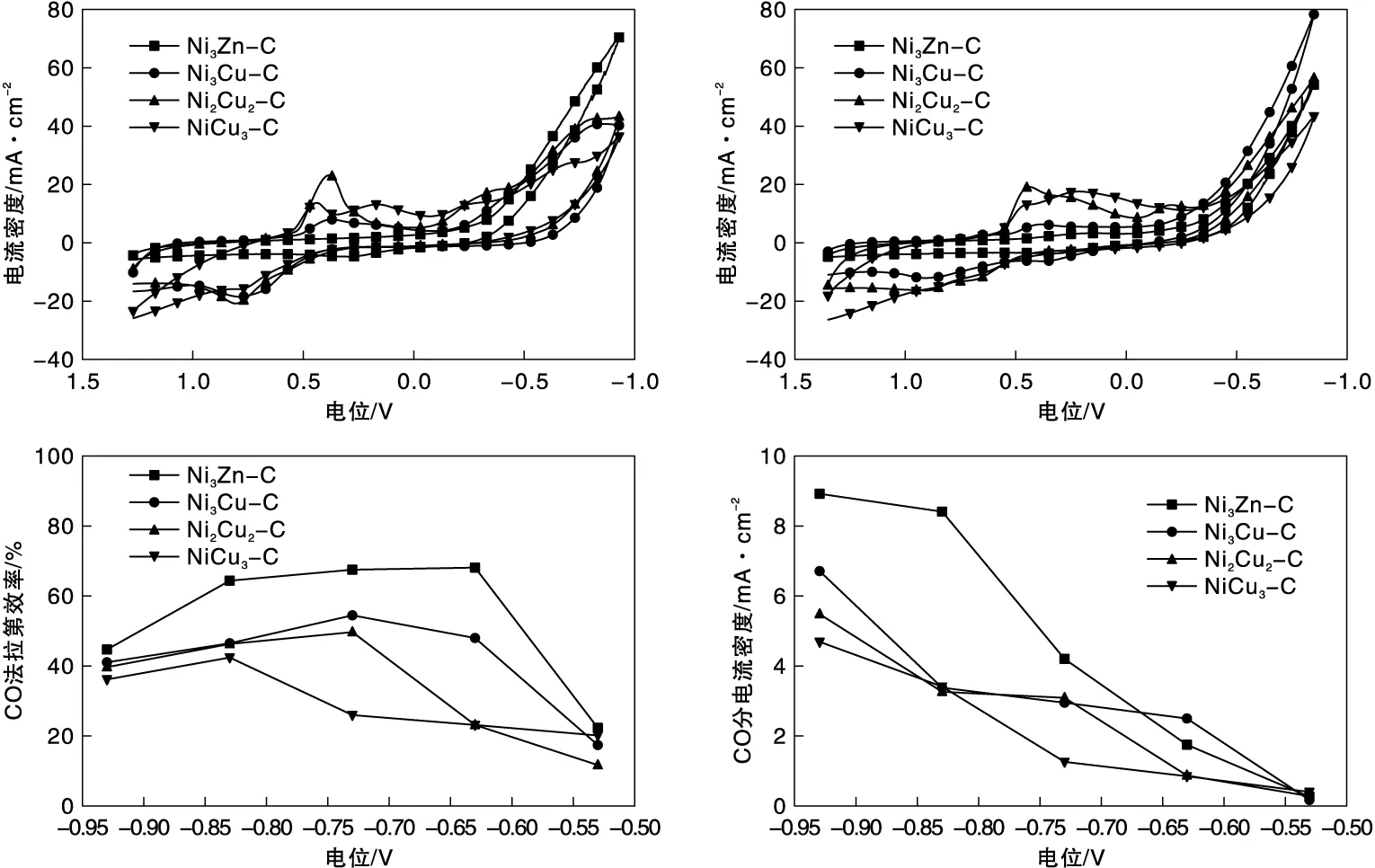
图4 NiCu3-C,Ni2Cu2-C,Ni3Cu-C和Ni3Zn-C样品的电催化性能Figure 4 Electrochemical performance of NiCu3-C,Ni2Cu2-C,Ni3Cu-C and Ni3Zn-C samples
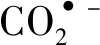
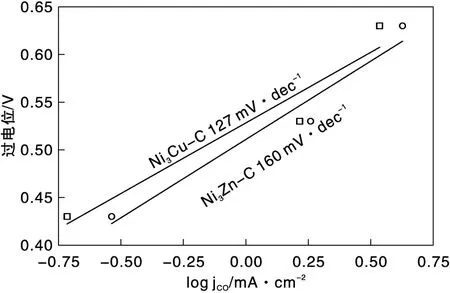
图5 Ni3Cu-C和Ni3Zn-C材料的塔菲尔曲线Figure 5 Tafel plots of Ni3Cu-C and Ni3Zn-C samples
CO2(g)+*+H+(aq)+e-→*COOH
(1)
*COOH+H+(aq)+e-→CO*+H2O
(2)
CO*→CO(g)+*
(3)
3 结 论
(1)通过浸渍-氨还原法制备了Ni4N立方相的二元氮化物Ni3Cu-C和Ni3Zn-C纳米材料,且对电催化CO2还原反应具有较高的催化性能。
(2)二元氮化物电催化还原CO2的主要产物是CO,Ni4N立方相氮化物是主要活性物质。
(3)当在0.5 mol·L-1NaHCO3溶液中进行电催化CO2还原反应时,Ni3Cu-C和Ni3Zn1-C材料可以将CO2还原为CO,且两者的最大CO的法拉第效率达54.5%和68.1%,Ni3Zn-C材料的催化性能优于NiCu基材料。

