北京市PM2.5中类腐殖质的生物氧化应激效应初探
张 东,张元勋,2,3*,尚 晶,薛凯兵,马 健,陈 琦
1. 中国科学院大学资源与环境学院,北京 100049
2. 北京燕山地球关键带国家野外科学观测研究站,北京 101408
3. 山东大学生态环境损害鉴定研究院,山东 青岛 266237
4. 北京城市气象研究院,北京 100089
5. 北京大学环境科学与工程学院,北京 100871
大气颗粒物是化学成分复杂的混合物,对人体健康的影响不仅取决于其粒径和浓度,还与其组分密切相关[1]. 研究[2]表明,大气颗粒物中的有机物和金属是两类对健康影响最重要的组分. 类腐殖质(humic-like substances, HULIS)是大气颗粒物中一类大分子有机化合物,具有复杂的化学结构,主要在生物质燃烧过程中排放并通过大气过程原位形成[3].HULIS的平均分子量在200~700 Da之间[4-6],是水溶性有机物(water soluble organic compounds, WSOCs)的重要组成部分[7],占WSOCs浓度的20%~70%,占PM2.5浓度的10%[8-9]. HULIS广泛存在于大气气溶胶、云、雾中,对大气环境具有重要的影响[10-11]. 与陆生和水生系统中常见的腐殖质一样,大气颗粒物中的HULIS由疏水性脂肪族和芳香族化合物组成,包含不同的极性官能团,如羧基(−COOH)、羟基(−CH2OH)和羰基(−COCH3)等,其中羧基含量较高[12-14]. 由于这些含氧官能团的存在,HULIS可以与金属阳离子络合,导致生成过量的活性氧(reactive oxygen species, ROS),引起机体氧化应激,进而诱导各种炎症效应,对人体健康造成损害[15-16]. 基于HULIS的环境效应和健康危害,有必要对其进行深入研究.
ROS是指机体内或自然环境中含氧并且性质活泼的物质的总称,是一类短寿命亲电化学物质,由超氧化物通过不完全还原反应产生,由于其具有重要的化学反应性,因此被认为对细胞和组织具有毒性作用[17]. ROS主要包括以下几种类型:激发态的氧分子,即单线态氧分子(1O2);含氧自由基,包括超氧阴离子自由基(O2−)、羟基自由基(·OH)和氢过氧自由基(HO2);过氧化物,包括过氧化氢(H2O2)、过氧化脂质(ROOH)等[18-19]. ROS的过量生成可能会导致其在细胞内产生与降解的失衡,从而使细胞内ROS水平升高,超过细胞耐受性,导致氧化应激[20]. 氧化应激在空气污染引起的健康效应中起至关重要的作用,能够影响机体正常的生理功能,并诱发炎症反应[21]. HULIS是颗粒有机物中的主要氧化还原物质,可以作为颗粒物中ROS产生的媒介,起到催化ROS组分形成的作用,从而对ROS的形成产生间接贡献[22].
目前,大气颗粒物化学组分对健康的影响仍是研究的热点和难点,有关大气颗粒物中HULIS诱导ROS生成的研究通常采用化学法,如二硫苏糖醇(DTT)法等[9,13],该方法以DTT来代替细胞内的辅酶或抗坏血酸,DTT的消耗速率与样品中氧化还原活性物质的浓度成正比,从而测定污染物本身携带的ROS,即外源性ROS. 体外细胞法测定的是污染物进入机体后,与细胞发生生物化学反应产生的过量ROS,即内源性ROS. 该研究分析了北京市区、郊区不同季节大气PM2.5中碳质组分的浓度特征,并以大鼠肺泡巨噬细胞NR8383作为细胞模型,测定了PM2.5及HULIS诱导内源性ROS的能力,以期对PM2.5以及HULIS的生物氧化应激效应做出定量评价.
1 材料与方法
1.1 PM2.5样品的采集
该研究布设了2个采样点. 采样点1位于北京大学城市大气环境定位观测站(116.31°E、39.99°N),采样器架设在北京大学理科一号楼的楼顶,距离地面约20 m,周围无明显的局地源排放,属于典型的市区站点;采样点2位于中国科学院大学雁栖湖校区教一楼顶(116.69°E、40.40°N),距离地面约15 m,周围多为山区,为典型郊区站点.
采样时间为2021年1月13日−2月6日(冬季)以及2021年7月31日−8月30日(夏季). 冬季使用大流量大气颗粒物采样器(TH-1000CⅡ型,武汉天虹仪表公司)采集石英膜样品(8 cm×10 cm),采样流量为1.05 m3/min,使用个体采样器(SKG100-3000型,USA)采集Teflon膜样品(直径37 mm),采样流量为10 L/min;夏季使用大流量大气颗粒物采样器(TH-1000CⅡ型,武汉天虹仪表公司)采集石英膜样品(8 cm×10 cm),采样流量为1.05 m3/min,使用小流量大气颗粒物采样器(2030D型,青岛崂应环境科技公司)采集Teflon膜样品(直径47 mm),采样流量为16.67 L/min.
采样前,将石英膜在550 ℃的马弗炉中灼烧5 h,以去除碳本底. Teflon膜在采样前后均在恒温〔(23.0±0.6)℃〕、恒湿(40%±3.5%)的超净室至少平衡48 h,使用自动称膜机(CEWS-AUTO-BE型,中国科学院重庆绿色智能技术研究院)进行称量,每张膜至少称量3次,取相差不超过0.06 mg的相邻3次称量结果的平均值[23]. 冬季采样时长为23.5 h (09:00−翌日08:30),共采集石英膜53张(空白膜4张),Teflon膜51张(空白膜4张);夏季采样时长为47.5 h(09:00−第三日08:30),共采集石英膜31张(空白膜2张),Teflon膜32张(空白膜2张). 采集的样品放入−20 ℃冰箱中保存待分析.
1.2 大气颗粒物中碳质组分的提取与定量
OC和EC的测定采用EC/OC分析仪(Forest Grove OR型,Sunset Lab,USA)和热学/光学方法. 使用固相萃取法提取分离HULIS样品,具体步骤为用铳子取3片直径为47 mm的石英膜溶于超纯水中,超声提取20 min,重复两次,将得到的提取液经PTFE滤膜(0.22 μm)过滤得到WSOC溶液,定容至20 mL,其中,10 mL用于WSOC的定量,剩余10 mL WSOC溶液用1.2 mol/L的HCl酸化至pH=2. 用HLB小柱对酸化后的样品进行固相萃取,具体步骤为先用2 mL超纯水和5 mL甲醇活化HLB小柱,然后把酸化后的样品加入HLB小柱中萃取,用2 mL超纯水冲洗萃取柱,之后用6 mL纯甲醇溶液洗脱附着在萃取柱上的HULIS,使用高纯氮气吹干洗脱液,加入10 mL超纯水再次溶解HULIS,用于HULIS的定量测定[10]. 使用总有机碳分析仪(Multi N/C 3100,JENA,Germany)对WSOC与HULIS进行定量测定[24-25].
1.3 金属元素测定
取1/4的Teflon膜微波消解后,使用激光烧蚀电感耦合等离子体质谱仪(ICAP Qc型,Thermo Fisher,USA)对样品中的Li、Na、Mg、Al、K、Ca、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、Ga、As、Se、Rb、Sr、Mo、Cd、Cs、Ba、Ce、Tl、Pb元素进行检测[26].
1.4 体外细胞试验测定内源性ROS
1.4.1 暴露液制备
PM2.5暴露液:用铳子取1片直径为2 cm的石英膜,加入1 mL超纯水,漩涡混合仪振荡30 s后超声15 min;放入摇床15~18 h,取出后再次超声15 min,振荡30 s,用0.22 μm无菌PTFE过滤器过滤除菌后,置于−20 ℃的冰箱中冷冻保存.
HULIS暴露液:用铳子取3片直径为2 cm的石英膜,每次加入5 mL超纯水,超声提取20 min,重复2次,其余步骤同1.2节;最后,将被氮气吹干的浓缩液溶于1 mL超纯水中,并用Na型前处理柱去除其中的金属,经0.22 μm无菌PTFE过滤器过滤除菌后,放置在−20 ℃冰箱中冷冻保存.
1.4.2 细胞培养
该研究使用的细胞为大鼠肺泡巨噬细胞(NR8383),将其置于5% CO2、37 ℃的培养箱中培养,当细胞密度达到试验要求后,收集细胞以进行细胞内源ROS的测定.
1.4.3 PM2.5及HULIS诱导生成的内源性ROS的测定
将培养好的细胞集中于一个培养瓶中,用细胞计数板进行计数,确保细胞密度达1 000细胞/μL后,将细胞分装至离心管中,离心后去除上清液,加入10 mL 1×SGM培养基后转移至96孔板中,每孔100 μL,置于培养箱中2 h使细胞贴壁. 贴壁后的细胞去除细胞液并加入提取的暴露液,以2',7'-二氢二氯荧光素二乙酸酯(DCFH-DA)作为荧光探针,放入培养箱中,避光暴露约2.5 h,用酶标仪(SynergyTMH1,BioTek,美国)(发射波长为488 nm,激发波长为530 nm)进行检测[27].
1.4.4 统计分析
使用SPSS 25.0软件对PM2.5及其化学组分与ROS进行相关性分析,当皮尔逊相关系数大于0.5时,认为两变量之间具有相关性.
2 结果与讨论
2.1 PM2.5中含碳组分浓度及来源
2.1.1 PM2.5中含碳组分浓度特征
冬季北京市采样点1(市区采样点)、采样点2(郊区采样点)的PM2.5浓度分别为(93.94±34.22) (65.45±34.83)μg/m3,夏季分别为(30.45±13.24) (22.55±9.22) μg/m3,冬季市区采样点PM2.5浓度超过《环境空气质量标准》(GB 3095−2012)中的二级标准限值(75 μg/m3)[28],郊区采样点PM2.5浓度未超过二级标准限值. 由表1可见,对于同一季节,与郊区采样点相比,市区采样点PM2.5中OC、WSOC和HULIS-C (HULIS中的碳)的浓度略高,与PM2.5浓度结果相同,说明市区污染较严重,这可能是由于市区的移动源以及人为源等排放量更高所致. 对于同一采样点,OC、WSOC及HULIS的浓度均呈冬季高、夏季低的特点,这主要是由于冬季供暖导致PM2.5中碳质气溶胶含量增加,并且冬季气温较低,促进了碳氢化合物凝结在颗粒物表面;另外,低温也会导致机动车燃料的燃烧率降低,使污染物排放量(尤其是碳质组分排放量)升高;此外,冬季边界层高度相对较低,逆温天气频发,不利于污染物扩散,导致冬季污染较为严重[32].
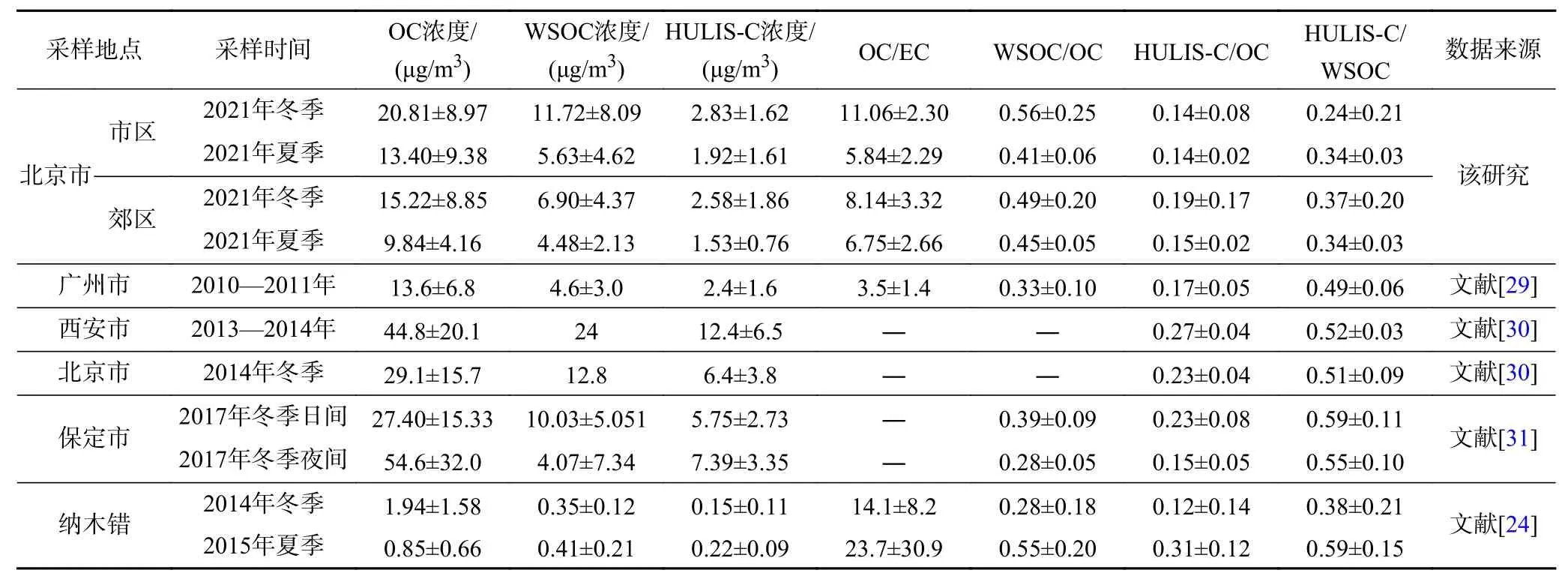
表1 不同地区大气PM2.5中碳质组分特征Table 1 Characteristics of carbon compounds in PM2. 5 from different regions
由表1可见,该研究中碳质组分浓度与广州市[29]、西安市[30]等城市较为接近,WSOC浓度高于纳木错地区[24]. 北京市区和郊区WSOC/OC (二者浓度之比,下同)在冬季分别为0.56±0.25和0.49±0.20,在夏季分别为0.41±0.06和0.45±0.05. WSOC/OC与气溶胶的老化程度成正比[33],因此冬季北京市区气溶胶的老化程度高于郊区,而夏季郊区气溶胶的老化程度则高于市区. 北京市区,HULIS/OC在冬季和夏季均为0.14,HULIS-C/WSOC在冬季和夏季分别为0.24±0.21和0.34±0.03;北京郊区,HULIS/OC在冬季和夏季分别为0.19±0.17和0.15±0.02,HULIS-C/WSOC分别为0.37±0.20和0.34±0.03. 因此,北京郊区HULIS对OC的贡献要高于市区,但HULIS对WSOC的贡献在市区与郊区相当. 相较于表1中其他地区的研究结果,笔者结果相对偏低,可能与近年来北京市空气质量明显改善,严重污染天气减少有关[24,30-32].
2.1.2 OC/EC
OC/EC (二者浓度之比,下同)常被用来评价颗粒物的来源及排放特征[34],其值越高,表明大气二次污染越严重. 北京市区采样点冬季和夏季的OC/EC范围分别为8.94~19.29和3.24~10.37,平均值分别为11.06±2.30和5.84±2.29;郊区采样点冬季和夏季的OC/EC范围分别为5.47~22.48和3.50~12.41,平均值分别为8.14±3.32和6.75±2.66. 两个采样点的OC/EC均呈冬季高于夏季的特征,与董贵明等[32]在北京南部城区观测的结果一致,表明碳质组分的来源具有明显的季节性差异,冬季OC/EC较高可能与生物质燃烧源和燃煤源的贡献有关,其中生物质燃烧是主要原因[35],而夏季OC/EC则主要受机动车排放源和燃煤源的影响[36].
2.1.3 一次有机碳(POC)和二次有机碳(SOC)的估算
Chow等[37]发现,当OC/EC大于2时,可能存在SOC污染,目前还没有直接测定颗粒物中SOC含量的方法,常采用OC/EC示踪比值法来评估SOC水平,计算公式[23]:
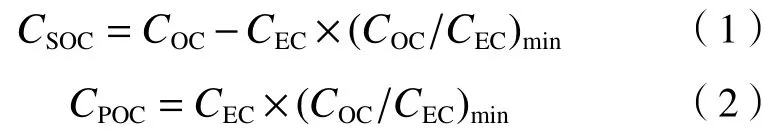
式中:CSOC为SOC的浓度,μg/m3;COC为OC的浓度,μg/m3;CEC为EC的浓度,μg/m3;(COC/CEC)min为OC/EC的最小值;CPOC为POC的浓度,μg/m3. 因不同季节的污染物来源存在差异[36],因此该研究选取每个季节OC/EC的最小值,根据式(1)(2)计算SOC及POC的浓度.
由图1可见,不同季节、不同采样点EC浓度差异不明显. 两个采样点冬季POC浓度较为接近,夏季北京市区采样点略高于郊区采样点. 采样期间,SOC/OC均在30%以上,与Zhang等[38-39]研究结果一致,表明SOC是北京市PM2.5中OC的重要组成部分. 在北京郊区,SOC浓度的季节性差异不明显,SOC/OC呈夏季高于冬季的特征;在市区,SOC浓度及SOC/OC均呈冬季明显高于夏季的特征. 与万州城区同类污染物的季节性变化特征[35]相似,这可能是由于冬季市区经常出现逆温天气,逆温天气有利于污染物的积累,且冬季低温加速了挥发性有机物在颗粒物上的冷凝,导致冬季SOC/OC较高[40].
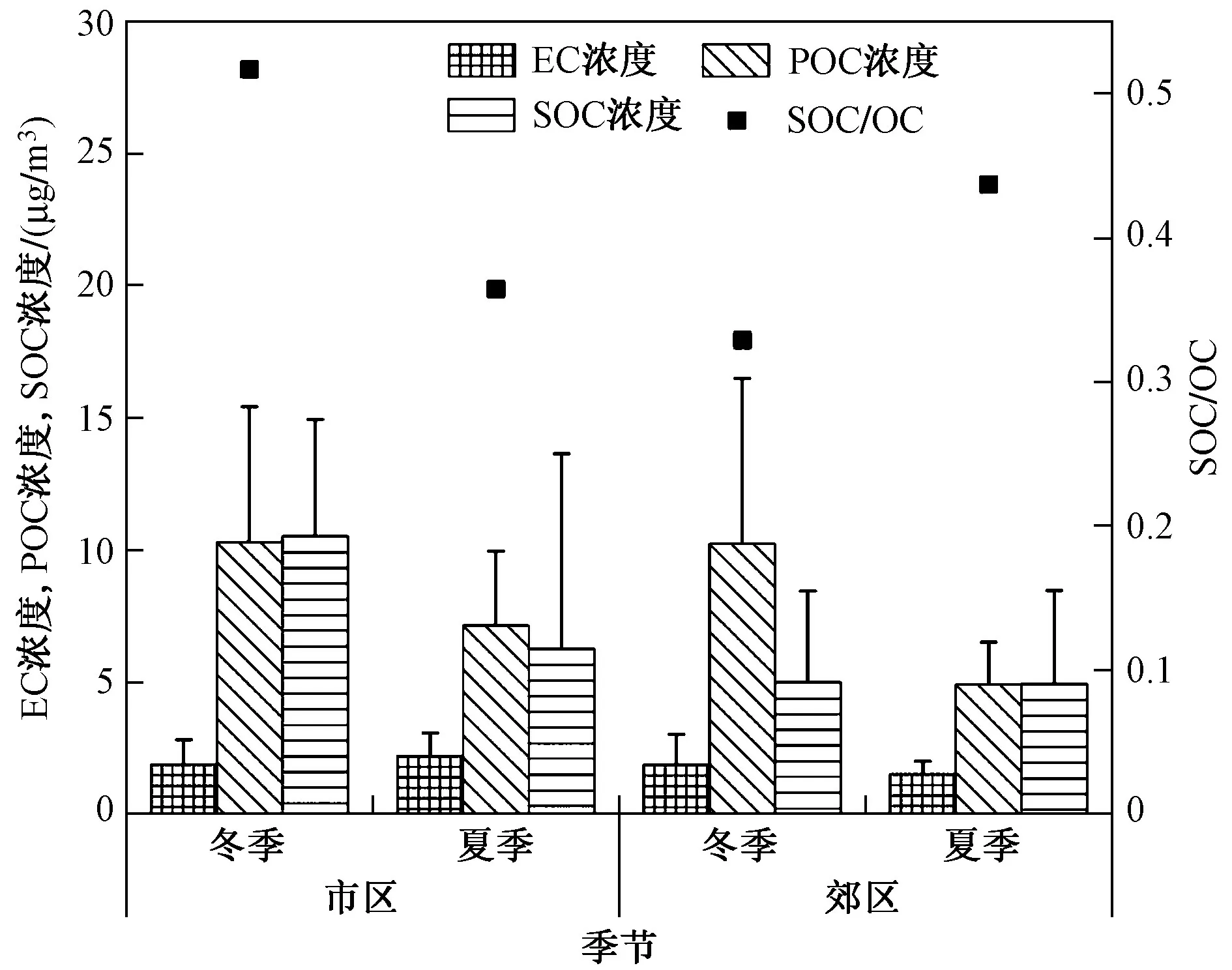
图1 北京市不同采样点EC、POC、SOC浓度及SOC/OC的季节性变化情况Fig.1 Seasonal variations of EC, POC, SOC concentration and SOC/OC in different sampling sites in Beijing
2.2 PM2.5诱导内源性ROS生成
2.2.1 PM2.5诱导生成的内源性ROS浓度水平
该研究测定内源性ROS时以酵母聚糖(zymosan)作为阳性对照,ROS浓度以μg zymosan/m3和μg zymosan/mg PM来表示,前者反映了单位体积空气中颗粒物的氧化能力,即内源性ROS在大气中的暴露浓度,后者则反映了单位质量颗粒物的氧化能力. 由图2可见:观测期间PM2.5诱导产生的总内源性ROS浓度水平有较大差异. 从暴露角度〔见图2(a)〕来看,在相同季节,北京市区的内源性ROS浓度水平高于郊区;在相同采样点,内源性ROS浓度变化特征均呈冬季高于夏季的特征. 内源性ROS浓度与PM2.5浓度变化特征具有一致性,表明颗粒物浓度越高,其对健康的影响就越大. 从颗粒物的生物氧化潜力〔见图2(b)〕来看,在相同季节,北京市区内源性ROS浓度水平高于郊区;在相同采样点,夏季内源性ROS浓度高于冬季,表明夏季郊区的PM2.5具有更高的生物氧化潜力.
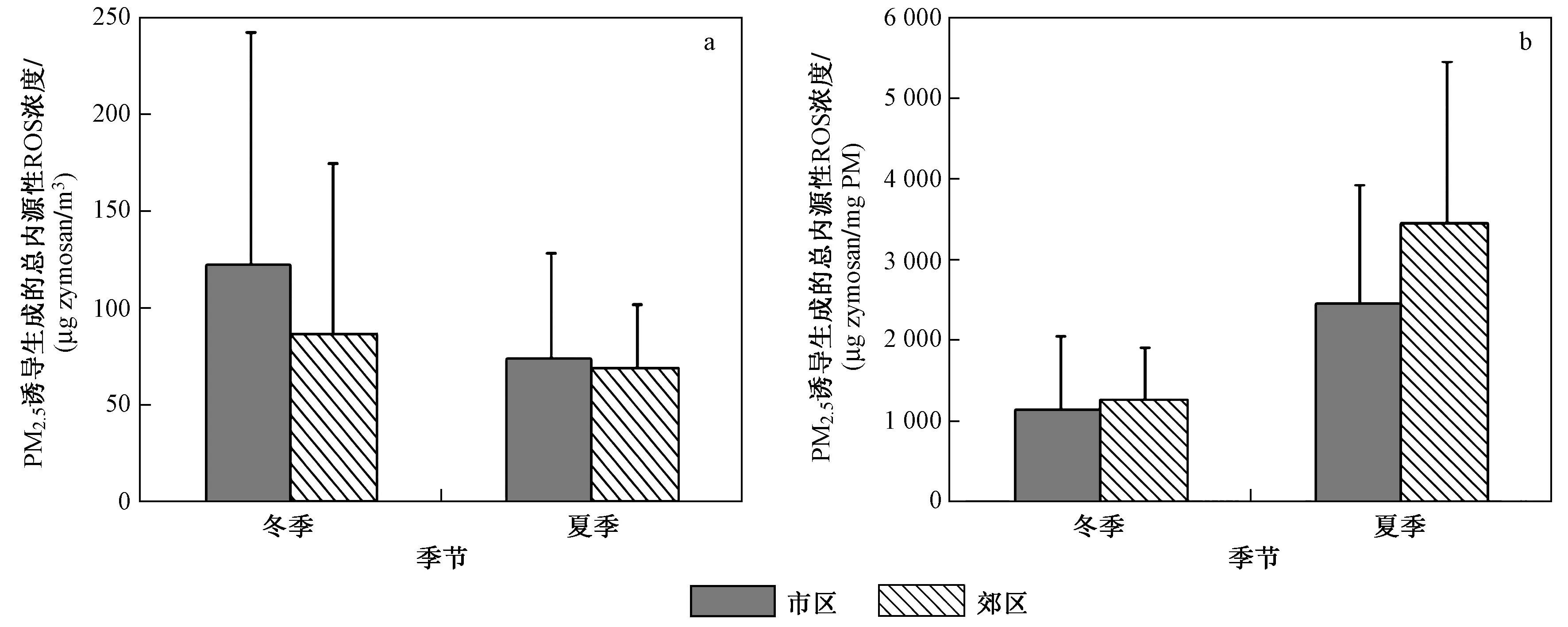
图2 PM2.5诱导生成的总内源性ROS浓度水平Fig.2 Endogenous ROS concentration level of PM2.5 water extract
已有研究使用酵母聚糖作为阳性对照,测定了不同地区大气PM2.5体外诱导产生内源性ROS的浓度水平,笔者研究中PM2.5诱导产生的内源性ROS浓度水平高于巴格达[41],但低于米兰[34]和首尔[42],这可能是由于不同地区PM2.5样品的浓度以及化学组分差异较大,因此诱导产生内源性ROS的水平具有较大差异[26,34,41-43]. 已有研究[9,16,25,44]表明,PM2.5中过渡金属(如Fe、Cu等)以及有机组分对内源性ROS的生成具有重要贡献,它们不仅能单独促进内源性ROS的生成,还能够相互作用,进而影响内源性ROS的生成. 此外,通过光化学反应产生的二次气溶胶比一次污染物更有可能引起氧化应激,从而生成过量内源性ROS并导致细胞损伤[26]. 因此,该研究中夏季PM2.5的生物氧化潜力更高,可能与PM2.5组分差异以及夏季光化学反应剧烈导致二次气溶胶生成等因素有关.
2.2.2 PM2.5及其化学组分与内源性ROS的相关性分析
为确定PM2.5中对内源性ROS浓度水平贡献较大的组分,对PM2.5及不同化学组分浓度与内源性ROS浓度的相关性进行分析,结果如表2所示. 由表2可见,北京市两个采样点的内源性ROS浓度与碳质组分浓度之间均有较高的相关性,与Park等[42]在韩国首尔的研究结果一致,表明一次源和二次源的碳组分在内源性ROS的生成中都起重要作用. 金属元素如K、Fe、Mn、Cu、Zn、As、Se、Cd、Tl和Pb等同样与内源性ROS的生成有关,其原理主要是金属能够通过Fenton反应促进ROS的生成,表明PM2.5中的金属元素也在生物氧化应激中具有重要作用.
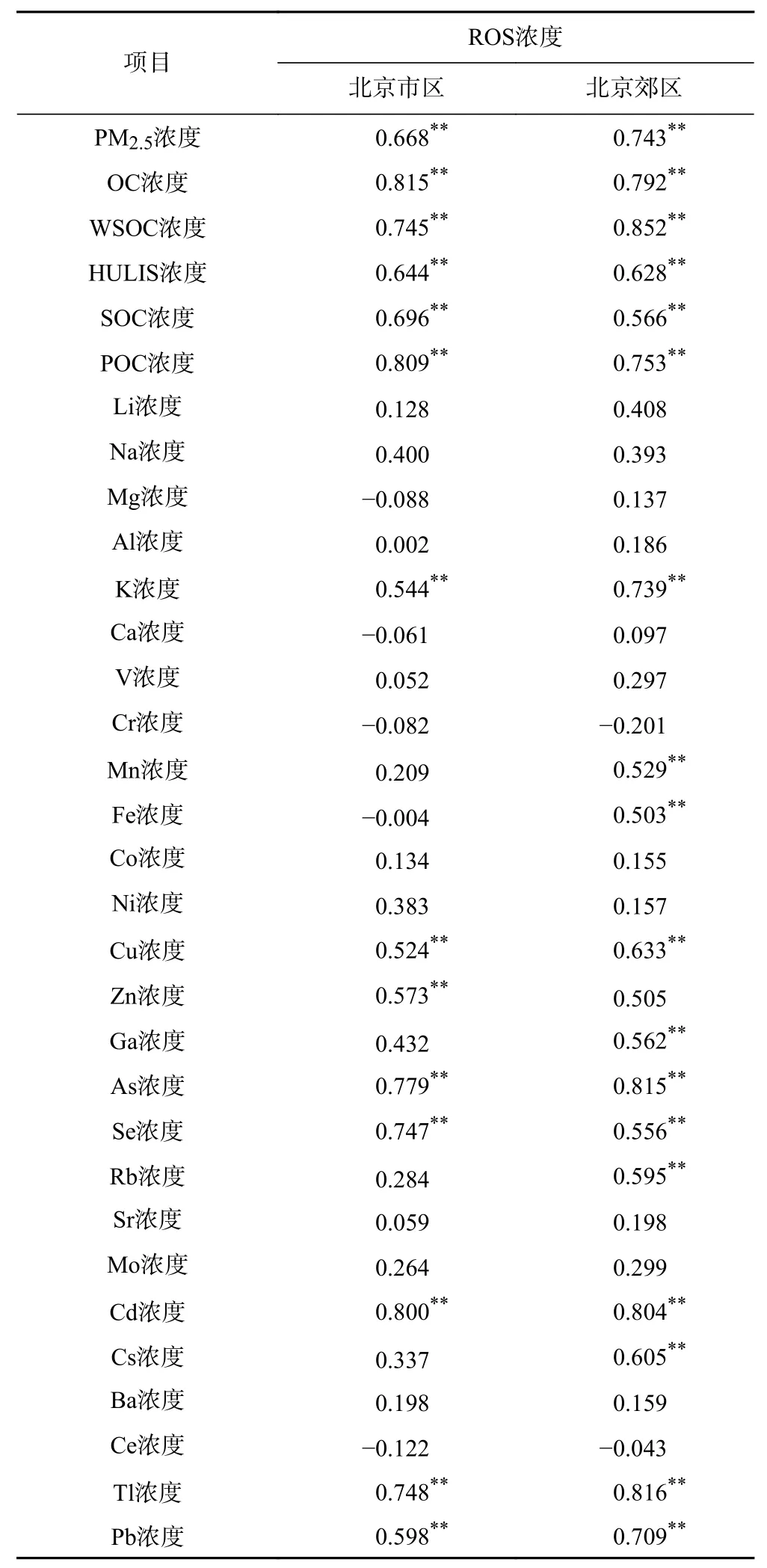
表2 PM2.5及化学组分浓度与内源性ROS浓度的相关性Table 2 Correlation coefficient between PM2.5 and chemical components and ROS
2.3 HULIS诱导内源性ROS 生成
相关性分析表明,北京市两个采样点的HULIS浓度与内源性ROS浓度具有较好的相关性(市区和郊区R值分别为0.644和0.628,P均小于0.01). 作为水溶性有机碳中的重要组分,许多研究[16,22,25,45-48]表明,HULIS中含有可逆的氧化还原位点,可作为电子载体催化ROS的形成,且HULIS中的大量酸性官能团还可与金属阳离子络合,进而促进ROS的产生和释放,因此该研究进一步探究了PM2.5中HULIS诱导的内源性ROS生成情况.
2.3.1 HULIS诱导生成的内源性ROS浓度水平
由图3可见,采用不同的计量单位表征HULIS诱导的内源性ROS浓度水平时,其结果有所不同. 从暴露的角度〔见图3(a)〕来看,HULIS诱导生成的内源性ROS浓度水平表现为冬季市区>冬季郊区>夏季市区>夏季郊区,与2.2.1节中PM2.5诱导生成的内源性ROS水平结果一致,表明冬季HULIS的健康风险更高. 从HULIS的生物氧化潜力〔见图3(b)〕来看,HULIS诱导生成的内源性ROS浓度水平表现为冬季郊区>冬季市区>夏季市区>夏季郊区. 研究[48]表明,HULIS是诱导生物氧化应激的重要组分之一,能够促进内源性ROS的生成. 其机理是HULIS中可逆的氧化还原位点能够作为电子载体,将电子从细胞中的还原物质(如NADPH或抗坏血酸)转移到O2中,并导致ROS随着细胞的有氧呼吸持续产生. 核磁共振结果[49]表明,不同来源的HULIS所含官能团差异较大,通过二次反应生成的HULIS化学成分更为复杂,其中芳香性物质(如醌等)含量也更高. 已有研究[22]表明,醌基是HULIS中的重要氧化还原活性位点. 因此,冬季HULIS的氧化还原活性更强,可能与其成分中醌基较多有关,因此具有更高的生物氧化潜力.

图3 HULIS诱导生成的内源性ROS浓度水平Fig.3 Endogenous ROS concentration level of HULIS
2.3.2 HULIS诱导生成的内源性ROS浓度的日变化情况
HULIS诱导生成的内源性ROS浓度水平的日变化情况如图4所示. 由图4可见,HULIS诱导生成的内源性ROS浓度与HULIS浓度变化趋势基本一致,二者相关性(北京市区和郊区R值分别为0.775和0.660,P均小于0.01)较高. HULIS浓度升高或降低时,单位体积空气中HULIS诱导生成的内源性ROS浓度也随之升高或降低. 在相同季节,北京市区的内源性ROS浓度与HULIS浓度均高于郊区,从暴露的角度来看,HULIS浓度越高,其对健康的影响越大. 但在北京郊区,2月2−6日HULIS诱导生成的内源性ROS浓度变化与HULIS浓度变化趋势相反,可能是由于HULIS样品中存在过渡金属的干扰导致测定误差增大. 2月2−6日,过渡金属V、Cr、Mn和Fe的浓度平均值分别为(3.76±1.47) (4.94±2.04) (70.68±27.51)(2 044.00±879.95) ng/m3,远高于采样期间的平均值〔V、Cr、Mn和Fe的浓度平均值分别为(3.15±1.73)(3.92±1.92) (53.24±27.28) (1 535.85±863.79) ng/m3〕.尽管在提取HULIS过程中,已经使用Na型前处理小柱对可能存在的过渡金属进行处理,但过渡金属与HULIS还可以络合态的形式存在,而前处理小柱对络合态的过渡金属的去除率相对较低,因此可能会导致实际测定中内源性ROS浓度水平过高.

图4 HULIS诱导生成的内源性ROS浓度水平的时间序列Fig.4 Time series of endogenous ROS concentration level induced by HULIS
2.1.1节中OC/EC结果表明,冬季OC主要来自生物质燃烧源和燃煤源,夏季主要来自机动车排放源和燃煤源. Ma等[50]分析了HULIS不同来源对其氧化还原活性的贡献,结果表明,生物质燃烧源产生的HULIS具有较高的氧化潜势(62.9%),而通过二次有机气溶胶生成的HULIS氧化潜势(12.6%)相对较低,进一步解释了冬季HULIS诱导生成的内源性ROS水平高于夏季的原因. 因此,控制生物质燃烧源及二次有机气溶胶生成对于降低HULIS的氧化还原活性,以及由此导致的生物氧化应激效应具有重要意义.
2.3.3 HULIS对PM2.5诱导生成的内源性ROS的贡献率
HULIS诱导生成的内源性ROS浓度与PM2.5诱导生成的总内源性ROS浓度的相关性分析如图5所示. 由图5可见,在北京市区和郊区二者的相关系数分别为0.771(P<0.01)和0.679(P<0.01),相关性均较好. 此外,在北京市区和郊区,HULIS对PM2.5诱导生成的内源性ROS的贡献率分别为42%和37%,表明HULIS在诱导内源性ROS生成中起重要作用. 鉴于HULIS在生物氧化应激中起的关键作用,有必要对其进行针对性控制.

图5 HULIS诱导生成的内源性ROS浓度与PM2.5诱导生成的总内源性ROS浓度的相关性Fig.5 Correlation between endogenous ROS concentration induced by HULIS and total ROS concentration in PM2.5
3 结论
a)北京市PM2.5中碳质组分浓度呈冬季高于夏季、市区高于郊区的特征. 冬季生物质燃烧源和燃煤源对OC具有较大贡献,夏季OC则主要来自机动车排放源及燃煤源.
b)观测期间,PM2.5诱导生成的总内源性ROS浓度(μg zymosan/m3)呈冬季高于夏季的特征,但夏季PM2.5具有更高的生物氧化潜力(μg zymosan/mg PM).相关性分析表明,PM2.5中的碳质组分和一些金属在内源性ROS生成中起重要作用.
c) HULIS诱导生成的内源性ROS浓度同样呈冬季〔市区和郊区分别为(55.46±22.69) (43.27±23.89)μg zymosan/m3〕高于夏季〔市区和郊区分别为(18.73±11.94) (7.88±3.63) μg zymosan/m3〕的特征,在市区和郊区HULIS对PM2.5诱导生成的内源性ROS的贡献率分别为42%和37%,表明HULIS在诱导内源性ROS生成、促进生物氧化应激中起重要作用,针对性控制HULIS能够有效降低大气PM2.5的生物氧化应激效应.

