全肿瘤弥散峰度成像直方图分析预测脑膜瘤分级及细胞增殖活性
陈晓丹,郑德春,陈兴发,林孔起,何庄贞,苏丽清,陈韵彬,林 霖,薛蕴菁
(1.福建医科大学附属肿瘤医院 福建省肿瘤医院放射诊断科,福建 福州 350014;2.福建医科大学附属协和医院放射科,福建 福州 350001)
脑膜瘤是颅内最常见的原发性肿瘤[1-2],WHO中枢神经系统肿瘤分类将其分为低级别脑膜瘤(low-grade meningioma, LGM,Ⅰ级)和高级别脑膜瘤(high-grade meningioma, HGM,Ⅱ/Ⅲ级)[2],准确分级对临床制定治疗决策和预后评估至关重要。反映肿瘤细胞增殖活性的Ki-67标记指数(labeling index, LI)对评估脑膜瘤细胞增殖具有重要价值[3]。弥散峰度成像(diffusion kurtosis imaging, DKI)为非高斯弥散成像技术,可表征病理组织微观结构[4]并用于评估脑膜瘤[5-6];但以肿瘤代表性区域的DKI参数平均值评估肿瘤不能充分反映其空间异质性。本研究观察全肿瘤DKI直方图分析[7]评估脑膜瘤分级及细胞增殖活性的价值。
1 资料与方法
1.1 一般资料 回顾性分析2016年12月—2020年1月就诊于福建医科大学附属协和医院的174例脑膜瘤患者。纳入标准:①临床和/或影像学疑诊脑膜瘤;②于颅脑MR扫描(包括DKI)后10天内接受手术,并获得明确病理诊断。排除标准:①既往曾接受相关抗肿瘤治疗;②MR图像质量不佳。本研究经院伦理委员会批准,检查前患者或家属签署知情同意书。
1.2 仪器与方法 采用GE Discovery 750 3.0T MR仪,8通道头部线圈,获取颅脑轴位T1WI、T2WI、DKI及增强T1WI。采用自旋回波平面回波序列行DKI,TR 6 000 ms,TE 94 ms,FOV 240 mm×240 mm,矩阵128×128,层数48,层厚3 mm,层间距0 mm,b值为0、1 000、2 000 s/mm2,30个弥散敏感梯度方向,NEX为1,采集时间384 s。
1.3 图像后处理和直方图分析 以DKE软件(V2.5.1)处理DKI数据,获得平均弥散系数(mean diffusivity, MD)、各向异性分数(fractional anisotropy, FA)、平均弥散峰度(mean kurtosis, MK)、轴向峰度(axial kurtosis, AK) 及径向峰度(radial kurtosis, RK)参数图[5,8]。以ITK-SNAP软件(V4.6.1)分割肿瘤,参照常规MRI所见,避开囊变、坏死、钙化和出血区域,于MD图上逐层勾画全肿瘤实性区域作为ROI。以Python 3.6.1软件将MD图全肿瘤ROI配准到FA、MK、AK及RK图上,提取全肿瘤DKI参数,获得包括均值、最大值、最小值,第10、50及90百分位数(p10、p50、p90),峰度、偏度及方差等直方图参数。由具有8年和11年神经系统影像学诊断经验的放射科副主任医师各1名以盲法独立、随机绘制ROI并提取直方图参数,取二者平均值进行分析。
1.4 病理分析 由1名具有10年神经病理学经验的病理科医师进行诊断,并计算肿瘤热点区域内Ki-67阳性染色细胞核百分比而得到Ki-67 LI。
1.5 分组 根据病理结果将患者分为LGM (Ⅰ级)组和HGM (Ⅱ/Ⅲ级)组,比较2组临床、影像学和病理学表现。
1.6 统计学分析 采用SPSS 20.0和MedCalc 15.2.2统计分析软件。以组内相关系数(intra-class correlation coefficient, ICC) 评估2名观察者所获直方图参数的一致性,ICC≤0.20为一致性较差,0.21~0.40一致性一般,0.41~0.60一致性中等,0.61~0.80一致性良好,0.81~1一致性极好。以频数表示分类变量,行χ2或Fisher精确概率检验。连续变量数据不符合正态分布,故以中位数(上下四分位数)表示,行Mann-WhitneyU检验。采用受试者工作特征(receiver operating characteristic, ROC)曲线评估各参数鉴别高、低级别脑膜瘤的曲线下面积(area under the curve, AUC)。以多变量逐步logistic回归分析筛选预测脑膜瘤分级的最佳因子。以Spearman相关分析计算Ki-67 LI与DKI直方图参数间的相关性。P<0.05为差异有统计学意义。
2 结果
174例中,153例经病理确诊为LGM (Ⅰ级),包括过渡型55例、上皮型48例、纤维型34例、血管瘤型11例、砂砾体型3例、分泌型1例及化生型1例;21例为HGM,其中非典型(Ⅱ级)20例、间变型(Ⅲ级)1例。组间患者年龄、性别、肿瘤部位、大小及瘤内钙化差异均无统计学意义(P均>0.05),但HGM组瘤内出血发生率均高于LGM组(P<0.05),见表1。

表1 高、低级别脑膜瘤患者一般资料及临床资料比较
2.1 DKI直方图参数 HGM组MK(p10、p50、p90、均值、最大值及方差)、AK(p10、p50、p90、均值、最大值)、RK(p50、p90、均值、最大值、方差)、MD(方差)及FA(最大值)均高于LGM组,MD(p10、最小值)低于LGM组(P均<0.05),见表2及图1、2。

表2 高、低级别脑膜瘤间MK、AK、RK、MD及FA直方图参数比较[中位数(上下四分位数)]
观察者间评估MK、AK、RK及MD的峰度和AK的偏度的一致性中等 (ICC为0.056~0.587),评估其余DKI直方图参数的一致性良好或极好(ICC为0.733~0.998)。
2.2 诊断效能 MKp90鉴别高、低级别脑膜瘤的AUC最大,为0.87,截断值取1.08时,敏感度85.62%,特异度71.43%,准确率83.33%,见表3、图3。多变量逐步logistic回归分析显示,MKp90为最佳脑膜瘤分级的预测因子,参数估计为-8.56,标准误差为1.92(P<0.01)。
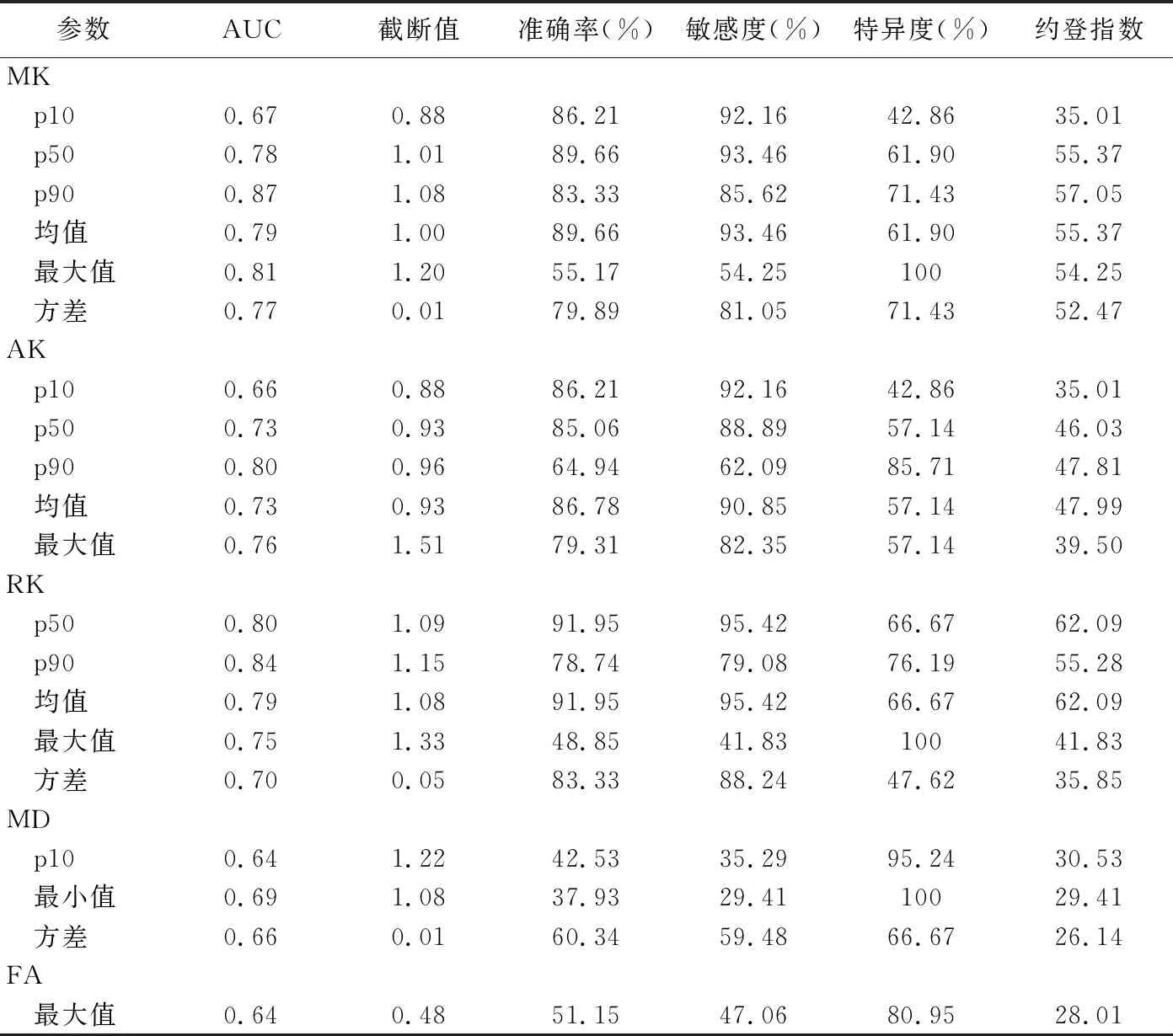
表3 DKI直方图参数鉴别高、低级别脑膜瘤的效能
2.3 相关性分析 共对145例患者检测了Ki-67。HGM组Ki-67 LI为10 (5,15),LGM组为2(1,3),组间差异有统计学意义(U=-6.15,P<0.01)。Ki-67 LI与MK(p10、p50、p90、均值、最大值及方差的rs分别为0.35、0.57、0.64、0.56、0.43及0.27)、AK(p10、p50、p90、均值及最大值的rs分别为0.38、0.52、0.51、0.51及0.27)、RK(p10、p50、p90、均值及最大值的rs分别为0.29、0.52、0.57、0.53及0.31)及MD(最大值、峰度及偏度的rs分别为0.22、0.24及0.34)均呈正相关,与MD(p10、最小值的rs均为-0.17)和FA(最小值的rs=-0.17)呈负相关(P均<0.05)。
3 讨论
DKI可用于术前评估脑膜瘤分级,但对其应用价值尚存争议[9]。本研究发现HGM的MDp10和最小值显著低于LGM,提示HGM肿瘤细胞较LGM更为致密[10-11];MD的方差可用于鉴别HGM与LGM,与既往研究[12]相符。直方图分析中,峰度、偏度和方差分别度量分布的峰性、不对称性和异质性。本研究发现HGM的MK、RK和MD的方差均高于LGM,提示HGM瘤内空间异质性较高,与其细胞生物学特征相符合[13]。既往研究[5,14]对于FA用于脑膜瘤分级的认知存在一定差异。本研究发现,FA相关直方图参数中,仅最大值组间差异有统计学意义,结果差异可能与样本量及病理亚型不同有关。
DKI可量化肿瘤细胞和微观结构的复杂性,而组织结构的异质性与MK值相关[4-6]。以传统ROI测量方法无法评估肿瘤的空间异质性[5-6]。本研究采用全肿瘤直方图分析,以全面反映肿瘤内部的空间异质性,发现根据MK的p10、p50、p90、均值、最大值及方差,AK的p10、p50、p90、均值和最大值,RK的p50、p90、均值、最大值及方差均能有效区分高、低级别脑膜瘤;尤以MKp90的AUC最大,诊断效能最佳。HGM的病理学特征是有丝分裂活性增加、核仁明显、微坏死及小细胞成分具有高核质比。HGM峰度值参数和变异度参数增高反映肿瘤内较高的细胞密度和异质性。全肿瘤体积直方图分析测量结果不具观察者依赖性,结果的一致性和可重复性均更好。LI等[15]将常规MR直方图分析用于脑膜瘤分级,发现T1WI直方图参数模型的诊断敏感度为71.4%,特异度为78.6%,AUC为0.79。本研究结果显示MKp90鉴别不同级别脑膜瘤的效能更佳 (AUC为0.87),DKI直方图分析更具诊断价值。
作为仅在细胞增殖期表达的核蛋白,Ki-67被广泛用于评价细胞增殖活性[16]。HGM细胞有丝分裂指数和细胞增殖增加,微结构的异质性和复杂性升高,水分子在细胞内外运动受限[5]。DKI可定量评估肿瘤细胞增殖情况。XING等[6]发现脑膜瘤MK、RK与Ki-67 LI呈正相关。LIN等[5]报道,脑膜瘤AK与Ki-67 LI呈正相关,MD与Ki-67 LI呈负相关。本研究结果显示,脑膜瘤多种DKI直方图参数与其Ki-67 LI相关,以MKp90相关性最高(rs=0.64),提示其可能代表肿瘤内异质性较高区域,能更好地反映肿瘤增殖活性;但各参数的相关系数不高,有待后续进一步分析。
综上,全肿瘤DKI直方图分析可用于评估脑膜瘤分级及细胞增殖活性。本研究样本量有限,HGM相对更少,可能对结果产生一定影响;且DKI序列扫描时间较长,其临床实际应用价值有待观察。

