一株高产β-苯乙醇酵母的筛选、鉴定及其增殖培养条件优化
刘子睦,李娜,项馨瑶,薛鲜丽,2,王德培,3*
(1.天津科技大学生物工程学院,天津 300457;2.工业发酵微生物教育部重点实验室,天津 300457;3.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457)
β-苯乙醇(2-phenylethanol,2-PE),又名 2-苯乙醇。常温下为无色、透明液体,具有令人愉悦的玫瑰香味[1],属于高级芳香醇,易溶于醇、酯、苯和醛等有机溶剂中。天然的β-苯乙醇主要存在于显花植物的茎、叶及其提取的精油中,如玫瑰、茉莉、风信子等[2]。β-苯乙醇及其衍生酯(乙酸苯乙酯、丙酸-2-苯乙酯等)是重要的芳香物质,可作为食品添加剂,广泛应用于食品和日化用品等生产领域[3]。而且以β-苯乙醇为底物合成的苯乙醇苷具有抗肿瘤、强心等作用,故在医疗领域有着重要应用[4-6]。近期有研究发现,β-苯乙醇的混合辛烷值质量高于现在使用的许多辛烷值促进剂,所以认为β-苯乙醇是一种理想的辛烷值促进剂[7]。
当前市场上的β-苯乙醇主要通过化学合成,化学合成过程中会产生多种杂质,使得无法达到食用及香料的质量标准[8-9]。通过植物萃取得到的β-苯乙醇安全无害,但植物所含β-苯乙醇浓度非常低,且提取生产周期长、成本昂贵[10],远远不能满足市场需求。微生物合成β-苯乙醇是欧洲食品管理局认可的“天然”方法[11],是合成天然β-苯乙醇工业化新趋势。
自然界中存在能够合成β-苯乙醇的多种微生物。牛明福等[12]筛选得到一株马克斯克鲁维酵母,其β-苯乙醇产量可达到1.45 g/L。富志磊等[13]从酒曲中筛选得到一株耐高温季也蒙毕赤酵母合成β-苯乙醇浓度为1.66 g/L。但微生物合成β-苯乙醇受到产物抑制,3 g/L的β-苯乙醇可以抑制大部分的微生物生长,是微生物发酵法合成β-苯乙醇的瓶颈[14]。
本研究从玉米胚芽粕和玉米皮、玉米淀粉渣等淀粉加工下脚料,及其废料堆放的土壤中取样筛选到一株可耐受高浓度β-苯乙醇的酵母菌株,通过优化其增殖培养条件获得大量菌体以实现β-苯乙醇转化发酵。为后期的研究与生产β-苯乙醇奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
玉米胚芽粕、玉米皮、玉米淀粉渣、土壤样品:黑龙江金象生化有限责任公司。
1.1.2 试剂
葡萄糖、酵母粉、胰蛋白胨、磷酸二氢钾、硫酸镁、氯化锰、硫酸铜(均为分析纯):天津市北方天医试剂公司;β-苯乙醇(色谱纯)、L-苯丙氨酸(分析纯):上海麦克林生化科技有限公司。
1.1.3 培养基
酵母提取物蛋白胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[15]:葡萄糖 20g/L、酵母粉 10 g/L、胰蛋白胨20 g/L。灭菌条件:115℃、20 min。
初筛培养基:葡萄糖10 g/L、酵母粉10 g/L、胰蛋白胨10 g/L、琼脂20 g/L。灭菌条件:115℃、20 min。灭菌后加入终浓度达到2 g/L的β-苯乙醇。
复筛培养基:葡萄糖10 g/L、酵母粉10 g/L、胰蛋白胨10 g/L、琼脂20 g/L。灭菌条件:115℃、20 min。灭菌后加入终浓度达到3.5 g/L的β-苯乙醇。
发酵培养基[13]:葡萄糖80 g/L、酵母粉5.5 g/L、磷酸二氢钾5 g/L、硫酸镁0.5 g/L。灭菌条件:115℃、20 min。灭菌后加入8 g/L的L-苯丙氨酸。
1.2 仪器与设备
752紫外可见分光光度计:天津市华伟科技有限公司;LRH-250-A生化培养箱:韶关市泰宏医疗器械有限公司;AELTA320 pH计:梅特勒仪器(上海)有限公司;HYG恒温培养振荡器:上海欣蕊自动化设备有限公司;LDZX-50FB立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 酵母菌分离
分别称取10 g的玉米胚芽粕和玉米皮、玉米淀粉渣、土壤样品放入装有100mL含2g/Lβ-苯乙醇无菌蒸馏水的锥形瓶(250mL)中,在180r/min,28℃的条件下,振荡培养2 h。取样品悬液,采用10倍梯度稀释法[16],从104、105稀释倍数的菌液中吸取100 μL涂布在含有2 g/L β-苯乙醇的YEPD固体平板上(每个稀释度涂两个平板)。将涂布后的平板放在28℃的恒温培养箱中培养20 h。
将实验室现存的23株酵母菌分别在YEPD平板上活化,挑取单菌落于液体YEPD培养基中,在180r/min,28℃的条件下,振荡培养20 h。采用10倍梯度稀释法[16],从 106、107稀释倍数的菌液中吸取 100 μL 涂布在含有2 g/L β-苯乙醇的YEPD固体平板上(每个稀释度涂两个平板)。将涂布后的平板放在28℃的恒温培养箱中培养20 h。将初筛中生长快、菌落直径大的进行复筛,复筛将β-苯乙醇浓度提高到3.5 g/L,从中选择长势较好的菌株进行进一步分离纯化。
1.3.2 酵母菌筛选
采用三区划线的方法,将纯化好的酵母菌株接种于含有4 g/L β-苯乙醇的YEPD固体平板上,在28℃的恒温培养箱中培养60 h。每12 h观察1次生长状况,挑选长势较好的菌株(YDF-1)进行保存。
1.3.3 酵母菌形态观察及分子鉴定
菌落及细胞形态观察:将筛选得到的酵母接种到YEPD平板上,在28℃条件下培养20 h,观察其菌落形态[17];挑取平板上菌落直径较大的单菌落到YEPD液体培养基中,在28℃、180 r/min的条件下摇床振荡培养20 h,在光学显微镜下观察YDF-1菌落形态。
YDF-1的分子鉴定:18S rDNA序列的聚合酶链式反应扩增采用真菌通用引物为NS1(5′-GTAGTCATATGCTTGTCTC-3′)和 NS8(5′-TCCGCAGGTTCACCTACGGA-3′)[18],扩增条件为 95℃ 5min,95℃ 30s,58℃ 30s,72 ℃ 90 s,30个循环,72℃,10 min。
1.3.4 β-苯乙醇标准曲线的绘制
取分析纯级别的β-苯乙醇试剂,配制浓度为0.5、0.4、0.3、0.2、0.1 g/L的标准品。采用高效液相色谱仪测定不同浓度标准品对应峰面积,并根据出峰面积绘制β-苯乙醇的标准曲线。
1.3.5 发酵液中β-苯乙醇含量的测定
取2mL发酵液,在8000r/min离心10min;取1mL上清液,用超纯水稀释10倍;用0.22 μm有机系滤膜过滤稀释后的发酵上清液。高效液相色谱条件:C-18反相柱 4.6 mm×250 mm×5 μm; 流动相为甲醇∶水=1∶1(体积比),流速 1 mL/min;检测波长260 nm;柱温30 ℃;进样量 10 μL。
1.3.6 增殖培养基优化
通过单因素试验确定合适的碳源、氮源,然后通过正交试验确定对应的碳源、氮源与磷酸氢二钾的浓度。在此基础上通过单因素试验确定合适的金属离子的种类与浓度,利用Design-Expert软件设计Box-Benhenken试验[19]并对试验结果进行分析。
通过比较YDF-1在YEPD培养基中的生长曲线和优化后的培养基中的生长曲线,评价优化后的培养基[20]。
1.3.7 酵母转化L-苯丙氨酸生成β-苯乙醇
以1.3.6中优化好的增殖培养基培养YDF-1,取40 mL发酵液,5 000 r/min离心15 min,收集菌体,转接于转化培养基中,培养48 h后,测得发酵液中β-苯乙醇含量。
1.3.8 酵母增殖菌体量的测定方法
比浊法:将发酵液稀释一定倍数,在600 nm波长下测定OD值[21]。
稀释微量活菌计数法:取100 μL菌液在1.5 mL离心管中进行梯度稀释,最后将10 μL稀释菌液点在平板上计数[22]。
1.4 数据分析
菌株测序结果通过Biodiet软件处理后,在NCBI核酸系列数据库中通过BLAST进行同源序列比对,再通过MEGA 7.0软件进行系统分析并构建系统发育树;通过IBM SPSS Statistics 25软件对碳源、氮源及金属盐离子单因素试验进行显著性分析;通过Design-Expert软件进行金属盐离子响应面试验设计和分析。
2 结果与分析
2.1 酵母菌株的分离鉴定
2.1.1 酵母菌分离
经过浓度为2.0 g/L β-苯乙醇的固体培养基初筛获得24株酵母菌,经3.5 g/L β-苯乙醇的固体培养基复筛得到6株菌。分别为实验室已有的Y322、Y714、YZM-1、RY7、RY3,以及从玉米胚原料中得到的酵母菌株YDF-1。
2.1.2 酵母菌筛选
60 h内,在4 g/L的β-苯乙醇的固体培养基上,只有YDF-1可以较好地生长。对YDF-1酵母菌株进行3轮分离纯化,甘油管保藏。再进行分子生物学鉴定。
2.2 YDF-1形态学及分子鉴定
2.2.1 YDF-1形态学鉴定
YDF-1单菌落形态如图1所示,YDF-1光学显微镜下形态如图2所示。
图1 YDF-1单菌落形态Fig.1 Single colony morphology of YDF-1

图2 YDF-1光学显微镜下形态Fig.2 Morphology of YDF-1 under light microscope
由图2可知,YDF-1在YEPD平板上28℃下培养24 h,菌落呈现圆形,初期边缘整齐,72 h开始,边缘有向外的假菌丝生成,菌落中间微微隆起,不透明呈乳白色。在YEPD液体培养基中28℃、180 r/min条件下培养20 h后,具有甜苹果香味。在光学显微镜下观察到的细胞形态:呈椭圆形或棒状,一端或两端芽殖。
2.2.2 YDF-1分子鉴定
YDF-1与相关菌株的18S rDNA进化树见图3。

图3 YDF-1与相关菌株的18S rDNA进化树Fig.3 18S rDNA evolutionary tree of YDF-1 and related strains
YDF-1测序得到的序列全长约为1 600 bp,通过BioEdit软件处理后,在NCBI核酸系列数据库中通过BLAST进行同源序列比对,下载相似性较高的酵母菌的相关序列。通过MEGA 7.0软件进行系统分析并构建系统发育树[23]。从进化树结果中可得出,YDF-1属于Pichia(毕赤酵母属),与Pichia kudriavzevii NRRL Y-5396(NG 063274.1)最为接近,相似性为99.88% 。
2.3 β-苯乙醇产量的测定
2.3.1 β-苯乙醇标准品的测定
β-苯乙醇浓度为0.5g/L标准品的高效液相色谱图如图4所示,β-苯乙醇出峰时间为8.087 min。
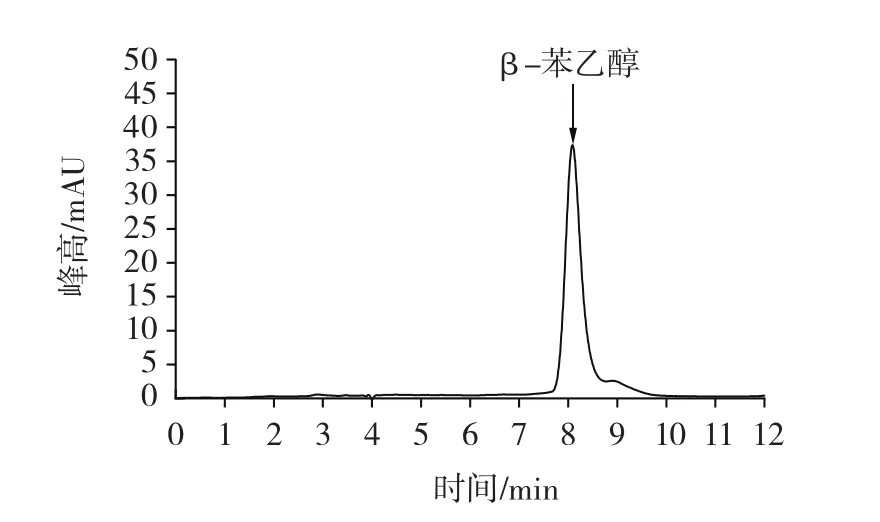
图4 0.5 g/L β-苯乙醇标准样品液相色谱图Fig.4 Liquid chromatography of 0.5 g/L β-phenylethanol standard sample
2.3.2 β-苯乙醇标准曲线的制备
以β-苯乙醇浓度为横坐标,出峰面积为纵坐标绘制标准曲线结果见图5。
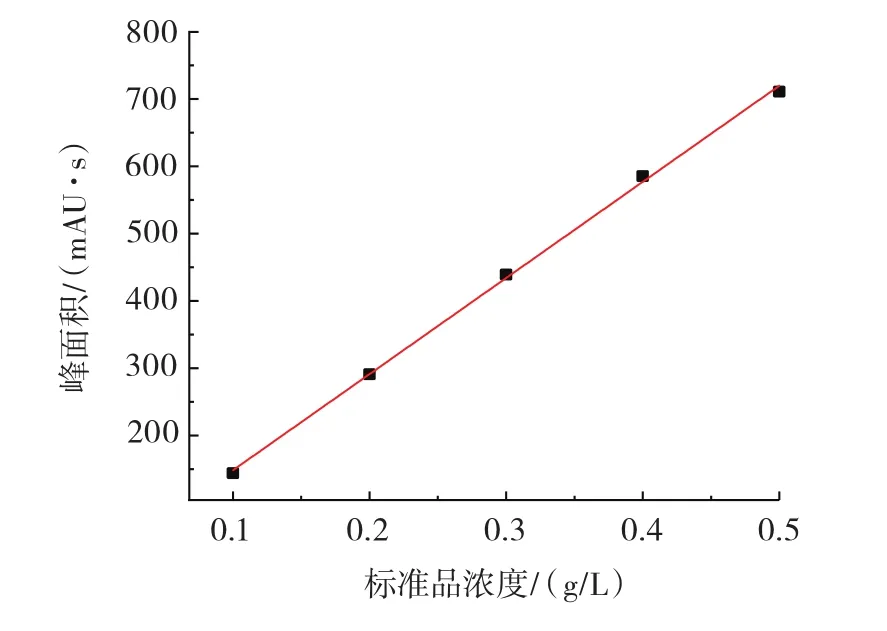
图5 β-苯乙醇标准品标准曲线Fig.5 β-Phenylethanol standard curve
由图5中标准曲线得到方程:A=1 428.3×C+5.61,R2为 0.999 04。
2.3.3 YDF-1发酵产β-苯乙醇的测定
YDF-1发酵60 h后发酵液的色谱图见图6。

图6 60 h发酵液液相色谱图Fig.6 60 h liquid chromatogram of fermentation broth
由图6可知,β-苯乙醇峰面积为409.2,将峰面积代入标准曲线中计算得苯乙醇浓度为2.83 g/L。说明YDF-1具有良好的发酵β-苯乙醇的潜力。
2.4 培养基及培养条件优化
2.4.1 碳源种类及浓度优化
碳源种类单因素结果见图7。选取20 g/L~100 g/L碳源初始浓度,培养YDF-1,观察其对YDF-1的增殖影响,结果见图8。
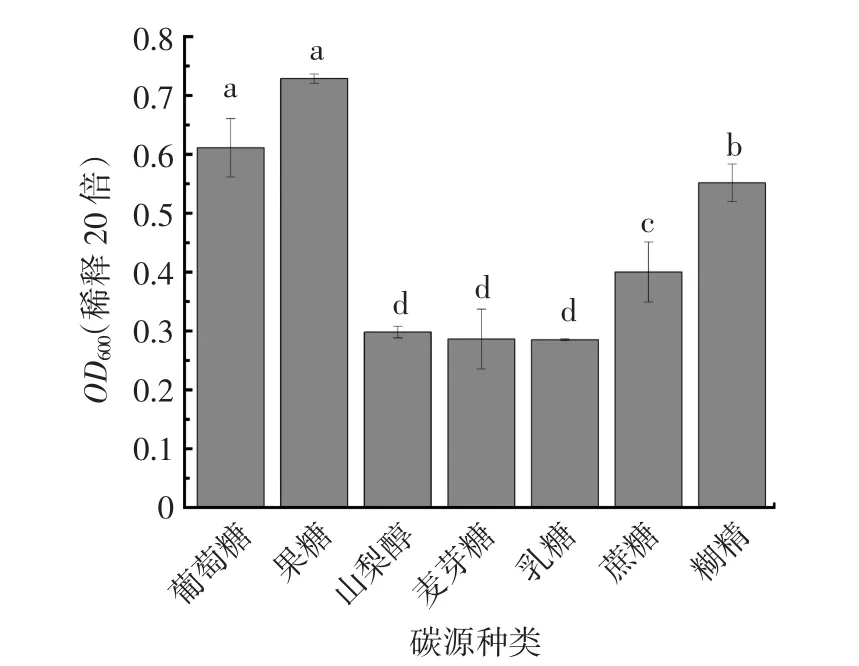
图7 不同碳源种类发酵液最终OD600值Fig.7 Final OD600value of fermentation broth of different carbon source species

图8 不同葡萄糖浓度的最终发酵液OD600值Fig.8 OD600value of final fermentation broth with different glucose concentration
由图7可知,6种碳源中果糖最合适YDF-1的生长,但葡萄糖作为自然界中分布最广泛的单糖,在实际生产中较果糖成本低,且发酵后活菌数相差不显著(P>0.05),故选择葡萄糖作为碳源。由图8可知,菌体浓度随葡萄糖浓度的增大而增大,而且葡萄糖浓度(80 g/L~100 g/L)较高时 YDF-1增殖效果不显著(P>0.05),因此选择葡萄糖的最佳浓度为100 g/L。
2.4.2 氮源种类及浓度优化
氮源种类单因素试验结果见图9。
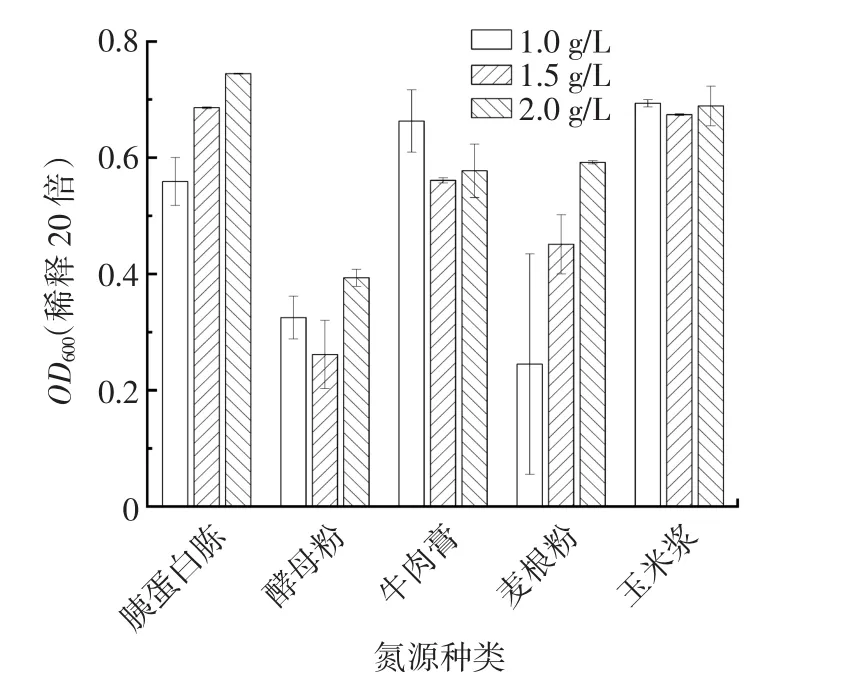
图9 氮源种类与浓度单因素试验结果Fig.9 Results of single factor experiments on nitrogen source species and concentration
由图9可知,YDF-1对牛肉膏、胰蛋白胨和玉米浆的利用较好,当胰蛋白胨浓度为2 g/L时,可获得最高的菌体量,所以选择2 g/L的胰蛋白胨浓度作为最佳氮源。
2.4.3 碳源氮源与磷酸氢二钾的正交试验
根据单因素试验结果,YDF-1在葡萄糖浓度为100 g/L时可获得较高菌体量,且增幅较为平缓,所以选取80、100、120 g/L作为碳源水平选择。YDF-1在胰蛋白胨浓度为2 g/L时可获得较高菌体量,但增幅较大,所以选取2.0、2.5、3.0 g/L作为氮源水平选择。因为磷酸二氢钾在培养基中具有促进微生物生长繁殖的作用,且与葡萄糖和胰蛋白胨具有交互作用,所以选择磷酸氢二钾浓度作为第3个影响因子。选择葡萄糖浓度(A)、胰蛋白胨浓度(B)、磷酸二氢钾浓度(C)作为研究对象,设计三因素三水平正交试验,因素水平设计见表1,试验结果见表2。
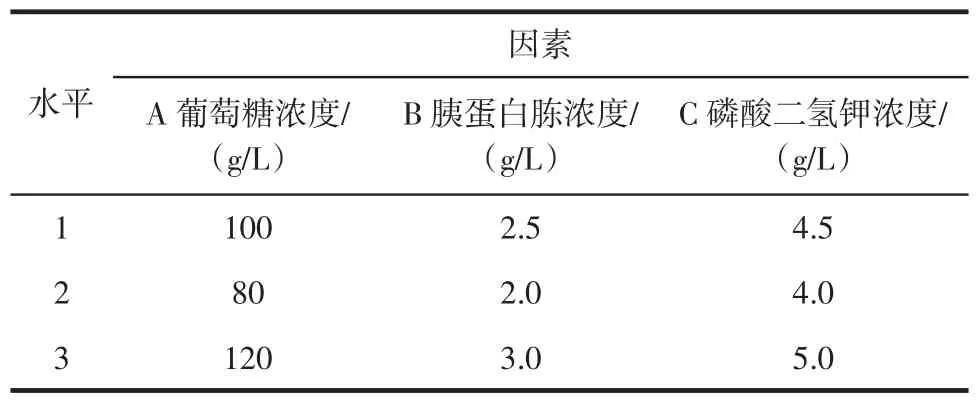
表1 正交试验设计因素水平Table 1 Factor and levels of orthogonal experimental design
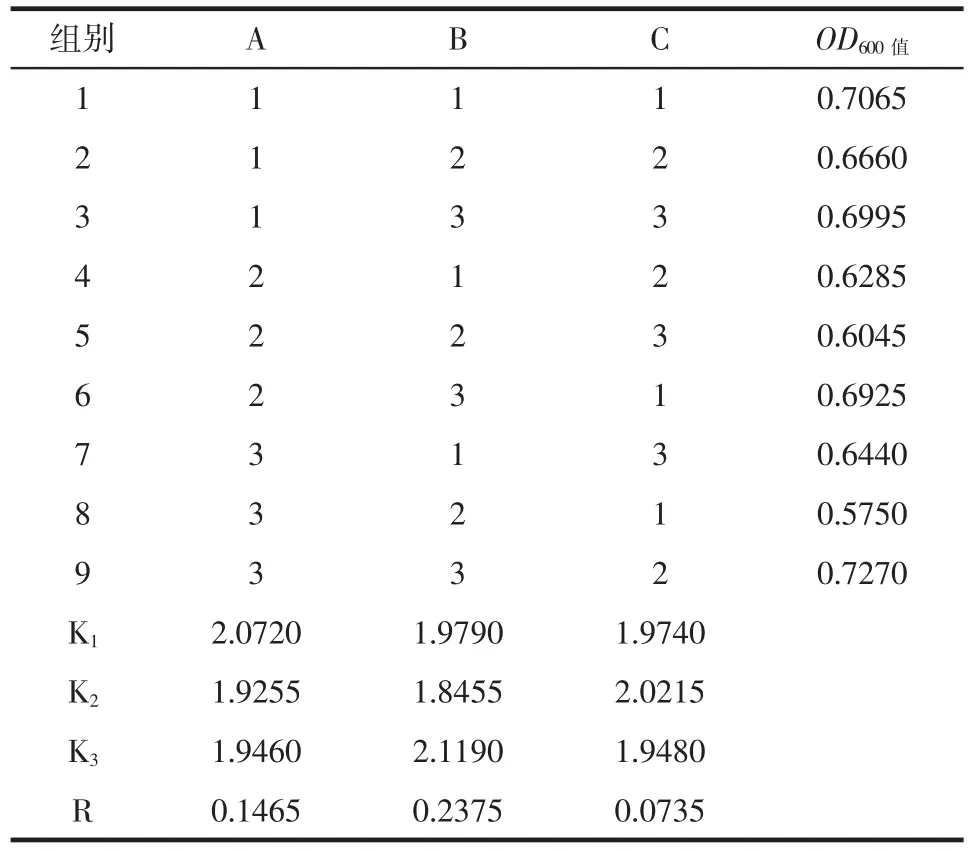
表2 正交试验结果Table 2 Results of orthogonal experiment
从表2可看出,胰蛋白胨浓度的改变对YDF-1菌体增殖的影响最大,葡萄糖浓度次之,磷酸氢二钾浓度对毕赤酵母YDF-1菌体增殖的影响最小。根据表2的结果得最佳组合为A1B3C2,即葡萄糖浓度100 g/L、胰蛋白胨浓度3.0 g/L、磷酸二氢钾浓度4.0 g/L。以A1B3C2的组合与正交组合中OD600值最高组(A3B3C2)组进行验证比较。经验证,A1B3C2组合的发酵液稀释35倍测得OD600值为0.753,A3B3C2组合的发酵液稀释35倍测得OD600值为0.732。故选择最佳组合为葡萄糖浓度为100 g/L、胰蛋白胨浓度为3.0 g/L、磷酸二氢钾浓度为4.0 g/L。
2.4.4 金属离子种类及浓度的优化
金属离子单因素试验结果见图10。
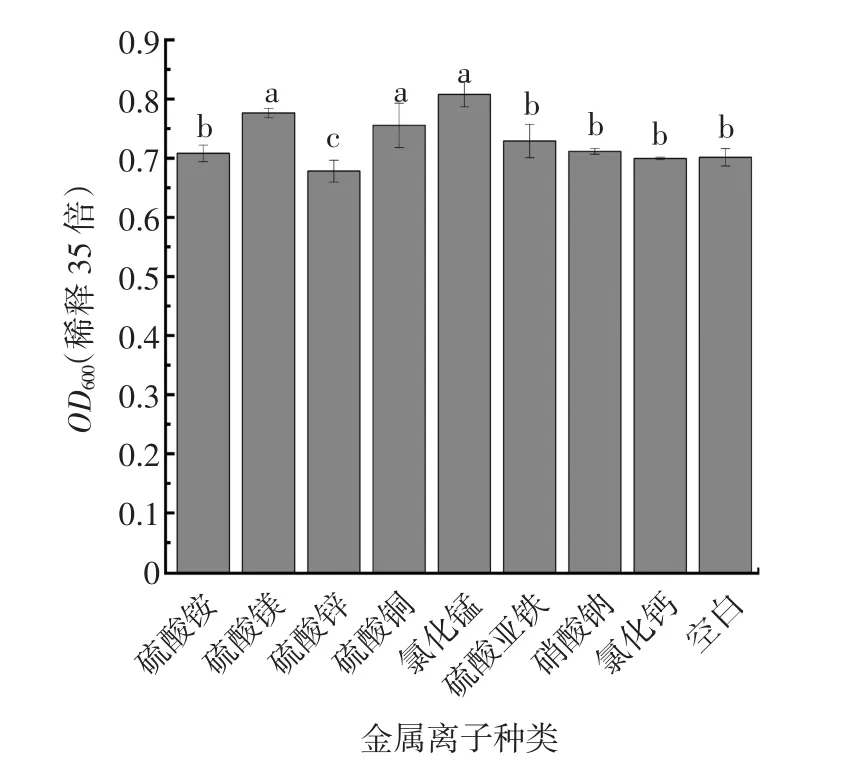
图10 不同金属离子种类的单因素试验结果Fig.10 Single factor experimental results of different metal ion types
由图10可知,与空白组相比,只有氯化锰、硫酸铜、硫酸镁对菌体增殖有显著促进(P<0.05),硫酸铵、硫酸亚铁、硝酸钠、氯化钙对菌体增殖无显著性影响,而硫酸锌可能对YDF-1生长有抑制作用。通过SPSS软件分析,氯化锰、硫酸铜、硫酸镁3种金属离子均为显著影响因子,选择此3种进行后续的优化试验。
3种金属离子不同浓度单因素试验结果见图11。
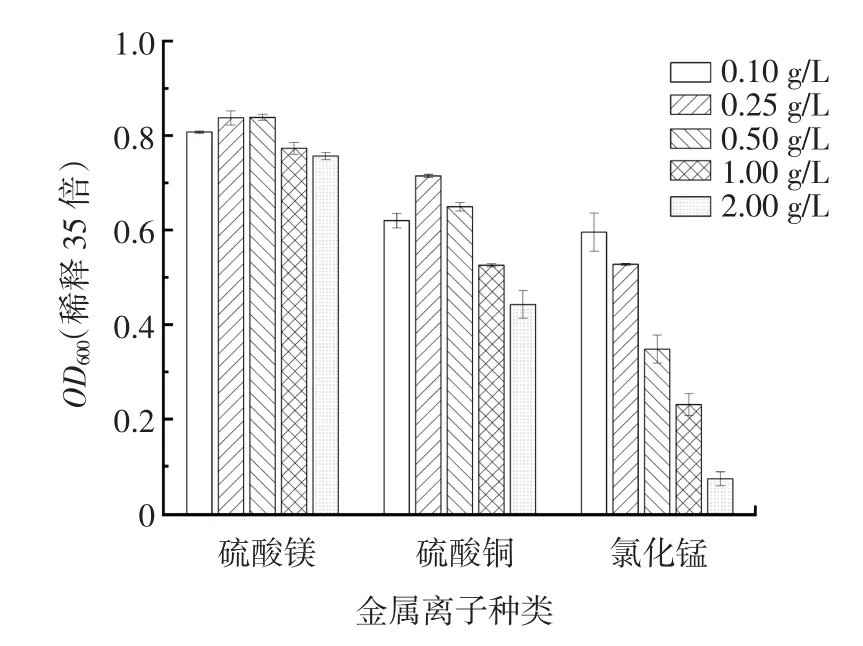
图11 不同金属离子浓度的单因素试验结果Fig.11 Single factor experimental results for different metal ion concentrations
从图11中可看出酵母菌体量随硫酸镁与硫酸铜浓度增加先升高后下降,而添加氯化锰组的OD600值一直随着金属离子浓度的升高而降低。
根据上述的试验结果,利用Design-Expert软件设计三因素三水平的Box-Behnken试验,试验设计及结果见表3与表4。
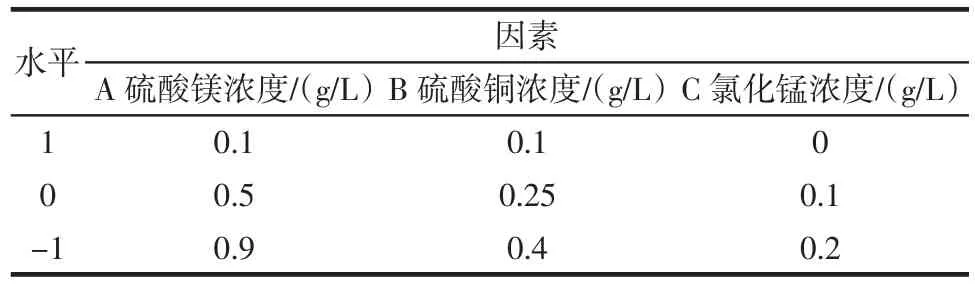
表3 Box-Behnken试验设计水平及因素Table 3 Factor and levels of Box-Behnken experimental design
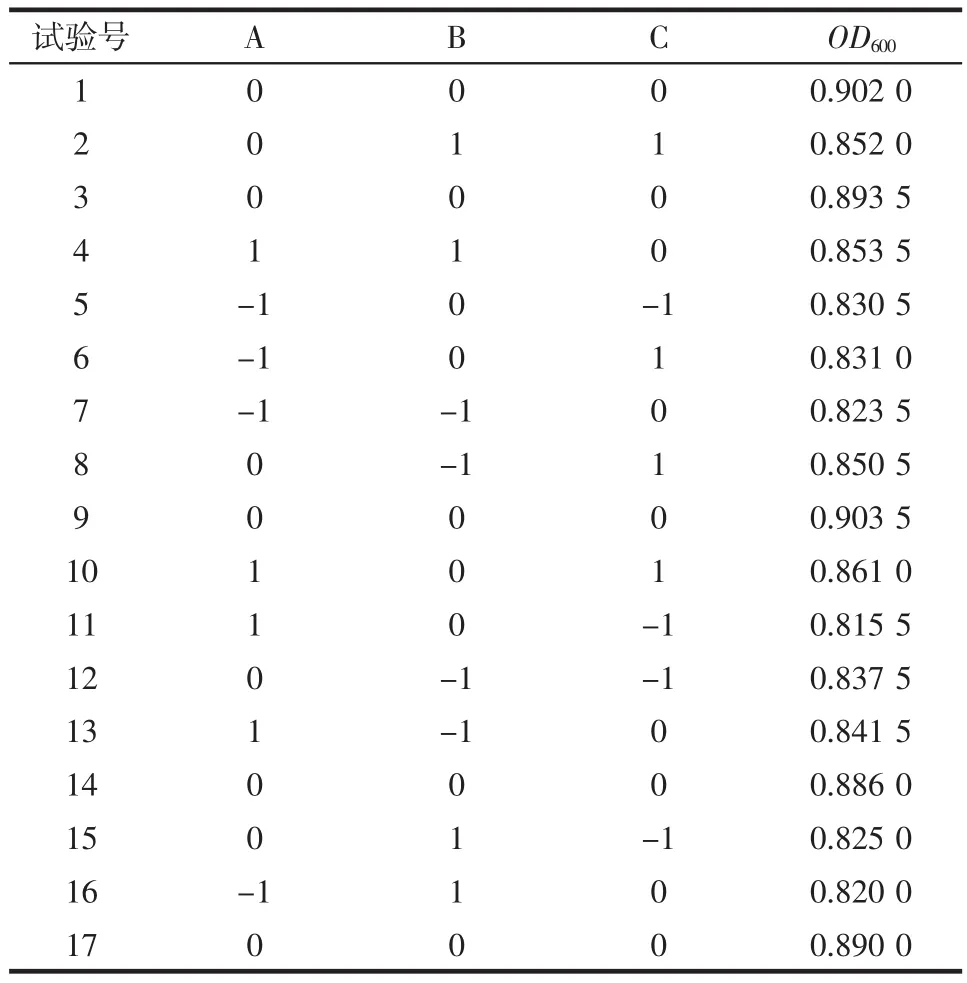
表4 Box-Behnken试验结果Table 4 Box-Behnken experimental results
通过Design-Expert软件对试验数据进行多元回归分析,可得到三元二次回归拟合方程:OD600=0.734585+0.202 422A+0.593 750B+0.505 625C+0.281 25AC-0.209 766A2-1.191 67B2-2.69375C2。
表5为YDF-1金属离子优化试验结果的回归系数显著性检验。
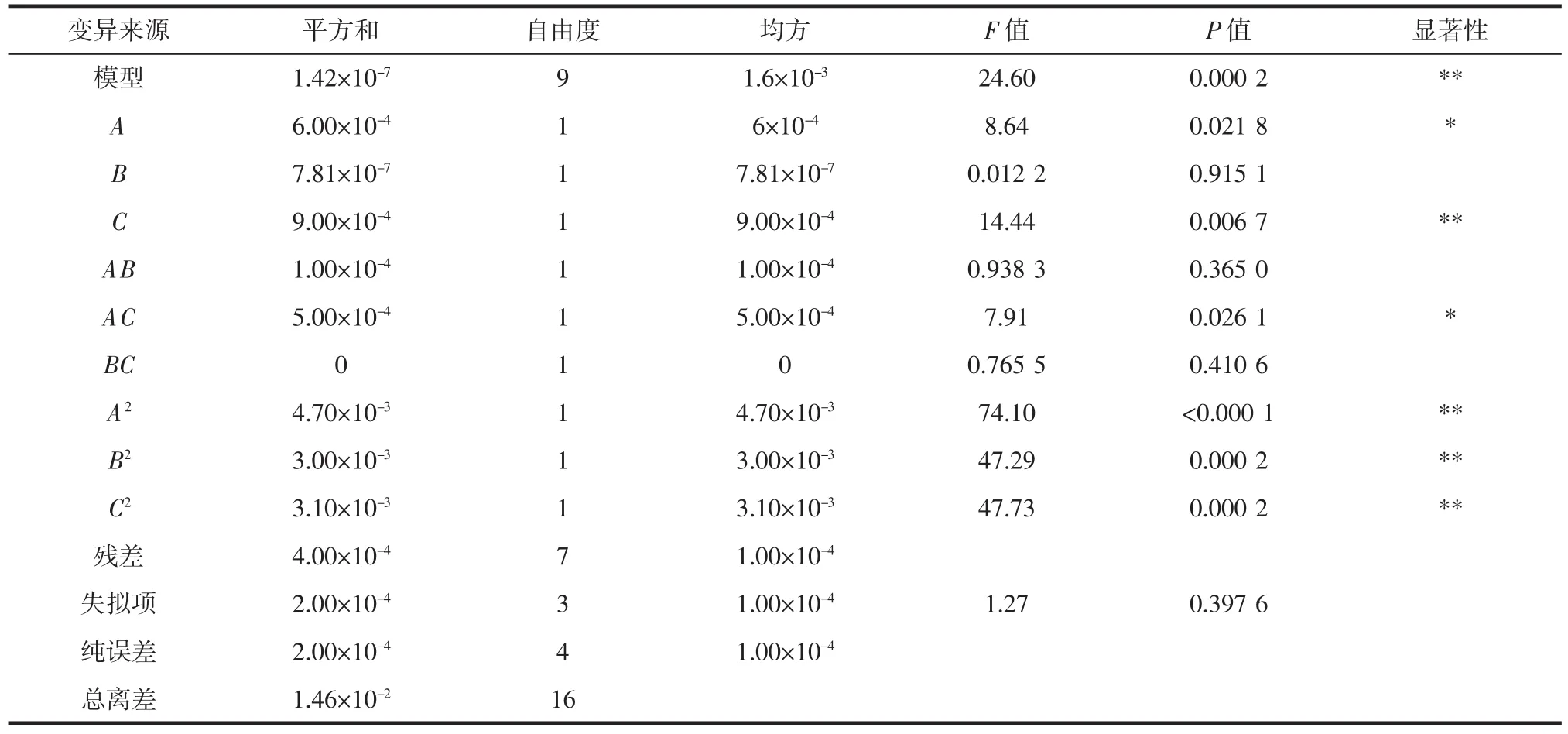
表5 回归系数显著性检验Table 5 Test for significance of regression coefficients
从表5中可看出:所选用的模型极显著(P=0.0002<0.01),说明模型选择合适,且经方差分析结果表明,该方程的决定系数为R2=0.969 4,校正决定系数AdjR2=0.929 9,说明该模型预测值与实测值拟合度较高,能解释92.99% 的响应值的变化,因此可用此回归方程对试验结果进行分析预测。方程中一次项中A对结果影响显著,C对结果有极显著影响;二次项A2、B2、C2对结果均具有极显著影响;交互项中只有AC对结果有显著影响。
3个因子交互作用对OD600影响的响应曲图见图12。

图12 硫酸镁、硫酸铜和氯化锰浓度交互作用对OD600值的影响Fig.12 Effects of interaction levels of magnesium sulfate,copper sulfate and manganese chloride on OD600value
由图12可知,通过二次多项数学模型解逆矩阵,得出最佳金属离子浓度为硫酸镁0.5 g/L、硫酸铜0.25 g/L、氯化锰0.142 g/L,其预测YDF-1发酵液稀释35倍可获得最大OD600值为0.89。经后续两次验证,YDF-1发酵液稀释35倍测得OD600值分别为0.885与0.887,与预测值接近,所以可使用0.5 g/L的硫酸镁、0.25 g/L的硫酸铜、0.142 g/L的氯化锰作为金属离子最佳浓度。
2.5 生长曲线的测定
YDF-1的生长曲线见图13。

图13 YDF-1的生长曲线Fig.13 Growth curve of YDF-1
由图13可知,YDF-1在普通YEPD培养基中,0~2 h为延滞期,2 h~6 h为对数生长期,6 h以后为稳定期,此时发酵液中活菌数为5.3×108CFU/ml。YDF-1在优化培养基中,0~2 h为生长延滞期,2 h~13 h为生长对数期,13 h以后为稳定期,在20 h时取样,进行稀释涂布活菌计数,此时发酵液中活菌数为1.39×109CFU/mL。相比较YEPD培养基,优化后OD600值(稀释40倍)提高了2.4倍,活菌数提高了2.6倍。
2.6 增殖YDF-1转化L-苯丙氨酸生成β-苯乙醇
将YDF-1在上述增殖培养基中培养至OD600(稀释35倍)值高于0.85以上时,离心收集菌体,将菌体置于转化培养基中培养48 h,测其发酵液中β-苯乙醇浓度,结果见图14。
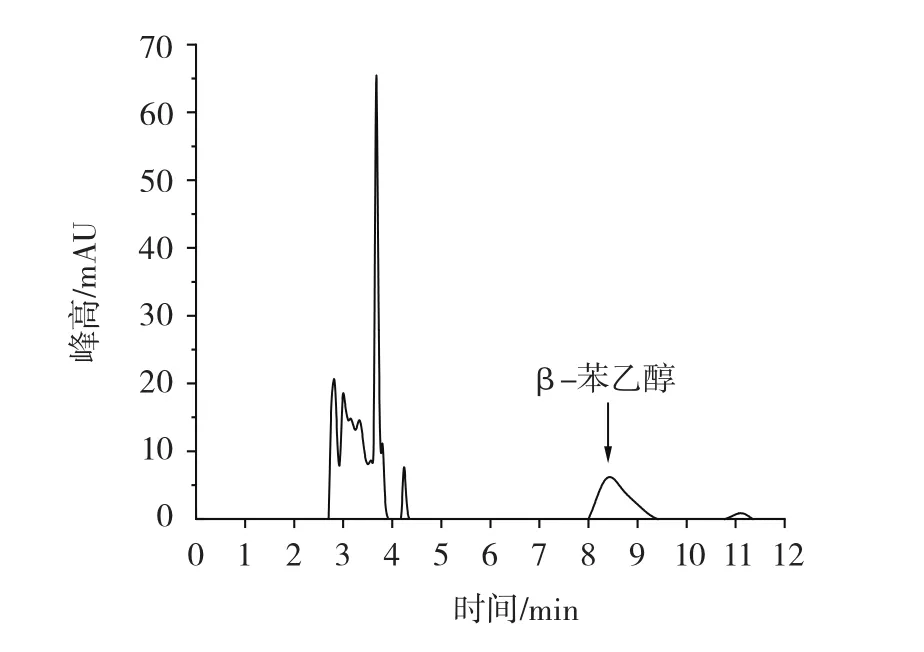
图14 48 h发酵液液相色谱图Fig.14 48 h liquid chromatogram of fermentation broth
由图14可知,β-苯乙醇对应峰面积为478.7,计算得到苯乙醇浓度为3.27 g/L。说明经增殖培养后再进行L-苯丙氨酸转化,可以有效地提高β-苯乙醇的产量。
3 结论
自然界中多种酵母都可以通过艾氏途径转化L-苯丙氨酸合成β-苯乙醇,但高浓度的β-苯乙醇会抑制酵母的生长,同时也有研究发现酵母对β-苯乙醇的耐受性越好,其转化合成β-苯乙醇的能力越强。所以选育可耐受高浓度β-苯乙醇的酵母是高产β-苯乙醇的必备条件之一。而本试验通过增殖培养实现了β-苯乙醇产量的增加,相比较传统方法,这种方法在缩短了发酵周期的同时也提高了β-苯乙醇产量,为后续转化合成β-苯乙醇的研究奠定了基础,为应用生产天然β-苯乙醇提供了菌株来源。
本文从玉米胚芽、玉米皮等淀粉生产下脚料中分离出的酵母菌株YDF-1,通过形态、18S rDNA序列分析鉴定,确认其为Pichia kudriavzevii(库德里阿兹威毕赤酵母)。经试验证明,YDF-1可耐受4 g/L的苯乙醇浓度,初步发酵β-苯乙醇产量为2.82 g/L,具有高产β-苯乙醇的潜力。通过单因素和响应面试验获得YDF-1增殖培养最优化培养基:葡萄糖100 g/L、胰蛋白胨 3 g/L、KH2PO44 g/L、MgSO4·5H2O 0.5 g/L、CuSO40.25 g/L、MnCl20.142 g/L。培养20 h,每毫升发酵液中含有活菌1.39×109个。相比初始YEPD培养基,活菌数提高了2.6倍。以此优化条件增殖培养YDF-1后进行初步转化试验生产β-苯乙醇,培养48 h时β-苯乙醇产量可达3.27 g/L。

