鹿茸菇多糖对小鼠抗疲劳能力的影响
李欣
(天津师范大学体育科学学院,天津 300387)
鹿茸菇(Lyophyllum decastes)又名荷叶蘑、荷叶离褶伞,属于担子菌亚门、层菌纲、伞菌目、白蘑科、离褶伞属,主要分布在我国黑龙江、吉林、四川、云南、青海等地,是非常珍贵的药食两用食用真菌,味道鲜美、营养丰富[1-2]。鹿茸菇中富含氨基酸,其中必需氨基酸的比例很高,脂肪含量很低,而且还含有人体必需的维生素和微量元素,具有多种功效,包括降血脂、降血压、预防糖尿病、抗肿瘤、抗炎和抗过敏等[3-5]。Miura等[6]研究发现鹿茸菇多糖可改善高胰岛素血症小鼠胰岛素功能、降低血糖水平;Ukawa等[7-8]通过高脂血症大鼠摄入鹿茸菇发现,鹿茸菇可以促进大鼠胆汁酸分泌、降低血清总胆固醇含量;体内生长肉瘤细胞的小鼠摄入鹿茸菇,可降低肉瘤细胞活性、抑制细胞增殖;Pushpa等[9]研究发现鹿茸菇对培养基中7种细菌和5种真菌具有抑菌作用;Nakamura等[10]对小鼠摄入鹿茸菇多糖后进行X射线照射,发现放射的副作用有效降低。近年来国内对鹿茸菇营养价值、活性成分的研究逐渐兴起,但相关资料较少[11]。本研究从鹿茸菇中分离纯化鹿茸菇多糖,对力竭运动小鼠进行鹿茸菇多糖干预,分析鹿茸菇多糖对抗氧化和抗运动性疲劳的作用,为鹿茸菇多糖功能性产品的研发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
昆明小鼠[雄性,5周龄]:北京维通利华实验动物技术有限公司;鹿茸菇:江苏江南生物科技公司;红景天:广州赛健生物科技有限公司。
葡萄糖(glucose,GLU)含量检测试剂盒、血乳酸(blood lactic acid,BLA)含量检测试剂盒、尿素氮(blood urea nitrogen,BUN)含量检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒、肝/肌糖原测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒、过氧化氢酶(catalase,CAT)活性检测试剂盒、钠钾三磷酸腺嘌呤核苷酸酶(Na+K+-adenosine triphosphatase,Na+K+-ATPase)活性检测试剂盒、钙镁三磷酸腺嘌呤核苷酸酶(Ca2+Mg2+-adenosine triphosphatase,Ca2+Mg2+-ATPase)活性检测试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
血液分析仪(LH750):美国贝克曼库尔特有限公司;匀浆机(FSH-2):江苏省金坛市环宇科学仪器厂;全自动生化分析仪(iMagic-M7):深圳市库贝尔生物科技有限公司;真空冷冻干燥机(ALPHA 1-2 LD plus):德国Christ公司;小鼠恒温游泳池(JD-XSC):上海继德教学实验器械厂;分析天平(FA1204T):厦门雄发仪器仪表有限公司;高速台式离心机(TGL-20B):上海安亭科学仪器厂。
1.3 方法
1.3.1 鹿茸菇多糖的配制
将鹿茸菇置于50℃烘箱中干燥至恒重,用粉碎机粉碎至100目,按料液比1∶20(g/mL)加入85% 乙醇,在70℃下水浴8 h,重复处理至溶液无颜色,将样品脱脂后,于50℃烘箱中烘干至恒重。将样品置于料液比1∶26(g/mL)、89 ℃下蒸馏水中浸提 3 h,得到鹿茸菇粗多糖浸提液,浸提后7 000 r/min离心10 min,取上清液,按体积比1∶4加入无水乙醇,静置24 h,去除蛋白质,7 000 r/min离心10 min得沉淀物。依次用DEAE cellulose-52色谱、DEAE-FF凝胶色谱层析法和超净水透析法分离纯化粗多糖,经冷冻干燥得到鹿茸菇多糖(Lyophyllum decastes polysaccharides,LDP)[12-13]。
1.3.2 动物分组与灌胃
50只小鼠在正常条件下适应性饲养7 d,随机分为5组(每组10只),分别为鹿茸菇多糖低剂量组[LDPL组,100 mg/(kg·d)]、鹿茸菇多糖中剂量组[LDPM组,200 mg/(kg·d)]、鹿茸菇多糖高剂量组[LDPH组,400 mg/(kg·d)]、阳性对照组[AG组,200 mg/(kg·d)]、空白对照组(BC组,等剂量蒸馏水),连续灌胃30 d。
1.3.3 小鼠负重游泳实验
小鼠末次灌胃40 min后,在小鼠尾部固定一质量为小鼠体重5% 的铅条,将小鼠置于水深30 cm的游泳箱中游泳,水温控制在(26.0±0.5)℃,记录自游泳开始至鼻孔10 s不能浮出水面的时间,即小鼠负重游泳力竭时间。
1.3.4 血清、肌组织和肝组织的采集与制备
小鼠力竭运动后,眼球取血,在4℃下3 500 r/min离心15 min制备血清,取上清液置于试管中,-20℃保存。取血后小鼠脱颈处死,取其后腿肌肉和肝脏,分别用生理盐水漂洗3遍,用滤纸吸干后,称量0.5 g标本加入4.5 mL生理盐水,将其置于匀浆机中低温粉碎匀浆,转速3 500 r/min离心15 min,取上清液于试管中,-20℃保存。
1.3.5 小鼠运动疲劳相关生化指标检测
将制备的血清用于检测血清葡萄糖、血清乳酸、尿素氮含量和乳酸脱氢酶活性,肌组织液用于检测肌糖原含量,肝组织液用于检测肝糖原、丙二醛含量及谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶、钠钾三磷酸腺嘌呤核苷酸酶、钙镁三磷酸腺嘌呤核苷酸酶活性,指标检测方法均按照试剂盒说明书操作。
1.4 统计分析
数据处理采用SPSS 21.0软件,统计结果为平均值±标准差,用单因素方差分析进行组间比较,P<0.05表示有统计学意义。
2 结果与分析
2.1 鹿茸菇多糖对小鼠力竭运动时间的影响
力竭运动时长是运动能力最客观、最直接的表现,实验期间鹿茸菇多糖对小鼠负重游泳力竭时间的影响见图1。

图1 鹿茸菇多糖对小鼠负重游泳力竭时间的影响(n=10)Fig.1 Effect of Lyophyllum decastes polysaccharides on the exhaustive weight-loading swimming time in mice(n=10)
由图1可知,鹿茸菇多糖各剂量组和空白对照组比较,小鼠负重游泳力竭的时间显著延长(P<0.05),鹿茸菇多糖低、中、高剂量组分别延长42.1% 、52.6% 、61.2% ,阳性对照组延长53.1% 。随鹿茸菇多糖剂量的增加,小鼠负重游泳力竭的时间延长;鹿茸菇多糖各剂量组与阳性对照组比较,小鼠负重游泳力竭时间无统计学差异。实验结果表明鹿茸菇多糖具有提高运动耐力的作用。
2.2 鹿茸菇多糖对小鼠力竭运动后肌糖原和肝糖原储备的影响
运动过程中,肌糖原和肝糖原分解为机体提供能量,能源物质的储备直接影响运动能力,实验期间鹿茸菇多糖对小鼠力竭运动后肌糖原和肝糖原储备的影响见图2。

图2 鹿茸菇多糖对小鼠肌糖原和肝糖原含量的影响(n=10)Fig.2 Effect of Lyophyllum decastes polysaccharides on the content of muscle glycogen and liver glycogen in mice(n=10)
由图2可知,鹿茸菇多糖各剂量组和空白对照组比较,小鼠力竭运动后肌糖原和肝糖原储备显著增加(P<0.05),鹿茸菇多糖低、中、高剂量组肌糖原含量分别增加13.3% 、24.8% 、29.5% ,阳性对照组肌糖原含量增加28.6% ,肝糖原含量低、中、高剂量组和阳性对照组分别增加21.9% 、34.7% 、39.9% 、36.9% 。随鹿茸菇多糖干预剂量的增加,肌糖原和肝糖原的含量也随之增加。鹿茸菇多糖各剂量组与阳性对照组比较,无明显差异,表明鹿茸菇多糖可有效提高体内肝糖原和肌糖原的储备。
2.3 鹿茸菇多糖对小鼠力竭运动后血清葡萄糖、血乳酸、尿素氮含量和乳酸脱氢酶活性的影响
机体在力竭运动过程中,血中葡萄糖被消耗,血乳酸和尿素氮水平会增加,图3为实验期间鹿茸菇多糖对小鼠力竭运动后血清葡萄糖、血乳酸、尿素氮含量和乳酸脱氢酶活性的影响。

图3 鹿茸菇多糖对小鼠血清葡萄糖、血乳酸、尿素氮含量和乳酸脱氢酶活性的影响(n=10)Fig.3 Effect of Lyophyllum decastes polysaccharides on GLU,BLA,BUN and LDH of serum in mice(n=10)
由图3可知,鹿茸菇多糖各剂量组和空白对照组比较,小鼠力竭运动后血清中GLU含量和LDH活性显著增加(P<0.05),BLA和BUN含量显著降低(P<0.05)。鹿茸菇多糖低、中、高剂量组和阳性对照组血清GLU含量分别升高12.1% 、21.7% 、24.2% 、20.9% ,血清LDH活性分别升高14.9% 、25.1% 、31.2% 、23.9% ,BLA含量分别降低10.6% 、17.1% 、21.0% 、15.9% ,BUN含量分别降低18.9% 、28.8% 、32.7% 、24.5% 。随鹿茸菇多糖剂量的增加,小鼠血清GLU含量、LDH活性明显升高,BLA和BUN含量明显降低。鹿茸菇多糖各剂量组与阳性对照组比较,各项指标无统计学差异。以上数据表明鹿茸菇多糖具备缓解运动性疲劳的能力。
2.4 鹿茸菇多糖对小鼠力竭运动后肝组织抗氧化指标的影响
力竭运动过程中机体产生大量自由基,体内抗氧化系统容易出现失衡现象,实验期间鹿茸菇多糖对小鼠力竭运动后肝组织抗氧化指标的影响见图4。


图4 鹿茸菇多糖对小鼠肝组织抗氧化效果的影响(n=10)Fig.4 Effect of Lyophyllum decastes polysaccharides on antioxidation of liver tissue in mice(n=10)
由图4可知,鹿茸菇多糖各剂量组和空白对照组比较,小鼠力竭运动后肝组织中SOD活性显著升高(P<0.05),鹿茸菇多糖低、中、高剂量组和阳性对照组分别升高11.5% 、18.2% 、27.6% 、20.7% ;CAT活性显著升高(P<0.05), 各组分别升高14.2% 、25.5% 、27.5% 、26.8% ;GSH-Px活性显著升高(P<0.05),各组分别升高 16.7% 、27.3% 、30.6% 、29.2% 。力竭运动后小鼠SOD、CAT和GSH-Px的活性,随鹿茸菇多糖干预剂量的增加而升高。与空白对照组比较,鹿茸菇多糖低、中、高剂量组和阳性对照组MAD含量显著降低(P<0.05),各组分别降低13.9% 、20.8% 、26.9% 、26.2% ,随鹿茸菇多糖干预剂量的增加,MAD含量降低越明显。鹿茸菇多糖各剂量组与阳性对照组比较,各项指标无统计学差异。以上实验结果表明鹿茸菇多糖具备较强的抗氧化能力。
2.5 鹿茸菇多糖对小鼠力竭运动后Na+K+-ATPase和Ca2+Mg2+-ATPase的影响
Na+K+-ATPase和Ca2+Mg2+-ATPase对能量代谢具有重要作用,机体在力竭运动过程中,这两种酶的活性容易失衡。实验期间鹿茸菇多糖对小鼠力竭运动后肝组织Na+K+-ATPase及Ca2+Mg2+-ATPase活性的影响见图5。
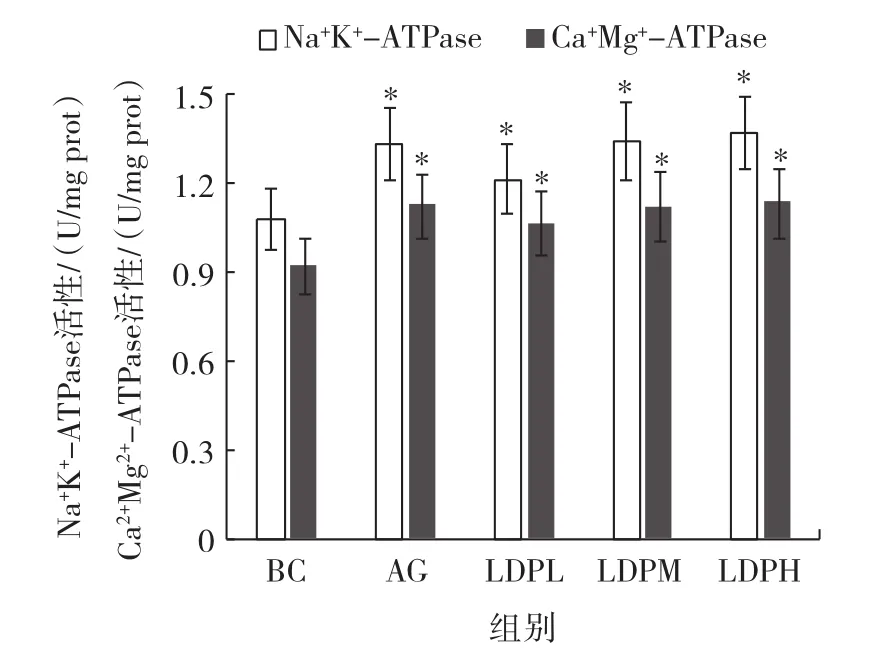
图5 鹿茸菇多糖对小鼠力竭运动后Na+K+-ATPase和Ca2+Mg2+-ATPase活性的影响(n=10)Fig.5 Effect of Lyophyllum decastes polysaccharides on activities of Na+K+-ATPase and Ca2+Mg2+-ATPase in mice(n=10)
由图5可知,鹿茸菇多糖各剂量组和阳性对照组与空白对照组比较,小鼠力竭运动后肝组织中Na+K+-ATPase和 Ca2+Mg2+-ATPase活性显著增加(P<0.05),鹿茸菇多糖低、中、高剂量组Na+K+-ATPase活性分别增加12.5% 、24.1% 、26.7% ,阳性对照组增加23.4% ,与鹿茸菇多糖中剂量组相当;Ca2+Mg2+-ATPase活性低、中、高剂量组和阳性对照组分别增加16.1% 、21.8% 、23.2% 、22.5% 。随鹿茸菇多糖干预剂量的增加,Na+K+-ATPase和Ca2+Mg2+-ATPase活性明显升高。与阳性对照组比较,鹿茸菇多糖各剂量组该酶活性无显著差异,结果表明鹿茸菇多糖可有效提高能量代谢酶的活性。
3 讨论与结论
运动性疲劳是机体在力竭运动中产生的自我保护的生理现象,其发生的机制尚未定论,可能与能源物质耗竭、代谢产物堆积、内环境稳定性失调、大脑皮质保护性抑制、自由基损伤等因素有关[14]。本研究发现,鹿茸菇多糖可有效延长小鼠负重游泳力竭时间,随摄入剂量的增加,效果越明显,分析其原因,鹿茸菇多糖可增加小鼠负重游泳后肝糖原、肌糖原、血清中葡萄糖的含量,高剂量组分别提高39.9% 、29.5% 、24.2% ,提高能源储备能够有效地保障能源供给,提高小鼠运动耐力[15-16];而且鹿茸菇多糖提高供能酶钠钾三磷酸腺嘌呤核苷酸酶和钙镁三磷酸腺嘌呤核苷酸酶的活性,该酶可使细胞膜两侧Na+/K+和Ca2+/Mg2+正常运输,维持膜电位的均衡,催化ATP供能,使机体供能代谢保持较高水平,延缓游泳力竭的时间[17];同时,鹿茸菇多糖可减少代谢产物乳酸和尿素氮的堆积,高剂量组分别降低21.0% 和32.7% 。乳酸可使H+浓度升高、pH值降低,加速疲劳的产生[18],鹿茸菇多糖可提高乳酸脱氢酶的活性,高剂量组提高31.2% ,加速乳酸分解,降低乳酸含量[19];而且能源储备增加,减少了蛋白质分解供能,尿素氮的产生也相应降低,有效地控制代谢产物的含量[20-21]。在力竭运动中,机体产生大量的活性氧,高浓度活性氧可导致细胞氧化损伤及细胞凋亡,加速疲劳的产生[22]。本研究发现,鹿茸菇多糖可有效提高抗氧化酶系统活性[23],高剂量组谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶活性分别提高30.6% 、27.6% 、27.5% ;同时降低丙二醛的含量,丙二醛是反映机体过氧化程度的重要指标[24],鹿茸菇多糖高剂量组可显著降低丙二醛的含量(26.9% )。鹿茸菇多糖通过提高抗氧化酶系统的活性,清除了体内过剩的活性氧,减少其对细胞的损伤,有效延缓疲劳的产生[25]。
综上所述,鹿茸菇多糖可有效延长小鼠负重游泳力竭时间,增加体内肝糖原和肌糖原的能源储备、提高能源代谢酶钠钾三磷酸腺嘌呤核苷酸酶和钙镁三磷酸腺嘌呤核苷酸酶的活性,增加谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶的活性,降低乳酸、尿素氮和丙二醛的含量,有效提高机体的抗疲劳、抗氧化能力。

