西兰花茎果胶的提取及理化性质研究
让凤菊,王俊龙,刘伟,任家璇,欧阳艳
(伊犁师范大学化学与环境科学学院新疆维吾尔自治区教育厅普通高等学校重点实验室,新疆 伊宁 835000)
果胶是一种结构复杂的天然高分子多糖,主要以α-1,4糖苷键连接半乳糖醛酸组成。根据酯化程度的不同,果胶可分为两种:酯化度(degree of esterification,DE)值高于50% 的称为高酯果胶(high methoxyl pection,HMP),低于50% 的则称为低酯果胶(low methoxyl pection,LMP)[1]。因其具有良好的凝胶性、乳化性和抗氧化性等功能而被广泛应用于食品医药行业[2],被粮农组织和世界卫生组织[FAO(Food&Agriculture Organization)/WHO(World Health Organization)]联合委员会认定为一种安全无毒的食品添加剂。作为可溶性膳食纤维,果胶表现出一定的药理活性,如降胆固醇水平、降糖及减肥[3],提高人体免疫能力和抗癌[4]等。目前,国内果胶的产能受制于原料问题,大部分需要靠进口解决,且成本昂贵,近年来,从农副产品的生产废料中寻找新果胶来源已成为研究热点。如葡萄渣[5]、可可豆荚[6]和香蕉皮[7]、西红柿渣[8]、火龙果皮[9]等等。
西兰花,又名西蓝花(Brassica oleracea L.var.Italica),是为十字花科芸薹属一年生植物,因其营养丰富,富含多种活性成分,备受研究者关注。近年来,随着国际市场对西兰花的需求量的增大,国内西兰花的产量日益增加,2017年产量己超过1 044万t,占世界西兰花总产量的40.2% ,居世界第一。西兰花的食用部分是花球,占其总重量的25% ~40% ,根茎部分则被视为废弃物而丢弃,造成环境的污染和资源的浪费。因此研究这些废弃物再利用既有较大经济效益,又能减少环境污染。
目前有关西兰花的活性成分研究多集中在硫代葡萄糖苷[10-12],而关于果胶的研究较少[13-14]。本试验采用正交试验优化西兰花茎果胶提取工艺,测定了果胶的理化性质、表观结构,以期为西兰花果胶的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
西兰花茎:餐厅;柠檬酸、乙酸、盐酸、硫酸、氢氧化钠、酚酞、无水乙醇(均为分析纯):上海士峰生物科技有限公司;咔唑、半乳糖醛酸:阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
UV-2500紫外可见分光光度计、傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR):日本岛津分析仪器厂;heidolph旋转蒸发仪:上海铂鳞贸易仪器;BSA124S电子天平:北京赛多利斯仪器有限公司;JSM-7500F扫描电镜:日本电子株式会社;LGJ-10N冷冻干燥机:北京亚星仪科科技有限公司。
1.3 方法
1.3.1 原材料预处理
将回收的西兰花茎洗净、切片,在80℃~100℃水中煮沸2 min~3 min灭酶,将灭酶后的西兰花茎放入烘箱中90℃烘干,粉碎,过40目筛备用。
1.3.2 果胶提取工艺流程
精确称取一定质量西兰花茎粉末于烧杯中,加入稀盐酸溶解,调节适当pH值,置于一定温度的恒温水浴锅中加热一定时间,趁热用四层纱布过滤,将滤液旋转蒸发浓缩,以粗果胶提取液的2倍的量加入95% 乙醇,置于冰箱中冷藏过夜,用纱布静置过滤后得粗果胶,将其置于烘箱中80℃烘干,干燥,称量粗果胶重量,计算粗果胶的得率。
1.3.3 西兰花茎果胶提取单因素试验
1.3.3.1 不同酸对果胶得率的影响
按照1.3.2提取果胶的工艺流程,在料液比为1∶20(g/mL)、提取温度为 80 ℃、pH 值为 2.0、提取时间60 min条件下,分别用盐酸、硫酸、柠檬酸、磷酸、乙酸提取西兰花茎果胶,比较果胶得率,确定最佳提取剂。
1.3.3.2 不同pH值对果胶得率的影响
以盐酸为提取剂,在料液比为 1∶20(g/mL)、提取温度为80℃、提取时间60 min条件下,调节pH值分别为 1.5、2.0、2.5、3.0、3.5, 按照 1.3.2 提取果胶的工艺流程提取果胶,比较不同pH值下果胶得率。
1.3.3.3 不同料液比对果胶得率的影响
以盐酸为提取剂,在pH值为1.5、提取温度为80℃、提取时间为60 min条件下,调节料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),按照 1.3.2 提取果胶,比较不同料液比下西兰花茎果胶得率。
1.3.3.4 不同提取温度对果胶得率的影响
以盐酸为提取剂,在 pH1.5、料液比为 1∶25(g/mL)、提取时间为60 min条件下,调节提取温度分别为50、60、70、80、90 ℃,按照 1.3.2 提取果胶,比较不同温度下西兰花茎果胶得率。
1.3.3.5 不同提取时间对果胶得率的影响
以盐酸为提取剂,在 pH1.5、料液比为 1∶25(g/mL)、提取温度为90℃条件下,调节提取时间分别为35、50、65、80、95 min,按照 1.3.2 提取果胶,比较不同提取时间下西兰花茎果胶得率。
1.3.4 正交试验优化西兰花茎果胶提取工艺
在单因素试验的基础上,以pH值、料液比、提取温度、提取时间为考察因素,果胶的得率为指标,进行正交试验,优化西兰花茎果胶提取的最佳工艺参数。
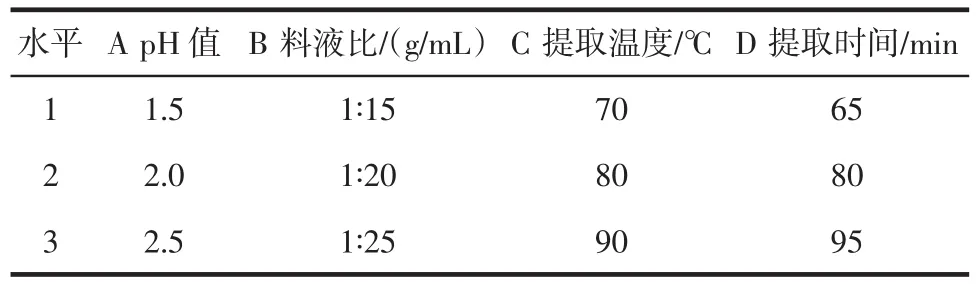
表1 正交试验因素水平Table 1 Factor level of orthogonal test
1.3.5 西兰花果胶得率的计算
西兰花果胶得率按式(1)计算。

式中:P为果胶得率,% ;m为提取得到的粗果胶质量,g;W为西兰花茎粉末质量,g。
1.3.6 西兰花理化性质指标的测定
1.3.6.1 半乳糖醛酸含量
标准曲线的绘制:参考侯彩云[15]和侯玉婷等[16]的方法略微改动,称取0.100 g D-半乳糖醛酸标准品于水中溶解,在100 mL容量瓶中定容混合均匀得到半乳糖醛酸标准品。用移液枪移取不同体积标准溶液分别注入10 mL容量瓶中定容,得到不同质量浓度半乳糖醛酸标准溶液。依次取1 mL上述半乳糖醛酸标准溶液于50 mL比色管中,再加入一定体积的浓硫酸,在100℃加热20 min,降温至室温后分别加入0.15% 咔唑-乙醇溶液,在暗处显色1 h,在528 nm出测定其吸光度,以半乳糖醛酸质量浓度为横坐标(x),以吸光度为纵坐标(y),绘制标准曲线。得标准曲线回归方程:y=0.018 2x-0.019 8,R2=0.999 3。
果胶半乳糖醛酸含量的测定:按照1.3.2提取一定量果胶,参照上述比色法测定吸光度,并依据式(2)计算西兰花样品中半乳糖醛酸含量(GA)。
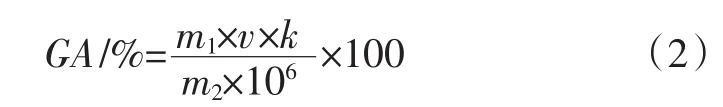
式中:m1为标准曲线方程计算出的每毫升稀释液中所含半乳糖醛酸的含量,mg/mL;v为西兰花果胶提取液体积,mL;k为西兰花茎果胶提取液稀释倍数;m2为所称取的西兰花茎果胶粉末的质量,g。
1.3.6.2 西兰花茎果胶溶解度的测定
参考邹荣[17]的方法并改进,取果胶样品0.5 g,加入75 mL蒸馏水,于40℃下振荡2 h,悬浮液离心(5 000 r/min,15 min),取上清液,置于 105℃烘箱中烘至恒重,按式(3)计算果胶溶解度。

式中:S为溶解度,% ;M1为西兰花茎果胶的原始质量,g;M2为西兰花茎果胶恒重后质量,g。
1.3.6.3 西兰花茎果胶灰分含量的测定
根据GB 25533—2010《食品安全国家标准食品添加剂果胶》[18]中灰分的测定方法分析西兰花中灰分含量。按式(4)计算灰分含量。

式中:m1为坩埚和果胶样品总质量,g;m2为灰化的坩埚和粗果胶质量,g;m0为西兰花茎果胶的质量,g。
1.3.6.4 西兰花果胶酸不溶物的测定
参考辛明等[19]的方法,根据干燥后滤渣的质量计算西兰花茎中果胶酸不溶物的含量,按式(5)计算果胶酸不溶物含量。
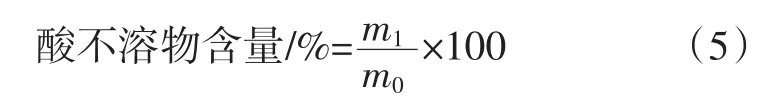
式中:m1为西兰花果胶滤渣恒重质量,g;m0为西兰花果胶的质量,g。
1.3.6.5 西兰花茎果胶pH值的测定
用热蒸馏水配制0.1% 西兰花茎果胶溶液,冷却至室温后,用pH计测定其果胶的pH值。
1.3.6.6 西兰花茎果胶酯化度的测定
西兰花果胶酯化度的测定方法参考郭兴峰等[20]的方法。称取西兰花果胶提取物0.5 g左右,先加少量浓度为95% 的乙醇将其润湿,再加少量的热蒸馏水溶解。待西兰花茎的果胶完全溶解后,滴加2滴酚酞指示剂,再加入0.1 mol/L的NaOH溶液,滴定至刚有颜色变化时记录下NaOH溶液消耗体积(V1)。在西兰花茎果胶溶液中再加入10 mL 0.1 mol/L的NaOH溶液混匀,酯化反应2 h,加入0.1 mol/L的HCl溶液10 mL,最终再使用1 mol/L的NaOH溶液滴定至溶液刚有颜色变化,记录NaOH消耗的溶液的体积(V2),西兰花茎的酯化度(DE)按照式(6)计算。
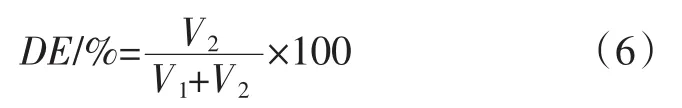
1.3.7 西兰花果胶的纯化
参照张士凯等[21]果胶纯化方法,在西兰花茎的粗果胶中加入95% 的乙醇,使用磁力搅拌器以500 r/min搅拌20 min使杂质溶出,然后以5 000 r/min离心10 min去上清液收集沉淀,使用95% 乙醇重复上述步骤3次,以此保证可以获得较为纯净的果胶。使用95% 乙醇洗涤所获得的果胶沉淀,静置使乙醇挥发,再用少量蒸馏水溶解,装入3 500 Da的透析袋中,以蒸馏水为透析液透析24 h,每4 h更换一次透析液。纯化后的果胶冷冻干燥24 h后备用。
1.3.8 西兰花果胶扫描电镜测定
根据王文骏[22]的方法并加以改进优化,取适量冷冻干燥的西兰花茎果胶,用玛瑙研钵将其研磨成粉末,检验粉末无磁性后,将其放到样品台的双面胶上并涂薄金层,用10 kV的加速电压扫描电镜拍摄样品的形貌特征,放大倍数为13 000倍。
1.3.9 西兰花果胶红外光谱的测定
参考王炜清等[23]的方法测定,称取质量为0.100 g的溴化钾粉末,西兰花茎果胶粉末0.001 g,将二者混合均匀,用玛瑙研钵研磨5 min。将研磨好的混合物样品置于60℃干燥箱里干燥1 h,制成透明压片,采用傅里叶变换红外光谱仪于400 cm-1~4 000 cm-1范围内进行光谱扫描。
1.4 数据处理
所有试验均重复3次,结果用平均值±标准差表示。运用Microsoft Excel 2016进行数据处理。用Origin 8.0软件绘制图形。
2 结果与分析
2.1 单因素试验
2.1.1 提取酸的选择
以西兰花果胶得率、半乳糖醛酸含量为指标,用盐酸、硫酸、柠檬酸、磷酸、乙酸提取果胶,结果见图1。

图1 不同酸对果胶得率及半乳糖醛酸含量的影响Fig.1 Effect of different acids on pectin yield and galactolic acid content
由图1可知,柠檬酸组的果胶得率最多,为5.80% ;磷酸、乙酸较少不考虑;盐酸组果胶得率为4.75% ,而硫酸组果胶得率为4.82% ,二者差别不大,但是用硫酸提取出的果胶颜色较深;通过比较盐酸、柠檬酸提取粗果胶中半乳糖醛酸的含量发现,柠檬酸为提取剂果胶产率高但其半乳糖醛酸含量较低,为32.27% ,盐酸的半乳糖醛酸含量为56.54% ;综上,选用盐酸作为提取剂。
2.1.2 pH值对果胶得率的影响
pH值对果胶得率的影响见图2。
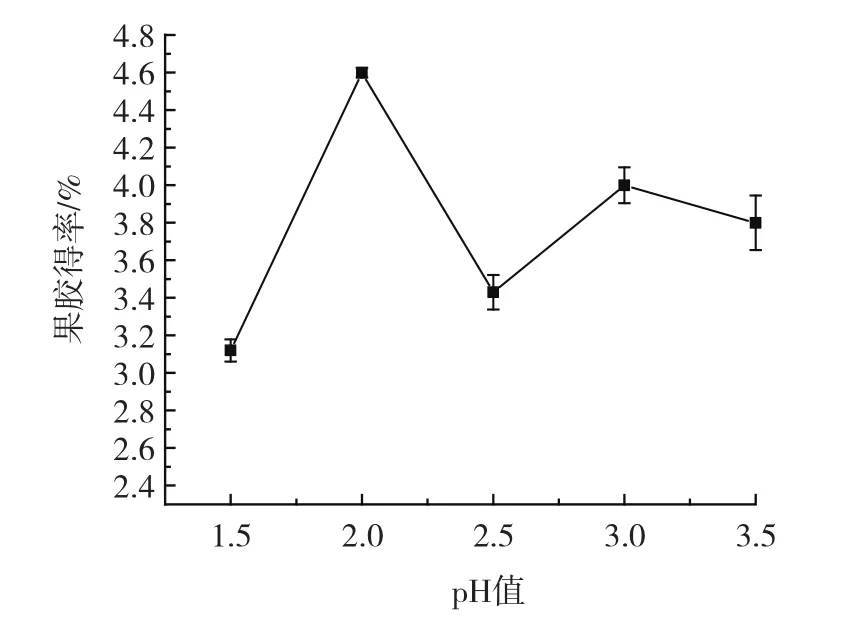
图2 pH值对果胶得率的影响Fig.2 Effect of pH value on the yield of pectin
由图2可知,西兰花果胶得率随着pH值的升高先增加后减小,在pH2.0时果胶得率最大,为4.60% ,后又缓慢上升。这可能是酸度增强有利原果胶的水解,使更多的原果胶转化为水溶性的果胶,但当pH小于2.0时,果胶得率较低,原因是溶液中的水溶性果胶在强酸条件下会进一步脱脂裂解,从而使果胶得率下降。所以,较适合的pH值为2.0。
2.1.3 料液比对果胶得率的影响
料液比对果胶得率的影响如图3所示。
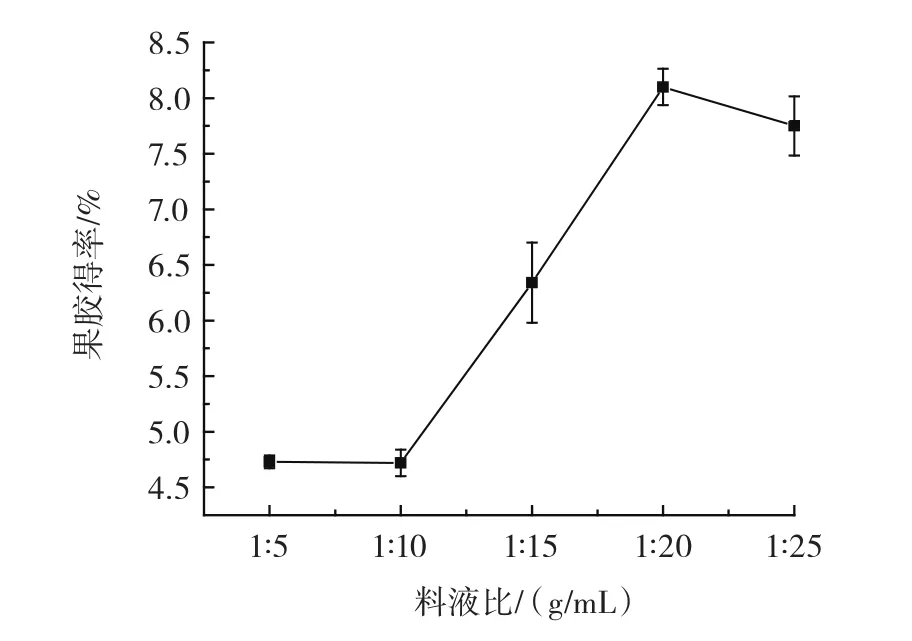
图3 料液比对果胶得率的影响Fig.3 Effect of feed-liquid ratio on the yield of pectin
由图3可知,随着提取溶剂的逐渐增加,果胶得率先增大后减小。由于果胶在水中的溶解度较小,当提取溶剂用量较小时,果胶分子不能很好的扩散溶出,导致果胶得率不高;而提取溶剂用量过多,增加后续浓缩时间,醇沉成本,综合考虑,选择料液比1∶20(g/mL),进行后续试验。
2.1.4 提取温度对果胶得率的影响
提取温度对果胶得率的影响结果如图4所示。
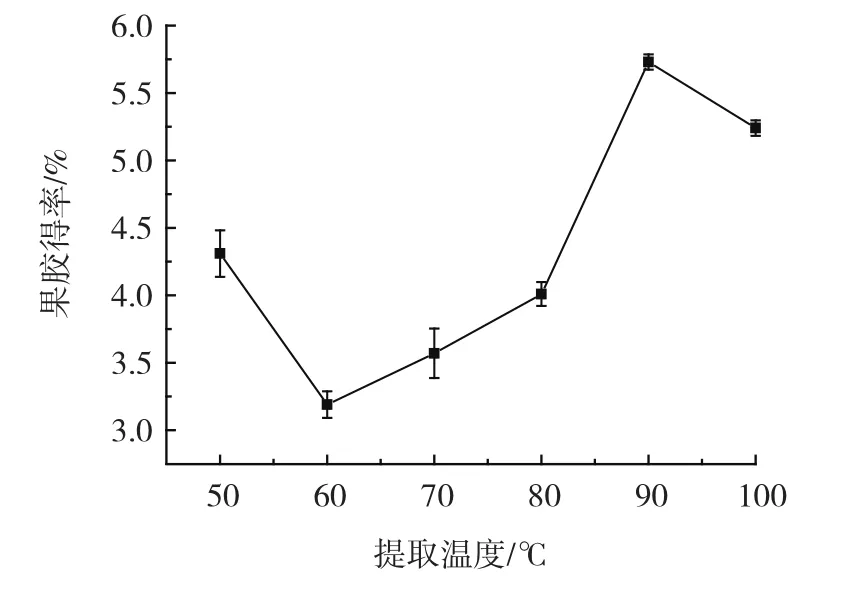
图4 提取温度对果胶得率的影响Fig.4 Effect of extraction temperature on the yield of pectin
由图4可知,随着提取温度的升高,果胶产率先降低后增大最后降低,当提取温度升高至90℃时,果胶的产率最高,为5.73% 。提取温度影响物质的扩散系数、大分子溶液的黏度以及某些物质的溶解度,较高的提取温度可以降低体系的黏度,加快传质速率,提高果胶多糖的溶解度,从而提高果胶的得率。但是过高的提取温度,又会导致糖苷键水解,故选择提取温度90℃进行后续试验。
2.1.5 提取时间对果胶得率的影响
提取时间对果胶得率的影响如图5所示。
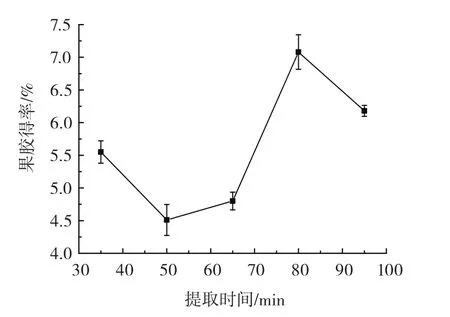
图5 提取时间对果胶得率的影响Fig.5 Effect of extraction time on the yield of pectin
由图5可知,随着提取时间不断延长,果胶产率先降低后增加再降低。可能是由于提取时间过长,将果胶溶解为更小的分子而被过滤,使果胶的产率降低。因此选提取时间80 min进行后续试验。
2.2 正交试验结果
西兰花茎果胶提取工艺正交试验结果如表2所示。
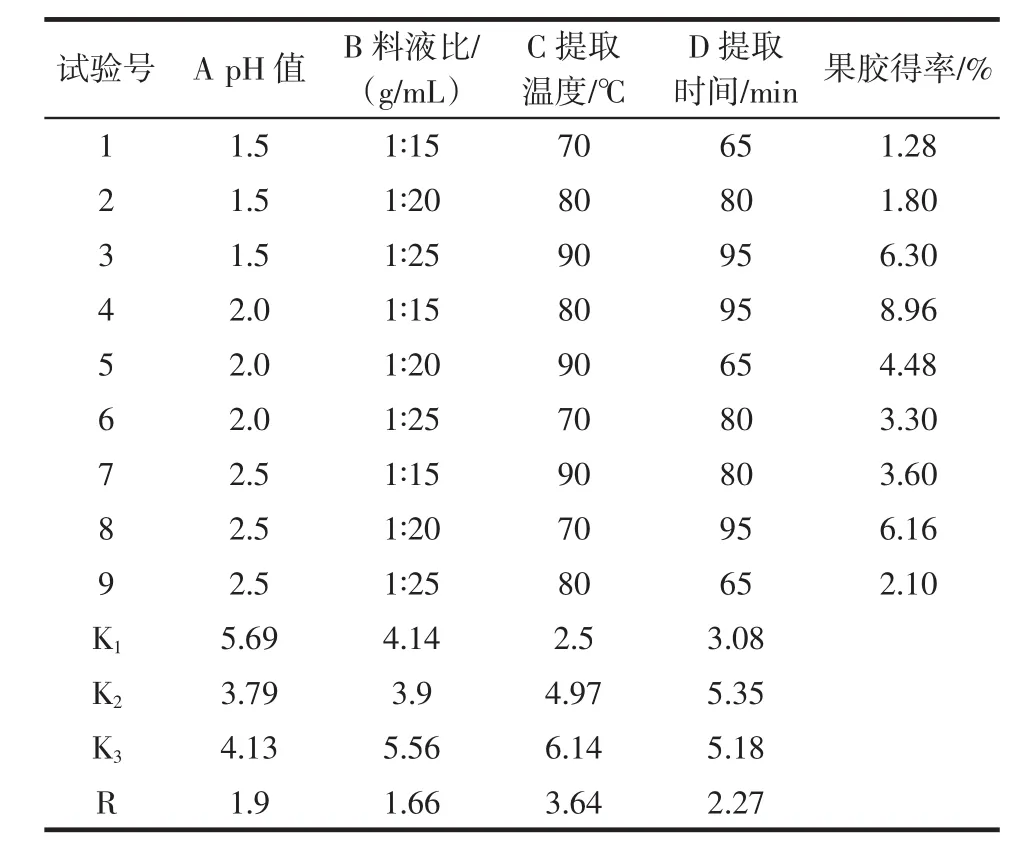
表2 正交试验结果Table 2 Orthogonal test results
由表2可知,由极差R分析得到4个因素中,影响果胶得率的顺序是提取温度>提取时间>pH值>料液比。由K值得到最佳的工艺组合为A1B3C3D2,即最佳工艺条件:pH1.5,料液比 1∶25(g/mL),提取温度 90℃,提取时间80 min。在最佳提取条件下对西兰花茎果胶得率进行验证,平均果胶得率为9.42% 。
2.3 西兰花茎果胶的理化性质
西兰花茎果胶的理化性质如表3所示。

表3 西兰花茎果胶的理化性质Table 3 Physical and chemical properties of pectin extracted from broccoli stalk
由表3可知,采用酸水法提取的西兰花茎果胶的溶解度、半乳糖醛酸含量,符合GB 25533—2010《食品安全国家标准食品添加剂果胶》的有关规定。所提取果胶的酯化度为46.70% ,属于低酯化果胶(DE<50% )。低酯果胶形成凝胶时不受体系pH值和可溶性固形物含量影响,可以用于低糖、无糖食品的增稠剂[24]。与COR相比,pH值、灰分和酸不溶物含量指标差距较大,推断是西兰花茎中无机物的含量较高或粗果胶提取纯化工艺有待改进。
2.4 西兰花茎果胶的扫描电镜图
果胶样品的扫描电镜图见图6。

图6 果胶样品的扫描电镜图Fig.6 Scanning electron microscopy(SEM)of pectin samples
由图6可知,13 000倍电镜下西兰花茎果胶(Brassica oleracea L.pectin,BOP)与商品橘子皮果胶(commercial orange pectin,COR)相对照,可以看出西兰花茎果胶和商品果胶均为片状结构,但商品果胶排列的更加紧密、缝隙小,西兰花茎果胶的片层相比于商品果胶更大,排列也不紧密,有较多的缝隙。果胶来源、提取方法以及后期处理方法的不同都会造成其表观颗粒形态的差异。
2.5 红外光谱
FTIR测定结果如图7所示。果胶的得率为9.42% ;所得果胶为低酯果胶,其半乳糖醛酸含量,溶解度达到国家标准,灰分和酸性不溶物质含量较高,且有待进一步纯化。

图7 果胶样品FTIR谱图Fig.7 The FTIR spectrum of pectin
由图7可知,两种果胶在4 000 cm-1~400 cm-1处轮廓基本一致,均有糖类[25]的特征吸收峰,说明两种果胶多糖的类型基本相同。3 422 cm-1处峰来自—OH的伸缩振动,在2 918 cm-1处是—CH2的吸收峰,为C—H伸缩振动,在2 350 cm-1处为CO2杂质的吸收峰。在1 740 cm-1吸收峰是酯化的羧基官能团(—COOR)C—O的伸缩振动,1 648 cm-1附近的吸收峰为自由羧基官能团(—COO)CO的非对称伸缩运动,这两个吸收峰是果胶多糖特征峰,说明提取多糖为果胶多糖[26]。BOP在1 740 cm-1处左右处的吸收峰低于1 648 cm-1左右处的吸收峰[27],代表着此样品是低酯果胶。两种果胶在800 cm-1~1 300 cm-1处的吸收峰有差异,表明两种果胶在结构和单糖组成上有差异。
3 结论
本研究采用传统酸提醇沉法获取西兰花废弃茎果胶,并初步探究其理化性质。首先以西兰花茎果胶的得率为指标,考察酸的种类、pH值、料液比、提取温度、提取时间等因素对其的影响,并在此基础上进行正交试验,得出最佳工艺条件:pH1.5,料液比 1∶25(g/mL),提取温度90℃,提取时间80 min,此条件下验证试验

