藿类生物标志物及其对海洋碳氮循环过程的指示
尹美玲,段丽琴*,宋金明,袁华茂,李学刚
藿类生物标志物及其对海洋碳氮循环过程的指示
尹美玲1,2,3,4,段丽琴1,2,3,4*,宋金明1,2,3,4,袁华茂1,2,3,4,李学刚1,2,3,4
(1.中国科学院海洋研究所,海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049;3.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;4.中国科学院海洋大科学研究中心,山东 青岛 266071)
由微生物介导的海洋碳氮生物地球化学循环对全球气候变化具有重要影响.五环三萜的藿类化合物(hopanoids),包括以细菌藿多醇(BHPs)为主的生物藿类和藿烷等地质藿类,是指示近现代环境和重建古环境中碳氮循环过程的重要类脂生物标志物.本文总结了藿类化合物的生物合成途径和生理功能,及在海洋碳氮循环关键过程(固氮、硝化、厌氧氨氧化、甲烷氧化和陆源有机质输入)中的指示作用.微生物膜脂中的藿类化合物主要由基因编码的藿类合成和修饰酶调控,与微生物理化特征及环境条件具有密切关系.2-甲基藿类、2-甲基环醇醚和不饱和环醇醚等藿类化合物可调节细胞膜的氧渗透性以发挥固氮酶保护作用,可指示环境中固氮蓝细菌及其固氮过程.细菌藿四醇异构体之一的BHT-x是海洋厌氧氨氧化菌的专属产物,可指示海洋厌氧氨氧化和低氧环境.土壤标志物BHPs及陆源输入指标soil可追踪陆源有机质向海洋环境的输入和迁移.35-氨基BHPs和3-甲基(氨基)BHPs可指示好氧甲烷氧化活动.细菌藿六醇和3-甲基细菌藿六醇可指示亚硝酸盐型甲烷氧化活动.未来,随着分子生物学、基因组学和仪器分析技术的不断发展,藿类化合物在指示海洋碳氮循环过程方面势必会发挥更加重要的作用.
藿类化合物;细菌藿多醇(BHPs);海洋氮循环;好氧甲烷氧化;生物标志物
碳、氮循环是生物地球化学过程的关键,对海陆物质循环和全球气候变化具有重要影响.海洋碳、氮生物地球化学过程均由特定的微生物驱动,一些微生物在生物化学过程中可产生藿类(hopanoids)等类脂化合物[1].藿类化合物是地质体中普遍存在、保存稳定的五环三萜化合物,由于其具有细菌来源专属性和环境特异性,可指示生物来源并记录沉积环境演变信息,在反演海洋碳氮循环关键过程方面发挥重要作用[2].藿类化合物包括以细菌藿多醇(BHPs)为主的生物藿类和藿烷、藿酸、藿烯等地质藿类(表1),其中BHPs是地质藿类的前体物质,在成岩作用中脱去部分侧链结构保留稳定的碳骨架而形成地质藿类化合物[2-3].在微生物学和生物地球化学领域,通常所说的藿类脂质主要指微生物参与合成的生物藿类BHPs[4-5].BHPs具有五环三萜碳骨架和多结构的官能基团侧链,在微生物体内的合成过程主要由基因编码的藿类合成和修饰酶调控.微生物在角鲨烯-藿烯环化酶(SHC)的作用下合成C30里白烯或里白醇,并经过S-腺苷基甲硫氨酸(SAM)自由基酶(HpnH)、磷酸化酶(HpnG)和氨基转移酶(HpnO)等酶促反应转化成具有多官能化极性侧链结构的BHPs[5-7].
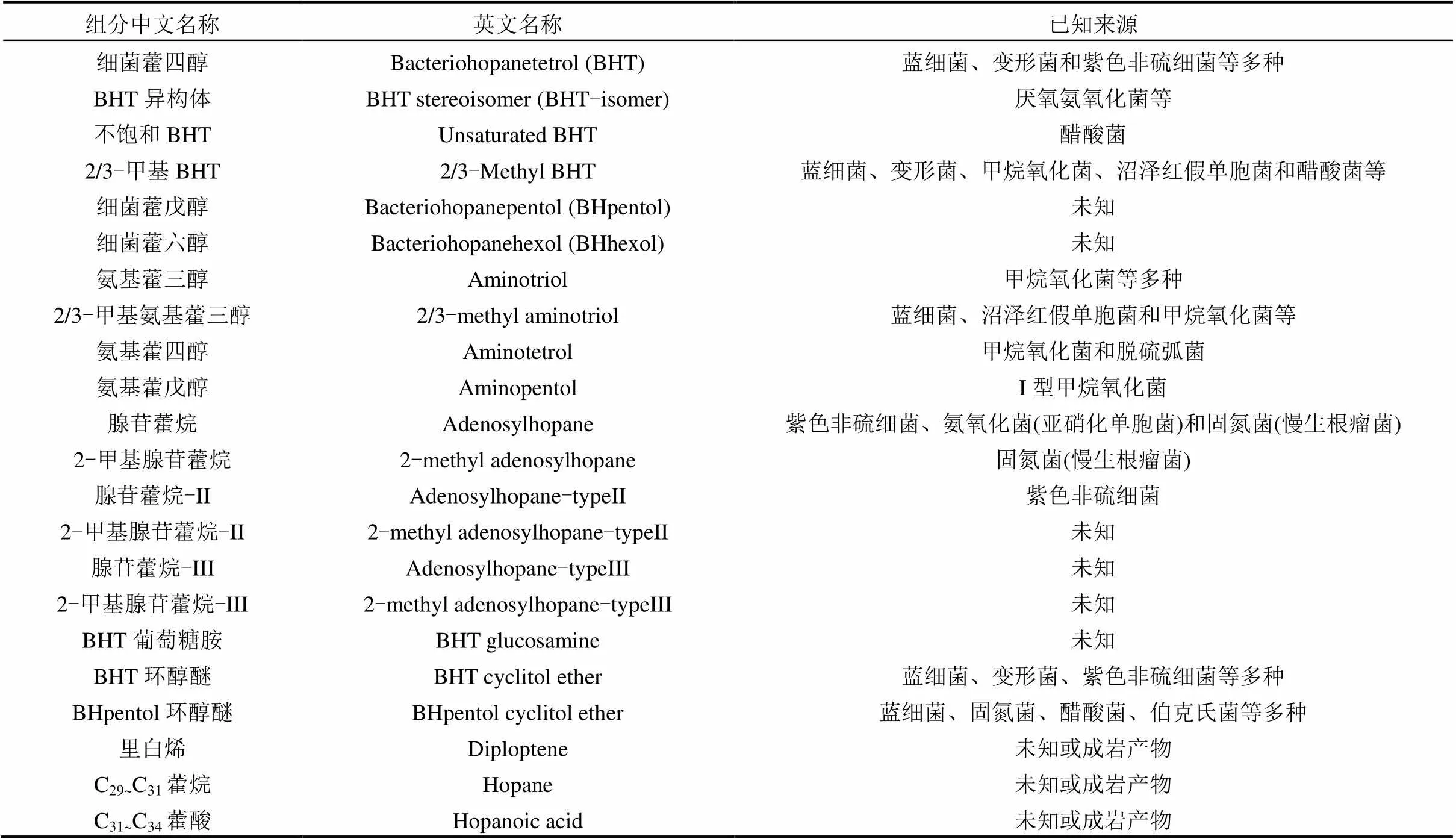
表1 环境中常见的BHPs和地质藿类种类与来源[3]
早期发现的藿类化合物主要是高等植物来源的不饱和藿类(如里白烯),以及广泛存在于地质体岩石和石油中的藿烷及其衍生物,这些地质藿类分子化石及其相关参数最早被成功应用于石油地球化学勘探,成为油气运移和有机质成熟度的重要判别指标[8].直到1973年从一株醋酸菌中分离并检测到细菌藿四醇(BHT),人们才逐渐认识和研究这类细菌来源的生物藿类BHPs.蓝细菌、变形菌等原核生物膜脂中的BHPs被认为与真核生物膜中固醇类化合物的作用相似,在维持和调节膜稳定性、渗透性及流动性方面具有重要作用[6,9].近20年来,得益于色谱-质谱联用、同位素质谱等仪器和分析技术的创新发展,多结构的藿类分子不断被鉴定和发现,藿类化合物在生物地球化学领域的应用也不断拓展[10-11].一些藿类化合物侧链基团的结构差异包含了特定的生物和环境信息,在指示生物来源、生物过程以及沉积环境方面发挥重要作用.如2-甲基藿类通常作为蓝细菌和固氮贡献的生物标志物[12];3-甲基藿类主要来源于好氧甲烷氧化菌和醋酸菌[13],其中35-氨基BHPs(氨基藿三醇、氨基藿四醇和氨基藿五醇)是好氧甲烷氧化菌和好氧甲烷氧化过程的生物标志物[14-15];来源于海洋厌氧氨氧化菌的BHT异构体(BHT-isomer)与海洋低氧条件密切相关,对厌氧氨氧化过程和低氧环境具有较大的指示潜力[16-17].
然而,目前环境中藿类化合物的生物来源专属性还存在一些不确定性.基因组学和系统发育的最新研究表明,虽然藿类合成基因广泛存在于非异形胞分化的固氮蓝细菌中,但并不是所有的固氮蓝细菌均可以产生2-甲基藿类[18];某些其他菌群也具有C-2甲基化基因,如沼泽红假单胞菌TIE-1[19].可能最早起源于需氧微生物的祖先—ɑ-变形菌,即2-甲基藿类的存在可能早于蓝细菌光合作用的发生[20].实验室研究已表明,温度、pH值、盐度、溶解氧等多种环境条件均会影响微生物生理特征及藿类合成,且不同微生物合成的不同藿类对环境压力的调节作用具有差异[21-23];但关于藿类合成基因选择性表达以应对环境胁迫的响应机制的研究还有待深入探索.本文总结了藿类化合物的生物合成途径及其生理功能,分析了藿类生物标志物在固氮、硝化、厌氧氨氧化和甲烷氧化等海洋碳氮循环关键过程中的生成机理及指示作用.未来,随着分子生物学、基因组学和分析鉴定技术的不断发展,藿类化合物在指示碳氮循环过程方面势必会发挥更重要的作用.
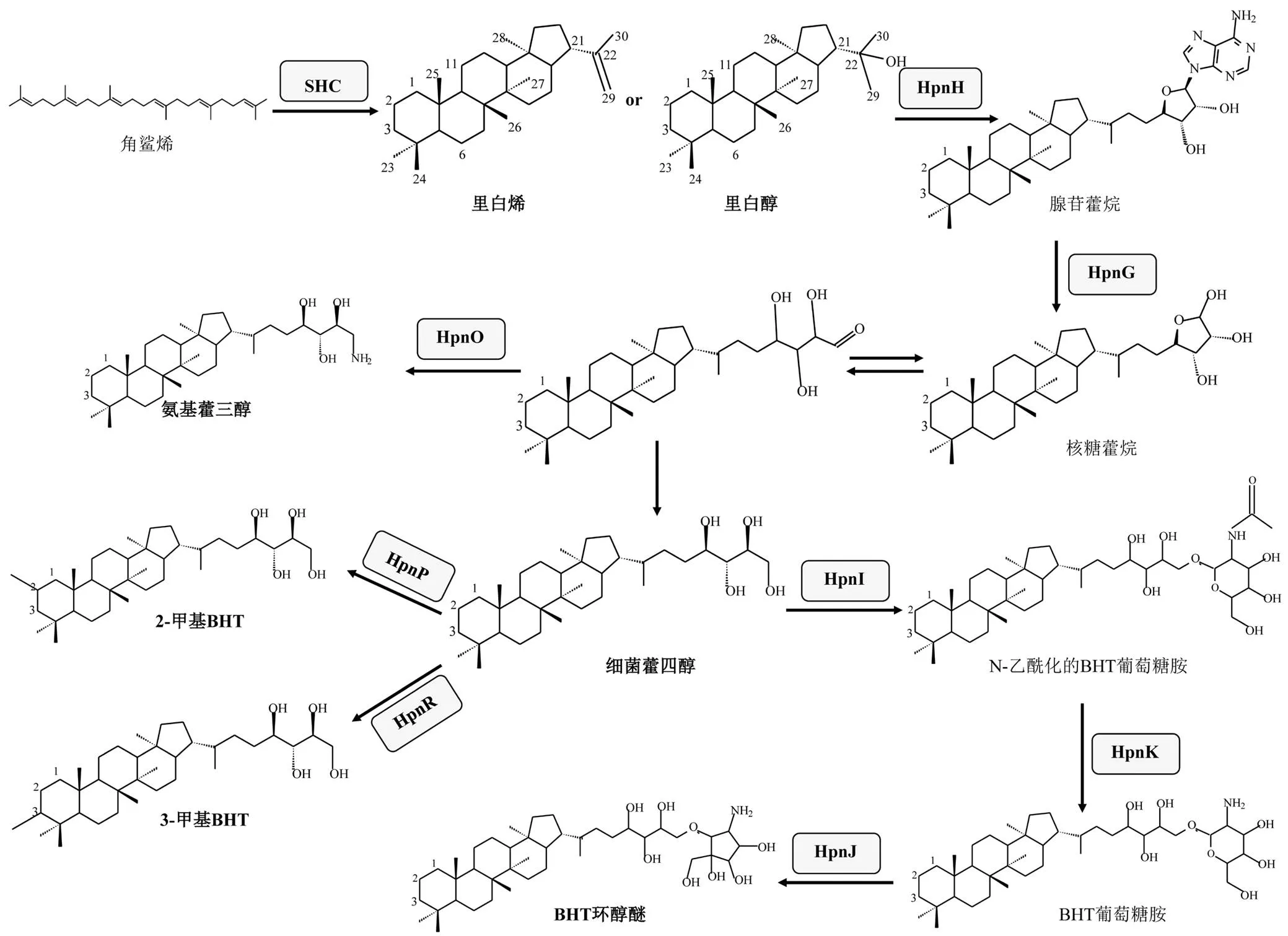
图1 藿类化合物的生物合成过程[5-7]
1 藿类化合物的生物合成与生理功能
藿类化合物的生物合成主要由微生物基因编码的藿类合成和修饰酶调控(图1).五环三萜藿类化合物的生物合成首先开始于角鲨烯的形成.角鲨烯是环状三萜的母体分子,由两个支链的法尼基二磷酸经3种角鲨烯合成酶(类角鲨烯合成酶(HpnD)、类角鲨烯合成酶(HpnC)和氨基氧化还原酶(HpnE))共同催化合成[24].微生物在藿类合成酶SHC的作用下,将支链的角鲨烯经非氧气参与过程环化形成藿类化合物—C30里白烯或里白醇[25-26].微生物宏基因组研究表明,大约10%的细菌具有编码藿类合成酶SHC的基因,包括变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、酸杆菌门(Acidobacteria)和浮霉菌门(Planctomycetes)等,它们广泛分布在沉积物、湖泊和海洋环境中[27].
微生物中C30藿类化合物向BHPs转化的关键环节是由HpnH催化的酶促反应,将5'-脱氧腺苷自由基(5'-dA•)与C30里白烯结合,合成C35BHPs的基本骨架[28-29].SAM带有一个活化的甲基,可以作为一种辅酶参与合成和分解代谢中的甲基转移反应,将活化甲基转移到核酸、蛋白质等底物中[18].另一方面,SAM还可以被SAM自由基酶活性位点上的[4Fe-4S]+团簇还原裂解,形成5'-dA•,从而引发多种自由基反应[30].HpnH几乎存在于所有产生藿类化合物的微生物中[28].Sato等[5]通过链霉菌的酶体外实验进一步验证了HpnH催化下自由基反应形成C35BHPs中间体—腺苷藿烷的生物合成机理.SAM还原裂解后的5'-dA•与里白烯的末端双键进行自由基加成反应,在5'-dA•的C-5'与里白烯的C-29之间形成碳碳单键,将腺苷基团侧链与C30里白烯结合从而合成22(R)-腺苷藿烷.
C35BHPs的基本骨架形成后,可以被微生物体内的其他基因转化合成多样化的侧链结构.尽管目前对于不同BHPs侧链结构的合成过程及其环境适应还了解不足,但基因的表达会受到微生物种类和环境条件的调控[6,31].腺苷藿烷可以在参与藿类合成的HpnG作用下去除腺嘌呤,生成具有核糖侧链的核糖藿烷;核糖藿烷作为腺苷藿烷合成多种BHPs结构的中间体,其核糖侧链可打开环状结构并在未知酶的催化下形成C35BHT[7,32].BHT及其他藿类化合物在C-2甲基转移酶(HpnP)和C-3甲基化酶(HpnR)的作用下可以形成C-2或C-3位置甲基化的藿类化合物[19,33].此外,BHT还可以被参与藿类合成的酶HpnO,HpnJ,HpnI和HpnK调控,依次合成氨基三醇,BHT环醇醚,N-乙酰化的BHT葡萄糖胺和BHT葡萄糖胺[34].
藿类化合物作为原核生物膜脂的重要组分,在微生物膜中的结构和分布与微生物理化特征及环境条件具有密切关系.藿类化合物广泛存在于微生物胞内膜、胞外膜、孢子膜、囊泡膜等多种膜结构中,在微生物膜中所占比例差异较大,由<1%至90%不等[35-36].由于藿类化合物具有极性的侧链基团和疏水的环状结构,可以插入微生物双层膜脂中并与其他膜脂分子相互作用,从而改变微生物膜的理化特征[9,37].具体来说,原核生物膜脂中的藿类化合物可以影响生物膜的流动性和渗透性,使生物膜结构紧密,强度增加,并不同程度地降低膜渗透性[6].尽管目前的研究证据还较少,但藿类化合物可与膜脂中脂质相互作用,促进形成结构致密的有序液体区域—脂筏[37-38],从而在细胞信号传导、离子稳态、通道蛋白等过程中具有不可或缺的作用[6].此外,微生物膜中藿类化合物受到细胞应激反应的调控,有助于提高微生物在高温、低pH值、高渗透压等逆境胁迫时的抗逆性,在调节细胞稳态方面发挥重要作用[22,39].不同种类微生物所合成的不同藿类化合物对环境压力的响应具有差异.例如,嗜热嗜酸芽孢杆菌合成的BHPs含量随环境温度升高而增加,随pH值降低而略有增加[40];甲基单胞菌属的耐冷菌株合成的藿类化合物含量则随着环境温度升高而下降[41].2-甲基藿类通常与微生物的低pH值胁迫有关.当环境pH值降低时,细胞膜脂中2-甲基藿类含量增加,从而降低细胞膜的渗透性,阻止阳离子和质子的扩散[23].
2 2-甲基藿类生物标志物对固氮过程的指示
2.1 2-甲基藿类化合物
生物固氮作用通过固氮酶将N2还原为生物有效态氮,是海洋环境中提供氮源,维持初级生产力和新生产力的重要过程.海洋中的固氮生物包括蓝细菌、异养细菌、光合细菌和单细胞固氮蓝藻等,其中固氮蓝细菌是主要的固氮生物,仅束毛藻属(sp.)的固氮量就达到87.4Tg/a,占海洋总固氮量的36%[42-43].固氮生物的固氮酶体系是由多种蛋白组成的复合体,以含钼固氮酶,含钒固氮酶和含铁固氮酶为作用中心[44].含钒固氮酶和含铁固氮酶只在缺乏钼离子时表达,分别由和基因编码;组成含钼固氮酶的铁蛋白和ɑ、ß钼铁蛋白结构分别由、,基因编码[45].由于编码铁蛋白的基因在不同固氮微生物中广泛存在并具有高度保守性,且携带的功能信息比其他序列更加丰富,因而通常作为环境中固氮生物多样性的分析依据[44].
蓝细菌是环境中重要的藿类化合物来源,它不仅可以合成BHT和氨基藿三醇等非来源特异性的BHPs,还可以合成来源特异性的2-甲基BHPs[46].2-甲基BHPs广泛存在于沉积物和实验室培养的蓝细菌中,通常作为蓝细菌的生物标志物用以反映近现代沉积物和古环境中蓝细菌的生物量及光合作用进程[12,47].虽然海洋中具有固氮作用的蓝细菌只占到总蓝细菌量的一小部分,但这些固氮蓝细菌却对海洋固氮和氮循环具有重要作用[48].因此2-甲基藿类化合物指数(2-MeHI=2-甲基藿类化合物/总藿类化合物×100%)可用于指示海洋蓝细菌的固氮强度和贡献[49].中生代海洋缺氧事件(OAEs)和其他历史时期沉积物中2-甲基藿类化合物丰度的增加,被认为是该时期海洋固氮蓝细菌繁殖和海洋固氮作用增强的结果[49-50].
微生物在HpnP的催化作用下合成A环2号碳位置甲基化的2-甲基BHPs(图1),而后在地质过程中经氧化和成岩作用脱去侧链基团形成结构更稳定的2-甲基藿烷等地质藿类化合物(图2).目前已在固氮蓝细菌束毛藻属(sp.),蓝丝藻属(spp.),眉藻属(sp.)和单细胞固氮蓝藻瓦氏鳄球藻(spp.)等多种主要的固氮蓝细菌中检测到基因[33],进一步证明2-甲基藿类化合物作为固氮蓝细菌生物标志物的潜力.然而,基因组学的最新研究发现,多数蓝细菌同时具有和基因序列,是可以合成2-甲基藿类的固氮蓝细菌;但并不是所有的固氮蓝细菌均具有基因,具有基因序列的蓝细菌只占到已测序蓝细菌的13%[18,31].其他细菌菌群中也检测到基因序列,例如沼泽红假单胞菌TIE-1[19],甲基杆菌属(spp.)[51]和土壤慢生根瘤菌属(spp.)[52].这些证据表明,目前环境中2-甲基藿类化合物的潜在微生物来源并不局限于蓝细菌,其作为固氮蓝细菌的生物标志物具有复杂性和不确定性,需要谨慎应用.
2.2 藿类化合物的固氮酶保护作用
固氮蓝细菌的固氮酶对氧含量极其敏感,高氧环境对固氮酶具有抑制作用[53].那么进行产氧光合作用的固氮蓝细菌是如何在开放环境中维持细胞内缺氧水平从而保护固氮酶活性呢?固氮蓝细菌具有独特的保护固氮酶机制.一部分固氮蓝细菌(如丝状蓝细菌)会分化形成进行固氮作用的异形胞.异形胞内缺乏产氧光合系统Ⅱ(PSII),具有高的脱氢酶、氢化酶和超氧化物歧化酶活力,以及较高的呼吸强度,这些特性使异形胞内保持高度的无氧或还原状态从而保护固氮酶的活性[33,54].没有异形胞分化的蓝细菌则会将固氮作用与光合作用在空间和时间上分开进行,如束毛藻和瓦氏鳄球藻;或者通过提高细胞内的过氧化物酶和超氧化物歧化酶活力以保护固氮酶[54-55].
但上述固氮酶保护机制都不能消除环境中氧气通过生物膜扩散所产生的影响.藿类化合物分子可通过在细胞膜上的分布调节膜稳态,其疏水结构嵌入双层生物膜脂以降低细胞膜对氧气的渗透性[6,56],因此藿类化合物可能在蓝细菌固氮作用中发挥重要作用.Cornejo-Castillo等[33]对所有已知基因组的海洋蓝细菌中藿类合成基因进行研究,结果显示,非异形胞分化的海洋蓝细菌中普遍存在编码藿类合成酶SHC的基因,例如固氮蓝细菌束毛藻属,蓝丝藻属和单细胞固氮蓝细菌UCYN-A;而海洋中主要的非固氮蓝细菌聚球藻属(spp.)和原绿球藻属(spp.),以及分化异形胞的固氮眉藻属和植生藻属(sp.)中均不具有藿类合成基因.该研究表明,生物膜脂中的藿类化合物作为非异形胞分化的海洋固氮蓝细菌所独有的一种固氮酶保护机制,通过降低细胞膜对氧气的渗透性,限制膜外氧气扩散,从而维持固氮酶所需的缺氧环境.此外,在瓦氏鳄球藻和蓝丝藻属中,藿类合成酶基因的转录在固氮酶基因转录水平增加之前达到峰值[57].陆源固氮菌弗兰克氏菌属(sp.)中,发生固氮作用的囊泡中的藿类化合物具有限制氧气扩散的作用,且囊泡胞膜厚度与胞外氧气浓度具有直接关系[58].这些研究证据均证明了生物膜脂中的藿类化合物在固氮细菌中的酶保护作用.
2.3 固氮蓝细菌的其他生物标志物
除2-甲基BHPs外,还有一些BHPs组分对固氮蓝细菌的某些属种具有来源专一性,可以作为环境中来源蓝细菌的良好生物标志物.C-6或C-11位置不饱和的BHT环醇醚主要由束毛藻属合成[59].虽然在醋酸菌和伯克氏菌中也发现了不饱和BHT环醇醚,但由于这两种细菌几乎不存在于开放的海洋环境中,因此不饱和的BHT环醇醚可作为海洋环境中束毛藻的生物标志物,用以指示其生物量及对氮循环的影响[60].2-甲基环醇醚被证明仅由组囊藻属(sp.)产生[61];细菌藿五醇则来源于蓝细菌的念珠藻属(sp.)[59].
对于分化有异形胞的固氮蓝细菌,厚密的异形壁通过阻止氧气扩散入异形胞内来保护固氮酶.异形胞糖脂是异形胞壁包被层的主要组分,可以在沉积环境中稳定保存,因此通常被作为异形胞固氮蓝细菌特有的生物标志物[4,62].异形胞糖脂由糖基(六碳糖或五碳糖)与C26~C32的长链二醇、三醇、酮醇或酮二醇连接组成(图2),不同的异形胞糖脂结构来源于不同种类的异形胞蓝细菌,所以异形胞糖脂还可用于指示蓝细菌的种群结构.例如,胶须藻科()目前被证实主要合成C28的糖脂三醇和糖脂酮醇[63];与硅藻共生的异形胞蓝细菌则主要合成具有五碳糖的糖脂结构[62].
3 藿类生物标志物对硝化过程的指示
固氮生物固定的有效态氮通过硝化过程在NH4+、NO2-和NO3-之间进行氧化还原转化.作为重要的氮循环过程之一,硝化反应包括氨氧化(NH4+被氧化为N2O和NO2-)和亚硝酸盐氧化(NO2-被氧化为NO3-)两个过程,其中氨氧化过程由氨氧化古菌(AOA)和氨氧化细菌(AOB)参与,亚硝酸盐氧化过程主要由亚硝酸盐氧化细菌(NOB)参与.目前研究认为,AOA主要属于奇古菌门(Thaumarchaeota.泉古菌醇(crenarchaeol)作为仅由奇古菌产生的一种甘油二烷基甘油四醚(GDGTs),可较好的指示氨氧化古菌参与的氨氧化过程[4].而AOB通常产生非来源特异性的氨基藿三醇、里白烯和不饱和脂肪酸等,运用特定的生物标志物来识别细菌氨氧化过程还存在困难[65].NOB主要包括硝化杆菌属(spp.),硝化球菌属(spp.),硝化刺菌属(spp.)和硝化螺菌属(spp.)四个属.在硝化螺菌属中鉴定出一种特异性的脂肪酸—11-甲基十六烷酸后,该脂肪酸常用于指示硝化螺菌属及其硝化活动[66].然而,由于脂肪酸较易受到成岩作用的降解,在百万年以上的古沉积物中难以发挥分子标志物作用[4].
Elling等[18]研究发现,NOB的硝化杆菌属可以合成2-甲基藿类化合物,并利用2-甲基藿类作为亚硝酸盐氧化过程的生物标志物解释了地质历史时期的海洋氮循环变化,为生物标志物反演硝化过程提供了新思路.硝化杆菌属产生2-甲基藿类的生物合成机制需要钴胺素的参与.首先,一个SAM将其活化甲基转移到钴胺素而形成甲基钴胺;另一个SAM还原裂解形成5'-dA•,5'-dA•与藿类化合物C-2位置的H原子结合而形成5'-dAH和藿类C-2位置自由基中间体.随后,藿类化合物C-2位置自由基中间体攻击甲基钴胺的甲基部分,形成2-甲基藿类化合物.然而,已测序的硝化杆菌属均缺乏完整的钴胺素生物合成途径,但AOA却是钴胺素的重要来源微生物[67].基于钴胺素生产者AOA和钴胺素缺乏体NOB的共同生态位,Elling等[18]认为NOB的硝化杆菌属从同生态位的AOA中获得生物体所必须的钴胺素组分,二者形成协同促进硝化过程的共生机制.

海洋碳氮循环示意图改编自文献[64],其中数字代表相应的微生物过程,实线箭头代表氮循环过程,虚线箭头代表陆源有机质输入和甲烷氧化过程.4藿类生物标志物对脱氮过程的指示
4 藿类生物标志物对脱氮过程的指示
4.1 微生物厌氧氨氧化作用
全球海洋中低氧区不断扩大是海洋生态变化的总体趋势.厌氧氨氧化过程对海洋脱氮的贡献也随之增强,铵盐等生物可利用性氮的减少又会反馈到海洋初级生产力和固碳的降低,从而影响海洋碳循环[4].因此,了解和研究海洋尤其是低缺氧海域中的厌氧氨氧化变化对海洋碳氮循环具有重要意义.
厌氧氨氧化菌广泛存在于海洋沉积物、低缺氧水柱、泥炭土壤、陆地淡水等环境中,在严格低缺氧条件下,以CO2和CO32-作为碳源,NO2-为电子受体,将NH4+氧化为N2.研究表明,在氧气浓度高于大约20 μmol/L时,厌氧氨氧化活动将受到明显抑制[68].目前已知的厌氧氨氧化菌有6个属,包括()、、、、和,它们同属于浮霉状菌目的厌氧氨氧化菌科.其中是海洋环境中最主要的厌氧氨氧化菌,其余5个属均为淡水厌氧氨氧化菌[69-70].厌氧氨氧化菌最主要的特点是细胞分室,包括厌氧氨氧化体、核糖细胞质及外室细胞质3个部分,其中厌氧氨氧化体在细胞内高度折叠,体积占到总细胞体积的50%~80%,是进行厌氧氨氧化活动的场所[71].
van de Graaf等[72]通过15N同位素示踪法研究了微生物体内厌氧氨氧化的代谢过程首先NO2-在亚硝酸盐还原酶(NiR)的作用下被还原为羟胺 (NH2OH),NH2OH和NH4+共同在联胺水解酶(HH)的作用下形成联胺(又称为肼,N2H4).N2H4通过联胺氧化还原酶(HZO)生成N2,并伴随着4个质子和4个电子产生.这4个电子与来自核糖质中的5个质子又通过NiR将NO2-还原为NH2OH,使厌氧氨氧化代谢过程循环进行.在厌氧氨氧化代谢过程中,通过核糖质中的质子消耗和厌氧氨氧化体内的质子产生,在厌氧氨氧化体和核糖质之间形成电化学梯度,因此维持膜内外的质子梯度是厌氧氨氧化代谢过程的重要环节[71].厌氧氨氧化体膜脂的主要成分是由3个或5个线性顺式连接的四元环和烷基链所组成的酯类结构—梯烷脂(ladderane)(图2).梯烷脂具有致密和相对不渗透性,能够有效阻止小分子物质的扩散,保持膜两侧质子的电化学梯度,且可以避免有毒小分子中间产物联胺N2H4对其他细胞结构的毒害作用[73-74].因此,作为厌氧氨氧化菌一种独特的膜脂结构,梯烷脂通常可用于指示环境中的厌氧氨氧化菌群生物量和厌氧氨氧化强度[4,75].
4.2 生物标志物BHT异构体
梯烷脂的四元环和烷基链结构的不稳定性,使其受成岩作用的影响较大,在反演长时间尺度古沉积环境中的厌氧氨氧化过程方面具有局限性[76].近年来在海洋厌氧氨氧化菌中发现了另一种特异性膜脂组分—BHT的立体异构体(BHT- isomer).鉴于Rush等[77]在距今2.97百万年的上新世腐泥中仍检测到BHT异构体的存在,因此BHT异构体作为厌氧氨氧化菌的生物标志物可以填补长时间尺度古环境中厌氧氨氧化反演的空白.此外,在阿拉伯海、卡利亚科盆地、智利北部和东海等海域的低缺氧水柱和沉积物中检测到BHT异构体,且BHT异构体相对含量[BHT异构体/(BHT异构体+BHT)]与溶解氧浓度具有良好的负相关关系,所以BHT异构体还可以作为低氧指示指标来示踪海洋低缺氧状况[16-17,78].
微生物在未知酶的催化下合成的BHT及异构体,是在C-32至C-35上具有四个羟基的四官能化BHPs(图2).相较于环境中存在广泛、丰度高的BHT,BHT异构体的分布和丰度则较少.目前已鉴定的BHT及异构体结构包括5种,分别是BHT-34S(17β,21β(H),22R,32R,33R,34S)、BHT-34R(17β,21β(H),22R,32R,33R,34R)、BHT-22S-34S(17β,21β(H),22S,32R,33R,34S)、BHT-17α-34S(17α,21β(H),22R,32R,33R,34S)和BHT-17α-34R(BHT-17α,21β(H),22R,32R,33R,34R),还有一种未知立体结构的BHT-x[79].继在阿拉伯海、卡里亚科盆地和秘鲁低氧水体悬浮颗粒物中检测到晚于BHT洗脱的BHT异构体后,Rush等[80]首次在培养的海洋厌氧氨氧化菌中检测出BHT异构体,证明了BHT异构体与厌氧氨氧化菌的特异性关系.最新研究表明,利用乙酰化BHT的气相色谱(GC)结合非乙酰化BHT的超高效液相色谱(UHPLC)分析,可以识别出中的BHT异构体为未知立体结构的BHT-x,且为BHT-x目前已知的唯一微生物来源[79],即BHT-x可作为海洋厌氧氨氧化菌的特异性生物标志物.而传统的高效液相色谱法(HPLC)检测到的BHT异构体包括BHT-x和BHT-34R两种异构体的共洗脱.其中,目前已知BHT-x仅来源于海洋厌氧氨氧化菌,而BHT-34R由多种陆地细菌产生,包括醋酸菌和[81],固氮菌弗兰克氏菌属(spp.)[82],II型甲烷营养细菌[15]和淡水厌氧氨氧化菌[79].鉴于外海海洋环境中的BHT及其异构体主要来源于海洋细菌的原位产生,因而一般可认为外海海洋环境中共洗脱的BHT异构体主要为来源于海洋厌氧氨氧化菌的BHT-x[83].
5 藿类生物标志物对陆源有机质迁移过程的指示
全球海洋中约有80%以上的沉积有机质埋藏在边缘海中,包括海洋自生有机质和陆源输送的有机质,是生物地球化学循环中的巨大碳库[84].准确识别边缘海中沉积有机质的来源和迁移过程,对了解海洋碳汇潜力和全球碳循环具有重要意义.研究发现,腺苷藿烷、腺苷藿烷-II、腺苷藿烷-III以及它们的2-甲基同系物对陆源土壤细菌具有高度来源专属性(图2).其中,腺苷藿烷和2-甲基腺苷藿烷由紫色非硫细菌、亚硝化单胞菌和根瘤菌产生,腺苷藿烷-II主要来源于紫色非硫细菌[3,85].它们被作为一组“土壤标志物BHPs(soil marker BHPs)”,已成功应用于追踪陆源土壤有机质向水生环境的输入和迁移[86-88].此外,基于土壤标志物BHPs和海洋来源BHT相对含量定义的陆源输入指标soil(soil= soil marker BHPs/(soil marker BHPs + BHT)),可有效指示海洋沉积有机质中有机质的来源及贡献比例[83,89-90]. Wagner等[89]利用土壤标志物BHPs及其soil指标追踪了亚马逊河口近600年的陆源有机碳输入过程,发现陆源有机质贡献呈现随年代增加而波动降低的变化趋势,这与近年来亚马逊河口的冲淡水径流量和输沙量变化有关.Yin等[83]分别选取0.65和0作为soil指标的陆源和海源端元值,通过soil指标的二端元混合模型有效指示了东海沉积物中的有机质来源及贡献比例.东海沉积有机质中的soil指标呈现“离岸降低”的分布特征,陆源有机质贡献从近岸的63%下降至外海的0.81%.
6 藿类生物标志物对好氧甲烷氧化过程的指示
甲烷(CH4)是仅次于CO2的重要温室气体.好氧甲烷氧化过程可以将CH4氧化为CO2,有效减少其在环境中的积累,是一种重要的甲烷汇,在全球甲烷循环和碳循环以及气候变暖中发挥重要作用[91].参与甲烷氧化的好氧甲烷氧化菌主要包括I型和II型甲烷氧化菌,它们利用CH4为碳源和能源,以O2为电子受体,将CH4经甲醇、甲醛、甲酸最终氧化为CO2[92].甲烷氧化过程中起关键作用的是甲烷单加氧酶(MMO),包括可溶性MMO(sMMO)和颗粒状MMO(pMMO)[93].与生物膜结合的pMMO可以催化甲烷的羟基化反应,它几乎存在于所有的甲烷氧化菌中,因此通常利用编码pMMO活性位点多肽的功能基因来调查环境中好氧甲烷氧化菌的丰度和活性[93].
由于微生物遗传基因易受降解作用影响,通常不能用于反演古环境记录中的好氧甲烷氧化活动.好氧甲烷氧化菌产生的结构稳定的特异性藿类,在指示好氧甲烷氧化菌群落和反演古甲烷氧化活动方面具有重要作用[94].对好氧甲烷氧化菌特异性的藿类化合物主要是具有3~5个羟基(C-30至C-34)和C-35末端氨基的35-氨基BHPs,以及3-甲基化的(氨基)BHPs(图2)[15,95].其中,氨基藿五醇几乎完全由I型好氧甲烷氧化菌合成;氨基藿四醇由I、II型好氧甲烷氧化菌以及少量的硫酸盐还原菌(SRB)合成;氨基藿三醇来源于所有的好氧甲烷氧化菌及其他好氧细菌,特异性较低.因此,目前通常将氨基藿四醇、氨基藿五醇同系物(氨基藿五醇、不饱和氨基藿五醇、氨基藿五醇异构体)以及它们的3-甲基化BHPs作为环境中好氧甲烷氧化菌和好氧甲烷氧化过程的生物标志物[14-15].
值得注意的是,并不是所有的好氧甲烷氧化菌均具有藿类C-3甲基化基因,且在某些好氧醋酸菌中也被检测到[95].因此3-甲基(氨基)BHPs作为好氧甲烷氧化菌的标志物具有一定的复杂性.此外,由于微生物优先利用环境中的12C,使生物成因的CH4亏损13C,13C值低至−45‰~−65‰;好氧甲烷氧化菌以CH4为碳源,所合成的藿类化合物通常也亏损13C,13C值约为−35‰~−75‰[96].尽管有研究表明,并非所有好氧甲烷氧化菌产生的藿类都具有13C亏损的同位素特征[41],例如II型甲烷氧化菌可以同时利用CH4和CO2进行代谢过程,但沉积环境中13C值亏损的藿类化合物通常可被认为是好氧甲烷氧化活动的标志物.Pancost等[97]发现古第三纪湿地沉积物中C31和C29藿烷的13C值分别低至−42‰和−76‰,反映该时期强烈的好氧甲烷氧化活动.
一般来说,好氧甲烷氧化菌的生物活性受到温度、pH值、盐度、甲烷和有效态氮等环境条件的影响,氨基BHPs等藿类可以反映好氧甲烷氧化菌对环境胁迫的调节作用[95,98].例如,培养实验表明嗜碱好氧甲烷营养菌中BHPs含量随着盐度降低和硝酸盐浓度增加而增加[91].好氧甲烷氧化菌的嗜热甲基暖菌属(sp.)中(3-甲基)氨基藿五醇含量随着温度升高而增加;当环境中甲烷浓度不足或缺氧时,氨基五醇及其同系物的合成量增加[99].泥炭苔藓()中好氧甲烷氧化菌产生的里白烯的13C值与温度和甲烷通量具有良好的相关性,当温度升高和甲烷浓度增加时,里白烯的13C同位素效应更强[100].这表明里白烯的13C值具有指示沉积环境中好氧甲烷氧化活动的潜能.好氧耐冷甲氧营养菌中不饱和藿醇的含量和比例随着温度降低而明显增加.由此提出了不饱和藿类通过在膜脂上的重新排列以维持低温下膜稳态的冷适应机制[101].
此外,在海洋最小含氧带中还存在一种亚硝酸盐型甲烷氧化,该过程将碳循环和氮循环耦合起来,对了解低缺氧环境中碳和氮元素的生物地球化学过程具有重要作用[102].亚硝酸盐型甲烷厌氧氧化菌()是一种独特的甲烷氧化菌,它以CH4作为碳源和电子供体,NO2-作为电子受体,通过亚硝酸还原酶将NO2-还原产生NO和O2,并利用所产生的O2氧化CH4[103].可以合成BHT、细菌藿五醇、细菌藿六醇及它们对应的3-甲基BHPs,而并没有检测到好氧甲烷氧化菌所独特的35-氨基BHPs.其中细菌藿六醇和3-甲基细菌藿六醇主要来源于,对具有特异性,可作为特征生物标志物[104].此外,13C追踪实验表明合成的BHPs中的碳来源于HCO3-或者CO2,而不是来源于CH4中碳的同化.因此不同于好氧甲烷氧化菌,所合成的BHPs并不一定表现出13C亏损的同位素特征[104].
7 结语
微生物膜脂中由基因编码的藿类合成和修饰酶所调控的藿类化合物,不仅在微生物理化特征和环境适应方面扮演重要角色,还可作为生物标志物有效揭示海洋碳氮循环关键过程(如固氮、硝化、厌氧氨氧化和甲烷氧化).2-甲基藿类和不饱和环醇醚等可调节细胞膜的氧渗透性以保护固氮酶,可指示环境中固氮蓝细菌及固氮过程.作为海洋厌氧氨氧化菌特异性产物的BHT异构体—BHT-x,可指示海洋厌氧氨氧化过程和低氧环境.土壤标志物BHPs及其soil指标可追踪陆源土壤有机质向水生环境的输入和迁移.35-氨基BHPs和3-甲基(氨基)BHPs可用于指示好氧甲烷氧化过程.
然而,藿类化合物作为碳氮循环生物标志物的研究中仍然存在一些亟待诠释的科学问题:1)目前关于生物藿类BHPs的生物合成过程、受控因素以及不同环境条件下生理功能与适应性的了解仍然不足.随着分子生物学和基因组学的不断发展,将会进一步明确微生物膜脂中藿类化合物的合成及响应机制;2)目前已知的碳氮循环过程中的生物标志物仍然有限.一方面,一些碳氮循环关键过程缺少特异性的生物标志物,特别是反硝化过程、硝酸盐异化还原为铵(DNRA)和细菌参与的氨氧化过程;另一方面,有些类脂生物标志物如2-甲基藿类具有来源复杂性和不确定性,在指示和反演应用中需要谨慎考虑.随着仪器和分析手段的优化更新,从复杂基质中鉴定出更多具有特征指示意义的新型生物标志物将对深入了解海洋碳氮循环意义深远.
[1] Hofreiter M,Collins M,Stewart J R. Ancient biomolecules in Quaternary palaeoecology [J]. Quaternary Science Reviews,2012,33:1-13.
[2] Rohmer M,Bouviernave P,Ourisson G. Distribution of hopanoid triterpenes in prokaryotes [J]. Journal of General Microbiology,1984,130:1137-1150.
[3] 尹美玲,段丽琴,宋金明,等.细菌藿多醇的环境指示作用及其在海洋生态环境重建中的应用 [J]. 地质论评,2020,66(6):1486-1498.
Yin M L,Duan L Q,Song J M,et al. Environmental indication of Bacteriohopanepolyols and its application on eco-environmental reconstruction [J]. Geological Review,2020,66(6):1486-1498.
[4] Rush D,Damste J S S. Lipids as paleomarkers to constrain the marine nitrogen cycle [J]. Environmental Microbiology,2017,19(6):2119-2132.
[5] Sato S,Kudo F,Rohmer M,et al. Characterization of radical SAM adenosylhopane synthase,HpnH,which catalyzes the 5'- deoxyadenosyl radical addition to diploptene in the biosynthesis of C-35bacteriohopanepolyols [J]. Angewandte Chemie International Edition,2020,59(1):237-241.
[6] Belin B J,Busset N,Giraud E,et al. Hopanoid lipids: from membranes to plant-bacteria interactions [J]. Nature Reviews Microbiology,2018,16(5):304-315.
[7] Sohlenkamp C,Geiger O. Bacterial membrane lipids: diversity in structures and pathways [J]. Fems Microbiology Reviews,2016,40(1): 133-159.
[8] 盛国英,卢 鸿,廖 晶,等.地质体中藿烷类新化合物研究进展 [J]. 地球化学,2019,48(5):421-446.
Sheng F Y,Lu H,Liao J,et al. Advances on novel hopanoids present in geological bodies [J]. Geochimica,2019,48(5):421-446.
[9] Poralla K,Kannenberg E,Blume A. A glycolipid containing hopane isolated from the acidophilic,thermophilic,has a cholesterol-like function in membranes [J]. Febs Letters,1980,113(1):107-110.
[10] Talbot H M,Sidgwick F R,Bischoff J,et al. Analysis of non- derivatised bacteriohopanepolyols by ultrahigh-performance liquid chromatography/tandem mass spectrometry [J]. Rapid Commun Mass Spectrom,2016,30(19):2087-2098.
[11] Talbot H M,Watson D F,Murrell J C,et al. Analysis of intact bacteriohopanepolyols from methanotrophic bacteria by reversed- phase high-performance liquid chromatography-atmospheric pressure chemical ionisation mass spectrometry [J]. Journal of Chromatography A,2001,921(2):175-185.
[12] Summons R E,Jahnke L L,Hope J M,et al. 2-Methylhopanoids as biomarkers for cyanobacterial oxygenic photosynthesis [J]. Nature,1999,400(6744):554-557.
[13] Zundel M,Rohmer M. Prokaryotic triterpenoids. 3. The biosynthesis of 2-beta-methylhopanoids and 3-beta-methylhopanoids ofandssp pasteurianus [J]. European Journal of Biochemistry,1985,150(1):35-39.
[14] van Winden J F,Talbot H M,de Vleeschouwer F,et al. Variation in methanotroph-related proxies in peat deposits from Misten Bog,Hautes-Fagnes,Belgium [J]. Organic Geochemistry,2012,53:73-79.
[15] van Winden J F,Talbot H M,Kip N,et al. Bacteriohopanepolyol signatures as markers for methanotrophic bacteria in peat moss [J]. Geochimica Et Cosmochimica Acta,2012,77:52-61.
[16] Matys E D,Sepulveda J,Pantoja S,et al. Bacteriohopanepolyols along redox gradients in the Humboldt Current System off northern Chile [J]. Geobiology,2017,15(6):844-857.
[17] Saenz J P,Wakeham S G,Eglinton T I,et al. New constraints on the provenance of hopanoids in the marine geologic record: Bacteriohopanepolyols in marine suboxic and anoxic environments [J]. Organic Geochemistry,2011,42(11):1351-1362.
[18] Elling F J,Hemingway J D,Evans T W,et al. Vitamin B12-dependent biosynthesis ties amplified 2-methylhopanoid production during oceanic anoxic events to nitrification [J]. Proceedings of the National Academy of Sciences of the United States of America,2020,117(52): 32996-33004.
[19] Rashby S E,Sessions A L,Summons R E,et al. Biosynthesis of 2-methylbacteriohopanepolyols by an anoxygenic phototroph [J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(38):15099-15104.
[20] Ricci J N,Michel A J,Newman D K. Phylogenetic analysis of HpnP reveals the origin of 2-methylhopanoid production in Alphaproteobacteria [J]. Geobiology,2015,13(3):267-277.
[21] Matys E D,Mackey T,Grettenberger C,et al. Bacteriohopanepolyols across environmental gradients in Lake Vanda,Antarctica [J]. Geobiology,2019,17(3):308-319.
[22] Schmerk C L,Bernards m A,Valvano M A. Hopanoid production is required for low-pH tolerance,antimicrobial resistance,and motility in[J]. Journal of Bacteriology,2011,193 (23):6712-6723.
[23] Welander P V,Hunter R C,Zhang L C,et al. Hopanoids play a role in membrane integrity and pH homeostasis inTIE-1 [J]. Journal of Bacteriology,2009,191(19):6145-6156.
[24] Pan J J,Solbiati J O,Ramamoorthy G,et al. Biosynthesis of squalene from farnesyl diphosphate in bacteria: three steps catalyzed by three enzymes [J]. Acs Central Science,2015,1(2):77-82.
[25] Abe I. Enzymatic synthesis of cyclic triterpenes [J]. Natural Product Reports,2007,24(6):1311-1331.
[26] Hoshino T,Sato T. Squalene-hopene cyclase: catalytic mechanism and substrate recognition [J]. Chemical Communications,2002,4:291-301.
[27] Racolta S,Juhl P B,Sirim D,et al. The triterpene cyclase protein family: A systematic analysis [J]. Proteins-Structure Function and Bioinformatics,2012,80(8):2009-2019.
[28] Bradley A S,Pearson A,Saenz J P,et al. Adenosylhopane: The first intermediate in hopanoid side chain biosynthesis [J]. Organic Geochemistry,2010,41(10):1075-1081.
[29] Rohmer M. The biosynthesis of triterpenoids of the hopane series in the eubacteria-a mine of new enzyme reactions [J]. Pure and Applied Chemistry,1993,65(6):1293-1298.
[30] Broderick J B,Duffus B R,Duschene K S,et al. Radical S-adenosylmethionine enzymes [J]. Chemical Reviews,2014,114 (8):4229-4317.
[31] Ricci J N,Coleman M L,Welander P V,et al. Diverse capacity for 2-methylhopanoid production correlates with a specific ecological niche [J]. Isme Journal,2014,8(3):675-684.
[32] Liu W,Sakr E,Schaeffer P,et al. Ribosylhopane,a novel bacterial hopanoid,as precursor of C-35bacteriohopanepolyols inA3(2) [J]. Chembiochem,2014,15(14):2156-2161.
[33] Cornejo-Castillo F M,Zehr J P. Hopanoid lipids may facilitate aerobic nitrogen fixation in the ocean [J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(37): 18269-18271.
[34] Schmerk C L,Welander P V,Hamad M A,et al. Elucidation of thehopanoid biosynthesis pathway uncovers functions for conserved proteins in hopanoid-producing bacteria [J]. Environmental Microbiology,2015,17(3):735-750.
[35] Kleemann G,Alskog G,Berry A M,et al. Lipid composition and nitrogenase activity of symbiotic() in response to different oxygen concentrations [J]. Protoplasma,1994,183(1-4):107-115.
[36] Wu C H,Bialecka-Fornal M,Newman D K. Methylation at the C-2position of hopanoids increases rigidity in native bacterial membranes [J]. Elife,2015,4:e05663.
[37] Saenz J P,Grosser D,Bradley A S,et al. Hopanoids as functional analogues of cholesterol in bacterial membranes [J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(38):11971-11976.
[38] Saenz J P,Sezgin E,Schwille P,et al. Functional convergence of hopanoids and sterols in membrane ordering [J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(35):14236-14240.
[39] Kulkarni G,Busset N,Molinaro A,et al. Specific hopanoid classes differentially affect free living and symbiotic states of[J]. Mbio,2015,6(5):e01251-15.
[40] Poralla K,Hartner T,Kannenberg E. Effect of temperature and pH on the hopanoid content of[J]. Fems Microbiology Letters,1984,23(2-3):253-256.
[41] Jahnke L L,Summons R E,Hope J M,et al. Carbon isotopic fractionation in lipids from methanotrophic bacteria II: The effects of physiology and environmental parameters on the biosynthesis and isotopic signatures of biomarkers [J]. Geochimica Et Cosmochimica Acta,1999,63(1):79-93.
[42] Gallon J R. N2fixation in phototrophs: adaptation to a specialized way of life [J]. Plant and Soil,2001,230(1):39-48.
[43] Martinez-Perez C,Mohr W,Loescher C R,et al. The small unicellular diazotrophic symbiont,UCYN-A,is a key player in the marine nitrogen cycle [J]. Nature Microbiology,2016,1(11):16163.
[44] 丁昌玲,孙 军,顾海峰,等.海洋蓝藻固氮基因 [J]. 海洋科学,2008,(7):75-80.
Ding C L,Sun J,Gu H F,Wang M,The nitrogen fixation gene in marine cyanobacteria [J]. Marine Sciences,2008,(7):75-80.
[45] Short S M,Jenkins B D,Zehr J P. Spatial and temporal distribution of two diazotrophic bacteria in the Chesapeake Bay [J]. Applied and Environmental Microbiology,2004,70(4):2186-2192.
[46] Talbot H M,Farrimond P. Bacterial populations recorded in diverse sedimentary biohopanoid distributions [J]. Organic Geochemistry,2007,38(8):1212-1225.
[47] 张俊杰,邢 磊,侯 笛.蓝细菌生物标志物——2-甲基藿烷类化合物研究进展及其应用 [J]. 地球环境学报,2018,9(5):434-443.
Zhang J J,Xing L,Hou D,Progress of research on the cyanobacterial biomarker——2-methylhopanoid and its application [J]. Journal of Earth Environment,2018,9(5):434-443.
[48] Zehr J P. Nitrogen fixation by marine cyanobacteria [J]. Trends in Microbiology,2011,19(4):162-173.
[49] Dumitrescu M,Brassell S C. Biogeochemical assessment of sources of organic matter and paleoproductivity during the early Aptian Oceanic Anoxic Event at Shatsky Rise,ODP Leg 198 [J]. Organic Geochemistry,2005,36(7):1002-1022.
[50] Kasprak A H,Sepulveda J,Price-Waldman R,et al. Episodic photic zone euxinia in the northeastern Panthalassic Ocean during the end-Triassic extinction [J]. Geology,2015,43(4):307-310.
[51] Knani M H,Corpe W A,Rohmer M. Bacterial hopanoids from pink- pigmented facultative methylotrophs (PPFMs) and from green plant surfaces [J]. Microbiology (Reading),1994,140(10):2755-2759.
[52] Bravo J M,Perzl M,Hartner T,et al. Novel methylated triterpenoids of the gammacerane series from the nitrogen-fixing bacteriumUSDA 110 [J]. European Journal of Biochemistry,2001,268(5):1323-1331.
[53] Gallon J R. Reconciling the incompatible: N2fixation and O2[J]. New Phytologist,1992,122(4):571-609.
[54] Berman-Frank I,Lundgren P,Falkowski P. Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria [J]. Research in Microbiology,2003,154(3):157-164.
[55] Fay P. Oxygen relations of nitrogen-fixation in cyanobacteria [J]. Microbiological Reviews,1992,56(2):340-373.
[56] Poger D,Mark A E. The relative effect of sterols and hopanoids on lipid bilayers: when comparable is not identical [J]. Journal of Physical Chemistry B,2013,117(50):16129-16140.
[57] Munoz-Marin M D,Shilova I N,Shi T,et al. The transcriptional cycle is suited to daytime N2fixation in the unicellular cyanobacterium “Candidatus Atelocyanobacterium thalassa” (UCYN-A) [J]. Mbio,2019,10(1):e02495-18.
[58] Berry A M,Harriott O T,Moreau R A,et al. Hopanoid lipids compose the frankia vesicle envelope,presumptive barrier of oxygen diffusion to nitrogenase [J]. Proceedings of the National Academy of Sciences of the United States of America,1993,90(13):6091-6094.
[59] Talbot H M,Summons R E,Jahnke L L,et al. Cyanobacterial bacteriohopanepolyol signatures from cultures and natural environmental settings [J]. Organic Geochemistry,2008,39(2):232-263.
[60] Handley L,Talbot H M,Cooke M P,et al. Bacteriohopanepolyols as tracers for continental and marine organic matter supply and phases of enhanced nitrogen cycling on the late Quaternary Congo deep sea fan [J]. Organic Geochemistry,2010,41(9):910-914.
[61] Herrmann D,Bisseret P,Connan J,et al. Relative configurations of carbapseudopentose moieties of hopanoids of the bacterium Zymomonas mobilis and the cyanobacterium “Anacystis montana” [J]. Tetrahedron Letters,1996,37(11):1791-1794.
[62] Bale N J,Hopmans E C,Zell C,et al. Long chain glycolipids with pentose head groups as biomarkers for marine endosymbiotic heterocystous cyanobacteria [J]. Organic Geochemistry,2015,81:1-7.
[63] Bauersachs T,Compaore J,Hopmans E C,et al. Distribution of heterocyst glycolipids in cyanobacteria [J]. Phytochemistry,2009,70(17/18):2034-2039.
[64] Arrigo K R. Marine microorganisms and global nutrient cycles [J]. Nature,2005,438(7064):122.
[65] Sakata S,Hayes J M,Rohmer M,et al. Stable carbon isotopic compositions of lipids isolated from the ammonia oxidizing chemoautotroph[J]. Organic Geochemistry,2008,39(12):1725-1734.
[66] Lipski A,Spieck E,Makolla A,et al. Fatty acid profiles of nitrite-oxidizing bacteria reflect their phylogenetic heterogeneity [J]. Systematic and Applied Microbiology,2001,24(3):377-384.
[67] Doxey A C,Kurtz D A,Lynch M D J,et al. Aquatic metagenomes implicate Thaumarchaeota in global cobalamin production [J]. Isme Journal,2015,9(2):461-471.
[68] Kalvelage T,Jensen M M,Contreras S,et al. Oxygen sensitivity of anammox and coupled N-cycle processes in oxygen minimum zones [J]. Plos One,2011,6(12):e29299.
[69] Quan Z X,Rhee S K,Zuo J E,et al. Diversity of ammonium- oxidizing bacteria in a granular sludge anaerobic ammonium- oxidizing (anammox) reactor [J]. Environmental Microbiology,2008,10(11):3130-3139.
[70] Schmid M C,Risgaard-Petersen N,van de Vossenberg J,et al. Anaerobic ammonium-oxidizing bacteria in marine environments: widespread occurrence but low diversity [J]. Environmental Microbiology,2007,9(6):1476-1484.
[71] van Niftrik L,Geerts W J C,van Donselaar E G,et al. Linking ultrastructure and function in four genera of anaerobic ammonium- oxidizing bacteria: Cell plan,glycogen storage,and localization of cytochrome c proteins [J]. Journal of Bacteriology,2008,190(2):708-717.
[72] van de Graaf A A,de Bruijn P,Robertson L A,et al. Metabolic pathway of anaerobic ammonium oxidation on the basis of N- 15studies in a fluidized bed reactor [J]. Microbiology-Sgm,1997,143:2415-2421.
[73] Boumann H A,Longo M L,Stroeve P,et al. Biophysical properties of membrane lipids of anammox bacteria: I. Ladderane phospholipids form highly organized fluid membranes [J]. Biochimica Et Biophysica Acta-Biomembranes,2009,1788(7):1444-1451.
[74] Neumann S,Wessels H J C T,Rijpstra W I C,et al. Isolation and characterization of a prokaryotic cell organelle from the anammox bacterium Kuenenia stuttgartiensis [J]. Molecular Microbiology,2014,94(4):794-802.
[75] Rush D,Jaeschke A,Hopmans E C,et al. Short chain ladderanes: Oxic biodegradation products of anammox lipids [J]. Geochimica Et Cosmochimica Acta,2011,75(6):1662-1671.
[76] Rush D,Hopmans E C,Wakeham S G,et al. Occurrence and distribution of ladderane oxidation products in different oceanic regimes [J]. Biogeosciences,2012,9(7):2407-2418.
[77] Rush D,Talbot H M,van der Meer M T J,et al. Biomarker evidence for the occurrence of anaerobic ammonium oxidation in the eastern Mediterranean Sea during Quaternary and Pliocene sapropel formation [J]. Biogeosciences,2019,16(12):2467-2479.
[78] 尹美玲,段丽琴,宋金明,等.长江口邻近海域表层沉积物中的细菌藿多醇及对低氧区的响应判别 [J]. 环境科学,2021,42(3):1343-1353.
Yin M L,Duan L Q,Song J M,et al. Response of bacteriohopanepolyols to hypoxic conditions in the surface sediments of the Yangtze Estuary and its adjacent areas [J]. Environmental Science,2021,42(3):1343-1353.
[79] Schwartz-Narbonne R,Schaeffer P,Hopmans E C,et al. A unique bacteriohopanetetrol stereoisomer of marine anammox [J]. Organic Geochemistry,2020,143:103994.
[80] Rush D,Damste J S S,Poulton S W,et al. Anaerobic ammonium- oxidising bacteria: A biological source of the bacteriohopanetetrol stereoisomer in marine sediments [J]. Geochimica Et Cosmochimica Acta,2014,140:50-64.
[81] Peiseler B,Rohmer M. Prokaryotic triterpenoids of the hopane series- bacteriohopanetetrols of new side-chain configuration from acetobacter species [J]. Journal of Chemical Research-S,1992,0(9):298-299.
[82] Rosa-Putra S,Nalin R,Domenach A M,et al. Novel hopanoids fromspp. and related soil bacteria-Squalene cyclization and significance of geological biomarkers revisited [J]. European Journal of Biochemistry,2001,268(15):4300-4306.
[83] Yin M L,Duan L Q,Song J M,et al. Bacteriohopanepolyols signature in sediments of the East China Sea and its indications for hypoxia and organic matter sources [J]. Organic Geochemistry,2021,158:104268.
[84] Berner,R A. Burial of organic carbon and pyrite sulfur in the modern ocean: its geochemical and environmental significance [J]. American Journal of Science,1982,282:451-473.
[85] Cooke M P,Talbot H M,Farrimond P. Bacterial populations recorded in bacteriohopanepolyol distributions in soils from Northern England [J]. Organic Geochemistry,2008,39(9):1347-1358.
[86] Cooke M P,Talbot H M,Wagner T. Tracking soil organic carbon transport to continental margin sediments using soil-specific hopanoid biomarkers: A case study from the Congo fan (ODP site 1075) [J]. Organic Geochemistry,2008,39(8):965-971.
[87] Cooke M P,Van Dongen B E,Talbot H M,et al. Bacteriohopanepolyol biomarker composition of organic matter exported to the Arctic Ocean by seven of the major Arctic rivers [J]. Organic Geochemistry,2009,40(11):1151-1159.
[88] Rethemeyer J,Schubotz F,Talbot H M,et al. Distribution of polar membrane lipids in permafrost soils and sediments of a small high Arctic catchment [J]. Organic Geochemistry,2010,41:1130-1145.
[89] Wagner T,Kallweit W,Talbot H M,et al. Microbial biomarkers support organic carbon transport from methane-rich Amazon wetlands to the shelf and deep sea fan during recent and glacial climate conditions [J]. Organic Geochemistry,2014,67:85-98.
[90] Zhu C,Talbot H M,Wagner T,et al. Distribution of hopanoids along a land to sea transect: Implications for microbial ecology and the use of hopanoids in environmental studies [J]. Limnology and Oceanography,2011,56:1850-1865.
[91] 刘臻婧,肖启涛,胡正华,等.太湖竺山湾甲烷扩散通量及其驱动机 [J]. 中国环境科学,2022,42(1):393-401.
Liu Z J,Xiao Q T,Hu Z H,et al. Methane diffusion flux and its driving factors in Zhushan Bay of Lake Taihu. China Environmental Science,2022,42(1):393-401.
[92] Cordova-Gonzalez A,Birgel D,Kappler A,et al. Variation of salinity and nitrogen concentration affects the pentacyclic triterpenoid inventory of the haloalkaliphilic aerobic methanotrophic bacterium[J]. Extremophiles,2021,25(3):285-299.
[93] Ghashghavi M,Jetten M S M,Luke C. Survey of methanotrophic diversity in various ecosystems by degenerate methane monooxygenase gene primers [J]. Amb Express,2017,7:162.
[94] Spencer-Jones C L,Wagner T,Talbot H M. A record of aerobic methane oxidation in tropical Africa over the last 2.5Ma [J]. Geochimica Et Cosmochimica Acta,2017,218:27-39.
[95] Welander P V,Summons R E. Discovery,taxonomic distribution,and phenotypic characterization of a gene required for 3-methylhopanoid production [J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(32):12905-12910.
[96] Hornibrook E R C,Longstaffe F J,Fyfe W S. Evolution of stable carbon isotope compositions for methane and carbon dioxide in freshwater wetlands and other anaerobic environments [J]. Geochimica Et Cosmochimica Acta,2000,64(6):1013-1027.
[97] Pancost R D,Steart D S,Handley L,et al. Increased terrestrial methane cycling at the Palaeocene-Eocene thermal maximum [J]. Nature,2007,449(7160):332-335.
[98] Kulkarni G,Wu C H,Newman D K. The general stress response factor EcfG regulates expression of the C-2hopanoid methylase HpnP inTIE-1 [J]. Journal of Bacteriology,2013,195(11):2490-2498.
[99] Osborne K A,Gray N D,Sherry A,et al. Methanotroph-derived bacteriohopanepolyol signatures as a function of temperature related growth,survival,cell death and preservation in the geological record [J]. Environmental Microbiology Reports,2017,9(5):492-500.
[100] van Winden J F,Talbot H M,Reichart G-J,et al. Influence of temperature on the δ13C values and distribution of methanotroph- related hopanoids in-dominated peat bogs [J]. Geobiology,2020,18(4):497-507.
[101] Bale N J,Rijpstra W I C,Sahonero-Canavesi D X,et al. Fatty acid and hopanoid adaption to cold in the Methanotroph[J]. Frontiers in Microbiology,2019,10:589
[102] Padilla C C,Bristow L A,Sarode N,et al. NC10bacteria in marine oxygen minimum zones [J]. Isme Journal,2016,10(8):2067-2071.
[103] Ettwig K F,Butler M K,Le Paslier D,et al. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria [J]. Nature,2010,464(7288): 543-548.
[104] Kool D M,Talbot H M,Rush D,et al. Rare bacteriohopanepolyols as markers for an autotrophic,intra-aerobic methanotroph [J]. Geochimica Et Cosmochimica Acta,2014,136:114-125.
Hopanoids biomarkers and their indications in the marine carbon and nitrogen cycles.
YIN Mei-ling1,2,3,4,DUAN Li-qin1,2,3,4*,SONG Jin-ming1,2,3,4,YUAN Hua-mao1,2,3,4,LI Xue-gang1,2,3,4
(1.Key Laboratory of Marine Ecology and Environmental Sciences,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Laboratory for Marine Ecology and Environmental Sciences,Qingdao National Laboratory for Marine Science and Technology,Qingdao 266237,China;4.Center for Ocean Mega-Science,Chinese Academy of Sciences,Qingdao 266071,China).,2022,42(8):3890~3902
The microbe-mediated marine biogeochemical cycles of carbon (C) and nitrogen (N) have an important impact on the global climate changes. The hopanoids of pentacyclic triterpenoids,including biological hopanoids (e.g.,bacteriohopanepolyols (BHPs)) and geological hopanoids (e.g.,hopanes),are important lipid biomarkers for indicating and reconstructing C and N cycles in modern and ancient environments. In this paper,we reviewed the biosynthetic pathways and physiological functions of hopanoids,and their roles as indicators in the key processes of the marine C and N cycles (i.e.,nitrogen fixation,nitrification,anammox,methane oxidation and terrestrial organic matter input). The hopanoids in microbial membrane lipids are mainly regulated by enzymes of hopanoids synthesis and modification encoded withgene,which are closely related to microbial physicochemical characteristics and environmental conditions. The oxygen permeability of cell membrane can be regulated by 2-methyl hopanoids,2-methyl cyclitol ether and unsaturated cyclitol ether to protect nitrogenase,being able to indicate the diazotrophic cyanobacteria and N-fixation. Marine anammox bacteriais the only producer known as BHT-x (one of bacteriohopanetetrol isomers) so far,which can indicate marine anammox and hypoxic environment. Soil markers BHPs and terrestrial inputs indicator ofsoilcan track the input and migration of terrestrial organic matter to the ocean. Biomarkers 35-amino BHPs and 3-methyl (amino) BHPs can indicate aerobic methane oxidation. Bacteriohopanehexol and 3-methyl bacteriohopanehexol can indicate nitrite-reducing methanotrophy. With the development of molecular biology,genomics and instrumental analysis technology,hopanoids will play a more important role in indicating marine C and N cycles.
hopanoids;bacteriohopanepolyols (BHPs);marine nitrogen cycle;aerobic methane oxidation;biomarkers
X145
A
1000-6923(2022)08-3890-13
2022-01-13
国家自然科学基金资助项目(41976037);山东省自然科学基金资助项目(ZR2020YQ28);青岛海洋科学与技术试点国家实验室“问海计划”课题(2021WHZZB0903)
*责任作者,研究员,duanliqin@qdio.ac.cn
尹美玲(1996-),女,中国科学院海洋研究所博士研究生,主要从事海洋生物地球化学研究.发表论文3篇.

