miR-429在低氧环境中对MC3T3-E1细胞成骨分化的影响
黄江,焦旭峰,安帅,王居勇,曹光磊,沈惠良
(首都医科大学宣武医院骨科,北京 100053)
随着老龄化社会的发展,骨质疏松性骨折成为老年人群常见且严重的疾患。骨折发生后由于疼痛及卧床,患者活动减少,骨量进一步丢失[1]。骨质疏松性骨折具有骨量差、修复慢、内固定稳定性弱且失败率高等特点,因此术后骨折不愈合和延迟愈合成为常见的并发症[2]。作者前期的研究发现在体内用氯化钴(CoCl2)模拟低氧环境可以改善成骨和骨折愈合[3-4],然而低氧诱导因子(hypoxia inducible factor,HIF)-1α调控骨折愈合及其如何参与成骨细胞分化的机制尚不明确。
近年来,微小RNA(microRNA,miRNA)成为研究热点,它是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,在细胞内具有多种重要的调节作用[5]。本研究中将重点关注在低氧环境中会显著上调的miR-429[6],通过观察miR-429在低氧环境中对MC3T3-E1细胞成骨分化的影响,明确miR-429对成骨分化的作用,从而揭示低氧调控骨愈合新的机制。
1 资料与方法
1.1 细胞培养及低氧诱导 前成骨细胞系MC3T3-E1购买于美国模式培养物集存库(American type culture collection,ATCC)(Manassas,VA,USA),HEK293T细胞购买于上海细胞生化所。细胞在Dulbecco氏培养基(Dulbecoo's modified eagle medium,DMEM)(Life Technologies,Grand Island,NY,USA)中培养,并加入10%牛胎儿血清(Life Technologies),100 U/mL的青霉素和100 μg/mL的链霉素,37℃,5% CO2培养环境中生长。
氯化钴组在培养基中加入200 μmol/L的CoCl2,对照组使用常规培养基。在特定的时间点提取RNA和蛋白质,细胞诱导成骨使用成骨诱导培养基(完全培养基中添加10 mmol的β-磷酸甘油和50 μg/mL的抗坏血酸),诱导前成骨细胞MC3T3-E1分化,每2天更换1次。
1.2 实时荧光定量聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR) 根据试剂盒说明书使用Trizol从组织和细胞中提取总RNA。miR-429的表达则根据说明书使用TaqMan探针检测miR-429表达,U6作为内参。所有反应分3个重复进行,并进行3次独立测定。
1.3 质粒构建 使用聚合酶链式反应扩增从小鼠基因组DNA编码pre-miR-429序列加上两侧侧翼150 bp的片段,用于扩增的引物如下:(正向)5'-AAA GAA TTC AGT CTG C TG TGG CTG TAA CCG-3',(反向)5'-AAA GGA TCC CCA AAG AGG TGC TAT GAC GAGC-3'。然后将PCR产物克隆到pCDH-CMV-MCS-EF1-puro载体(System Biosciences,Mountain View,CA,USA)的EcoRI/BamHI位点。通过限制酶消化和测序确认所有质粒。将转染过表达miR-429质粒的细胞作为实验组,对照组为转染空载质粒的细胞。
1.4 细胞增殖和凋亡测定 根据试剂盒说明书通过细胞计数试剂-8(cell counting kit-8,CCK-8)(Dojindo,Japan)测定细胞活力。将100 μL细胞悬浮液中的3×103个细胞接种到96孔板的每个孔中培养过夜,分别在0 h、24 h、48 h和72 h向每个孔中加入10 μL CCK-8溶液。通过酶标仪(Bio-Rad Laboratories)在450 nm下测量光密度(optical density,OD)。细胞凋亡水平按照Annexin V-FITC 凋亡检测试剂盒I(BD Biosciences)说明书评估细胞凋亡。
1.5 碱性磷酸酶(alkaline phosphatase,ALP)活性测定 根据说明书,使用WAKO LabAssay TM ALP凋亡检测试剂盒(LabAssay TM ALP,Wako,Japan)测定不同条件处理细胞的ALP活性。总蛋白质浓度作为ALP活性测定内参。
1.6 茜素红S染色 不同条件下处理的细胞首先固定,然后使用1%茜素红S溶液(Sigma-Aldrich)染色。使用光学显微镜(Olympus,Tokyo,Japan)拍摄5个200倍随机非重叠区域的照片。通过Image J软件(NIH,Bethesda,MD,USA)提取来评估茜素红S染色的定量。
1.7 免疫蛋白印迹(western blot,WB) 用含有完全蛋白酶抑制剂(Roche,Mannheim,Germany)的ripa缓冲液裂解组织和细胞。在10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺梯度凝胶(Bio Rad Laboratories,Hercules,CA,USA)上分离蛋白质,并转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(Millipore,Billerica,MA)。封闭后将膜分别与兔多克隆HIF-1α抗体(1∶800,Abcam)、兔多克隆ALP抗体(1∶100,Abcam)、兔多克隆OC抗体( 1∶100,Thermofisher)以及兔多克隆Runt相关转录因子2(Runt related transcription factor 2,RUNX2)抗体(1∶1 000,Santa Cruz Biotechnology)在4℃孵育过夜。使用化学发光试剂(Millipore,Temecula,CA,USA)在LAS4000发光图像分析仪(GE Healthcare Japan,Japan)中曝光。
1.8 动物实验 本研究动物实验均经过首都医科大学宣武医院动物伦理委员会批准,许可证号为XW-20210410-1。所有5日龄Swiss小鼠均获自首都医科大学宣武医院实验动物中心。使用骨折装置制作小鼠骨折模型(每组8个)[7]。将100 μL过表达miR-429慢病毒(1×109TU/mL)直接注射到实验组局部骨折的皮下区域。在骨折后第14天及第21天应用首都医科大学的Inveon Micro-CT (Siemens AG,Munich,Germany)对骨折部位标本进行逐一扫描(层厚15 μm,500 μa,80 kV),将数据导入Mimics 16.0(Materialise NV,Leuven,Belgium)进行三维重建,在骨折线远近端1cm通过软件选取骨痂边界测得骨痂体积[8]。

2 结 果
2.1 miR-429在低氧环境中表达情况 在MC3T3-E1细胞培养基中加入CoCl2培养可以上调HIF-1α的表达(见图1a),实现模拟低氧环境。通过qRT-PCR检测各个时间点的miR-429的表达。研究发现在实现低氧环境的同时上调了miR-429的表达,并在4 h达到峰值(见图1b)。为了进一步证明体外培养的结果,作者检测了小鼠骨折模型中CoCl2治疗后骨折部位miR-429的表达,结果和体外实验一致,miR-429的表达在骨折后第7天显著上调,并在第14天能观察到miR-429的上调(见图1c)。通过CCK-8检测证实在培养基中加入CoCl2并不影响细胞的增殖与凋亡(见图1d~e)。体内、外实验均证明在低氧环境的成骨过程中miR-429显著上调,其可能参与骨折愈合的分子调节。
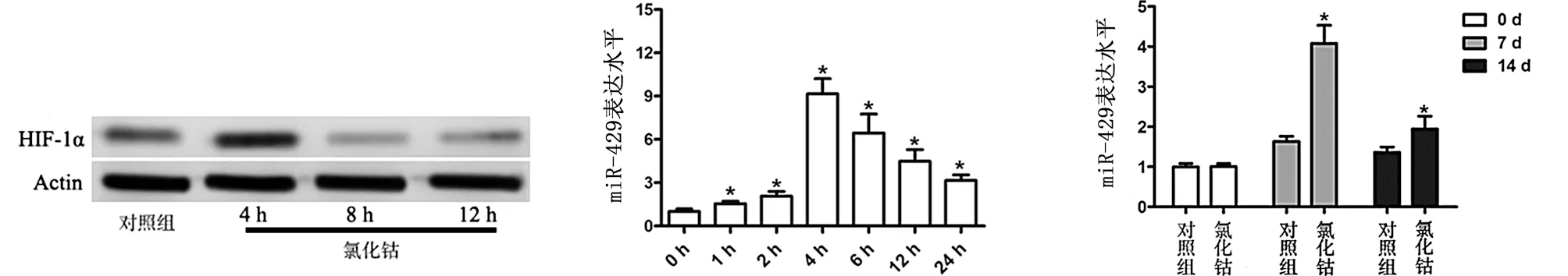
a HIF-1α蛋白水平比较 b 细胞中miR-429表达水平比较 c 骨组织中miR-429表达水平比较
2.2 miR-429对MC3T3-E1细胞成骨分化的影响 通过慢病毒转染技术过表达miR-429,细胞在转染miR-429慢病毒72 h后miR-429的表达明显增加,证明MC3T3-E1细胞成功转染miR-429慢病毒(见图2a)。之后为了证明miR-429在MC3T3-E1细胞成骨分化中的作用,采用ALP活性检测试剂盒比较两组细胞中ALP的活性,结果显示miR-429组中ALP的活性明显高于对照组,在第7天、第14天和对照组相比分别提高了近1.6倍、1.9倍(见图2b)。同时第21天用茜素红S染色发现miR-429组中矿物质的含量也明显增加(见图2c~d)。另外,在第21天及28天通过WB试验发现miR-429组中成骨标志物ALP、OC、RUNX2的蛋白水平均明显高于对照组(见图2e)。因此,在MC3T3-E1细胞中过表达miR-429可以促进成骨分化。

a 转染miR-429表达水平比较 b 各时间点ALP活性检测水平比较 c 细胞矿物化水平比较
2.3 MiR-429可以改善骨折修复过程中骨组织的形成和重建 研究中为了确认miR-429在体内是否可以改善骨折愈合,将过表达miR-429的慢病毒制备成试剂皮下局部注射在骨折部位,然后在骨折后14、21 d行micro-CT检查并进行骨痂量的测定。14 d时实验组的CT冠状位可见骨痂明显增厚,成骨能力增强;21 d时实验组骨折线基本消失,骨痂量较14 d时减少,骨痂塑形质量比对照组高(见图3a)。结果显示miR-429组的骨痂量高于对照组(见表1)。采用qRT-PCR技术检测骨折部位骨组织中miR-429的表达情况,发现miR-429组中骨折部位的miR-429表达也高于对照组(见图3b)。
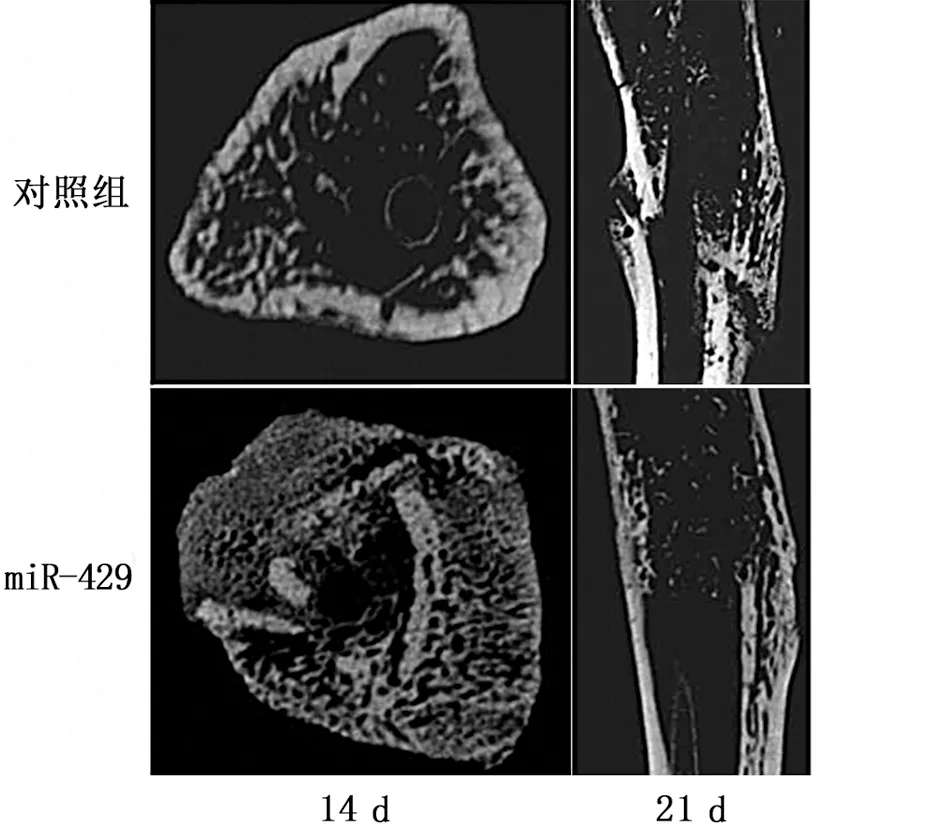
a micro-CT检测两组骨痂情况比较

表1 两组micro-CT测量骨痂量的比较
3 讨 论
近年来,大量研究证实miRNA对许多生命活动起到了非常重要的调控作用,例如细胞增殖、细胞分化、细胞凋亡和器官发育[9]。在成骨过程中miRNA可以通过调节成骨细胞和软骨细胞功能、血管生成以及其他对骨形成至关重要的过程来实现骨愈合[10]。在分子生物学方面,最近研究发现多种miRNA可增强骨形态蛋白的表达,在小鼠的股骨骨折模型中miR-186可以通过抑制SMAD6来激活BMP信号通路促进骨折愈合[11],在大鼠的骨折模型中抑制miR-9的表达可以靶向miR-9/BMP-7的信号通路促进骨折愈合[12]。miRNA同样可以调节多种骨形成的信号通路,Jia等[13]发现MiR-367在小鼠骨折模型中高表达,但PANX3、β-连环蛋白和Wnt5b在骨折小鼠中低表达。下调miR-367增加了PANX3、β-连环蛋白和Wnt5b的mRNA和蛋白质表达,同时可以增加了成骨细胞的生长、增殖和迁移,减少了细胞凋亡。另外有研究表明,miR-2通过调节同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)/磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)/HIF-1α信号途径促进成骨,并增强骨缺损的再生[14]。
骨折后的组织由于血管损伤以及软组织肿胀导致低氧状态的出现,有研究报道骨折部位的组织氧含量仅2%,大大低于正常骨组织的6%~8%[15]。同时也有研究证明低氧环境会抑制成骨细胞的分化和增殖,但HIF-1α的表达在调节低氧环境中成骨细胞分化的过程中发挥重要的作用[16]。本研究发现在大鼠骨折模型中局部注射CoCl2可以通过提高HIF-1α的表达来促进骨折愈合[3]。HIF被认为可以在多种病理条件下强有效地刺激血管生成和细胞代谢,同时一系列的低氧调控的microRNAs在低氧状态下被发现[17],从而给我们提供了一种新方式去了解低HIF和骨组织愈合之间的调控关系。miR-429是miR-200家族成员之一,在低氧条件下人羊膜间充质干细胞(humanamnioticmes-enchymalstromalcells,hAMSC)中会显著上调,miR-429通过促进HIF-1α的合成,增加血管内皮生长因子(vascular endothelial growth factor,VEGF)和Bcl-2蛋白水平。miR-429通过介导HIF-1α的表达,负性调节HAMSC的存活和抗凋亡能力,并提高hAMSC的耐缺氧能力[6]。
因此,本研究关注于低氧调节因子miR-429,它可能参与了CoCl2模拟低氧促进MC3T3-E1成骨细胞的分化。本研究通过RNA和蛋白水平的检测证实了在体内、外的成骨过程中低氧环境可以增加miR-429的表达;同时过表达miR-429能增加MC3T3-E1细胞的ALP活性、骨组织矿化以及成骨标志物的蛋白表达,这表明miR-429对成骨分化有促进作用,体内实验也同样证明过表达miR-429的病毒试剂可以增加骨痂体积促进骨折愈合。
综上所述,miR-429在低氧环境中可以促进MC3T3-E1细胞的成骨分化,能够增加成骨标志物的表达及组织矿化,是一种新型的可以促进成骨分化的调节因子,为低氧调控骨折愈合提供一种新的机制。

