全可视化内镜技术治疗腰椎椎间孔狭窄症的疗效分析
宋正鑫,卫力晋,刘岩,吴立君,毛英夫,杨传忠
(北京京煤集团总医院骨科,北京 102300)
腰椎椎间孔狭窄(lumbar foraminal stenosis,LFS)是引起腰椎神经根压迫的常见病因,其发病率可达8%~11%[1],保守治疗效果不佳时需要手术治疗。近年来,经皮椎间孔镜技术作为一种微创减压技术,已经广泛应用于治疗各类腰椎间盘突出症及腰椎管狭窄症,并取得了满意的临床疗效[2],但应用于LFS的临床研究报道较少。由于LFS病变的特点及位置的特殊性,使得传统内镜技术在治疗该疾病时非常容易刺激到出口神经根,导致术中患者剧烈疼痛,严重影响手术进程,因此,需要一种安全高效的内镜技术来解决这一难题[3]。全可视化内镜技术作为一种新的内镜技术,其可视化的椎间孔成形优势,使手术更为安全,效率更高,逐步得到了微创脊柱外科医生的广泛认可[4]。北京京煤集团总医院骨科自2018年1月至2020年1月,采用全可视化内镜技术治疗LFS患者43例,取得了满意的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料 纳入标准:(1)单侧下肢症状,伴或不伴有下腰痛;(2)CT及MRI证实椎间孔区狭窄;(3)经系统保守治疗6周以上无效;(4)选择性神经根阻滞有效。排除标准:(1)椎间孔区脱出游离型椎间盘突出;(2)伴有节段不稳定或椎体滑移;(3)合并重度脊柱畸形;(4)言语不利,不能配合局麻手术。
本组共43例,男性15例,女性28例;年龄39~79岁,平均(59.90±8.93)岁;手术节段:L3~42例(4.7%),L4~519例(44.2%),L5S122例(51.1%);所有患者术前经CT及MRI证实椎间孔狭窄、出口神经根周围脂肪消失,并按照Lee等[5]提出的LFS分级标准,1级2例(4.7%),2级16例(36.2%),3级25例(58.1%)。患者主要症状表现为下肢的麻木、疼痛、间歇性跛行,伴或不伴有腰痛,其中25例患者存在明显静息痛,18例表现为间歇性跛行。所有手术均由同一术者完成。
1.2 手术方法 患者俯卧位,调整手术床使腰椎前屈,依据患者体型及腰椎生理曲度确定棘突中线旁开距离(6~12 cm),C型臂透视定位并体表标记手术椎间隙,参考以手术间隙为中心的标准正侧位图像标定穿刺方向及基本路径;消毒铺单,注射器注满1%利多卡因连接17号穿刺针,穿刺同时行分层阻滞麻醉,透视引导下穿刺针定位于椎间孔背外侧,穿刺针尖定于上关节突肩背部,透视证实后,改换0.5%利多卡因在椎间孔周围充分阻滞麻醉,后经穿刺针套管置入导丝,经导丝引导放置“铅笔头”导棒,置入工作套管及可视环锯,透视确认工作套管位于椎间孔背外侧、紧贴上关节突肩背部(见图1);连接内镜、成像系统,镜下经低温等离子显露上关节突,常规显露上关节突尖部至基底部全貌,同时在椎间孔区预防性电凝止血,经可视化环锯逐步切除上关节突增生部分,重点切除上关节突尖部,显露出椎间孔区黄韧带外缘(见图2),逐步扩大椎间孔骨性空间后,切除椎间孔黄韧带直至显露到出口神经根下缘,此时用探钩松解出口神经根与覆盖在其背侧的黄韧带,松解后再逐步切除神经根背侧覆盖的黄韧带,并沿出口神经根走形向内显露至硬膜囊外侧缘、向外显露至下位椎体后上缘,探查神经根腹侧,必要时切除椎体后缘骨赘及增生膨隆的纤维环、突出髓核,再次全程探查出口根,确认减压满意后,撤出内镜,全层缝合穿刺切口。

图1 术中全可视化内镜技术穿刺透视图像
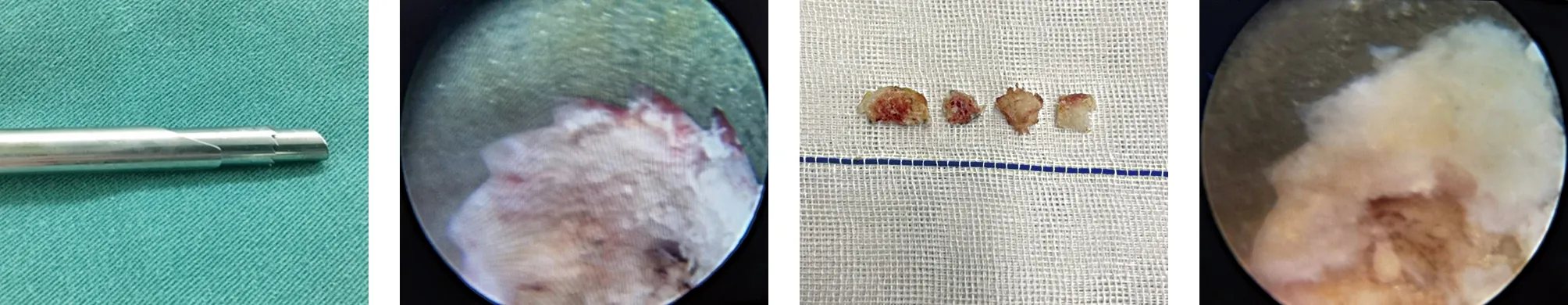
图2 可视化环锯切削上关节突成形
1.3 术后处理 术后卧床2 h后可佩戴腰围下地,术后6 h开始规律口服非甾体类消炎镇痛药,术后24 h可出院。
1.4 评价指标 记录手术时间、术中射线暴露次数、围手术期并发症;分别在术前及术后1 d、1个月、3个月、末次随访时采用疼痛视觉模拟评分(visual analogue scale,VAS)、Oswestry功能障碍指数(Oswestry disability index,ODI)评估患者的腰腿疼痛程度和腰椎功能。末次随访时依据改良Macnab标准[6]评估临床疗效,优:症状完全消失,恢复原来的工作和生活;良:大部分症状缓解,偶有疼痛,对工作生活无影响;可:症状减轻,活动受限,影响正常工作和生活;差:治疗前后无差别,甚至加重。

2 结 果
所有患者均顺利完成手术,手术时间45~125 min,平均(71.90±15.43)min;术中透视次数3~9次,平均(5.40±1.46)次;无手术相关并发症发生。所有患者术后均获得随访,随访时间12~26个月,平均(15.9±3.3)个月。术前、术后1 d、术后1个月、术后3个月、末次随访时腰痛VAS分别为(5.02±1.10)分、(2.37±0.69)分、(1.44±0.55)分、(1.21±0.41)分、(1.02±0.46)分,与术前相比,术后腰痛VAS明显降低,差异有统计学意义(P<0.05);术前、术后1 d、术后1个月、术后3个月、末次随访时下肢疼痛VAS分别为(7.67±1.17)分、(3.00±0.72)分、(2.40±0.69)分、(2.02±0.83)分、(1.84±0.84)分,与术前相比,术后下肢疼痛VAS明显降低,差异有统计学意义(P<0.05);术后1个月、术后3个月、末次随访时ODI分别为(28.47±3.95)%、(24.74±3.63)%、(18.42±2.88)%,与术前(67.77±7.32)%相比明显下降,差异有统计学意义(P<0.05,见表1);末次随访时,根据改良Macnab评定标准,优17例(39.5%),良19例(44.2%),可5例(11.6%),差2例(4.7%),优良率达83.7%,症状改善率达95.3%。1例患者在术后2个月时再次出现同侧下肢疼痛,考虑减压椎间隙髓核突出,给予内镜下翻修、突出髓核摘除,术后症状缓解;1例患者术后3个月时再次出现腰腿痛,考虑节段性不稳定,经保守治疗2个月无效后行腰椎后路减压、融合手术。

表1 手术前后腰腿痛VAS与腰椎ODI比较
典型病例为一58岁男性患者,以“腰痛伴右下肢跛行6个月,加重1周”入院。入院诊断:腰椎椎间孔狭窄症(L5S1右侧)。既往体健。术前腰痛VAS评分4分,右下肢疼痛VAS评分6分。明确无手术禁忌后,给予局麻及强化下行“全可视化内镜下L5S1右侧椎间孔扩大、神经根减压术”。术后腰腿痛明显缓解,术后第2天出院。术后3个月随访时,腰痛VAS评分1分,右下肢疼痛VAS评分0分。手术前后影像学资料见图3~4。
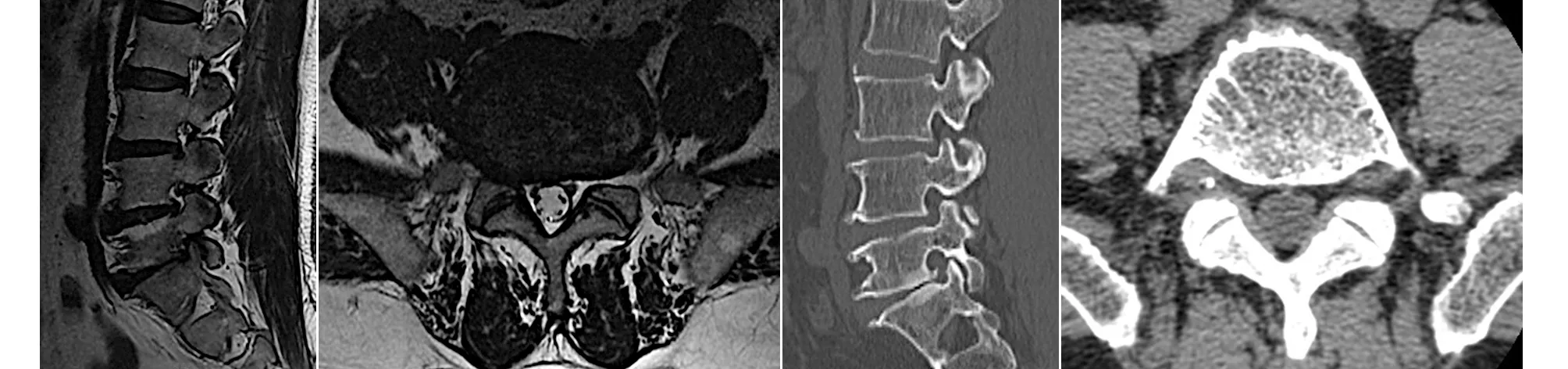
图3 术前MRI及CT示L5S1右侧椎间孔狭窄
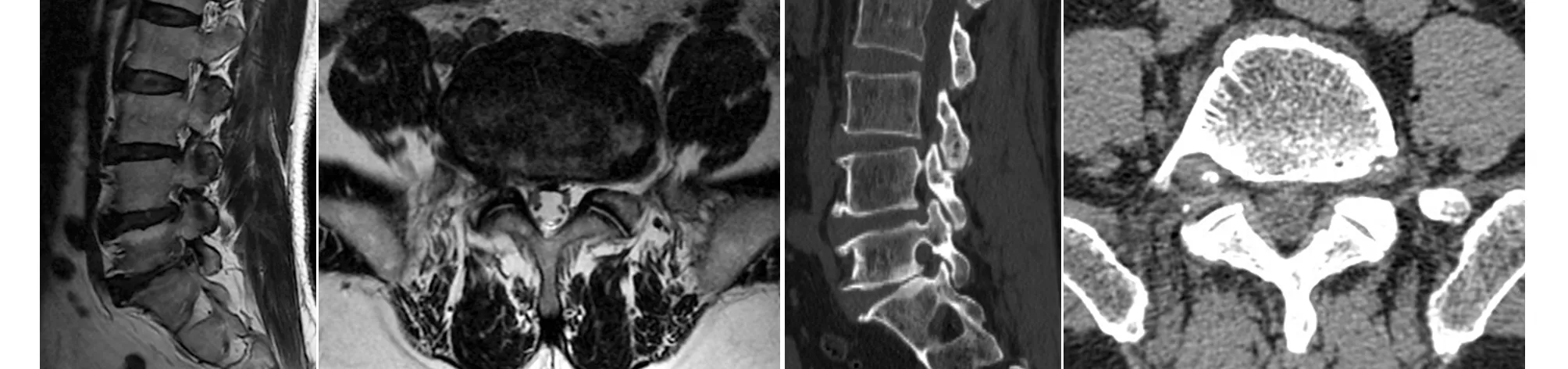
图4 术后3个月MRI及CT示右侧L5S1椎间孔减压满意
3 讨 论
3.1 LFS疾病特点 LFS被定义为神经根骨性出口的狭窄,其形成的原因包括椎间盘高度下降、腰椎关节突关节骨关节炎、上关节突向近端的半脱位以及黄韧带增生肥厚或纤维环的膨隆[7]。LFS通过矢状位MRI或CT影像可以诊断,发生节段主要在L4~5和L5S1[8]。但影像学上出现了椎间孔狭窄,并不一定会出现临床症状,无症状性腰椎椎间孔狭窄在老年患者中有较高的发生率,其发生率可达26%[8]。因此,LFS患者术前需要常规行选择性神经根阻滞术,以进一步明确诊断及责任节段。LFS患者腰腿痛症状较之中央椎管狭窄或侧隐窝狭窄患者更为严重,尤其在休息时,二者差异更为明显,考虑是由于LFS患者后根神经节(dorsal root ganglion,DRG)受到压迫所致[9],DRG受到刺激后产生的神经肽类物质会放大患者对疼痛的感知。研究证实腰骶部DRG的位置存在差异,L4和L5DRG多位于椎间孔内,且其直径相较于其他的DRG更大[1];因此,LFS在手术减压时容易刺激到DRG而出现术中患者痛感明显、术后下肢痛觉过敏等问题。
3.2 LFS手术方式历史及演变 传统的治疗腰椎椎间孔狭窄症的手术方式大致分为2类:切除关节突的减压融合术和保留关节突的微创减压术[10-12]。经椎旁肌间隙入路、保留关节突的显微镜下椎间孔切开减压术于20世纪80年代末被一些学者提出后,经过不断改良,逐步成为了治疗该疾病的金标准[13-14]。尽管其手术成功率高达83%,但仍有一些患者会出现术后下肢疼痛和感觉障碍,考虑其与手术中过多的刺激后根神经结有关[15-17]。同时,因为其有限的手术视野,容易出现减压不彻底。近年来,经皮脊柱内镜下上关节突部分切除、椎间孔减压术治疗LFS取得了满意的临床结果[3,18]。但是,常规内镜技术处理椎间孔骨性狭窄的效率较低,以及非可视化操作带来的风险,使得如何安全高效的完成经皮内镜下椎间孔减压手术,仍是一个挑战。
3.3 常规内镜技术治疗LFS的困难 LFS内镜下减压手术,核心部分为增生的上关节突的切除,特别是上关节突尖部的切除。常规内镜技术使用逐级环锯或骨钻来切除部分上关节突,这样的技术需要通过定位导杆预先建立一个稳定的成形路径,在术中X线透视引导下,紧贴上关节突尖部或肩部来反复切削骨质,逐级完成椎间孔扩大成型,这部分操作均在非可视状态下完成。有研究报道,常规内镜技术椎间孔入路手术出口神经根的损伤发生率高达8.9%[19],非可视化的操作是主要因素。而且,对于LFS患者,因为病变导致出口神经根本就受到不同程度的挤压,任何椎间孔区的盲视操作均容易出现神经损伤的风险,盲视操作手术中患者痛感明显,严重影响手术进程,甚至终止手术。
3.4 全可视化内镜技术治疗LFS的优势 近年来,随着全内镜手术在脊柱外科的广泛开展,手术医生对手术过程全部可视化的需求强烈,因此出现了一些可视化工具,实现了全可视化内镜技术在临床的应用,并取得了满意的临床疗效[20]。全可视化内镜技术应用镜外环锯将传统内镜技术中盲视操作的椎间孔扩大成形步骤实现可视化,较大直径的镜外环锯在切除增生骨质时效率高、操作精准;而且因为可视化操作避免了传统成形时的放射线暴露;同时能时刻观察神经根结构,减少神经根损伤风险;不需要额外的操作工具,降低了手术费用。全可视化内镜技术治疗LFS时,穿刺针、镜外环锯及工作通道均定位于椎间孔外,不干扰椎间孔,内镜监视下完成椎间孔扩大成形,降低了神经根损伤风险,减少了患者术中因神经根刺激出现的疼痛,患者体验良好,术中射线暴露少,减压精准高效、操作安全。
3.5 全可视化内镜技术治疗LFS的临床疗效 本研究43例患者均顺利完成了手术,无手术并发症发生,腰痛VAS评分由术前(5.02±1.10)分降至末次随访时的(1.02±0.46)分,下肢痛VAS评分由术前(7.67±1.17)分降至末次随访时的(1.84±0.84)分,腰椎ODI评分由术前(67.77±7.32)%降至末次随访时的(18.42±2.88)%;结果证实全可视化内镜下神经根减压安全、有效。末次随访时依据改良Macnab评定标准,优良率达83.7%,症状改善率达95.3%,临床疗效满意。术后随访时,有1例复发性椎间盘突出和1例继发性节段不稳定,分别进行了内镜下翻修和开放融合手术;这2例患者均为本研究的早期病例,后期手术中我们认为LFS患者虽然伴有一定程度的椎间盘突出,但局部结构经过长时间的退变过程已经变得稳定,所以在完成上关节突成形和椎间孔黄韧带切除后,确认出口神经根活动度满意时,不需要常规切除前方的突出椎间盘,以避免破坏稳定性,降低椎间盘突出复发和继发性节段不稳定的发生概率。
综上所述,全可视化内镜技术治疗腰椎椎间孔狭窄症降低了内镜下治疗该疾病的风险,提高了手术效率,减少了射线暴露,操作完全、疗效满意,值得临床推广。然而,本研究病例数及随访时间有限,远期疗效仍有待观察,尚需进一步临床研究。

