布鲁氏菌病不同血清学检测方法的比较
王维 沈艳 范亚楠 周迎春 刘华 王军 王倩 苗文萍 何长生
(安徽省动物疫病预防与控制中心 230091)
布鲁氏菌病(Brucellosis,简称“布病”)是由布鲁氏菌引起的一种人畜共患传染病,感染后会引起怀孕母畜流产、不孕、乳腺炎;公畜睾丸炎、不育等临床症状[1-2]。该病呈全球性流行,羊、牛和猪等家畜均为易感动物。我国将其列为二类动物疫病,世界动物卫生组织(OIE)将其列为B 类流行病[3]。
我国根据各地布病流行情况,结合人间病例的发病情况,将全国分为三类区域。安徽省作为布病二类地区,在布病防控中采取监测净化与申报免疫相结合的防控措施[4-5]。
由于布病病原学检测方法对实验室生物安全水平要求高,并存在一定的感染风险,而血清学检测操作相对简单,感染风险低,适用性广,在基层布病监测工作中被广泛应用[6]。目前,在日常防控工作中,主要采用虎红平板凝集试验(RBT)、试管凝集试验(SAT)、间接酶联免疫吸附试验(iELISA)与竞争酶联免疫吸附试验(cELISA)等血清学检测方法。本研究通过采用不同的血清学检测方法,对已知感染情况的87 份羊血清进行布鲁氏菌抗体检测,并根据检测结果对各种方法进行评估,尝试提出一种合理的血清学检测方法组合方案,以期在布病申报免疫及检测净化工作中提供技术指导。
1 材料与方法
1.1 材料
1.1.1 检测试剂
虎红平板凝集抗原、试管凝集抗原、布鲁氏菌病标准阳性与阴性血清,购自哈药集团生物疫苗有限公司;布鲁氏菌竞争ELISA 检测试剂盒,购自青岛立见诊断技术发展中心;布鲁氏菌抗体快速检测试剂卡,购自北京世纪元亨公司。以上试剂均按要求存放,并处于效期内。
1.1.2 血清样本
血清样本为本中心保存的已知感染情况的羊血清样本87 份。
1.1.3 主要仪器设备
96 孔酶标仪,Bio-Rad 公司产品;37℃恒温生化培养箱,哈尔滨市东明医疗器械厂产品;单道微量移液器和多道微量移液器,Transferpette 公司产品。
1.2 方法
1.2.1 试验方法
1.2.1.1 虎红平板凝集试验
对全部样品进行RBT 检测,操作与结果判定按照《动物布鲁氏菌病诊断技术》(GB/T18646-2018)进行。
1.2.1.2 试管凝集试验
对全部样品进行RBT 检测,采用常量法与微量法两种不同的检测方法,操作与结果判定按照《动物布鲁氏菌病诊断技术》(GB/T18646-2018)进行。
1.2.1.3 竞争酶联免疫吸附试验
对全部样品用cELISA 方法检测,具体步骤按说明书进行。
1.2.1.4 布鲁氏菌抗体定量检测试纸条检测
对全部样品采用GICA 检测,根据其各自说明书进行操作和结果判定。
1.2.2 数据分析与处理
检测数据采用SPSS 19.0 软件进行统计学分析。采用假阳性率、假阴性率、一致率和Kappa 值4 种分析指标。
假阳性率:即确证阴性中检测结果为阳性的占比。
假阴性率:即确诊阳性中检测结果为阴性的占比。
一致率:试验判定结果与标准诊断结果相同数占总检测数的比例。
符合程度依据一致性检验结果(Kappa 值)判定。相关参考文献显示:若0.81≤Kappa 值≤1.0,说明两种方法的诊断结果一致程度为极高;若0.61≤Kappa 值<0.81,说明两种方法的诊断结果一致程度为高;若0.41≤Kappa 值<0.61,说明两种方法的诊断结果一致性一般;若0.21≤Kappa 值<0.41,说明两种方法的诊断结果一致性较差;若Kappa 值<0.21,说明两种方法的诊断结果不一致[7]。
2 结果
2.1 RBT、SAT、cELISA 与GICA 血清学检测结果
应用RBT、SAT、cELISA 与GICA 分别对87 份已知感染情况的羊血清样品(53 份阳性、34 份阴性)进行检测,检测结果(表1)显示,经RBT 检测,阳性样本数量为54 份,阴性样本数量为33 份;经SAT(常量法)检测,阳性样本数量为50 份,阴性样本数量为37 份;经SAT(微量法)检测,阳性样本数量为51 份,阴性样本数量为36 份;经cELISA 检测,阳性样本数量为50 份,阴性样本数量为37 份;经GICA 检测,阳性样本数量为55 份,阴性样本数量为32 份。
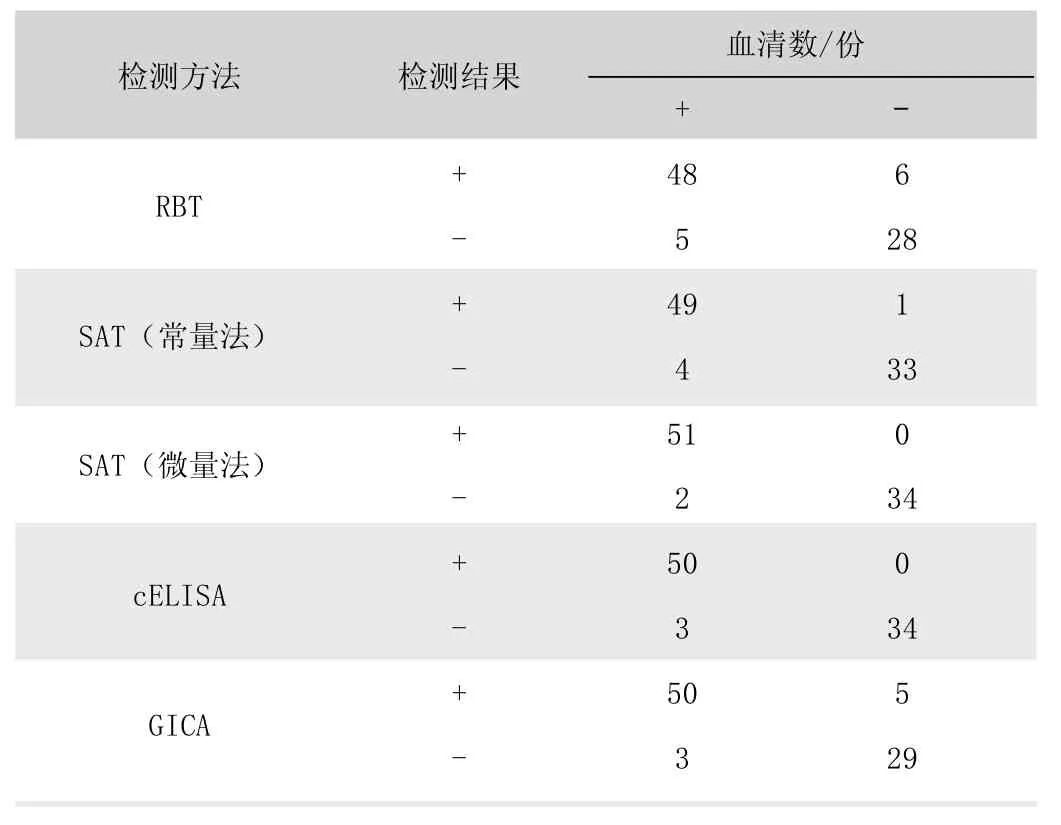
表1 RBT、SAT、cELISA 与GICA 血清学检测结果
2.2 RBT、SAT、cELISA 与GICA 的敏感性、特异性与一致性的比较
由表2 可知,RBT 的敏感性、特异性分别为90.57%、82.35%;SAT(常量法)的敏感性、特异性分别为92.45%、97.06%;SAT(微量法)的敏感性、特异性分别为96.23%、100%;cELISA 的敏感性、特异性分别为94.34%、100%;GICA的敏感性、特异性分别为94.34%、95.29%。其中RBT 的敏感性与特异性都比较差,SAT 与cELISA 的敏感性、特异性相对更优,同样作为初筛方法的GICA 敏感性与特异性都比RBT更加优良。
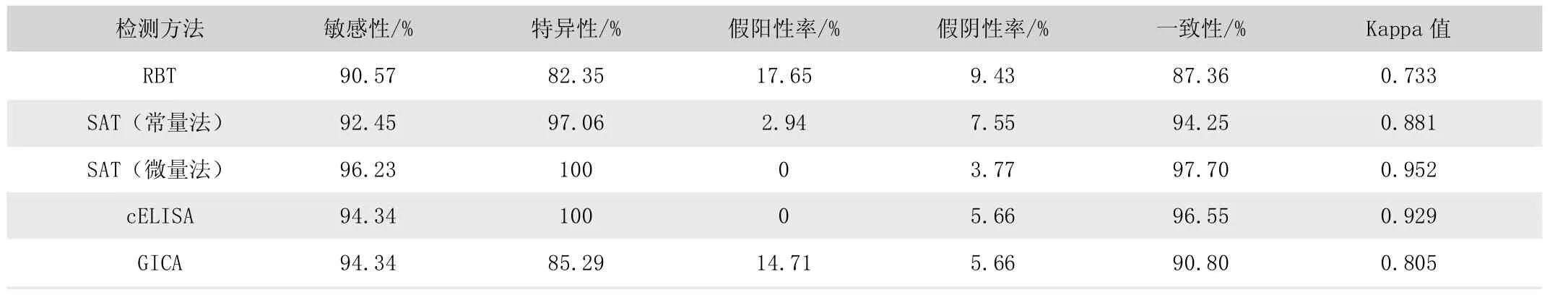
表2 RBT、SAT、cELISA 与GICA 血清学检测结果比较
假阳性与假阴性方面,RBT 的假阴性率与假阳性率都相对较高,分别为17.65%、9.43%;GICA 的假阳性率偏高;相较而言,SAT(常量法)、SAT(微量法)与cELISA 的准确性与一致性更好。
经Kappa 检验可以看出,RBT 与GICA 的Kappa 值均小于0.81,与真实结果一致程度为高;而SAT 与cELISA 的Kappa值均大于0.81,与真实结果一致程度为极高。
3 结论与讨论
从上述结果可以发现,RBT 的敏感性与特异性都相对较低,相关研究也表明,RBT 会因为疫苗免疫或交叉反应等因素而产生假阳性结果,同时亦会因前带现象而产生假阴性[8],但由于其操作简便,所需实验设备较少而被广泛应用于布病的初筛检测中[9]。需要注意的是,应用RBT 对临床样本检测时,由于各厂家生产的平板凝集抗原滴度不同,针对某些弱阳性样本,可能会产生不同的检测结果。为消除RBT 检测方法的缺陷,在实际工作中推荐选用SAT 与ELISA 方法中的一种或多种进行复核检测,以确保检测结果的准确性。
免疫胶体金检测技术是基于抗原抗体检测的一种新型免疫标记技术,在生物医学的各领域得到广泛应用[10]。通过本研究可以看出,与RBT 相比,GICA 的敏感性更好,但特异性较为一般。在实验操作与检测结果判定过程中,受主观因素与外界环境因素的影响更少,具有检测敏感性更高,所需血清量更少,检测样本类型更多样等优点[11]。因此,GICA 比RBT 更适合未来布病初筛实验。
《动物布鲁氏菌病诊断技术》(GB/T18646-2018)新增加了SAT(微量法)作为布病血清学检测确诊方法,从试验结果中可以看出,SAT 的敏感性较低,但特异性较高,适合在阳性样本复核及布病净化监测等情况下选用。同时,在实际操作中发现,微量法所需试剂耗材较少,可以在96 孔稀释板上进行操作,与常量法相比,更加适合大量的临床样本确认工作。在结果判定时,微量法将孔底凝集情况作为判定标准,比常量法更加易于实验员观察判定。
cELISA 于2018 年被纳入我国布病法定检测方法,该检测方法的敏感性、特异性及与正确结果一致性都比较优良,具有操作简便、判定标准准确、重复性好、单次试验可完成大量样本等优点[12]。在临床样本检测过程中,cELISA 的检测结果更加稳定可靠[13]。但因各厂家检测试剂的试验灵敏度与阈值线的设定各不相同,不同品牌检测试剂的检测结果无法直接进行参考比较,因此,在临床诊断中,需结合动物临床症状进行科学判定为宜。
在布鲁氏菌病防控工作中,实验室的检测结果可作为临床诊断与疫病净化消除的参考依据。检测方法的敏感性越高,对识别阳性动物越有利,特异性越高,可有效减少我们对疫病的误诊,从而进一步降低净化与扑杀过程中的成本。而当检测方法的检测性能较差时往往会导致疫病误诊与漏诊,对研判疫情存在状况与维护公共卫生安全等工作产生各种不利影响。从上述检测结果中不难发现,若仅选用某种血清学检测方法,很容易导致误诊或漏诊。因此,在布病临床诊断与疫病净化过程中,要合理选择联用不同的检测方法,根据当地疫病流行情况,采用垂直试验或平行试验进一步提高试验结果的准确性。
近年来,安徽省人布病病例数与动物布病抗体检测阳性数日益增加,《国家动物疫病强制免疫指导意见(2022-2025年)》(农牧发〔2022〕 1 号)中要求各地根据评估情况以县为单位确定本省份的布病免疫区,各场户可根据实际需要进行备案,采取布病疫苗免疫。种种迹象表明,未来布病诊断工作面临着更加复杂多变的形势与挑战。血清学检测方法存在的一个共性问题是无法有效鉴别感染抗体与免疫抗体。因此,在布病控制与净化工作中,既要科学选用血清学检测方法,也应结合动物临床症状及免疫情况,考虑使用病原学检测方法进行进一步的判定。

