利拉鲁肽治疗2型糖尿病合并 非酒精性脂肪性肝病的临床效果
王素莉,郭 赟,岑 冰,李敬华,匡 霞
(中国人民武装警察部队特色医学中心内分泌与血液科,天津 300162)
2型糖尿病(type 2 diabetes mellitus, T2DM)可引发各种肝脏损伤,其中非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)最为常见,指除过量饮酒,由其他肝损伤因素造成的,以肝脏脂肪积聚为主要临床表现的一种慢性肝脏疾病,其发病的主要因素在于胰岛素抵抗。T2DM合并NAFLD会使糖代谢进一步恶化,严重者甚至发生肝细胞肿瘤。二甲双胍在临床上多被用于治疗T2DM,其可提升胰岛素敏感性,抑制胰岛素抵抗,使脂肪对肝细胞的损伤减轻;甘精胰岛素与胰岛素的作用途径类似,可起到降血糖作用,但采用常规降糖药物治疗难以长期、有效维持患者血糖水平,且在保护患者肝脏功能,减轻炎症水平方面疗效欠佳;长期用药还会出现腹胀、胃肠胀气等不良反应[1-2]。利拉鲁肽属于胰高血糖素样肽 -1类似物,以葡萄糖依赖的方式刺激内源性胰岛素分泌,抑制胰高血糖素分泌,能够有效调节患者血糖水平,同时减少内脏脂肪,改善胰岛素抵抗,降糖效果更为显著,同时可有效缓解脂肪肝病变[3]。基于此,本研究旨在探讨利拉鲁肽对T2DM合并NAFLD患者血糖、血脂、脂肪肝病变程度的影响,以及血清炎症因子、氧化应激因子水平的变化,现报道如下。
1 资料与方法
1.1 一般资料按随机数字表法将中国人民武装警察部队特色医学中心2020年1月至2021年9月收治的120例T2DM合并NAFLD患者分为对照组(60例)和试验组(60例)。对照组(采用二甲双胍、甘精胰岛素治疗)患者中男性32例,女性28例;年龄26~78岁,平均(48.18±5.89)岁。试验组(在对照组治疗的基础上联合利拉鲁肽治疗)患者中男性31例,女性29例;年龄27~79岁,平均(48.76±5.13)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),组间可比。诊断标准:均符合《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[4]《中国2型糖尿病防治指南(2010年版)》[5]中的相关诊断标准。纳入标准:符合上述诊断标准者;体质量指数(BMI) ≥ 24 kg/m2且3个月内体质量波动≤ 10%者;无饮酒史者等。排除标准:存在严重交流沟通障碍,精神疾病者;近期存在其他降糖药物服用史者;有严重性肝肾功能障碍者;存在胰腺炎病史、甲状腺髓样癌家族史者等。研究经中国人民武装警察部队特色医学中心医学伦理委员会批准,且患者签署知情同意书。
1.2 治疗方法对照组患者予以盐酸二甲双胍缓释胶囊(哈药集团制药六厂,国药准字H20051805,规格: 0.25 g/粒)口服治疗,剂量为0.5 g/次,3次/d;甘精胰岛素注射液(通化东宝药业股份有限公司,国药准字S20190041,规格:3 mL∶300 U/支)皮下注射治疗,剂量为0.3 U/(kg·d),睡前给药,1次/d;护肝片(江西华太药业有限公司,国药准字Z20083259,规格:0.36 g/片)口服治疗,剂量为1.44 g/次,3次/d,连续给药24周。试验组患者在对照组患者上述治疗的基础上联合利拉鲁肽注射液(Novo Nordisk A/S,注册证号S20160005,规格:3 mL∶18 mg)治疗,将初始剂量定为0.6 mg,患者皮下注射,1次/d,最大用药剂量定为1.8 mg/d,治疗24周。
1.3 观察指标①对患者进行肝脏CT检查,肝脏密度弥漫性下降,肝脏与脾脏的CT值之比≤ 0.1即可诊断为脂肪肝。其中肝/脾CT比值0.8~1.0为轻度脂肪肝;肝/脾CT比值0.5~0.7为中度脂肪肝;肝/脾CT比值<0.5为重度脂肪肝[6]。CT检查显示为肝/脾CT比值>1.0,或由重度转为轻度为显效;肝/脾CT比值明显降低,且脂肪肝程度减轻1级为有效;肝/脾CT比值未升高且脂肪肝程度改善不足1级,甚至加重为无效。临床总有效率=显效率+有效率[4]。②分别于治疗前后抽取两组患者空腹时及早餐后2 h的外周静脉血,各3 mL,经3 000 r/min的转速离心10 min,取上层血清,以Au5 800型全自动生化分析仪(美国贝尔曼公司)检测患者血清血糖指标[空腹血糖(FPG)、餐后2 h血糖(2 h PG)],血脂指标[空腹血清中高/低密度脂蛋白胆固醇(HDL-C/LDL-C)、总胆固醇(TC)、三酰甘油(TG)]。③对比两组患者治疗后脂肪肝严重程度改善情况。④对比两组患者治疗前后血清炎症因子超敏 -C反应蛋白(hs-CRP)水平,采用酶联免疫吸附实验法检测,血清氧化应激因子丙二醛(MDA)水平,采用放射免疫法检测,血样采集、血清制备方法同②。
1.4 统计学方法采用SPSS 23.0统计学软件处理数据,计数资料以[ 例(%)]表示,行χ2检验;计量资料均经K-S法检验证实符合正态分布,以(±s)表示,行t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较相较于对照组的临床总有效率(86.67%),试验组(98.33%)显著升高,差异有统计学意义(P<0.05),见表1。
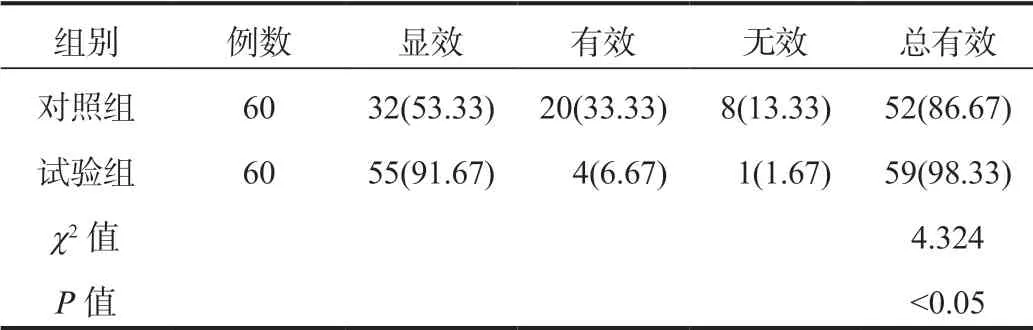
表1 两组患者临床疗效比较[ 例(%)]
2.2 两组患者血糖水平比较与治疗前比,两组患者治疗后血清FPG及2 h PG水平均显著降低,且试验组显著低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者血糖水平比较(±s , mmol/L)
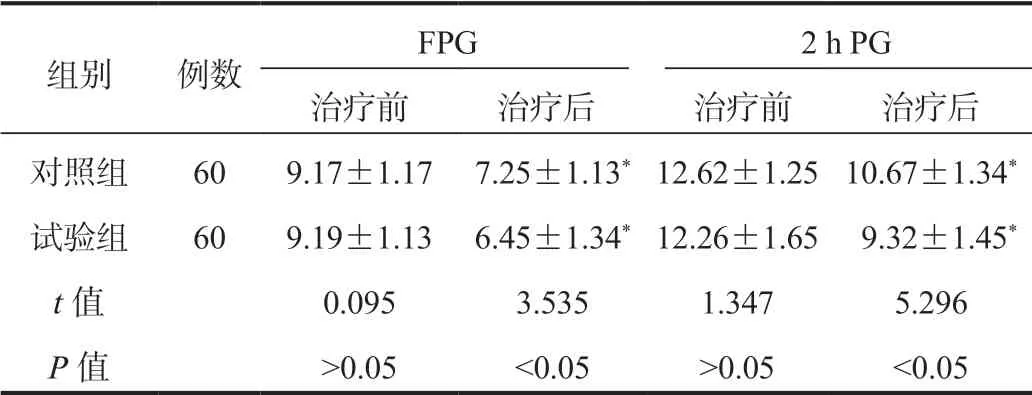
表2 两组患者血糖水平比较(±s , mmol/L)
注:与治疗前比,*P<0.05。FPG:空腹血糖;2 h PG:餐后2 h血糖。
组别 例数 FPG 2 h PG治疗前 治疗后 治疗前 治疗后对照组 60 9.17±1.17 7.25±1.13*12.62±1.25 10.67±1.34*试验组 60 9.19±1.13 6.45±1.34*12.26±1.65 9.32±1.45*t值 0.095 3.535 1.347 5.296 P值 >0.05 <0.05 >0.05 <0.05
2.3 两组患者血脂水平比较与治疗前比,两组患者治疗后血清TG、TC、LDL-C水平均显著降低,且试验组显著低于对照组;血清HDL-C水平治疗后均显著升高,且试验组显著高于对照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者血脂水平比较(±s , mmol/L)
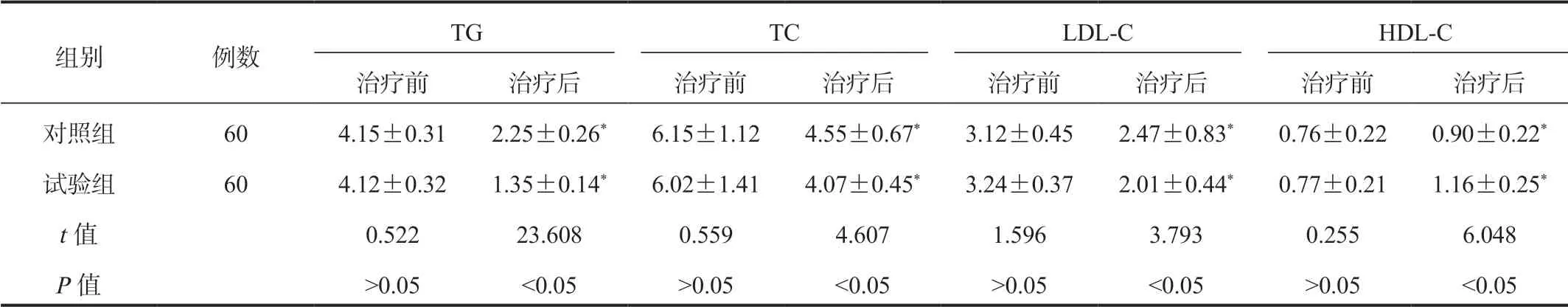
表3 两组患者血脂水平比较(±s , mmol/L)
注:与治疗前比,*P<0.05。TG:三酰甘油;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇。
组别 例数TG TC LDL-C HDL-C治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 4.15±0.31 2.25±0.26* 6.15±1.12 4.55±0.67* 3.12±0.45 2.47±0.83* 0.76±0.22 0.90±0.22*试验组 60 4.12±0.32 1.35±0.14* 6.02±1.41 4.07±0.45* 3.24±0.37 2.01±0.44* 0.77±0.21 1.16±0.25*t值 0.522 23.608 0.559 4.607 1.596 3.793 0.255 6.048 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组患者脂肪肝严重程度改善情况比较与治疗前比,治疗后试验组患者轻度脂肪肝占比显著升高,且显著高于对照组;两组患者治疗后重度脂肪肝占比均显著降低,且试验组患者重度脂肪肝占比显著低于对照组,差异均有统计学意义(均P<0.05),见表4。
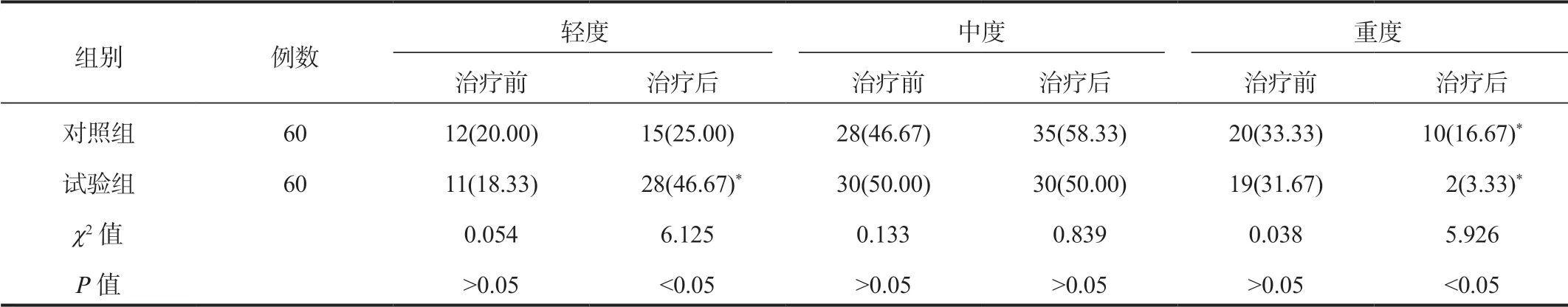
表4 两组患者脂肪肝严重程度改善情况比较[ 例(%)]
2.5 两组患者血清MDA、hs-CRP水平比较与治疗前比,治疗后两组患者血清炎症因子hs-CRP水平及氧化应激因子MDA水平均显著降低,且治疗后试验组显著低于对照组,差异均有统计学意义(均P<0.05),见表5。
表5 两组患者血清MDA、hs-CRP水平比较(±s)
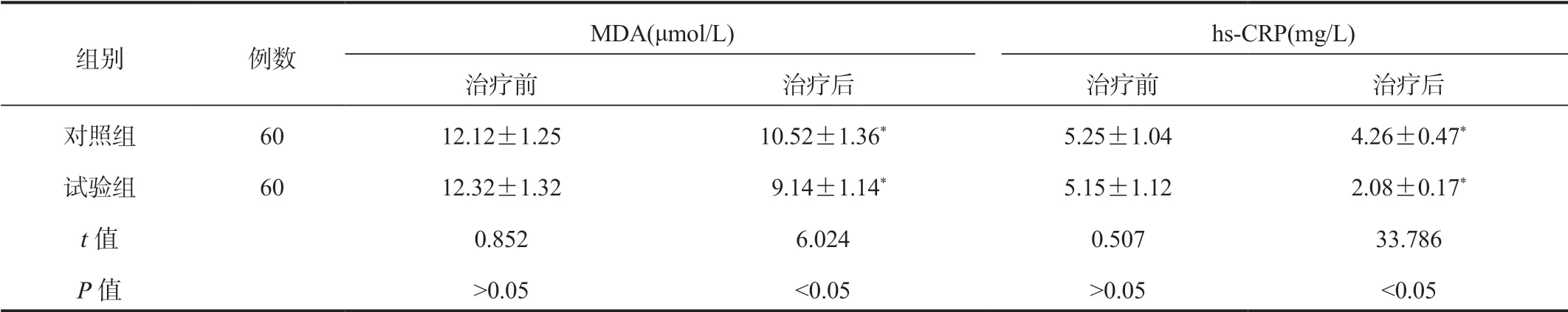
表5 两组患者血清MDA、hs-CRP水平比较(±s)
注:与治疗前比,*P<0.05。MDA:丙二醛;hs-CRP:超敏-C反应蛋白。
MDA(μmol/L) hs-CRP(mg/L)治疗前 治疗后 治疗前 治疗后对照组 60 12.12±1.25 10.52±1.36* 5.25±1.04 4.26±0.47*试验组 60 12.32±1.32 9.14±1.14* 5.15±1.12 2.08±0.17*t值 0.852 6.024 0.507 33.786 P值 >0.05 <0.05 >0.05 <0.05组别 例数
3 讨论
NAFLD患者肝细胞内部出现脂肪过度沉积的现象,常与T2DM合并存在,两者可相互影响,从而加重糖脂代谢紊乱。相关研究显示,胰岛素抵抗是NAFLD和T2DM的病理机制核心,但具体机制尚未完全阐明[7]。针对T2DM合并NAFLD患者来说,调节血糖代谢是临床治疗的关键。T2DM患者体内的胰岛素会抑制腺苷酸环化酶活性,而给予患者二甲双胍治疗可以有效缓解这一现象,促使胰岛素敏感性提升,同时该药物可以抑制胆固醇合成,改善患者机体血脂水平;二甲双胍常联合甘精胰岛素共同治疗T2DM患者,通过药物协同作用机制,有效控制血糖水平,但是难以长期、稳定调控糖脂代谢,减轻炎症 反应[8]。
T2DM合并NAFLD患者在摄入食物,或受其他因素的影响下,致使患者体内葡萄糖浓度明显升高,而利拉鲁肽是临床上应用的新型降糖药物之一,可有效调节胰岛β细胞功能,激活胰岛β细胞膜上的胰高血糖素样肽 -1 (GLP-1)受体,通过与GLP-1受体结合进行信号转导,对和受体呈现出偶联状态下的G蛋白产生激活作用,有效作用于患者体内胰岛β细胞内胰岛素基因,促进胰岛素分泌[9-10]。此外,该药物能够促进机体对于葡萄糖的利用与消耗,有效降低患者的餐后血糖含量;同时,该药物会介入胰岛α细胞对胰高血糖素的分泌过程,可以影响糖原异生效果,抑制肝糖原释放,从而降低患者FPG水平[11]。相关临床研究显示,给予T2DM合并NAFLD患者利拉鲁肽治疗,能够有效降低患者机体分泌C肽的含量,降低胰岛素原/胰岛素比值,促使胰岛β细胞增殖,降糖效果显著[12]。本研究中,治疗后试验组患者的临床总有效率(98.33%)较对照组(86.67%)显著升高,血糖水平较对照组显著降低,表明利拉鲁肽治疗T2DM合并NAFLD患者,降糖疗效更显著。
相关研究显示,肥胖是导致胰岛素抵抗的主要原因,在肥胖的NAFLD患者中,由于脂代谢障碍,会导致肝脏脂肪内环境失去平衡,从而造成TG的过度脂解和游离脂肪酸的过多产生,造成脂毒性,进而导致胰岛素抵抗,加重病情[13]。本研究中,治疗后两组患者血脂代谢指标水平与试验组患者脂肪肝病情程度较治疗前均明显降低,提示利拉鲁肽治疗T2DM合并NAFLD,可有效降低患者血脂水平,减轻患者脂肪肝病变程度,保护患者肝功能。主要原因可能是,利拉鲁肽能够发挥出抑制胰高血糖素分泌和增加胰岛素分泌双重功效,可针对患者体内GLP-1受体产生多靶点效应,更有效改善患者血脂代谢,从而有效控制相关血脂水平,可更有效促进游离脂肪酸氧化,提高游离脂肪酸的利用,避免因肝脏内脂质沉积导致肝功能异常,逐步改善患者脂肪肝严重程度[14]。
因T2DM合并NAFLD患者肝脏细胞不能耐受脂肪酸的毒性作用,导致细胞稳态失衡,造成肝细胞损伤、氧化应激损伤;其中血清hs-CRP水平异常升高,可直接反映患者肝脏损伤程度,因此将其作为内源性氧化应激损伤因子MDA所致肝细胞损伤的评估指标;氧化应激是T2DM发生的危险因素,高糖高脂诱导的线粒体超氧阴离子过量产生是其主要原因,氧化应激状态下大量产生的氧自由基可破坏线粒体结构,影响胰岛素的分泌,导致胰岛素抵抗出现,从而加重T2DM。利拉鲁肽具有明显抑制食欲功效,其可激活患者下丘脑食欲中枢含有的GLP-1受体,大幅度减轻饥饿感,从而明显减轻患者的食欲,使其摄食量降低;另外,利拉鲁肽还可以对胃壁上含有的GLP-1受体起到激活作用,调节迷走神经及交感神经,在给予患者该药物治疗或者同时联合其他降糖药物治疗时,能够获取到显著抑制食欲效果,增加饱腹感,促进体内脂肪的消耗,降低脂肪酸含量,避免脂肪沉积于肝脏组织,降低肝细胞毒性,抑制线粒体β氧化与内质网应激,因而减轻患者机体氧化应激损伤[15]。本研究中,治疗后两组患者血清氧化应激因子MDA、炎症因子hs-CRP水平均显著下降,且试验组显著低于对照组,提示给予T2DM合并NAFLD患者利拉鲁肽治疗,可显著抑制机体氧化应激损伤及炎症损伤,减轻患者脂肪肝病变程度。
综上,给予T2DM合并NAFLD患者利拉鲁肽治疗能够有效改善患者的血糖、血脂水平,减轻脂肪肝严重程度,缓解氧化应激损伤及炎症损伤,值得临床推广应用。

