不同肥源条件下Zn对农田土壤N2O排放的影响及其机制
周金蓉,张 婷,冯廉洁,蒋静艳
不同肥源条件下Zn对农田土壤N2O排放的影响及其机制
周金蓉,张 婷,冯廉洁,蒋静艳*
(南京农业大学资源与环境科学学院,江苏 南京 210095)
为探究锌(Zn)污染对农田土壤氧化亚氮(N2O)排放的影响,分别以猪粪和尿素为肥源进行室内培养实验,对比分析不同含量Zn(0、50、500、1500和5000mg/kg)对N2O排放的影响及其机制,并在培养第52d向所有处理再次添加尿素以探究其长期效应,共培养80d.结果表明:第1次添加肥料阶段,在尿素为肥源处理中不同含量Zn均表现为显著抑制作用(0.05),而猪粪为肥源处理中除50mg/kg无显著影响外(>0.05),其它含量处理均显著促进N2O排放(<0.05).第2次添加肥料阶段,不同肥源条件下Zn的作用规律一致,即50mg/kg无显著影响(>0.05),500和1500mg/kg显著提高N2O排放而5000mg/kg处理与之相反(0.05).此阶段500、1500和5000mg/kg处理以猪粪和尿素为肥源时其N2O累积排放量与同肥源对照的比值分别为3.49、3.13、0.01和2.53、2.74、0.04,可见同等含量Zn在猪粪为肥源条件下作用更强,500和1500mg/kg Zn的促进机制为Zn提高了土壤中NH4+-N、NO3--N含量以及控制反硝化过程N2O产生和还原功能基因相对丰度的比值(S/Z),而5000mg/kg Zn抑制了土壤中NH4+-N进一步转化为NO3--N,从而降低了N2O排放.
农田;土壤;Zn;猪粪;尿素;N2O排放
氧化亚氮(N2O)是重要的温室气体之一,农田土壤排放的N2O约占全球排放总量的60%[1].土壤N2O产生主要由硝化和反硝化过程主导[1].硝化过程的限速步骤是氨氧化过程,由氨氧化细菌(AOB)和氨氧化古菌(AOA)携带的A基因编码氨单加氧酶催化完成;反硝化过程中NO2-被还原为NO是溶解性氮转化为气态氮的关键过程,由K或S基因编码亚硝酸盐还原酶催化进行,进一步生成的N2O由Z基因编码N2O还原酶催化转化为N2[1-2].这些过程由微生物主导,易受外源物质的影响,如多环芳烃、农药和重金属等[3].以重金属为例,已有研究发现重金属对氨氧化菌[4]、硝化细菌[5]以及土壤中N2O产生和还原速率[6,7]有抑制作用;重金属对土壤硝化和反硝化酶活存在浓度效应,即有低浓度促进高浓度抑制的作用规律[8].也有研究表明添加猪粪可增加土壤氮循环过程的细菌丰度,缓解重金属对反硝化过程的抑制作用[9].
我国大部分省市土壤都受到由农业措施和工业活动造成的锌(Zn)等重金属污染[10].集约化养殖过程产生大量富含重金属的粪肥还田后造成农田土壤重金属持续累积[11],统计表明2008~2018年通过粪肥还田过程进入农田土壤的Zn达13.6万t/a[11].金属开采和冶炼等工业活动通常造成局部农田高污染,毗邻矿区、工业区或位于污水灌溉区的农田土壤中Zn含量范围为5.89~7076mg/kg,平均值为634.37mg/kg[12],远高于土壤环境质量标准.重金属进入土壤后会经历老化过程,即与土壤黏粒或有机物结合造成其生物有效性随时间延长而降低,一般会在50d左右与土壤达到新的平衡状态[13].
当前,关于Zn影响土壤氮循环的研究,多集中在某类氮转化微生物或土壤硝化或反硝化单个过程方面,且多研究土壤本底氮转化,研究周期较短,关于Zn污染对不同氮源条件下土壤N2O排放的影响及机制的研究较为少见.因此本研究添加不同外源氮,进行较长时间的室内模拟污染培养实验,对比分析两种氮源条件下Zn对N2O排放的浓度效应,从底物含量和氮循环微生物功能基因角度探索Zn对N2O排放的影响机制,其结果可为了解我国农田土壤Zn的生态环境效应以及高Zn污染背景下农田土壤N2O排放变化提供科学依据.
1 材料与方法
1.1 供试材料
供试土壤采自江苏省南京市江宁区农田土壤耕作层(0~20cm),pH(H2O)值为6.47,全氮含量为0.93g/kg,有机质含量为11.96g/kg,Zn全量为55.59mg/kg,<0.005mm、0.005~0.01mm、0.01~ 0.05mm和0.05~1mm的粒径含量分别为34.79%、13.17%、41.27%和10.77%.供试猪粪源于未食用饲料的家猪排泄物,堆置后使用,全氮含量为8.81g/kg,全磷含量为1.84g/kg,有机质含量为720.33g/kg,Zn全量为174.19mg/kg.
1.2 实验设计
采集土样风干后过10目筛,称取土样120g(干重)至575mL培养瓶中,加入适量超纯水预培养1周.根据设定的处理添加Zn溶液、猪粪和尿素,土壤水分维持浅水层(2cm),置于培养箱中恒温黑暗培养(25℃),通过重量法每3d补加损失的水分,在培养第52d将尿素以水溶液形式添加到全部处理,培养至80d结束.每处理9重复,3重复用于常规气体采集及培养结束时的土样采集,6重复分别用于培养前期(5d)、中期(51d)土壤样品的采集.采集土样保存于-20℃冰箱,用于各指标测定.
1.3 样品的采集与测定
气体样品采集与测定:通过间歇密闭培养-气相色谱法测定N2O排放速率.每日密闭培养12h,抽取密闭前后的瓶内气体15mL,用GC7890B气相色谱仪(Angilent,美国)测定N2O含量.所用载气为99.999%高纯氮气,检测器为电子捕获检测器(ECD),检测器温度为300℃,柱温为50℃.根据密闭前后气体样品中N2O含量差值计算12h内土壤N2O排放速率,通过时间加权计算培养期内N2O累积排放量.
具体计算公式如下:

式中:为N2O排放速率,ng/(g·h);ρ为气体密度,g/L;为培养瓶内气体的有效空间,L;为培养瓶内土壤干重,g;Δ为密闭培养时间,h;Δ为Δ时间内培养瓶内气体浓度差,µg/g;为N2O分子量,g/mol;为培养温度,℃.
通过时间加权平均计算N2O的累积排放量,计算公式为:

式中:为气体累积排放量,ng/g;为采样次数;为培养天数,d;为N2O排放速率,ng/(g×h).
土壤样品测定:功能基因测定:使用DNeasy®Powersoil® kit试剂盒(QIAGEN,德国)提取土壤总DNA,使用NanoDrop2000超微量紫外分光光度计(Thermo Scientific,美国)测定DNA浓度,使用实时荧光定量PCR仪(Thermo Scientific,美国)测定样品中N2O相关功能基因的丰度.PCR扩增体系为20μL: 10μL扩增酶混合物SYBR Premix Ex Taq TM(2×); 6.8μL灭菌且不含DNase的超纯水;2μL DNA模板;0.4μL 荧光定量PCR参比染料ROX Reference Dye(50×);0.4μL 正向引物(10μmol/L);0.4μL 反向引物(10μmol/L).扩增程序为:95℃ 30s;95℃ 5s,55℃ 30s,72℃ 1min,40个循环;95℃ 15s,60℃ 1min,95℃ 15s.相关引物见表1.
从城阳区乡村旅游者的月收入来看,大部分集中在中等偏上收入。3001-4000收入者最多,占36%;其次收入为2001-3000,占30%;1000-2000、4000以上收入者分别占14%和16%,1000以下收入者最少,占9%。

表1 目的基因的引物序列
注:H=A/C/T,Y=C/T,W=A/T,R=A/G.
NH4+-N、NO3--N含量测定:称取5g土样,加入25mL 2mol/L KCl溶液,恒温震荡1h(25℃,180r/min),过滤后使用连续注射流动分析仪(Skalar,荷兰)测定滤液中NH4+-N、NO3--N含量.有效Zn含量测定:配制二乙烯三胺五乙酸浸提液(pH值为7.3),称取10g土样,加入20mL浸提液,恒温震荡2h(20℃,180r/min),过滤后使用电感耦合等离子体原子发射光谱仪(Angilent,美国)测定浸提液中Zn浓度.根据浸提比例和土样含水率计算土样中目标物质含量.
1.4 数据处理
实验结果以算术平均值±标准误差表示,以最小显著差异法进行多重比较,使用Microsoft Office Excel 2019和IBM SPSS Statistics 25进行数据处理,使用Origin 2018绘图.
2 结果与分析
2.1 Zn对N2O排放速率和累积排放量的影响
以各处理和每次独立观测时间对N2O排放速率作双因素方差分析,发现不同肥源条件下不同培养阶段Zn对N2O排放速率产生了显著影响(0.01).如图1所示,第1次添加肥料阶段(1~51d),Zn在两种肥源条件下作用规律不同.猪粪处理中Zn显著提高了N2O排放速率(<0.05),以尿素为肥源的处理中表现为先促进后抑制.培养至30d左右,U+ Zn1500的N2O排放速率逐渐升高.第2次添加肥料阶段(52~80d),不同肥源条件下同等Zn含量的作用规律相同,均为M+Zn50和U+Zn50的N2O排放速率与同种肥源对照无显著差异(>0.05),M+Zn500、M+Zn1500和U+Zn500、U+Zn1500显著高于同种肥源对照(<0.01),M+ Zn5000和U+Zn5000显著降低N2O排放速率(<0.01).此外,同等Zn水平下以猪粪为肥源处理的N2O排放速率高于以尿素为肥源的处理.
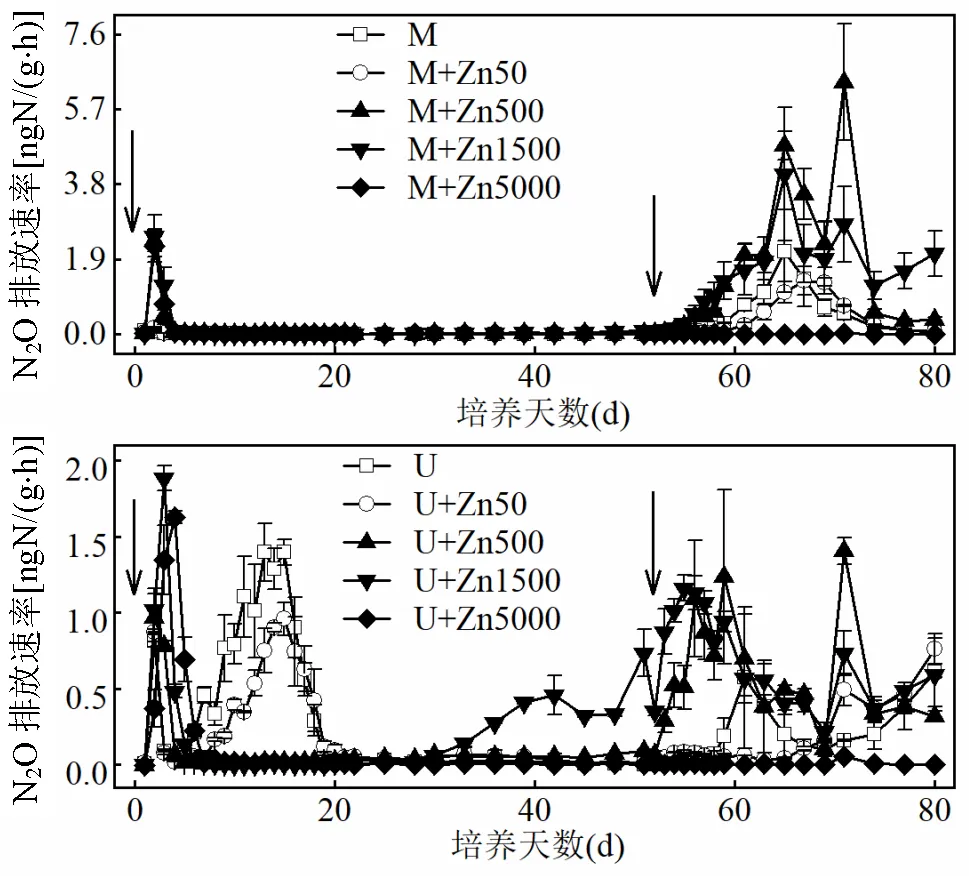
图1 培养期内N2O排放速率动态变化
图中箭头表示添加肥料

表2 培养期内N2O累积排放量
注:同一纵列同种肥源不同字母表示差异性达到显著水平(<0.05).
如表2所示,第1次添加肥料阶段,Zn在猪粪为肥源处理中除低含量(50mg/kg)无显著影响外(>0.05),其它含量处理均显著促进N2O排放(<0.05),约是对照的9~13倍.而在尿素为肥源处理中所有含量Zn均表现为显著抑制作用(0.05),N2O累积量减少幅度达11%~70%.第2次添加肥料阶段,不同肥源条件下Zn对N2O累积排放量的作用规律相同,即与同种肥源对照相比,低含量Zn无显著影响(>0.05),M+Zn500、M+Zn1500和U+Zn500、U+Zn1500显著提高了N2O累积排放量(<0.05),分别是同肥源对照的3.49、3.13和2.53、2.74倍,M+ Zn5000和U+Zn5000减排作用极其显著(<0.05),几乎无N2O排放.从N2O整个培养周期来看,不同肥源条件下Zn的浓度效应基本一致,均为低浓度无影响,中浓度促进,高浓度抑制.
2.2 培养期内土壤中有效Zn含量变化

图2 培养期内土壤中有效Zn含量变化
如图2所示,有效Zn含量在第1次添加肥料阶段快速下降,在第2次添加肥料阶段逐步稳定.到培养末期,猪粪处理中有效Zn含量显著低于尿素处理(0.05),表明添加猪粪提高了土壤对Zn的吸附固定能力.
2.3 N2O排放速率与NH4+-N、NO3--N、有效Zn和功能基因的相关性
结合培养第5、51和80d的NH4+-N含量、NO3--N含量、有效Zn含量、硝化及反硝化功能基因丰度和N2O排放速率进行相关分析,发现以猪粪和尿素为肥源条件下N2O排放速率与NO3--N含量均呈显著正相关(0.01,0.1),有效Zn含量与NH4+-N含量也呈显著正相关(0.01,0.01).此外,猪粪处理的N2O排放速率与S/Z呈极显著正相关(0.01),尿素处理中N2O排放速率与Z丰度呈显著负相关(0.1),而N2O排放速率与AOBA和AOAA均无显著相关性(0.1),表明本研究条件下N2O排放速率主要受反硝化过程微生物影响(表3).
为进一步探明不同肥源条件下N2O排放与有效Zn、NH4+-N、NO3--N含量及微生物功能基因丰度的关系,对土壤有效Zn、NH4+-N、NO3--N含量和S/Z按添加肥料阶段取平均值进一步分析,发现土壤NH4+-N与有效Zn平均含量呈显著正相关(0.05),如图3.不同肥源条件下,两阶段内土壤NH4+-N含量均随有效Zn含量增加而增加,尤其是Zn为5000mg/kg的处理增加最明显.回归方程斜率差异表明,同一肥源条件下Zn在第2培养阶段的影响强于第一阶段,且同一培养阶段内Zn在尿素处理中的作用强于猪粪处理.
表3 培养期内N2O排放速率与NH4+-N含量、NO3--N含量、有效Zn含量、硝化和反硝化过程功能基因丰度的相关性

Table 1 Correlations between N2O emission rates and NH4+-N,NO3--N,available Zn concentration and abundances of functional genes during the incubation period
注:*表示在0.1水平相关性显著,**表示在0.05水平相关性显著,***表示在0.01水平相关性显著,=15.
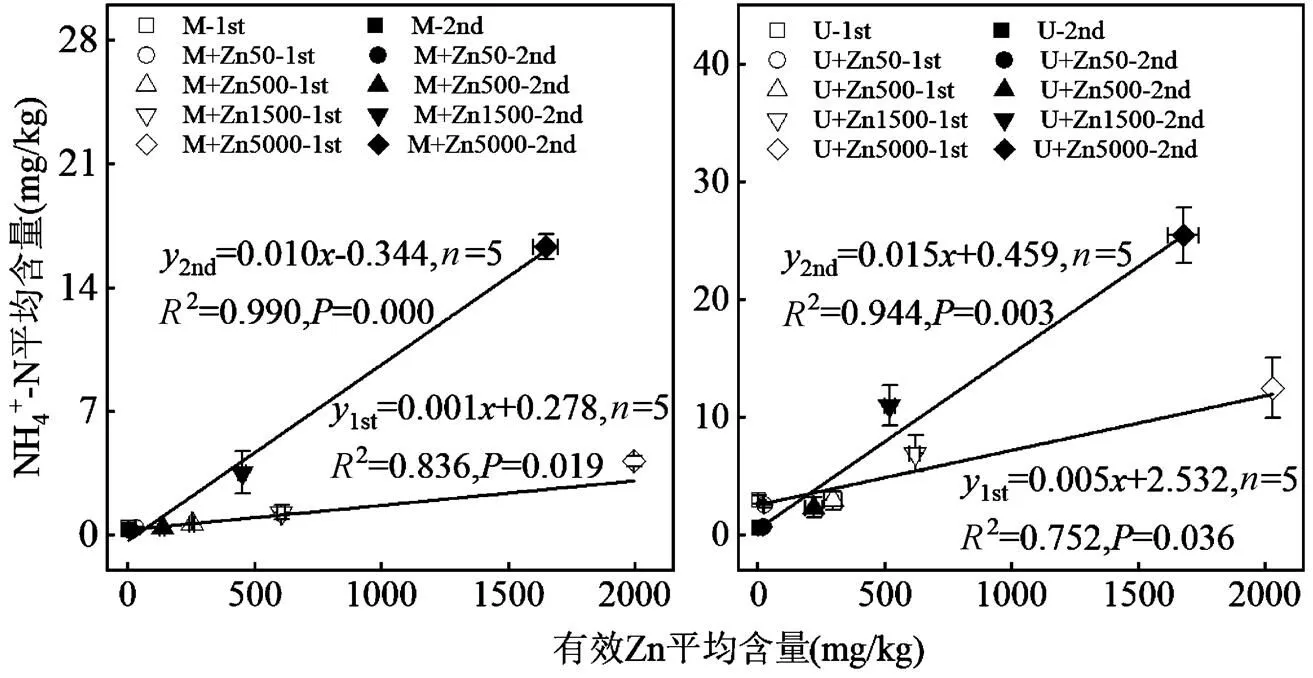
图3 不同肥源条件下土壤NH4+-N含量与有效Zn含量的关系
1st表示第1次添加肥料阶段,2nd表示第2次添加肥料阶段(后同)
如图4所示,第1次添加肥料阶段,猪粪为肥源时Zn对NO3--N含量和N2O累积量的影响无明显规律;尿素为肥源时,各处理NO3--N含量无明显差异,但N2O累积量有所降低.第2次添加肥料阶段不同肥源条件下Zn为500和1500mg/kg处理的NO3--N含量和N2O累积量大幅高于同种肥源对照;Zn为5000mg/kg处理的NO3--N含量和N2O累积量最低,表明该Zn水平下NH4+-N大量累积,未进一步转化为NO3--N.两种肥源条件下N2O累积量均与土壤NO3--N平均含量呈显著正相关(0.05),表明N2O累积量主要取决于NO3--N含量,Zn通过影响微生物而影响NO3--N含量,进而改变N2O排放,且从拟合方程的斜率看出以猪粪为肥源时其影响更大.
如图5所示,第1次添加肥料阶段,N2O累积排放量与S/Z未呈现明显关系;第2次添加肥料阶段,由于Zn为5000mg/kg的处理NO3--N含量和N2O排放量极低,与S/Z不成线性关系,因此排除该点进行线性拟合,结果表明两种肥源条件下N2O累积量与S/Z均呈正相关,表明Zn通过改变N2O产生和还原过程的相对强度影响N2O排放,且猪粪为肥源时S/Z对N2O阶段累积量的影响更大.两种肥源条件下,均是Zn为500和1500mg/kg的处理S/Z和N2O累积量远大于对照.
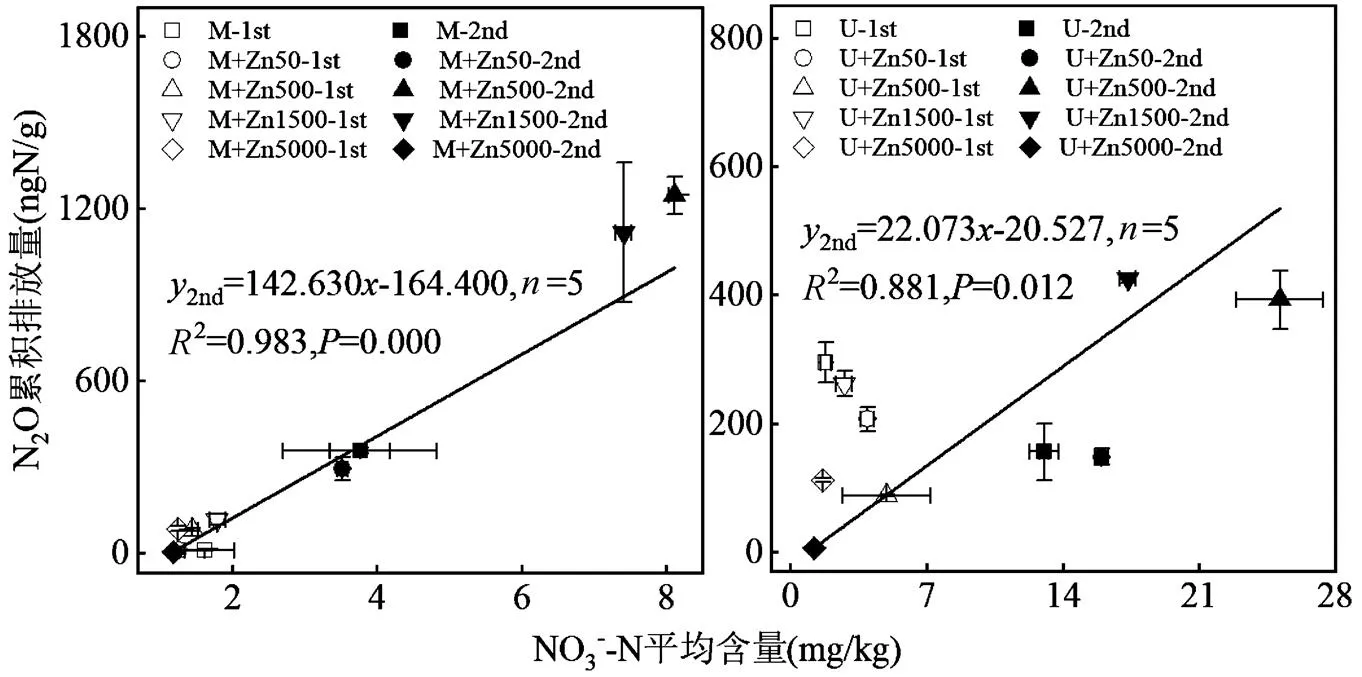
图4 不同肥源及不同Zn含量条件下土壤NO3--N含量对N2O阶段累积量的影响
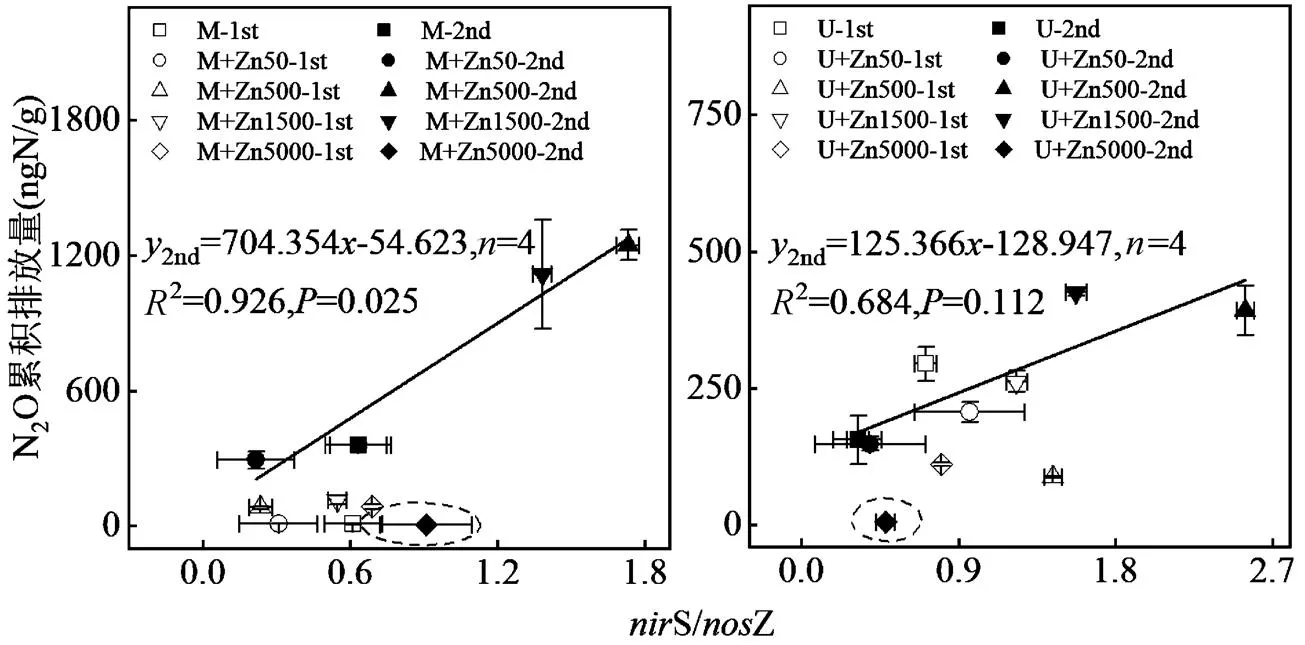
图5 不同肥源及不同Zn含量条件下nirS/nosZ对N2O阶段累积量的影响
虚线圆圈内的点未参与拟合
3 讨论
向土壤中添加肥源后,猪粪有机质发生氨化作用,尿素水解为NH4+,不同肥源条件下添加Zn均提高了土壤NH4+-N含量(图3).Khan等[19]发现Zn增加了土壤矿质氮含量(Zn为220~900mg/kg),魏义长等[20]也发现添加锌肥的水稻土中NH4+-N含量高于施用无Zn肥料对照.本研究发现培养第5d,尿素为肥源时添加Zn使K、S和Z丰度分别降低9%~68%、5%~54%和15%~62%且Zn水平越高作用越强(U的K、S和Z丰度分别为2.1×107、6.3×107和5.5×107copies/g);而50、500和1500mg/kg处理的氨氧化功能基因丰度(AOBA与AOAA之和)为U的1.07、1.92和1.52倍(U为1.25×107copies/g),5000mg/kg处理为U的45%.这表明培养前期Zn使部分微生物死亡,微生物残体有机氮可能被矿化为NH4+-N,增加了氨氧化过程底物含量,从而提高了氨氧化微生物活性,5000mg/kg处理的氨氧化活性降低可能是因过高含量的Zn对氨氧化微生物也有较强的毒害作用.猪粪为肥源处理的硝化和反硝化过程功能基因丰度未呈现与之相似的规律,可能是因为猪粪中丰富的有机质为Zn提供了更多吸附结合位点,进一步降低了Zn对微生物的毒性[21],且添加猪粪引入的微生物改变了土壤微生物群落结构[22].因此本研究中NH4+-N含量升高可能是因为土壤中不同微生物对Zn的耐受性存在差异,部分微生物死亡后其残体提供易分解氮源转化形成NH4+-N.Bogomolov等[23]研究也发现向土壤添加铜800mg/kg使土壤净氮矿化量显著增加,其机制为铜的毒性作用使微生物细胞释放有机氮,导致土壤中溶解态有机氮快速增加并大量转化为NH4+-N.对于NO3--N,其含量在第2次添加肥料阶段才表现出处理间差异,除Zn为5000mg/kg处理外其它处理NO3--N含量明显增加(图4).从基因丰度来看,不同含量Zn对AOBA和AOAA 基因丰度的影响不同(原始数据未列出),两种肥源条件下500和1500mg/kg表现为增加效应,表明NH4+-N转化为NO3--N的过程受到促进,而5000mg/kg基本表现为降低效应,表明Zn为5000mg/kg时阻碍了NH4+-N向NO3--N的转化.进一步计算第2次添加肥料阶段所有处理硝化和反硝化过程主要功能基因AOBA和S相对于同肥源对照处理的强度,并计算两基因相对强度的比值,发现两种肥源条件下50、500和1500mg/kg处理的比值均大于1,表明NO3--N生成强度大于消耗强度,而5000mg/kg处理的比值远小于1,这与各处理NO3--N含量变化相一致.但本研究仅测定NH4+-N和NO3--N转化过程中部分微生物功能基因的丰度,500和1500mg/kg提高NO3--N含量是否还与该过程其它功能微生物活性变化相关,还有待进一步研究.
在第1次添加肥料阶段,培养前5d两种肥源条件下N2O排放速率均出现峰值(图1),可能是由微生物残体有机氮转化产生的,猪粪处理的N2O排放也可能部分来源于猪粪所含的无机氮.淹水条件下随着尿素的缓慢水解[24],以尿素为肥源的处理在培养第15d左右再次出现N2O排放峰值,但添加Zn抑制了N2O排放(图1).Va´squez-Murrieta等[6]也发现土壤最大持水条件下反硝化过程N2O产生速率与Zn全量(81~4218mg/kg)呈显著负相关.而猪粪中部分有机氮以微生物难直接利用的形式存在,需要经过较长时间才能被分解,因此N2O排放速率保持较低水平,可能无法充分体现出Zn的作用,故在第1次添加肥料阶段Zn对N2O累积排放量的作用在两种肥源处理中呈现差异.
培养第52d再次施入尿素后,以尿素为肥源时Zn为50、500和1500mg/kg的处理N2O排放速率恢复,阶段累积量与对照持平或者高于对照(表2),表明在一定含量范围内Zn对N2O排放的抑制效应并不具有持久性.Ruyters等[7]向土壤中添加ZnCl2(Zn总量达220~5000mg/kg)进行盆栽实验,发现Zn强烈抑制了反硝化微生物群落功能,12个月后加Zn土壤的反硝化功能均恢复至对照水平,且添加有机物可加速反硝化菌群对Zn的适应.De Brouwere等[25]也在室内模拟实验中观察到高Zn污染(1600mg/kg)土壤的反硝化功能在2个月后逐渐恢复的现象.这可能是因为有效态Zn含量逐步降低(图2),毒性作用减弱,同时细菌在逆环境中通过各种抗性系统发挥较强的抵抗能力,适应了Zn污染[26].
第2次添加肥料阶段,添加Zn为500和1500mg/kg处理的N2O累积量显著高于同种肥源对照.可能是因为该水平Zn使NO3--N含量大幅增加(图4).通常认为,土壤水分决定了硝化过程和反硝化过程作为N2O来源的优势度.淹水2cm培养条件下,培养时间越长反硝化作用越强[27],且反硝化强度在很大程度上受NO3--N含量影响[28].路俊玲等[29]也发现NO3--N含量升高对N2O排放有促进作用.因此,此阶段N2O排放可能主要来源于反硝化过程,500和1500mg/kg处理的反硝化底物含量较高,同时该水平Zn还提高了S(控制N2O产生)与Z(控制N2O还原)基因的比值(图5),故N2O排放增加.此外,同等Zn水平下猪粪处理的N2O累积量约为尿素为肥源处理的2倍(表2),Meng等[30]研究也发现有机肥处理的N2O排放量高于无机肥.这可能是因为施用有机肥提高了土壤碳氮比,改变了土壤反硝化细菌群落结构,显著加快了反硝化速率[23,31].此外,添加猪粪提高了土壤有效碳含量,使得微生物生物量增加,进而促进微生物对NH4+和NO3-的利用,以此促进反硝化作用[32],造成N2O累积量在两种肥源条件下呈现差异.同种肥源条件下,均是5000mg/kg的处理N2O累积量最低(表2).Zhao等[33]研究也发现堆肥中高含量Zn(>2000mg/kg)降低了N2O累积排放量,且排放量与Zn含量成反比.在培养后期5000mg/kg处理的AOBA丰度显著低于同肥源对照,仅是对照的0.3~6%,说明该水平Zn对氨氧化微生物产生强烈的毒害作用,导致NH4+-N大量累积在土壤中无法进一步转化为NO3--N(图4,图5),继而导致该培养条件下几乎无N2O排放.
总之,本研究条件下一定含量的Zn进入农田土壤可促进N2O排放,且在以猪粪为肥源条件下促进作用更强.我国毗邻矿区、工业区或位于污水灌溉区的农田土壤中Zn平均含量在634.37mg/kg左右[12],此类农田土壤有N2O增排的可能,需加强对农田土壤重金属输入的管控.但实际污染农田处于开放环境,对N2O排放过程产生影响的因素更为复杂,Zn的效应可能与本研究有所不同,因此还需进行田间长期定位实验进一步判定其环境效应.
4 结论
4.1 不同肥源条件下,Zn对N2O排放的短期效应不同.猪粪为肥源时50mg/kg对N2O排放无影响,其它水平的Zn均有促进作用,而尿素为肥源时不同含量的Zn均有抑制作用.
4.2 不同肥源条件下,Zn对N2O排放的长期效应相似,即50mg/kg对N2O排放无影响,500和1500mg/kg有促进作用,且猪粪为肥源时促进作用更强,而5000mg/kg有抑制作用.
4.3 就长期效应而言,500和1500mg/kg促进N2O排放的机制为该水平Zn增加了土壤NH4+-N和NO3--N含量,提高了反硝化过程S与Z的相对丰度.5000mg/kg抑制N2O排放的机制为该水平Zn阻碍了NH4+-N转化为NO3--N的过程.
[1] Hu H W,Chen D,He J Z. Microbial regulation of terrestrial nitrous oxide formation: Understanding the biological pathways for prediction of emission rates [J]. FEMS Microbiology Reviews,2015,39(5):729- 749.
[2] Yang Y D,Nie J W,Wang S,et al. Differentiated responses ofS- andK-type denitrifiers to 30years of combined inorganic and organic fertilization in a paddy soil [J]. Archives of Agronomy and Soil Science,2021,67(1):79-92.
[3] Philippot L,Hallin S,Schloter M. Ecology of denitrifying prokaryotes in agricultural soil [J]. Advances in Agronomy,2007,96:249-305.
[4] Mundepi A,Cabrera M,Norton J,et al. Ammonia oxidizers as biological health indicators of elevated Zn and Cu in poultry litter amended soil [J]. Water Air and Soil Pollution,2019,230(10):239.
[5] Radniecki T S,Ely R L. Zinc chloride inhibition of[J]. Biotechnology and Bioengineering,2008,99(5):1085- 1095.
[6] Vásquez-Murrieta M S,Cruz-Mondragón C,Trujillo-Tapia N,et al. Nitrous oxide production of heavy metal contaminated soil [J]. Soil Biology & Biochemistry,2006,38(5):931-940.
[7] Ruyters S,Mertens J,T’Seyen I,et al. Dynamics of the nitrous oxide reducing community during adaptation to Zn stress in soil [J]. Soil Biology & Biochemistry,2010,42(9):1581-1587.
[8] Yin S X,Yang L Z,Yin B,et al. Nitrification and denitrification activities of zinc-treated soils worked by the earthwormsp. [J]. Biology and Fertility of Soils,2003,38(3):176-180.
[9] 李 平,郎 漫,李煜姗,等.施用猪粪条件下重金属对土壤氮素净转化的影响[J]. 土壤通报,2017,48(2):467-473.
Li P,Lang M,Li Y S,et al. Effects of heavy metals on net nitrogen transformation in soil with pig manure applied [J]. Chinese Journal of Soil Science, 2017,48(2):467-473.
[10] Sun Y M,Li H,Guo G L,et al. Soil contamination in China: current priorities,defining background levels and standards for heavy metals [J]. Journal of Environmental Management,2019,251:109512.
[11] Peng H,Chen Y L,Weng L P,et al. Comparisons of heavy metal input inventory in agricultural soils in north and south China: a review [J]. Science of the Total Environment,2019,660:776-786.
[12] Li X Y,Zhou Y Z,Zhang J R. Status and associated human health risk of zinc accumulation in agricultural soils across China [J]. Process Safety and Environmental Protection,2021,146:867-876.
[13] Guo G C,Yuan T,Wang W W,et al. Effect of aging on bioavailability of copper on the fluvo aquic soil [J]. International Journal of Environmental Science and Technology,2011,8(4):715-722.
[14] Tourna M,Freitag T E,Nicol G W,et al. Growth,activity and temperature responses of ammonia-oxidizing archaea and bacteria in soil microcosms [J]. Environmental Microbiology,2008,10(5):1357- 1364.
[15] Stephen J R,Chang Y J,Macnaughton S J,et al. Effect of toxic metals on indigenous soil β-subgroup proteobacterium ammonia oxidizer community structure and protection against toxicity by inoculated metal-resistant bacteria [J]. Applied and Environmental Microbiology,1999,65(1):95-101.
[16] Henry S,Baudoin E,López-Gutiérrez J C,et al. Quantification of denitrifying bacteria in soils byK gene targeted real-time PCR [J]. Journal of Microbiological Methods,2004,59(3):327-335.
[17] Braker G,Fesefeldt A,Witzel K P. Development of PCR primer systems for amplification of nitrite reductase genes (K andS) to detect denitrifying bacteria in environmental samples [J]. Applied and Environmental Microbiology,1998,64(10):3769-3775.
[18] Scala D J,Kerkhof L J. Nitrous oxide reductase (Z) gene-specific PCR primers for detection of denitrifiers and threeZ genes from marine sediments [J]. FEMS Microbiology Letters,1998,162(1):61- 68.
[19] Khan M,Scullion J. Effects of metal (Cd,Cu,Ni,Pb or Zn) enrichment of sewage-sludge on soil micro-organisms and their activities [J]. Applied Soil Ecology,2002,20(2):145-155.
[20] 魏义长,白由路,杨俐苹,等.测土推荐施锌对水稻产量结构及土壤有效养分的影响[J]. 中国水稻科学,2007,21(2):197-202.
Wei Y C,Bai Y L,Yang L P,et al. Effects of recommended zinc application according to soil testing on yield components of rice and soil available nutrients [J]. Chinese Journal of Rice Science,2007,21(2):197-202.
[21] 周国华.土壤重金属生物有效性研究进展[J]. 物探与化探,2014,38(6):1097-1106.
Zhou G H. Recent progress in the study of heavy metal bioavailability in soil [J]. Geophysical and Geochemical Exploration,2014,38(6): 1097-1106.
[22] Wolsing M,Priemé A. Observation of high seasonal variation in community structure of denitrifying bacteria in arable soil receiving artificial fertilizer and cattle manure by determining T-RFLP ofgene fragments [J]. FEMS Microbiology Ecology,2004,48(2):261- 271.
[23] Bogomolov D M,Chen S K,Parmelee R W,et al. An ecosystem approach to soil toxicity testing: a study of copper contamination in laboratory soil microcosms [J]. Applied Soil Ecology,1996,4(2):95- 105.
[24] Saraswathi P,Balachandran P V. Inhibition of urea hydrolysis in flooded soils and its significance in the molecular absorption of urea by rice [J]. Soil Biology & Biochemistry,1991,23(2):125-129.
[25] De Brouwere K,Hertigers S,Smolders E. Zinc toxicity on N2O reduction declines with time in laboratory spiked soils and is undetectable in field contaminated soils [J]. Soil Biology & Biochemistry,2007,39(12):3167-3176.
[26] Bruins M R,Kapil S,Oehme F W. Microbial resistance to metals in the environment [J]. Ecotoxicology and Environmental Safety,2000,45(3):198-207.
[27] Yang Y J,Zhang H P,Shan Y H,et al. Response of denitrification in paddy soils with different nitrification rates to soil moisture and glucose addition [J]. Science of the Total Environment,2019,651: 2097-2104.
[28] Lin Y X,Ding W X,Liu D Y,et al. Wheat straw-derived biochar amendment stimulated N2O emissions from rice paddy soils by regulating theA genes of ammonia-oxidizing bacteria [J]. Soil Biology & Biochemistry,2017,113:89-98.
[29] 路俊玲,陈慧萍,肖 琳.温度和氨氮浓度对水体N2O释放的影响 [J]. 中国环境科学,2019,39(1):330-335.
Lu J L,Chen H P,Xiao L. Coupling effect of temperature and ammonia on N2O emission in surface water [J]. China Environmental Science,2019,39(1):330-335.
[30] Meng L,Ding W X,Cai Z C. Long-term application of organic manure and nitrogen fertilizer on N2O emissions,soil quality and crop production in a sandy loam soil [J]. Soil Biology & Biochemistry,2005,37(11):2037-2045.
[31] 沈仕洲,王 风,薛长亮,等.施用有机肥对农田温室气体排放影响研究进展[J]. 中国土壤与肥料,2015(6):1-8.
Shen S Z,Wang F,Xue C L,et al. Research advances on effect of organic fertilizer on farmland greenhouse gas emissions [J]. Soil and Fertilizer Sciences in China,2015,(6):1-8.
[32] Wang J,Cheng Y,Jiang Y J,et al. Effects of 14years of repeated pig manure application on gross nitrogen transformation in an upland red soil in China [J]. Plant and Soil,2017,415(1/2):161-173.
[33] Zhao J C,Sun X N,Awasthi M K,et al. Performance evaluation of gaseous emissions and Zn speciation during Zn-rich antibiotic manufacturing wastes and pig manure composting [J]. Bioresource Technology,2018,267:688-695.
Effects and mechanisms of Zinc on nitrous oxide emissions from farmland soil under different fertilization conditions.
ZHOU Jin-rong,ZHANG Ting,FENG Lian-jie,JIANG Jing-yan*
(College of Resources and Environmental Sciences,Nanjing Agricultural University,Nanjing 210095,China).,2022,42(8):3931~3939
To understand effects and mechanisms of different Zinc (Zn) application rates (0,50,500,1500 and 5000mg/kg) on nitrous oxide (N2O) emissions from farmland soils under different nitrogen fertilizers (manure and urea),an 80-day simulating incubation experiment was conducted,and urea was added again to all treatments on the day 52 of incubation to explore its long-term effects. The results showed that Zn addition significantly reduced N2O emissions in urea-fertilized soil while enhanced N2O emissions in manure-amended soil in the first fertilization stage (<0.05) except for the experiment of 50mg/kg Zn with manure which had no significant effect on N2O emissions (>0.05). In the second fertilization stage,the effects of Zn on N2O emissions were consistent under different nitrogen fertilizers: 50mg/kg Zn had no significant effects (>0.05),500 and 1500mg/kg Zn significantly promoted N2O emissions,while 5000mg/kg Zn had the opposite effect (<0.05). At this stage,the ratios of cumulative N2O emissions from the 500,1500 and 5000mg/kg treatments to the corresponding control were 3.49,3.13,0.01 for manure treatments and 2.53,2.74,0.04 for urea treatment,respectively,indicating that the effect of Zn was much stronger in manure-amended treatments. The promotion mechanism of 500 and 1500mg/kg Zn could be the Zn-induced increase in the soil NH4+-N and NO3--N contents as well as the abundance ratio ofS toZ,and its control on the genes that are responsible for N2O production and reduction in the denitrification process. Moreover,the 5000mg/kg Zn might impede the transformation progress of NH4+-N to NO3--N in soil,thus reduced N2O emissions.
farmland;soil;Zn;swine manure;urea;N2O emission
X53
A
1000-6923(2022)08-3931-09
2022-01-03
国家自然科学基金资助项目(41675148)
* 责任作者,副教授,lilacjjy@njau.edu.cn
周金蓉(1997-),女,四川通江人,南京农业大学硕士研究生,主要研究方向为环境污染与全球变化.

