生物-化学法合成黑色素前体5,6-二羟基吲哚
金睿明,穆晓清,徐 岩
(1.江南大学生物工程学院酿造微生物学与应用酶学研究室,无锡 214122;2.江南大学产业技术研究院,宿迁 223800)
对苯二胺及其衍生物是染发剂中最常见和最有效的成分[1],但对苯二胺具有致癌致畸等不良作用,对人体健康具有潜在危害[2]. 5,6-二羟基吲哚(5,6-Dihydroxyindole,DHI)的染发机理与对苯二胺相同,可深入毛髓内部,染色明显且不易掉色[3],同时还具有低毒高效等优点. 因此,开发基于DHI的新型绿色安全染发剂已成为取代苯胺类染发剂的发展趋势[4].
DHI的工业合成大多采用苯乙腈、苯乙胺及苯甲醛等为原料通过化学方法合成. 苯乙腈法反应步骤多,涉及去甲基、羟基化、硝化及还原等多步反应,且反应需在110 ℃以上,条件苛刻[5];而苯乙胺法原料价格高,收率仅为10%[6];苯甲醛法原料毒性大,环境污染严重[7]. 因此,绿色高效合成DHI 极具挑战性.
科研人员在研究生物体内黑色素代谢过程中发现,DHI是黑色素代谢的重要中间体[8,9]. 在生物体内,酪氨酸或L-多巴(L-3,4-dihydroxyphenylalanine,L-Dopa)被酪氨酸酶(Tyrosinase,TYR)氧化为多巴醌(Dopaquinone,DQ),极不稳定的DQ 经过非酶促环化快速生成环多巴(Cyclodopa)和多巴色素(Dopachrome,DC)[10,11],DC自发发生重排脱羧反应生成DHI[12]. DHI经过酶促或非酶促氧化快速形成吲哚5,6-醌(Indole-5,6-quinone,IQ),并最终通过聚合作用形成大分子黑色素,这种生物体内的黑色素合成途径被称为Raper-Mason 途径(Scheme 1)[13]. 目前,利用酪氨酸酶合成黑色素的研究较为广泛[14~16]. 但由于生物体内TYR 和氧的存在,不仅有利于底物酪氨酸和L-Dopa 合成DC,促进DHI 的合成,同时生物催化剂和氧也会显著促进DHI 的氧化和聚合,导致DHI 在生物体细胞内无法实现积累,目前利用TYR合成DHI的研究报道较少.
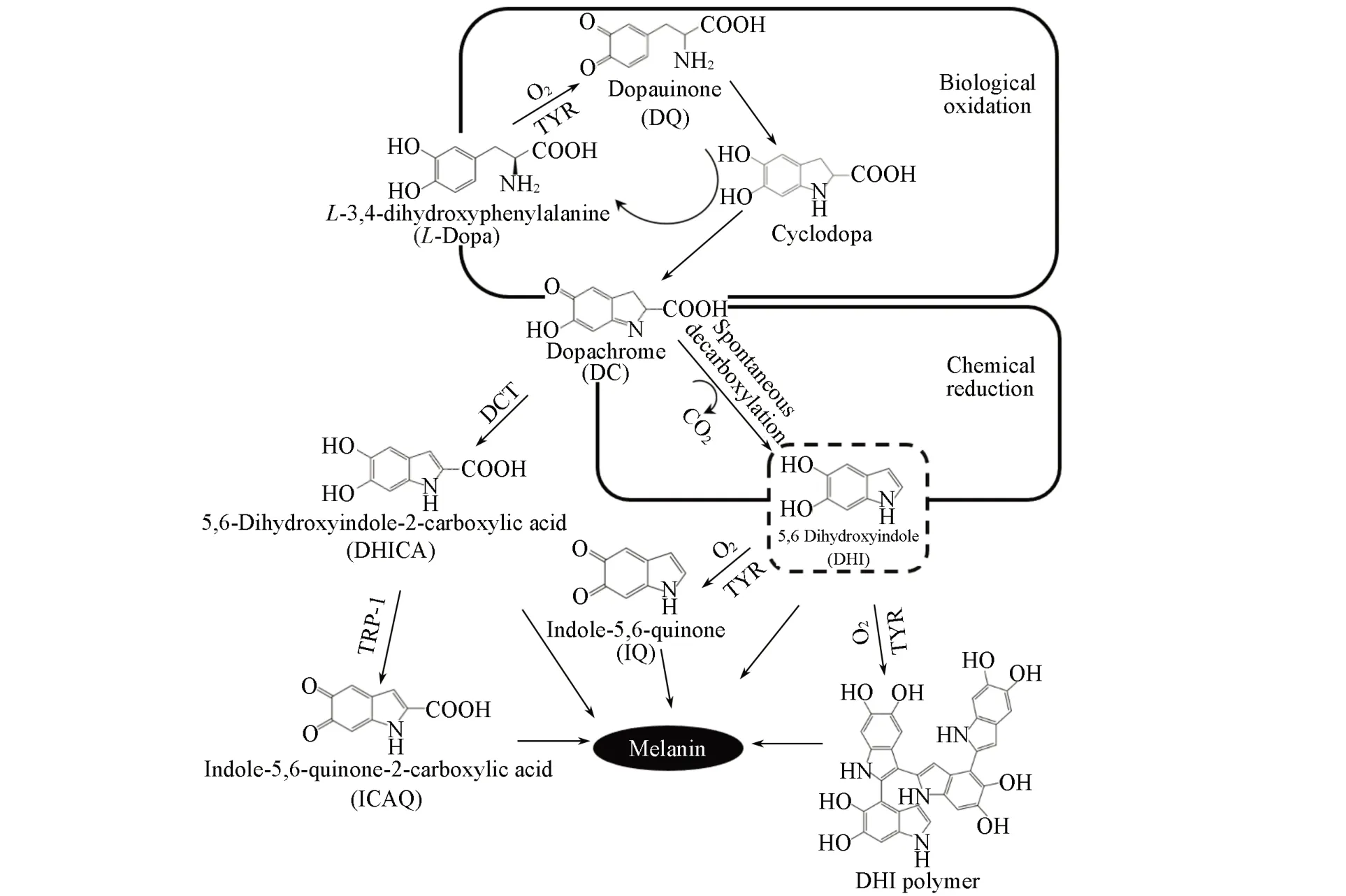
Scheme 1 Bio⁃chemical synthesis DHI in the Raper⁃Mason pathway
对Raper-Mason途径关键反应动力学及其影响因素的研究显示,生物途径合成并积累DHI需要解决底物高效转化合成DHI及避免DHI的氧化聚合两个关键问题. 研究表明,TYR及氧的存在有利于底物L-Dopa 氧化合成中间产物DC,但DHI 酶促聚合与自发聚合反应在速率上存在数量级差异[17],有氧条件有利于DHI的氧化聚合[18],因此分阶段控制生物催化剂的存在及环境溶解氧浓度是积累DHI的重要影响因子. DHI聚合反应的化学自发性导致反应时间也成为影响DHI积累的限制因子[19].
针对以上限制因素,本文采用全细胞催化的方式实现了不同步骤间生物催化剂的快速去除. 利用N2气实现环境溶解氧浓度的控制,分别构建了高溶氧条件下重组酪氨酸酶催化的L-Dopa合成DC生物氧化步骤,以及去除酪氨酸酶限制溶解氧条件下DC合成DHI的化学还原步骤. 通过优化反应过程,提高了底物转化率,减少了DHI 的自发聚合,实现了DHI 的有效积累,建立了DHI 合成的生物-化学途径[20],为工业化生产奠定了基础.
1 实验部分
1.1 试剂与仪器
重组表达菌株S.cerevisiaeBY4741/pYX212-TYR由本实验室构建并保藏;葡萄糖、三羟甲基氨基甲烷(Tris)及咪唑,分析纯,上海生工生物工程技术有限公司;氨苄青霉素及sgDNA,上海索莱宝生物科技有限公司;质粒提取试剂盒、PCR 产物纯化和胶回收试剂盒,美国Omega 公司;DNA Marker,蛋白Marker,限制性内切酶Xho I,EcoR I和Prime STAR,日本Takara 公司;ClonExpress ⅡOne Step Cloning Kit,南京Vazyme公司;引物合成和质粒测序由无锡天霖生物科技有限公司完成;甲醇,色谱纯,上海麦克林生化科技有限公司.
C1000 Touch 型双48 孔梯度PCR 仪(PCR),美国BIO-RAD 公司;VCX750 型超声细胞破碎仪(Ultrasonic Cell Disrupter System),美国Sonic公司;Cytation3型酶标仪(Microplate Reader),美国Bio Tek公司;MALDI SYNAPT MS 型超高效液相色谱串联四极杆飞行时间质谱联用仪(LC-MS),美国Waters公司;1260 Infinity Ⅱ型高效液相色谱仪(HPLC),美国Agilent公司;Star A型台式溶解氧测量仪(DO),美国Thermo Fisher 公司;A380 UV-1800 型紫外-可见光分光光度计(UV-Vis),翱艺仪器(上海)有限公司.
1.2 实验过程
1.2.1 酪氨酸酶的异源表达 通过EcoR I,Xho I限制性内切酶双酶切构建质粒pYX212-TYR,并将质粒转化进E. coliJM109进行扩增,平板划线于含50 μg/mL氨苄青霉素的LB固体培养基中,于37 ℃培养12 h,获得阳性转化子,测序并验证目的条带;提取质粒. 采用醋酸锂转化法[21]转化进S. cerevisiaeBY4741,涂布于省却培养基(SD)平板中,于30 ℃静置3 d,待长出阳性转化子,将阳性转化子接种于50 mL SD液体培养基中,于30 ℃以200 r/min的转速振荡培养15 h后,转接于500 mL相同的培养基中在相同条件下培养12 h,以8000 r/min的转速离心20 min,收集菌体,待活化.
1.2.2 酪氨酸酶的活化 取适量收集后的菌体,称重,悬浮于10 倍体积的2 mmol/L CuSO4的Tris-HCl溶液中(Tris-HCl的配制:将50 mL 0.1 mol/L Tris 和29.2 mL 0.1 mol/L盐酸加水稀释至100 mL,浓度为50 mmol/L,pH=8.0),于30 ℃静置1 h,使Cu2+充分配位[22,23],期间不断混匀;以8000 r/min的转速离心10 min,收集菌体备用. 用0.1 mol/L EDTA-2Na 重新悬浮菌体,以除去多余的Cu2+,以8000 r/min 的转速离心10 min,收集菌体,备用. 用pH=3.6的醋酸-醋酸钠缓冲重新悬浮菌体[24,25],于30 ℃静置1 h后以8000 r/min的转速离心10 min,收集菌体,并用去离子水清洗.
1.2.3 酶活力测定 取100 mg活化后的S. cerevisiaeBY4741/pYX212-TYR,在30 ℃下使细胞与1 mL含有0.8 μmolL-Dopa的水溶液反应5 min. 酶活单位定义为:在测定条件下,每分钟引起OD475增加0.001个单位为1 U[26~28].
1.2.4 分析方法 用HPLC分析L-Dopa和DHI. Diomansil C18色谱柱(250 mm×4.6 mm),进样量10 μL,流速1 mL/min;检测波长:L-Dopa 280 nm,DHI 300 nm;柱温20 ℃;流动相A 为1.5%磷酸,流动相B为100%甲醇;0 min:V(A)/V(B)=95/5;5 min:V(A)/V(B)=50/50;6~10 min:V(A)/V(B)=50/50;11 min:V(A)/V(B)=50/50;15 min:V(A)/V(B)=95/5.L-Dopa 出峰时间为6.29 min,DHI 出峰时间为8.69 min.
检测DC在475 nm的极大吸收值. 采用稀释测定的方法,通过稀释将样品的OD475限制在0.2~1.0之间,最终读数为稀释倍数与直接测定值的乘积.
采用LC/MS 分析DHI 低聚物. Zorbax Stable Bond C18色谱柱(150 mm×2.1 mm,3.5 μm);流动相A:V(H2O)/V(MeOH)=95/5,含25 mmol/L NH4OAc;B:V(MeOH)/V(H2O)=95/5,含25 mmol/L NH4OAc;1~10 min:100%A,然后在20 min 内逐渐升至100%B. 流速0.3 mL/min. MS 参数:毛细管电压3.5 V,雾化器气体:45 psi,干燥气体9 L/min.
2 结果与讨论
2.1 TYR的异源表达与酶活测定
TYR(EC 1.14.18.1)是黑色素生物合成途径的关键酶[29],基于丝状菌酪氨酸酶在宿主细胞内的高稳定性与安全性[30],本文选择用源于Aspergillus oryzae的酪氨酸酶基因(BAA07149.1)在酿酒酵母S288C 衍生体BY4741 中进行异源表达. 以穿梭质粒pYX212 为载体,获得了TYR 异源表达菌株S. cerevisiaeBY4741/pYX212-TYR,实现了TYR的可溶性表达.
L-Dopa在TYR的作用下氧化生成DQ,DQ具有极高的反应活性,会快速自发环化生成DC. 由于在反应死时间内难以检测到DQ 的生成[17],Falguera等[16]通过测定相对稳定的DC 来表征TYR 的活力.在酶促条件下,DC 还原并形成DH 的动力学常数K达到5.19×10-2min-1[17],DC在生物体内极不稳定,因此利用液相色谱等分析方法很难对DC 合成途径进行检测. 由于DC 是黑色素代谢的中间产物,且DC在全波长范围内在475 nm 处有极大吸收峰,因此研究人员大多采用OD475对中间产物DC进行检测[31~34].本文考察了细胞S. cerevisiaeBY4741/pYX212-TYR催化L-Dopa 的酶活,反应液呈现红色,并随时间变化而加深. 对反应液的300~600 nm全波长扫描显示DC 在475 nm 处具有极大吸收峰,并随时间而增强.因此,利用OD475值可以表征DC的生成[35]. 重组细胞S. cerevisiaeBY4741/pYX212-TYR 对L-Dopa 的 活 力达到8 U/mg(图1).
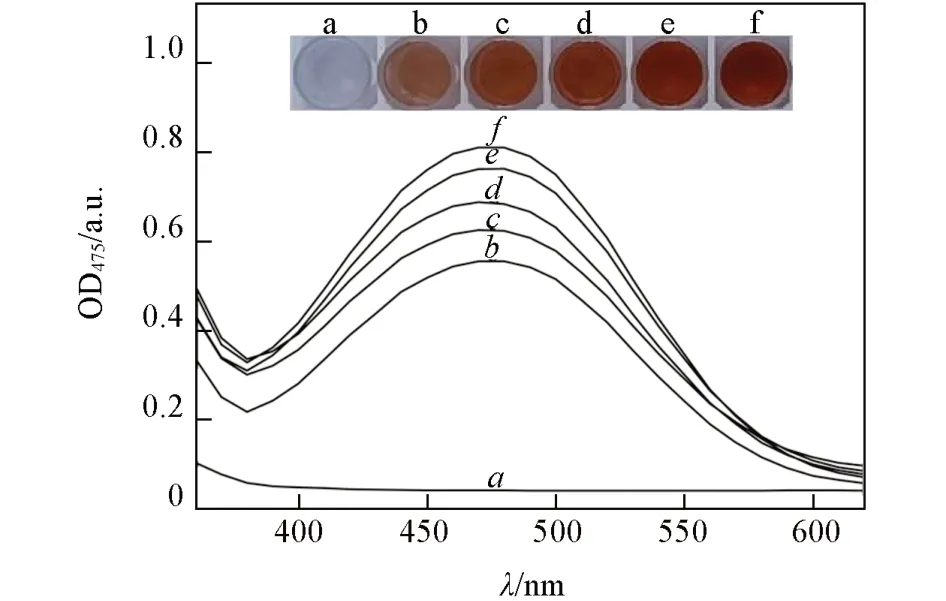
Fig.1 Full wavelength spectral analysis(a—f) and opticle images(a—f)of reaction mixture cata⁃lyzed by TYR at 0(a, a),1(b, b),2(c, c),3(d,d),4(e,e)and 5 min(f,f),respectively
2.2 反应条件对S.cerevisiae BY4741/pYX212⁃TYR催化L-Dopa氧化合成DC的影响
催化剂浓度、反应温度和反应pH值是影响S. cerevisiaeBY4741/pYX212-TYR氧化L-Dopa的重要因素[36],本文分别探究了这些因素的影响. 图2结果表明,OD475值随着细胞浓度的升高而增加,当细胞浓度超过50 g/L后,OD475值基本保持不变,因此选择细胞浓度为50 g/L. 温度对氧化反应效率的影响研究表明,S. cerevisiaeBY4741/pYX212-TYR 在最适反应温度35 ℃时,OD475值达到最大值0.862. pH 值对氧化反应效率的影响大,在最适反应pH=6.0时,OD475最大值提高至3.087. 通过对以上3个因素的优化,反应效率提高了327%.

Fig.2 Optimization of the reaction conditions of oxidation reaction catalyzed by TYR(A)Effect of cell concentration;a.10 g/L;b.30 g/L;c.50 g/L;d.70 g/L;e.90 g/L;(B)effect of temperature;(C)effect of pH value.Reaction condition:10 mmol/L L-Dopa;(A)30 ℃,pH=4.0;(B)pH=4.0,50 g/L;(C)35 ℃,50 g/L
2.3 底物浓度对S.cerevisiae BY4741/pYX212⁃TYR催化L-Dopa氧化合成DC的影响
TYR催化分子氧与L-Dopa氧化生成DC是典型的双底物反应[37],且TYR具有“自杀失活”特性,即TYR都会经历其生理底物L-Dopa诱导的不可逆失活的过程[38,39],因此底物浓度会对反应效率产生影响. 图3 结果表明,虽然随着L-Dopa 浓度的增加,OD475值增高,但底物利用效率显著下降. 较低的转化率会导致体系中大量L-Dopa 残余,不仅增加反应成本,同时也不利于下游DHI 的分离纯化. 综合考虑DC 生成与L-Dopa 转化率,确定3 mmol/L 为最佳底物浓度. 在此浓度下,OD475值达到2.181,L-Dopa的转化率为84.93%,较初始浓度为10 mmol/L 时的转化率提高209%.
分子氧是L-Dopa 氧化反应的底物,厌氧条件会抑制TYR活性[40],因此反应体系中溶解氧的浓度会对氧化反应效率产生影响. 研究发现,S. cerevisiaeBY4741/pYX212-TYR催化L-Dopa氧化反应前期溶解氧浓度急剧下降,1 min内反应体系溶解氧从11.7下降到2(图4),维持一段时间后,缓慢回升. 通过对反应体系进行通氧处理,可使溶解氧浓度维持在较高水平,OD475生成速率提高141%. 在有氧条件下,L-Dopa氧化反应产物DC在12 min时OD475值达到5.146,底物L-Dopa转化率提高到94.75%.
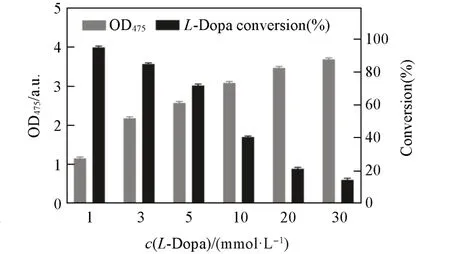
Fig.3 Optimization of the L⁃Dopa concentration of oxidation reaction catalyzed by TYRReaction conditions:35 ℃,pH=6.0,50 g/L S. cerevisiaeBY4741/pYX212-TYR.
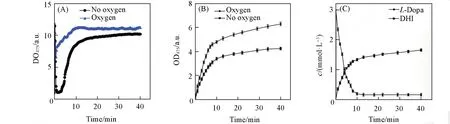
Fig.4 Optimization of the DO of oxidation reaction catalyzed by TYR(A)Effect of oxygen on dissolved oxygen;(B)effect of oxygen on OD475;(C)time course under oxygen conditions.Reaction conditions:35 ℃,pH=6.0,50 g/L S. cerevisiaeBY4741/pYX212-TYR,3 mmol/L L-Dopa.
2.4 反应条件对多巴色素DC化学还原生成DHI的影响

Fig.5 Optimization of the reaction conditions of chemical reduction(A)Effect of temperature;(B)effect of pH value.Reaction conditions:(A)pH=6.0;(B)20 ℃.
为了实现DHI的高浓度积累,在DC还原反应过程中必须去除催化剂和氧对DHI氧化聚合的促进作用. 实验中在完成TYR催化氧化步骤后,通过离心方式去除催化剂,同时通入N2气保护消除DC还原反应体系中的氧. 在此基础上,分别考察了不同温度和pH值对DC还原反应的影响. 图5结果表明,高温虽然有利于OD475值的下降,但同时也对DHI 的聚合产生促进作用,根据DHI 的积累浓度选择20 ℃为反应温度;低pH 条件降低了氧化还原电位[41],有效抑制了体系中的氧化作用,在pH=3.0 时,OD475转化率达到最高值,同时DHI积累浓度也最大.
2.5 化学助剂对多巴色素DC化学还原生成DHI的影响
化学助剂能够促进DC向DHI转变,主要包括水溶性有机溶剂(特别是醇类)及抗氧化剂[42,43]. 本研究考察了不同体积分数的乙醇及不同浓度抗坏血酸钠对DC化学还原生成DHI的影响. 化学还原反应1 h后,用体积分数50%的乙醇处理,DHI产率从44.86%提高至75.3%(图6);用质量分数3%的抗坏血酸钠处理可将DHI产率提高到79.4%. 通过叠加体积分数50%乙醇与质量分数3%抗坏血酸钠的协同作用,DHI产率进一步提升至90.03%.
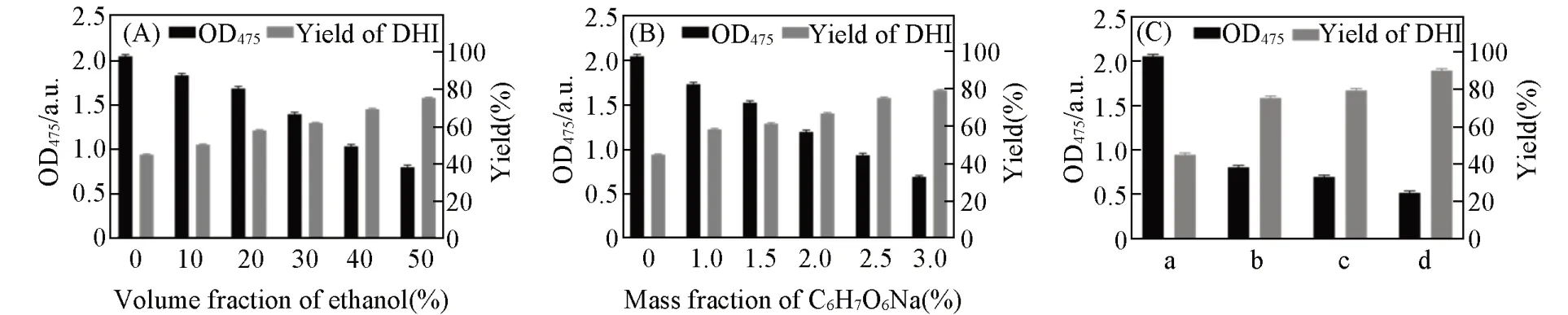
Fig.6 Optimization of reagent of chemical reductionReaction conditions:pH=3.0,20 ℃.(A)Effects of different v/v of ethanol on chemical reduction;(B)effects of different w/v of C6H7O6Na on chemical reduction;(C)the effect of combined additives on chemical reduction.(C)a. Control;b. 50%(volume fraction)Ethanol;c. 3%(mass fraction)C6H7O6Na;d. 50%(volume fraction)Ethanol+3%(mass fraction)C6H7O6Na.
2.6 反应产物的LC/MS鉴定
利用LC/MS 对反应体系中的DHI 及其聚合物进行了解析[44](图7),m/z150 为单体DHI 质子化的结果;m/z297 为二聚体DHI 质子化的结果;m/z443 为三聚体DHI 质子化的结果;m/z589 为四聚体DHI 质子化的结果;m/z736 为五聚体DHI 质子化的结果;m/z883 为六聚体DHI 质子化的结果.研究结果表明,虽然通过移除氧和催化剂等措施可以减缓DHI 氧化聚合,但DHI 在水相中依然会发生氧化聚合反应. 在后续研究中可以通过加快反应速率缩短反应时间或添加防聚剂来防止DHI聚合.

Fig.7 Average electrospray mass spectrum of the DHI reaction after chemical reduction
3 结论
构建了TYR 的异源表达菌株S. cerevisiaeBY4741/pYX212-TYR. 分别建立了S. cerevisiaeBY4741/pYX212-TYR催化L-Dopa氧化合成DC步骤和DC化学还原合成DHI步骤,实现了DHI的生物-化学合成途径. 通过优化生物氧化步骤,3 mmol/LL-Dopa在12 min内转化率达到94.75%;在去除生物催化剂和在氮气保护的基础上,对DC化学还原进行优化,通过组合添加化学助剂,DHI产率提升至90.03%. 产物LC/MS分析结果表明,反应体系中存在着DHI可溶性低聚物.

