胺类分子结构对油酸囊泡pH窗口的影响
李 磊,方 云,夏咏梅,范梦琦,樊 晔
(1.江南大学食品科学与技术国家重点实验室,2.化学与材料工程学院,合成与生物胶体教育部重点实验室,无锡 214122)
囊泡尤其是脂肪酸囊泡(FAV)对研究生命起源现象具有极其重要的理论意义[1~3],并对药物传输系统具有重要的应用价值[4]. 但脂肪酸仅在其表观pKa附近极窄的pH区间内形成脂肪酸囊泡[5],不利于理论研究和实际应用. 添加其它双亲分子与脂肪酸共组装[6]及脂肪酸化学改性[7]均可增强脂肪酸囊泡的稳定性,但外加多官能团小分子的方式更为简便. 已经发现一些碱性小分子(如胆碱[8]、核酸碱基[9]、精氨酸[10]以及赖氨酸[11]等)会影响脂肪酸囊泡,短链胺(如二乙烯三胺)会使油酸囊泡(OAV)的pH窗口向碱性拓宽[12],中长链伯胺与脂肪酸形成复合脂肪酸囊泡[13],而长链季铵盐则与脂肪酸形成所谓阴-阳离子囊泡[14,15]. 相关研究较多报道共存小分子对脂肪酸囊泡稳定性的客观影响,但尚未深入和系统地比较共存小分子结构对脂肪酸囊泡形成及稳定性的影响,以及其机理和规律. 综上所述,由于各种胺类小分子与脂肪酸及其囊泡的分子间相互作用信息尚不够明晰,因而对其作用机理有各种推测. 由于各种胺类分子结构影响脂肪酸形成脂肪酸囊泡的形貌和尺度各不相同,因而对其影响脂肪酸囊泡pH窗口的能力也尚未进行比较. 此外,发现短链多元醇的碳桥长度和羟基数目均会影响脂肪酸囊泡的形成[16],推测短链胺的碳桥长度和氨基多寡也会影响脂肪酸囊泡. 因此,本文将以油酸作为囊泡砌块,选用乙二胺等3种不同碳桥长度的二元胺,以及二乙烯三胺等3种不同氨基数目的多元胺,探究两者间相互作用对油酸囊泡pH窗口的影响,并与4种长链伯胺或季铵盐与油酸形成的共组装囊泡进行比较,以探讨胺类分子结构对油酸囊泡pH窗口的影响.
1 实验部分
1.1 试剂与仪器
油酸(OA,A. R. 级),上海阿拉丁生化科技股份有限公司;乙二胺(A. R. 级)、1,3-丙二胺(纯度≥99%)、1,4-丁二胺(A. R. 级)、二乙烯三胺(DETA,C. P. 级)、三乙烯四胺(C. P. 级)、四乙烯五胺(C. P. 级)和十二烷基三甲基溴化铵(DTAB,纯度≥99%),国药集团化学试剂有限公司;辛胺(纯度≥99%)和十二胺(DA,纯度≥98%),上海麦克林生化科技有限公司;十八胺(纯度≥96%),北京伊诺凯科技有限公司;N,N-二羟乙基甘氨酸(Bicine,纯度≥99%,Ruibio进口分装),合肥博美生物科技有限公司;其它试剂均为分析纯;实验用水均为超纯水,电阻率18.2 MΩ·cm.
FE-20型pH计,梅特勒-托利多仪器(上海)有限公司;DDSJ-308A 型电导率仪,上海仪电科学仪器股份有限公司;VHX-1000C 型超景深三维显微镜,Keyence(香港)有限公司;TU1950型双光束紫外-可见分光光度计(UV-Vis),北京普析通用仪器有限责任公司;MicroCal VP-ITC型等温滴定量热仪(ITC),英国Malvern Panalytical仪器有限公司.
1.2 油酸囊泡的pH窗口判断及形貌表征
用0.01 mol/L 的NaOH 溶液分别配制油酸(5 mmol/L)及二乙烯三胺(0.5 mmol/L)溶液,25 ℃下用0.1 mol/L 的盐酸溶液分别滴定,获得pH 滴定曲线. 用0.1 mol/L 的NaOH 溶液分别配制各种二元胺、多元胺以及长链胺系列储备液,再用其配制油酸浓度为5 mmol/L的样品分散液,参照文献[17,18]中丁达尔效应的方法判断pH窗口. 取5 μL处于上述pH窗口两端的样品分散液滴于载玻片上,用超景深三维显微镜(2500倍)观察组装体的形貌.
1.3 油酸囊泡冻融稳定性测试
用0.1 mol/L Bicine-NaOH 缓冲液(pH=8.7)配制油酸及二元胺/多元胺-油酸分散液并测定冻融性能[19],将二元胺/多元胺-油酸分散液于-18 ℃下冷冻24 h后,转移至40 ℃下静置24 h,循环3次,用超景深三维显微镜表征其形貌.
1.4 等温滴定量热测试
向样品池内注入1.4 mL 的油酸缓冲溶液(pH=8.1,4 mmol/L;pH=10.2,1 mmol/L),参比池注入同体积的超纯水,于300 r/min 转速及(25±0.1)℃条件下,采用28 滴(10 μL)自动加样滴定模式(两滴间时间间隔为240 s)加入20 mmol/L DETA 溶液. 校正实验以DETA 溶液滴定对应pH 值的缓冲液获得稀释热,各体系量热实验数据扣除相应稀释热后,得到DETA与油酸相互作用的热数据. 采用结合模型对数据进行拟合,获得相互作用的热力学参数. 向样品池内注入1.4 mL的十二胺(pH=8.7,0.43 mmol/L;pH=11.4,0.27 mmol/L)或DTAB(pH=7.5,0.6 mmol/L;pH=11.3,0.6 mmol/L)缓冲溶液,用6 mmol/L油酸溶液按上述步骤进行滴定和数据处理.
1.5 结合能的计算
采用Gaussian 16软件[20]对DETA与油酸分子/离子之间的弱相互作用进行理论计算.
2 结果与讨论
2.1 短链胺-油酸囊泡的pH窗口、形貌及稳定性
根据文献[12]报道,DETA的氨基随pH的变化在质子化与去质子化间转变,并与脂肪酸发生静电和氢键等丰富变化的相互作用. 调节氨基与脂肪酸的比例,能构筑拟双子表面活性剂结构单元,可产生丰富的形貌[21]. 而己二胺与棕榈酸形成多层大囊泡(MLV)维持其体系的稳定性[22]. 本文通过激光丁达尔效应确定二元胺/多元胺-油酸分散体系随pH变化所对应的胶束-囊泡-乳液-分相的各相区边界,其中典型的二乙烯三胺-油酸体系见图1,激光丁达尔效应随外观及pH降低而变化,由此可较为清晰地判断囊泡相边界,进而确定囊泡的pH窗口.

Fig.1 Determination of the pH window for OAV of DETA⁃OA and other phase boundaries of the suspension corresponding to pH change by aid of the laser Tyndall effect observation
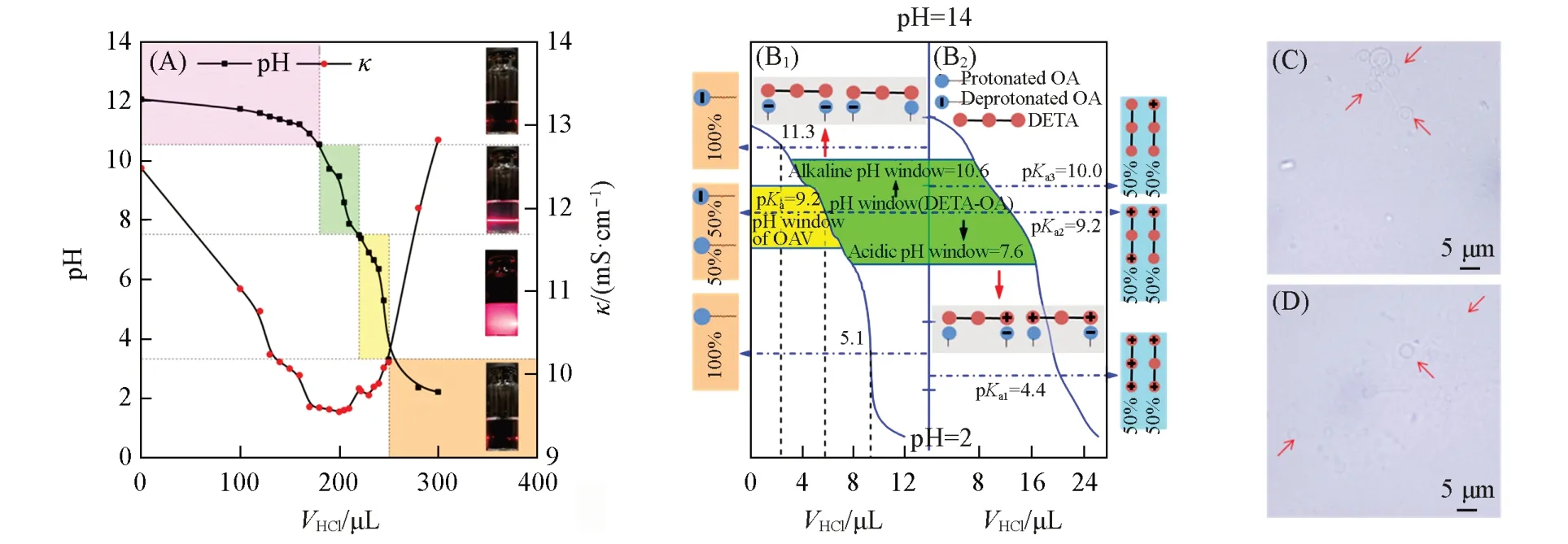
Fig.2 DETA⁃OA(molar ratio 0.1∶1.0)suspensions of pH⁃VHCl curve,conductometric(κ)⁃VHCl curve and the related laser Tyndall effects(inset)(A),correlation of the pH titration curves of sodium soap of 5 mmol/L OA(B1) and 0.5 mmol/L DETA(B2) by 0.1 mol/L HCl solution to schematically illus⁃trate molecular interactions between OA and DETA, optical micrographs of OAV on the near neutral⁃side pH window(C)and the alkaline⁃side pH window(D)corresponding to(A)at 25°C
将典型的二乙烯三胺-油酸(摩尔比0.1∶1.0)体系的相区分界标注于pH 滴定曲线上[图2(A)],图2(A)插图为图1中代表4种典型分散状态的样品瓶,表示所在的不同相区;图2(A)中电导(k)曲线的谷底与油酸囊泡相区相对应,佐证了激光丁达尔效应判断油酸囊泡pH窗口的可信性;其它5种短链胺-油酸(摩尔比0.1∶1.0)体系均有与此相似的结果(图S1,见本文支持信息),可以用于比较各种短链胺对油酸囊泡pH窗口的影响. 图2(B1)和(B2)关联了油酸钠皂和二乙烯三胺的pH滴定曲线,根据不同pH区间二乙烯三胺及油酸所对应的不同电离状态,可以分析油酸囊泡的pH窗口两端各种分子-离子间的相互作用,可见主要缘于二乙烯三胺的质子化和去质子化随pH的变化而转变,并引起与油酸间的氢键、离子-偶极相互作用及静电相互作用的变化. pH窗口碱性端主要为氢键和离子-偶极相互作用,而近中性端除此之外,还可能存在静电相互作用. 图2(C)和(D)为图2(A)中囊泡pH窗口两端的超景深三维显微镜图像,证实均存在2~5 μm 的MLV 型油酸囊泡. 其它5 种短链胺-油酸体系的类似结果见图S2(本文支持信息),其中除MLV外的少量非球形囊泡,可能为球形囊泡的融合或裂分所致,或与排水率(PRW)有关的亚稳态囊泡[23]. 除乙二胺-油酸和丙二胺-油酸体系外,pH窗口近中性端囊泡尺寸总体上大于pH窗口碱性端. 将所有短链胺对油酸囊泡pH窗口的影响列于表1,发现pH窗口向碱性拓宽比向近中性拓宽显著. 少量二元胺还会导致pH窗口双向拓宽的效果,而多元胺中只有二乙烯三胺具有这种效果. 1,4-丁二胺向碱性拓宽效果最佳(pH=11.5),而二乙烯三胺向近中性拓宽效果最佳(pH=7.6). 这些结果均可以用氨基随pH变化发生质子化和去质子化转变[图2(B)],从而导致与油酸及水分子间的相互作用及其变化予以解释[10].
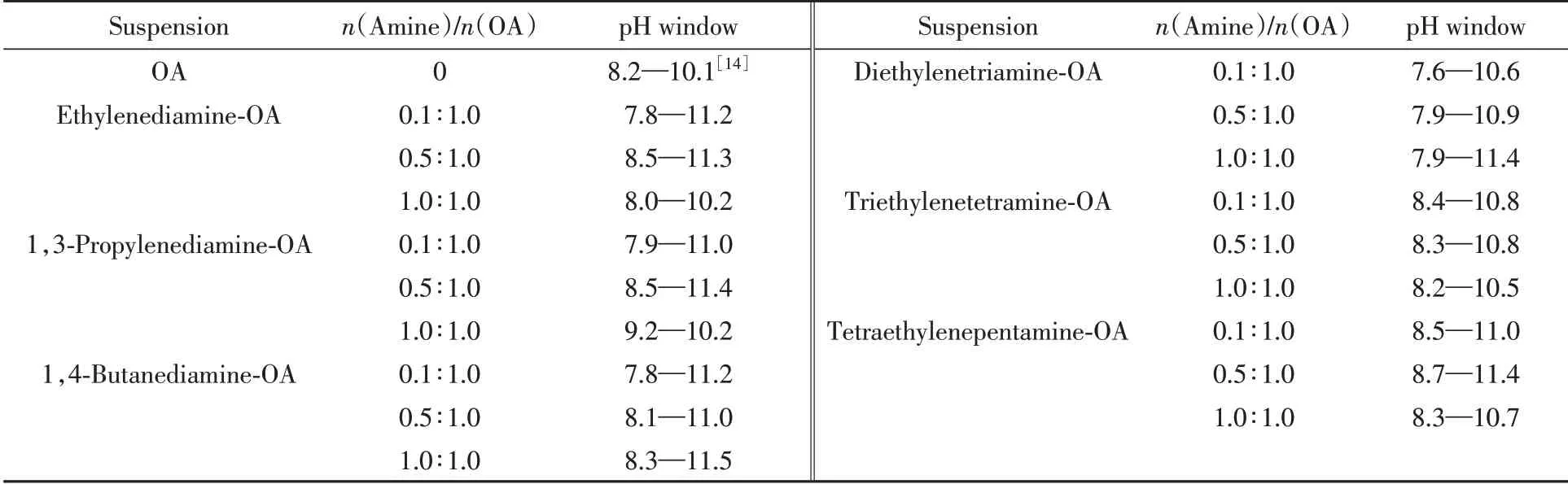
Table 1 pH window for OAV formation of indiamine(or polyamine)-OA suspensions
通过ITC 测试体系的热力学参数可以判断非共价作用的类型[24]. 以二乙烯三胺-油酸体系为例,二乙烯三胺与油酸囊泡表面结合均为自由能降低的自发过程(△G<0),且为放热过程[图3(A)和(B)]. pH 窗口近中性端(pH=8.1)的△H<0,且△S>0,表明涉及氢键和疏水作用. 由于二乙烯三胺的分子结构不可能导致与油酸分子/离子间直接产生疏水作用,故该疏水作用应该是两者间氢键作用引起油酸分子/离子间更为显著的疏水自组装,从而有利于pH窗口近中性端拓宽至pH=7.6. pH窗口碱性端(pH=10.2)的△H<0,且△S<0,表明主要为氢键作用,这与图2(B)的推断相一致. 图3(C)中二乙烯三胺与油酸的结合能计算值为负值,不仅支持图3(A)和(B)中二乙烯三胺与油酸囊泡表面自发产生氢键(4~120 kJ/mol)及离子-偶极(50~200 kJ/mol)量级的相互作用[25],而且支持图2(B)中关于氢键和离子-偶极作用影响二乙烯三胺与油酸囊泡pH窗口变化的推断. 图3(A)和(B)中pH窗口近中性端的焓变减小程度小于pH窗口碱性端,表明前者的相互作用比后者弱,这导致短链胺使油酸囊泡pH窗口向碱性拓宽比向近中性拓宽显著的实验结果. 图3(C)中近中性端的结合能大于碱性端,表明前者的相互作用比后者强,这与表1中的实验结果表观上相矛盾,但同时考虑二乙烯三胺与水的结合能就可以得到解释. 由于pH窗口近中性端水分子与短链胺的结合能比碱性端更大,明显的竞争结合作用将削弱短链胺与油酸的相互作用,因而才导致表1中碱性端拓宽更显著的实验事实. 同时,短链胺与油酸囊泡表面或水分子的相互作用及其竞争可能会影响囊泡的排水率[23],从而影响囊泡的形貌(图S2).
温度变化可能会影响脂肪酸囊泡的稳定性而使其解体[26],若二元胺或多元胺与油酸囊泡表面通过弱相互作用结合,则可以增强油酸囊泡的稳定性[27,28]. 冻融循环1次和3次后[19]的超景深三维显微镜影像表明,体系中均有囊泡存在,囊泡的大小或形状有些变化,且以形貌变化为主(图S3,见本文支持信息). 这可能与对图S2现象的解释一致[23],该现象由短链胺-油酸-水分子之间的竞争结合及平衡所决定,但油酸囊泡相始终存在.
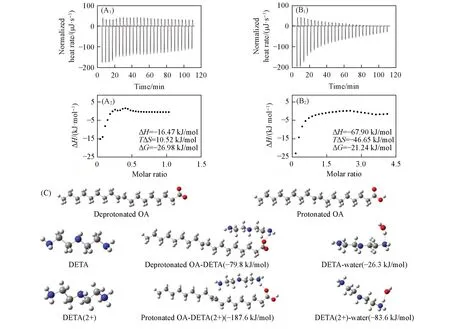
Fig.3 ITC of DETA titrating OAV in buffer solution at pH of 8.1(A1, A2) and 10.2(B1, B2) and binding energies between protonated/deprotonated DETA and OA or water(C)
2.2 中长链伯胺/季铵盐-油酸囊泡的pH窗口、形貌及稳定性
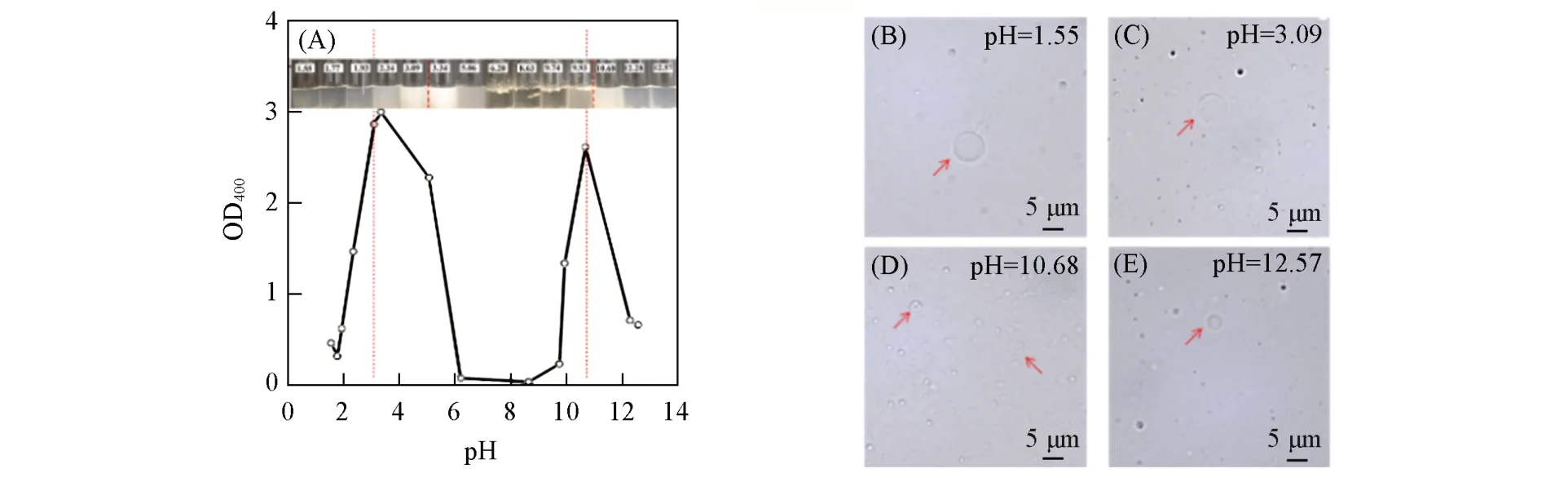
Fig.4 DA⁃OA suspension(molar ratio 1.0∶1.0)of appearance(inset)and turbidity with pH change(A),and optical micrographs on the near neutral⁃side and alkaline⁃side pH windows of two separated vesicular phases(B—E)
中短链脂肪酸(C4~C8)与中短链伯胺通过质子转移共组装为脂肪酸囊泡[29],中长链伯胺与脂肪酸疏水共组装为脂肪酸囊泡[13],DTAB易与脂肪酸形成阴-阳离子囊泡[14,15],但沉淀区(Precipitation zone,PZ)[30]会干扰激光丁达尔效应的测定,改用浊度方法(25 ℃下测定样品在400 nm 处的光密度OD400)测定该类体系的pH窗口. 典型的十二胺-油酸体系如图4(A)所示,观察到PZ相区两端分别有两个油酸囊泡相区,图4(B)~(E)中超景深显微镜结果证实,存在MLV型油酸囊泡,此外囊泡粒径随pH增大而减小的趋势较短链胺更为显著. 类似得到的其它各体系油酸囊泡的pH窗口数据列于表2,表明新出现的酸性区域的油酸囊泡相区随长链伯胺的碳链延长逐渐从无到有,随着长链伯胺浓度的增大,从介稳到稳定. 原有的碱性区域的油酸囊泡相区拓展到强碱区域,从而使得胶束相区消失. 与长链伯胺相比,DTAB使油酸囊泡的pH窗口双向拓宽且随浓度的增加而增大,但其不仅使强碱性区域的胶束相恢复,而且在强酸性下造就的新囊泡,相比伯胺能够更加长期稳定,推断这些均与DTAB在各种pH环境下均携带正电荷,因而强化与油酸的离子-偶极和静电相互作用有关[14,15].
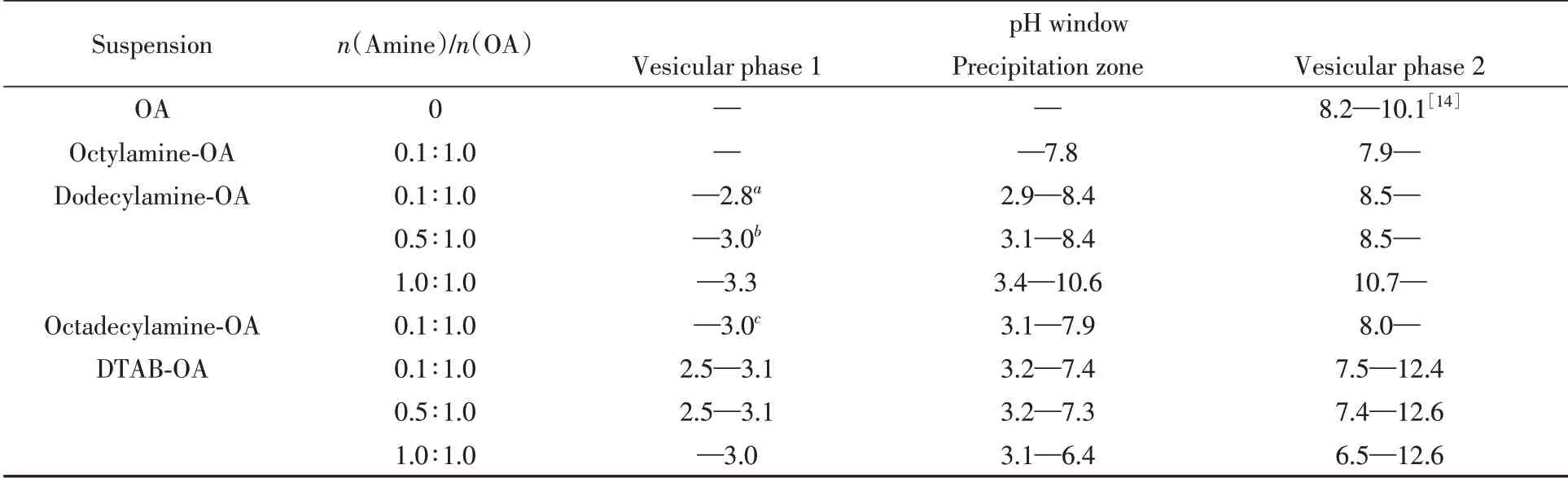
Table 2 pH window for OAV formation in primary fatty amine-OA and DTAB-OA suspensions
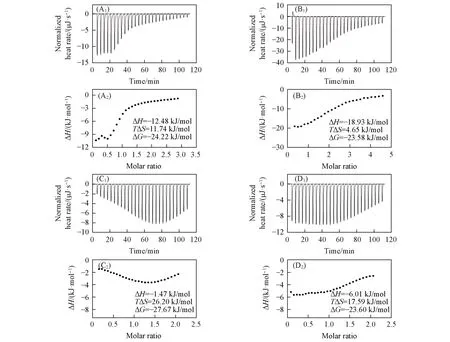
Fig.5 ITC of OA titrating into DA(A1, A2, B1, B2) or DTAB(C1, C2, D1, D2) in buffer solution at pH of 8.7(A1,A2),11.3(B1,B2),7.5(C1,C2)and 11.4(D1,D2)
图5 为碱性区域的囊泡相2的ITC结果,ΔH<0且ΔS>0表明十二胺或DTAB与油酸的相互作用涉及氢键和疏水作用,各pH下均存在疏水作用(ΔS>0),也说明了十二胺或DTAB与油酸通过共组装形成复合囊泡. 相较于DTAB,十二胺与油酸的相互作用焓变减小得更多,说明伯胺基与油酸羧基之间的氢键或离子偶极作用较DTAB的季铵基更为明显. 而DTAB在碱性条件下与油酸相互作用的焓变较近中性侧更小,体现了季铵基与油酸离子的羧酸基之间的静电相互作用,支持了上述DTAB强化了与油酸的静电相互作用的推断.
2.3 胺类分子结构对油酸囊泡pH窗口的影响
基于上述实验结果,以油酸体系为参照,选取胺/油酸的摩尔比均为0.1∶1的DETA-油酸,DA-油酸和DTAB-油酸体系为例,比较各类代表体系中相区差异以及囊泡相区和胶束相区中分子间的相互作用,以阐释胺类分子结构对油酸囊泡pH 窗口影响的机理(Scheme 1). 短链胺主要通过非共价键合作用,中长链胺与油酸形成油酸囊泡所需的“二聚体”,其在碱性范围发挥与脂肪醇类似的作用[16,31],以满足形成油酸囊泡的堆积参数(P)的条件(1/2<P<1)[32]. 而DTAB在强酸和碱性条件下均以阳离子形式存在,并在碱性条件下形成盐桥[33].
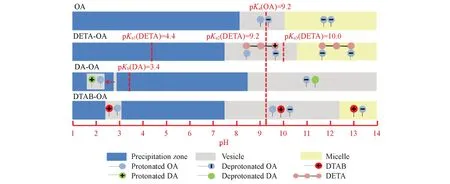
Scheme 1 Schematic comparison of mechanism dominating the pH window of OAV by amines
3 结论
选取油酸作为囊泡砌块,探究了二元胺、多元胺、中长链伯胺及DTAB 对油酸囊泡pH 窗口的影响. 采用激光丁达尔效应观察了二元胺(或多元胺)-油酸分散液相变. 结果表明,二元胺及多元胺均可使油酸囊泡的pH窗口向碱性拓宽,其中1,4-丁二胺向碱性侧拓宽效果最佳(pH=11.5),而二乙烯三胺向近中性侧拓宽效果最佳(pH=7.6). ITC 实验证明,二元胺或多元胺在油酸囊泡表面为非共价结合,而中长链伯胺及DTAB还可以与油酸通过疏水作用或静电吸引形成共组装囊泡,导致前者的调节功能弱于后者. 氨基的质子化和脱质子化随pH的转换是胺类分子调节油酸囊泡pH窗口的共同驱动力. 此研究对进一步深入探究小分子影响脂肪酸囊泡形成及其稳定性的构效关系,以及考察史前细胞的形成条件等均有参考价值.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20220144.
——以高中化学“氢键”的教学为例

