血液感染性病毒核酸检测室内质量控制方法的研究
高智俊,周国平,郑 岚,肇翊同,王 迅,何智纯(上海市血液中心,上海 200051)
室内质量控制(internal quality control, IQC)由实验室工作人员,采取一定的方法和步骤,连续评价本实验室工作的可靠性程度,以监控本实验室常规工作的精密度,确定实验结果是否可靠,可否发出报告的一项工作[1]。血液感染性疾病筛查的对象为健康献血者,在缺乏病史和体征的情况下,更多依赖于实验室检测[2],根据检测结果从健康献血者中挑出疑似感染者,因此血液筛查需要实验室的检测结果具有更高的稳定性和可靠性。血液筛查的质量控制是保证检测结果可靠的有效手段[3]。然而,病毒标记物检测的血液筛查不同于一般的化学检测,传统的基于正态分布原理的质控方法可能并不适合非正态分布的病毒标记物检测[3]。特别是核酸检测的IQC 具有更多的复杂性,其IQC 方法一直是业内讨论的热点。本文对本实验室的质控数据进行了分析,以当前所使用的室内质控方法作为标准,在判断在控的检测批次中再用两种不同的IQC 方法进行了分析,为探讨合适的血液核酸检测IQC 方法提供帮助。
1 材料与方法
1.1 质控品 本文使用两种室内质控品。一种为本实验室在用质控品产自北京康彻斯坦公司。用于罗氏核酸混样检测时,HBV DNA,HCV RNA,HIV RNA 浓度分别为 50 IU/ml,1 000 IU/ml,1 000 IU/ml;用于盖立复核酸单人份检测时,HBV DNA,HCV RNA,HIV RNA 浓度分别为 50 IU/ml,50 IU/ml,200 IU/ml。另一种为澳大利亚国立血清学参比实验室(National serdogical Reference Laboratory,NRL)提供的QConnect 质控品(评估的质控品),浓度分别为HBV DNA 50 IU/ml,HCV RNA 50 IU/ml,HIV RNA 250 IU/ml,罗氏核酸混样检测的质控品为三种标记混合在一起的多标记样品,本实验室检测时与5 支阴性血浆混合。盖立复核酸单人份检测的质控品为单一标记样品。
1.2 仪器与试剂 本实验室主要采用Roche COBAS TaqScreen s201 MPX v2.0 聚合酶链反应(polymerase chain reaction,PCR)方法(简称:罗氏)和Grifoles procleixTMTIGRIS Ultrio plus 转录介导的扩增(transcription-mediated amplification,TMA)方法(简称:盖立复)对血液感染性病毒进行核酸检测,本文数据均来自这两种检测系统。
1.3 方法 两种质控品与常规血液样品一起进行检测。收集2019年1月14日~5月31日两种质控品的检测结果,将北京康彻斯坦质控品的检测结果录入Excel 表格,将澳大利亚QConnect 质控品的检测数据录入EDCNet 软件。
1.3.1 本实验室常规室内质控方法:罗氏检测系统每天采用混样模式检测一套室内质控品(1 支HBV DNA,1 支HCV RNA,1 支HIV RNA 阳性室内质控品与3 支阴性室内质控品的混样样品),盖立复检测系统每个工作列表必须包含一套室内质控品,室内质控品检测模式与检测样本一致。质控品检测结果在控的标准:阴性室内质控品检测结果应为内标有效的无反应性,阳性质控品使用罗氏检测系统检测Ct 值(cycle threshold value)须在30 ≤Ct 值<40 范围内,使用盖立复检测系统检测S/CO 值(absorbance signal of sample/cutoff value)须在5 <S/CO 值≤25 范围内。
1.3.2 Westgard 多规则质控方法:将日常血液核酸筛查IQC 结果作Levey-Jennings 图,以在用批号的试剂和室内质控品前20 个点计算均数(x)和平均差(s),并在图上划出x,x±2s 和x±3s 质控限,根据Westgard 多规则判断当批检测是否在控。
1.3.3 NRL 质控限法:在使用NRL 同一浓度新批号QConnect 室内质控品监控核酸试验的有效性和稳定性之前,采集来自全球30 个国家的约300 个实验室使用该批号NRL QConnect 质控品的检测结果计算NRL 质控限[4],以此来监控以后的核酸试验的有效性和稳定性。NRL 质控限的计算方法参见文献[4],计算时考虑了不同实验室间正常的检测变异,也考虑了试剂批号之间的变异。鉴于NRL质控限计算的数据来自国外核酸单人份检测,因此,盖立复核酸单人份检测方法可直接使用根据国外数据计算得出的NRL 质控限,而国内罗氏核酸混样检测方法不能直接使用NRL 质控限,本文罗氏核酸混样检测方法 NRL 质控限是根据同一研究阶段本实验室、深圳市血液中心、大连市血液中心和山东省血液中心对QConnect 质控品的检测结果重新计算而得。如果QConnect 质控品的检测结果在NRL 质控限范围内,则当批检测在控,否则为失控。
2 结果
2.1 本实验室室内质量控制情况 2019年1月14
日~5月31日期间应用本实验室核酸室内质量控制方法,罗氏核酸混样检测康彻斯坦质控品在控批次为122 批,失控批次为2 批,失控率1.64%;盖立复核酸单人份检测康切斯坦质控品,在控批次为275 批,失控批次为0 批,失控率0。在此期间,使用罗氏核酸混样方法,检测NRL QConnect 质控品332 次,使用盖立复核酸单人份检测方法检测QConnect 质控品183 次。
2.2 Westgard 多规则质控方法在控和失控情况 见图1 和图2。使用罗氏核酸混样方法检测康彻斯坦HCV RNA 质控品和使用盖立复核酸单人份检测方法检测康彻斯坦HIV RNA 质控品的质控图。可见在根据日常质控规则判断为在控的检验批次中,如果采用Westgard 多规则质控方法判断HCV RNA 质控情况,又出现2 个13s失控和1 个10x失控,其中2 次超出+13s,提示弱阳性质控品的检测值偏低;在盖立复核酸单人份检测HIV RNA 质控品中,又出现6 个13s失控和1 个22s失控,其中有5 个失控点低于-13s,表明弱阳性质控品的检测值偏低。其他检测项目的质控图基本与图1 和图2 类似。统计所有检测项目的失控情况汇总见表1。
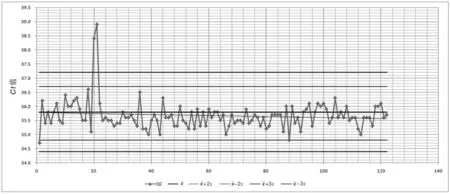
图1 罗氏HCV RNA 检测质控图
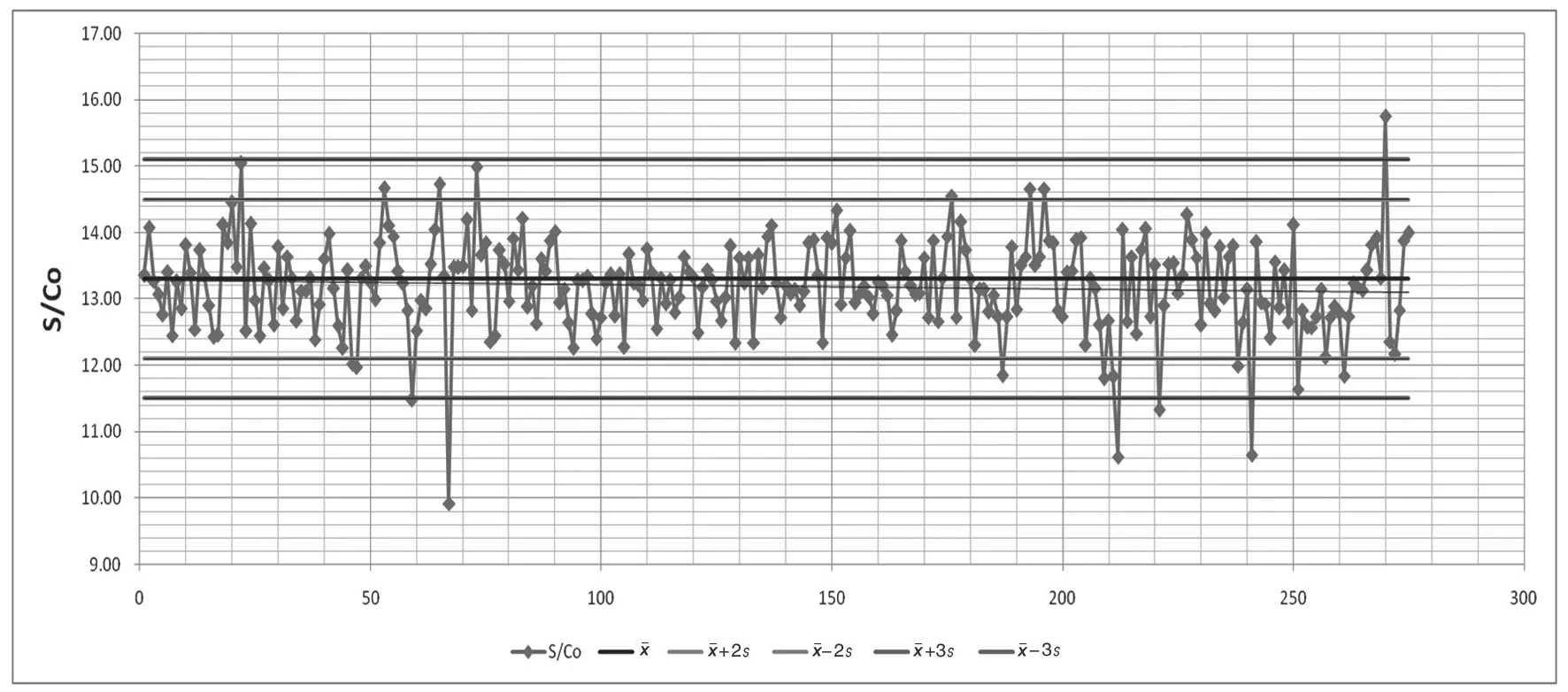
图2 盖立复HIV RNA 检测质控图
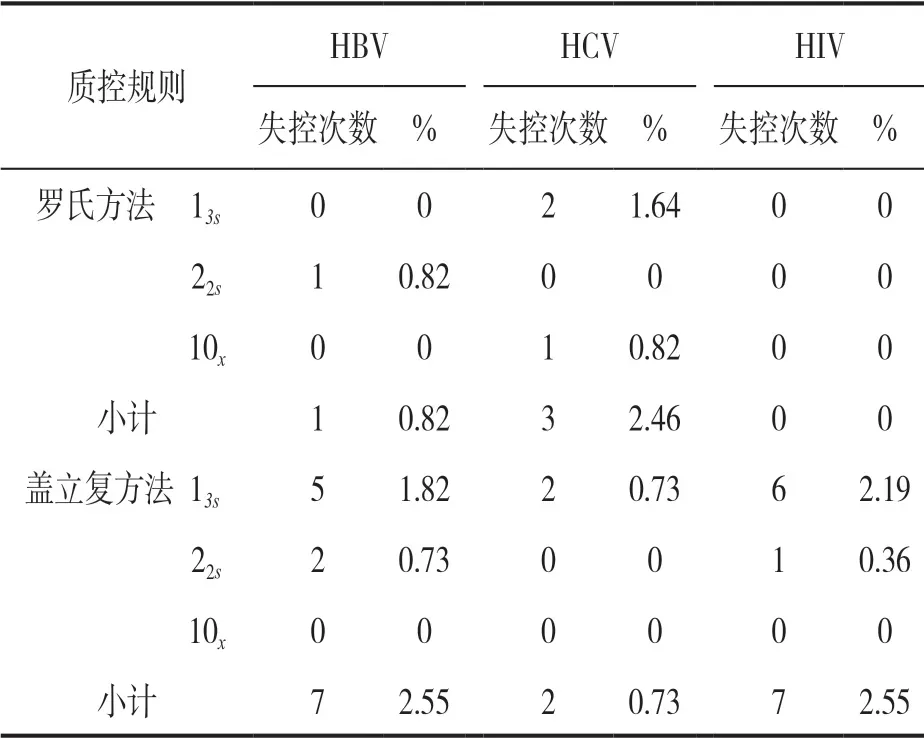
表1 使用Westgard 多规则质控方法判断失控情况汇总
2.3 NRL 质控限法在控和失控情况 使用NRL QConnect 质控品,盖立复核酸单人份检测,在本实验室核酸质控方法判断在控的检测批次中,使用NRL 质控限进行室内质量IQC,结果未发现失控情况;罗氏核酸混样检测,在本实验室核酸质控方法判断在控的检测批次中,使用NRL 质控限的计算方法,计算本实验室的质控限,结果发现在HBV DNA 核酸检测和HIV RNA 核酸检测中各有1 个失控结果(0.30%)见表2。图3 和图4 分别为罗氏核酸混样检测HIV RNA 质控品和盖立复核酸单人份检测HCV RNA 质控品的质控结果,其他检测项目与该结果相似。
3 讨论
血液筛查感染性病毒核酸检测作为一种定性检测,其室内质量控制方法一直是业内讨论的热点。目前各血站常用的室内质量控制技术有:①选择2 ~5 倍检测限浓度的质控品作定性监测;②以质控品的Ct值作质控图,并以Westgard 多规则质控方法判断是否在控;③在定性监测基础上,设定一系列判定指标,综合分析核酸检测的室内质控。

表2 使用QConnect 质控品,按NRL 质控限方法进行室内质控的结果
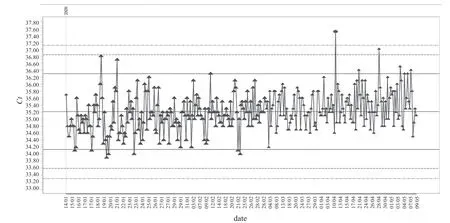
图3 使用QConnect 质控品按NRL 质控限法进行罗氏HIV RNA 室内质量控制
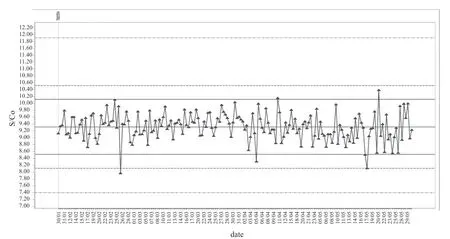
图4 使用QConnect 质控品按NRL 质控限法进行盖立复HCV RNA 室内质量控制
第一种方法单独使用时存在一定的缺陷,因为核酸检测是单管独立反应,室内质控品的检测情况并不能完全代表待检样品的真实反应情况,简单的定性监测不一定能发现实验室的系统偏差和大部分的随机偏差。
第二种是以室内质量控制结果作Levey-Jennings 图,加以Westgard 多规则质控的方法在国内一些血液筛查核酸实验室用以判断检测是否在控[4-6]。该方法虽然比单纯定性监测能提供更多的稳定性和重复性信息,但由于样本间的Ct值是指数关系,而不是线性关系,不能使用t检验或方差分析等这些正态分布的方法对Ct值进行统计分析[7-8],因此,按Westgard 多规则质控方法以Ct值作为指标判断PCR 检测结果是否在控时,可能会造成许多“假失控”[9]。本研究结果表明,盖立复核酸单人份检测方法出现假失控的概率会高于罗氏方法,这主要是因为盖立复的转录介导的扩增(transcription-mediated amplification, TMA)技术是一种终点检测方法,其S/CO 值与样品中的核酸浓度没有相关性,因此Westgard 多规则质控方法不适宜对TMA 的结果进行分析。如果日常检测中经常出现“假失控”,实验室可能会投入更多的精力去调查失控原因、复检该批样品、延迟报告发出时间,不仅会造成人、财、物和时间上的浪费,时间久了还可能会让实验室的员工对质量控制工作失去信心。因此本文研究结果表明,Westgard 多规则质控方法不适合用于目前国内血筛核酸检测的室内质控。
第三种为在定性监测基础上,设定一系列判定指标,综合分析核酸检测的室内质控。本实验室自2011年起即开始采用该方法对血筛核酸检测进行室内质量控制。除了试剂盒自带质控符合系统设定的要求、第三方弱阳性室内质控品的定性结果与预期相符以外,还对室内质控品的检测值建立了在控范围,同时还对日常检测指标进行监测。这样的综合判断指标来源于核酸扩增的基本原理和本实验室核酸检测方法性能验证数据。实验室日常监测核酸混样阳性拆分反应率、单人份反应率、鉴别阳性率、无效批次率及无效结果率等数据也为检测结果的有效性提供必要的支持,也与最近发布的《血站血液检测实验室质量监测指标》(T/CSBT 004-2019)和《可经输血传播感染病原体核酸筛查技术要求》(T/CSBT 008-2019)相符。因此本文以本实验室核酸检测所用质控限的室内质量控制方法是可行的。在符合实验室实际运行状况下,既避免其他质控方法带来的假失控风险,又能及时发现检测中的问题,保证血液筛查质量。
为了探讨目前澳大利亚核酸室内质控技术在我国应用的可行性,本文采用NRL 的QConnect 质控品,并使用互联网EDCNet 软件分析其日常质控的结果。在本实验室罗氏核酸常规质控方法判断在控的批次中,利用QConnect 质控品及NRL 质控限的方法进行判断,在HIV RNA 项目中发现1 个“失控”结果。这个“失控”结果也可能是“假失控”,主要是因为QConnect 用于罗氏检测方法的质控品HIV RNA 浓度只有250 IU/ml,这一浓度在国外均用于单人份检测,结果变异范围较小,而在国内开展的混样检测中,该浓度相对偏低,结果变异范围较大。因此,在研究中所使用QConnect 质控品的浓度并不适合用于罗氏核酸混样检测。但根据本实验室获得的稳定结果推测,如果提高该质控品浓度,可以达到对其进行室内质控的目的。在盖立复核酸常规质控方法判断在控的批次中使用NRL 质控限进行判断,未发现失控情况。表明当前QConnect质控品浓度配合NRL 质控限方法,与本实验室现行质控限的方法均适合用于盖立复核酸单人份检测的室内质控。
综上所述,在选择适宜浓度的质控品情况下本实验室在用质控限的方法与NRL 质控限的方法均可用于罗氏核酸混样检测和盖立复核酸单人份检测的室内质控。

