肺炎支原体肺炎患儿外周血miR-29c、miR-146a与炎症因子的相关性研究
孙玉军,马敬斌,马海凤
(聊城市第二人民医院儿科,山东 聊城 252600)
肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是儿童肺炎常见类型,在儿童社区获得性肺炎中占比约10%~30%。MPP可进一步发展为重症MPP,出现肺脓肿、肺不张等肺内并发症,或累及神经、心血管、消化等肺外系统,危及患儿健康与生命[1]。然而,MPP前期症状缺乏特异性,临床常规病情评估体系可能存在一定的滞后性,从而影响患儿的及时治疗[2]。因此,探寻MPP的早期客观指标以辅助临床评估,对及时干预治疗、改善预后至关重要。近年来,微小RNA(microRNA,miRNA)逐渐被证实参与许多生物学过程[3]。相关研究表明微小RNA-29c(microRNA-29c,miR-29c)、微小RNA-146a(microRNA-146a,miR-146a)与哮喘、病毒性肺炎等儿童呼吸系统疾病的发生发展有关[4-5];动物实验研究也表明miR-146a可调节炎症因子参与MPP发展[6]。鉴于炎症反应是目前公认的MPP重要发病机制,既往研究也证实炎症因子与MPP儿童密切相关但受到多因素影响[7],故本研究结合miR-29c、miR-146a与炎症因子相关性的分析,探讨二者与MPP的关系,旨在为临床防治提供依据。
1资料与方法
1.1研究对象
本研究为前瞻性研究,选取2018年5月至2020年10月于本院诊治的96例MPP患儿为MPP组对象,纳入标准:①MPP诊断符合《诸福棠实用儿科学(第8版)》中标准[8];②患儿年龄3~12岁;③MPP急性期入院;④患儿家属知情同意。排除标准:①入院7d内出现其他细菌或病毒感染;②伴其他呼吸系统疾病(哮喘、肺结核等);③免疫、血液系统疾病及皮肤病、全身过敏性疾病患儿;④近3个月有免疫抑制剂、糖皮质激素、抗凝药物应用史;⑤心、肝、肾、肺等器质性疾病及结缔组织病患儿。另选取同期住院且明确诊断为细菌性肺炎的69例患儿为细菌性肺炎组;同期于本院体检健康的87例儿童作为健康对照组(年龄3~12岁,排除近6个月有感染疾病史者及血液、免疫相关疾病儿童)。本研究符合《赫尔辛基宣言》要求,获得院医学伦理委员会批准,研究对象的家属均知情同意。
1.2研究方法
1.2.1外周血miR-29c、miR-146a水平检测
急性期MPP、细菌性肺炎患儿入院后12h内采集静脉血3mL(采血前均未使用抗生素、免疫抑制剂、糖皮质激素治疗),健康儿童于体检当天采血3mL,EDTA-K2抗凝,淋巴细胞分离液分离后加入TRIZOL-80℃存留备测。采用实时定量聚合酶链式反应(polymerase chain reaction,PCR)法测定外周血miR-29c、miR-146a相对表达量水平:①提取总RNA,测定RNA含量,反转录合成miR-29c cDNA、miR-146a cDNA,试剂供自日本TAKARA公司。②采用7500 FAST型实时荧光定量PCR仪(美国ABI公司)对miR-146a、miR-29c、U6(内参)实施扩增。反应体系:SYBR Green Mix=10μL,上游引物=0.5μL,下游引物=0.5μL,cDNA=1μL,Distillation-Distillation H2O=8μL,总体积=20μL。扩增引物序列:miR-29c上游引物序列为GGGTAGCACCATTTGAAA,下游序列为GGGCAATTGCACTGGATAC;miR-146a上游引物序列为CTGGACTGCAAGGAGGGGTC,下游序列为GCAGACTGAAAAAGTTCTT;U6上游引物序列为ATTGGAACGATACAGAGAAGATT,下游序列为GGA ACGCTTCACGAATTTG。扩增反应条件:95℃预变性1min,95℃变性30s,64℃退火30s,72℃延伸15s,共40个循环。各反应重复3次,以U6为内参,通过2-△△Ct计算外周血miR-29c、miR-146a相对表达量。
1.2.2炎症因子水平检测
采集研究对象入院后12h内(急性期MPP、细菌性肺炎儿童为入院治疗前,健康对照组儿童采血时间为体检当日)静脉血3mL,采血1次,离心10 min(3 000 r/min)取上清液,通过酶联免疫吸附试验测定血清白介素-17(interleukin-17,IL-17)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1beta,IL-1β)水平,试剂供自武汉博士德生物工程有限公司,所有操作严格按步骤遵循试剂盒说明完成。
1.2.3 MPP病情判定
依据《诸福棠实用儿科学(第8版)》中标准[8],确诊MPP患儿如出现以下“①、②、③”中任2条和(或)“④、⑤”中任1条则判定为重症MPP:①接受规范大环内酯类药治疗>7d仍无效,或发热持续>10d;②心动过速或气促明显(1~5岁和>5岁患儿心率分别为≥140次/min、≥120次/min;呼吸频率分别为≥40次/min、≥30次/min),可伴发绀、鼻扇、血压降低(收缩压≤75 mmHg)等;③胸部影像提示大片状致密影,占据≥1个肺叶/肺段,可累及单叶/多叶病变;④存在肺脓肿、肺不张等肺内合并症;⑤发生严重的低氧血症(氧分压<60 mmHg),或出现心力衰竭、微循环紊乱、中枢神经系统感染等肺外并发症。根据是否发生重症MPP将96例MPP患儿分为重症组(n=45)和轻症组(n=51)。
1.3观察指标
观察各组儿童外周血miR-29c、miR-146a水平及IL-17、TNF-α、IL-1β水平;分析miR-29c、miR-146a与炎症因子相关性;比较MPP不同病情组患儿的miR-29c、miR-146a水平。
1.4统计学分析

2结果
2.1三组儿童基线资料的比较
三组儿童性别、年龄、年龄组、体质指数等基线资料间的差异无统计学意义(P>0.05),具有可比性,见表1。

表1 三组儿童基线资料的比较
2.2三组儿童外周血miR-29c、miR-146a及炎症因子水平比较
三组儿童外周血miR-29c、miR-146a水平的差异均有统计学意义(F值分别是117.929、87.687,P<0.05),MPP组<细菌性肺炎组<健康对照组。三组儿童炎症因子IL-17、TNF-α、IL-1β水平的差异均有统计学意义(F值分别是129.282、107.023、386.649,P<0.05),MPP组>细菌性肺炎组>健康对照组,见表2。
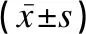
表2 三组儿童外周血miR-29c、miR-146a及炎症因子水平比较
2.3 MPP患儿外周血miR-29c、miR-146a与炎症因子的相关性
Pearson相关分析显示,MPP患儿外周血miR-29c、miR-146a与炎症因子IL-17、TNF-α、IL-1β均呈负相关(rmiR-29c分别是-0.512、-0.550、-0.494,rmiR-146a分别是-0.329、-0.282、-0.340,P<0.05),见表3及图1。

表3 MPP患儿外周血miR-29c、miR-146a与炎症因子的相关性
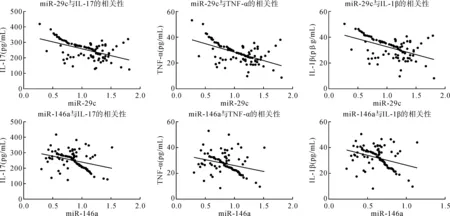
图1 MPP患儿外周血miR-29c、miR-146a与炎症因子的相关性
2.4 MPP不同病情组外周血miR-29c、miR-146a水平比较
MPP重症组患儿miR-29c和miR-146a水平均低于轻症组患儿,差异有统计学意义(t值分别是3.477、3.453,P<0.05),见表4。

表4 MPP不同病情组外周血miR-29c、miR-146a水平比较
3讨论
3.1MPP与炎症因子的关系
本研究发现,MPP组患儿的IL-17、TNF-α、IL-1β水平均明显高于细菌性肺炎组和健康对照组儿童。IL-17分泌自Th17促炎细胞,可经中性粒细胞招募性刺激多类炎症介质释放,在MPP中水平增高。既往研究也表明急性期MPP的IL-17水平相比正常者升高,且在合并肺外并发症组中升高显著[9]。MPP可刺激巨噬细胞释放TNF-α,过量TNF-α可诱发免疫损害、内皮细胞损伤,继而参与肺外系统受损,因此TNF-α与MPP病情有关。既往临床研究及动物实验均表明TNF-α有助于MPP评估[10-11]。IL-1β是主要分泌自巨噬细胞的促炎因子,可影响免疫应答、细胞增殖、感染过程等。蔡辰等人研究表明重症MPP组血清IL-1β相比非重症MPP组高[12],说明IL-1β可反映MPP病情。
3.2研究MPP客观标志物的必要性及意义
MPP发生过程可激活免疫细胞,促使大量炎症因子释放,参与MPP发展。但炎症因子受到多因素调节和影响,对MPP儿童病情的反映可能存在滞后性,加之MPP病因机制复杂,目前临床对客观指标的探寻尚不全面。蔡辰等[12]研究也指出,细胞因子水平对重症MPP缺乏诊断效能,在临床应用中难以预测重症MPP。因此,探寻更多潜在标志物辅助临床MPP的客观评估,从而为MPP的防治提供导向,具有重要研究意义。
3.3 MPP患儿miR-29c表达及与炎症因子的相关性
miR-29c在机体免疫应答、感染疾病中有重要意义。Zhang等人研究发现与对照组相比,哮喘加重患儿的miR-29c水平明显降低[13];另有资料显示miR-29c在呼吸系统疾病的病理生理过程中参与作用[14]。然而miR-29c与MPP的相关研究尚少。本研究显示MPP患儿外周血miR-29c水平低于细菌性肺炎组和健康对照组,且MPP重症组低于轻症组,说明miR-29c在MPP患儿中呈相对低水平,且与MPP病情有关。这可能与miR-29c调控T细胞分化,调节抗感染免疫反应等有关[15]。既往研究表明,MPP感染患儿免疫功能紊乱,Th1细胞受抑制,Th1/Th2丧失平衡[16];此外,Li等人[17]的研究显示与对照组相比,MPP患儿的miR-29c水平明显降低,而可溶性B7-H3、IL-17水平明显升高;B7-H3是miR-29c的直接靶标,miR-29c沉默会上调B7-H3的表达,因此miR-29c可能是防治MPP的新靶标。这可能是miR-29c水平可反映MPP患儿病情的重要原因。本研究相关性分析显示miR-29c与IL-17负相关,与上述发现较为一致。
3.4 MPP患儿miR-146a表达及与炎症因子的相关性
miR-146a是核因子-κB(nuclear factor kappa-B,NF-κB)通道依赖型的具有抗炎特性的miRNA。既往研究表明miR-146a与呼吸窘迫综合征、急性肺炎等呼吸系统疾病具有关联性[18-19]。本研究显示MPP患儿的miR-146a水平低于细菌性肺炎组和健康对照组,且MPP重症组低于轻症组,说明MPP患儿miR-146a呈相对低水平,且与MPP病情有关。究其原因,miR-146a可抑制Toll样受体4调节的诱导型一氧化氮合酶,提高M2基因表达,减少巨噬细胞促炎因子的释放[20];而低miR-146a水平预示机体抵抗能力和抗炎作用减弱,宿主反应失调,炎症及免疫损害增加,进而参与病情进展。Li等人[21]研究表明难治性MPP中miR146a5p的表达降低,可诱导ATP结合盒亚家族G成员1和白介素1受体相关激酶1的蛋白质表达,与MPP发展有关。另一方面,研究显示miR-146a可负性调控IL-1β等介导的白介素-6、环氧化酶-2的负性影响及炎症反应[22]。这可能是miR-146a与MPP相关联的机制之一,同时提示miR-146a与IL-1β等炎症因子存在关联性。国内报道显示miR-146a与TNF-α、IL-1β呈负相关[23];本研究也发现miR-146a与IL-17、TNF-α、IL-1β均呈负相关,间接提示了miR-146a监测的可行性及价值。国外一项研究也表明社区获得性肺炎入院时高水平的miR-146a与较低的30天死亡率相关,可作为预后生物标志物[24],但具体方案有待进一步实验明确。
综上所述,MPP儿童外周血miR-29c、miR-146a呈相对低水平,且与IL-17、TNF-α、IL-1β呈负相关关系;miR-29c、miR-146a可能参与MPP发病过程,其水平随病情加重而降低。但本研究属于单中心研究,样本量不大,后续尚待大样本量研究进一步予以验证。

