芪苈强心提取物对缺氧诱导的大鼠心肌细胞葡萄糖代谢异常的改善作用
汪菁峰 李福海 沈冬丽 宋 昱 韩雪婷 周京敏 葛均波
心力衰竭是各类心脏疾病的严重阶段或终末期表现。近年来,学者越来越重视能量代谢在心力衰竭发生、发展中的作用,心力衰竭实质上是由于心肌能量代谢异常及能量不足引起的一种超负荷性心肌病[1]。缺血性心肌病是心力衰竭发生的重要基础疾病。心肌缺血时,心肌脂肪酸和葡萄糖代谢紊乱,能量产生及能量储备均减少,而活性氧自由基产生增多,加速了心力衰竭的发展与恶化。因此,以心肌能量为治疗靶点,改善心肌缺血,延缓心脏重构,成为近年来缺血性心肌病的研究热点。通络方药“芪苈强心”是根据中医络病理论研制的治疗心力衰竭的中成药,主要由黄芪、人参、丹参、附子、葶苈子、陈皮、红花、桂枝、泽泻等组成,其既具有传统的强心、利尿、扩张血管作用,又能明显抑制RAAS等神经内分泌激素的过度激活,进而逆转左心室重构[2-3],但关于其对心肌能量代谢作用的研究并不多。本研究采用芪苈强心提取物干预体外缺氧诱导的心肌细胞,观察其对缺氧状态下心肌细胞葡萄糖代谢及关键酶表达的影响,探讨通络方药“芪苈强心”治疗缺血性心肌病的相关机制。
1 材料与方法
1.1 实验动物及药物配置 1~2 d龄野生型Sprague Dawley(SD)大鼠乳鼠购自复旦大学附属中山医院实验动物中心。芪苈强心超微粉由石家庄以岭药业股份有限公司提供。称取适量芪苈强心超微粉溶于DMEM培养基,以超声助溶,滤纸初滤,0.22 μm滤网过滤,配制成10 mg/mL 的芪苈强心提取物原液。密封保存于-20 ℃冰箱。曲美他嗪粉剂由施维雅天津制药有限公司提供。
1.2 主要实验试剂 DMEM培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),胰酶消化液(美国Invitrogen公司),TUNEL凋亡检测试剂盒[罗氏诊断产品(上海)有限公司],含半胱氨酸的天冬氨酸蛋白水解酶3(caspase 3)活性检测试剂盒、ATP检测试剂盒、Bradford蛋白浓度测定试剂盒、BCA蛋白浓度测定试剂盒、RIPA蛋白裂解液(上海碧云天生物技术有限公司),葡萄糖摄取检测试剂盒(美国Cayman Chemical 公司),微板法乳酸脱氢酶(LDH)测定试剂盒(南京建成生物工程研究所),蛋白酶磷酸酶抑制剂(美国Thermo Scientific公司),葡萄糖转运子-4(Glut-4)兔抗大鼠单克隆抗体(英国 Abcam公司),LDH A兔抗大鼠单克隆抗体、丙酮酸脱氢酶(PDH)兔抗大鼠单克隆抗体、柠檬酸合酶(CS)兔抗大鼠单克隆抗体(美国CST公司),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国Abbkine公司),HRP标记的抗大鼠β-actin抗体(美国Bioworld公司)。
1.3 大鼠乳鼠心肌细胞(neonatal rat cardiomyocyte,NRCM)培养 采用酶消化法+差速贴壁法分离培养原代心肌细胞。于大鼠乳鼠腹腔内注射10%水合氯醛50 μL行麻醉后,剪开其胸腔,弯镊取出心脏并置于4 ℃ PBS中清洗,然后将心脏组织剪为大小约1 mm×1 mm×1 mm的组织块,移入含0.1%胰酶消化液的烧杯中,将烧杯置于37 ℃恒温磁力搅拌器(1~2 r/s)上消化5 min,收集上清液,加入等量含10%胎牛血清的DMEM培养基终止消化,4 ℃、300×g离心5 min,弃上清液,以含10%胎牛血清的DMEM培养基重悬细胞。重复上述消化过程7~8次,直至心肌组织完全消化。将收集完毕的细胞悬液置于37 ℃、含0.05体积分数的CO2培养箱中差速贴壁培养90 min,此时贴壁的为成纤维细胞,悬液为心肌细胞。将细胞悬液转移至新瓶中,用于后续实验。
1.4 缺氧模型建立 采用缺氧培养箱模拟缺氧环境。缺氧培养箱各有一进气口和出气口,进气口连接无氧气体源(95% N2和5% CO2),出气口可将装置内O2排出。将细胞培养皿放入缺氧培养箱后,打开无氧气体源通气,同时打开出气口,约5 min后,充气完成,培养箱中O2基本排净,迅速关闭通气阀门,此时培养箱内最终O2体积分数<1%,从而实现对细胞的缺氧干预[4]。
1.5 实验分组及干预方式 将细胞悬液均匀接种于4个含8 mL DMEM培养基的10 cm细胞培养皿中,随机分为:对照组、缺氧组、芪苈强心+缺氧组、曲美他嗪+缺氧组。对照组于37 ℃、含体积分数为0.05的CO2培养箱中继续培养12 h。缺氧组细胞于37 ℃缺氧培养箱中培养12 h。芪苈强心+缺氧组则预先加入芪苈强心提取物原液(终质量浓度为0.5 mg/mL,本课题组已于前期采用台朌蓝试剂盒筛选出芪苈强心的最适干预浓度,在0.5 mg/mL时细胞存活率最高[3]),1 h后再置入37 ℃缺氧培养箱中培养12 h。曲美他嗪+缺氧组则预先加入曲美他嗪粉剂(终浓度为100 μmol/L)[5],1 h后再置入缺氧培养箱中37 ℃培养12 h。
1.6 心肌细胞凋亡检测
1.6.1 TUNEL染色 ①将心肌细胞按1×104个/孔接种于24孔板中,制备细胞爬片;②根据1.5所述实验分组及干预方式处理各组细胞;③干预结束后,吸尽培养基, 先后予4%多聚甲醛+PBS固定、3%过氧化氢甲醇封闭、0.1% Triton X-100细胞膜通透液冰上孵育;④将爬片移至载玻片上,每个样品避光滴加50 μL TUNEL反应液,在37 ℃暗湿盒中反应1 h;⑤反应结束后,以4’,6-二脒基-2-苯基吲哚(DAPI)复染10 min,样品上滴加抗促灭剂以封片;⑥荧光显微镜下(×200)观察样品染色情况,随机选取3个视野,观察TUNEL阳性细胞情况,计算凋亡细胞数量及凋亡比例。
1.6.2 caspase3活性检测 各组细胞干预结束后,分别以0.1%胰酶消化细胞并收集至细胞培养基中;4 ℃、600×g离心5 min,收集细胞沉淀;PBS洗涤1次,吸尽上清液,按照每2×107个细胞加入100 μL的比例加入裂解液,重悬、冰浴裂解细胞15 min;4 ℃、16 000×g离心15 min后,转移上清液至预冷的离心管内作为待测样品,同时取少量样品,采用Bradford法测定样品蛋白质浓度。于96孔板每孔中加入50 μL待测样品,每个样本均设复孔,按照说明书设置反应体系:37 ℃孵育60~120 min;波长405 nm处测定样品吸光度(A)值。根据标准曲线计算样品中催化产生了多少量的pNA,参考美国Chemicon公司的caspase 3酶活力单位的定义,计算每单位质量蛋白质样品的caspase3酶活力(单位为U/mg)。
1.7 心肌细胞葡萄糖摄取检测 DMEM培养基重悬心肌细胞,以5 000 个/孔均匀接种于96 孔板中,每个样本均设复孔,每孔加入100 μL培养基,在37 ℃、体积分数为0.05的CO2培养箱中孵育过夜。待细胞贴壁后,将培养液换成100 μL DMEM无糖培养基,对4组细胞进行相应的干预。干预结束前10 min加入含有荧光标记的2-脱氧葡萄糖(2-NBDG),于37 ℃、体积分数为0.05的CO2培养箱中孵育16 h;室温条件下400×g离心5 min。吸出培养液后,每孔加入200 μL细胞检测液,400×g离心5 min,吸尽上清液。再次加入100 μL细胞检测液,在激发波长/发射波长为485/535 nm处检测样品荧光值。
1.8 心肌细胞ATP水平检测 各组细胞干预结束后吸净培养液,加入800 μL裂解液裂解细胞,4 ℃ 12 000×g离心5 min,取上清液样品。按照说明书,于冰上配制ATP标准液和ATP检测工作液。取96孔板,每孔中加入ATP检测工作液100 μL,室温静置3 min后,每孔加入20 μL样品或标准品,每个样品均设复孔,迅速混匀,间隔2 min后,应用化学发光仪测定样品相对光单位(RLU)值,根据标准曲线计算出样品中ATP水平。应用BCA 蛋白质浓度测定试剂盒测定样品中的蛋白质水平,并将ATP水平换算成nmol/mg蛋白质单位形式。
1.9 细胞上清液LDH活性检测 4组细胞干预结束后,收集细胞上清液,于4 ℃、1 000×g离心5 min,取上清液为待测样品。取96孔板,测定孔及对照孔均加入20 μL待测样品,每个样品设复孔,并按说明书设置反应体系,混匀,室温静置5 min,应用酶标仪于450 nm波长处测定A值。根据以下公式计算样品LDH活性(U/L)=(测定孔A值-对照孔A值)÷(标准孔A值-空白孔A值)×丙酮酸标准液浓度(0.2 μmol/mL)×1 000。
1.10 葡萄糖代谢相关蛋白质表达检测
1.10.1 细胞蛋白质提取 4组细胞干预结束后,加入含有蛋白酶磷酸酶抑制剂的RIPA裂解液(1∶100),冰上静置5 min后刮下细胞,收集至无菌离心管,冰上静置30 min。应用匀浆器充分匀浆,4 ℃、12 000×g离心20 min,取上清液为心肌细胞胞质蛋白。留取10 μL细胞蛋白质,采用BCA法测蛋白质浓度,余加入5×上样缓冲液中,充分混匀,100 ℃水浴锅中煮5 min,自然冷却后保存于-80 ℃冰箱。
1.10.2 免疫印迹法 配制含10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶(PAGE)进行4组细胞蛋白质样品电泳。后在冰浴中,采用电转移法(300 mA、90 min)恒流转印蛋白质至聚偏氟乙烯(PVDF)膜。将整膜于室温下,在5%小牛血清(BSA)中封闭1 h。根据目的蛋白质分子量裁剪PVDF膜,分别加入1∶1 000稀释的Glut-4、LDH A、PDH、CS单克隆抗体,4 ℃摇床孵育过夜。弃去一抗,以TBST洗膜3次后,与HRP标记的二抗(1∶5 000)室温孵育1 h,洗膜后加入电化学发光(ECL)试剂进行曝光显影。
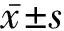
2 结 果
2.1 芪苈强心减少缺氧诱导的心肌细胞凋亡 与对照组相比,缺氧组TUNEL阳性细胞比例显著增高[(15.11±2.30)% 比(2.85±0.95)%,P<0.01],细胞caspase3活性显著增强[(81.53±13.78) U/mg比(27.61±5.82) U/mg,P<0.01)];与缺氧组比较,芪苈强心+缺氧组[(8.23±1.11)%比(15.11±2.30)%,P<0.01)]和曲美他嗪+缺氧组[(7.23±1.23)% 比(15.11±2.30)%,P<0.01)]的TUNEL阳性细胞比例显著降低,caspase3活性显著受到抑制[芪苈强心:(56.91±6.29) U/mg比(81.53±13.78) U/mg,P<0.01。曲美他嗪:(54.37±4.90) U/mg比(81.53±13.78) U/mg,P<0.01)]。见图1。提示芪苈强心对缺氧状态下心肌细胞具有较好的保护作用。

A 对照组TUNEL染色(200×) B 对照组DAPI染色(200×) C 对照组合并染色(200×) D 缺氧组TUNEL染色(200×) E 缺氧组DAPI染色(200×) F 缺氧组合并染色(200×) G 芪苈强心+缺氧组TUNEL染色(200×) H 芪苈强心+缺氧组DAPI染色(200×) I 芪苈强心+缺氧组合并染色(200×) J 曲美他嗪+缺氧组TUNEL染色(200×) K 曲美他嗪+缺氧组DAPI染色(200×) L 曲美他嗪+缺氧组合并染色(200×) M 4组心肌细胞TUNEL染色阳性细胞比例检测结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01) N 4组心肌细胞caspase3活性检测结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01)图1 不同干预组心肌细胞凋亡检测结果
2.2 芪苈强心促进缺氧心肌细胞的葡萄糖摄取 缺氧组心肌细胞葡萄糖摄取率较对照组显著降低[(66.82±10.88)%比(100.19±1.40)%,P<0.01],芪苈强心+缺氧组和曲美他嗪+缺氧组心肌细胞葡萄糖摄取率分别为(82.75±15.09)%和(80.18±14.42)%,均较缺氧组的(66.82±10.88)%显著增高(P值均<0.01)。提示芪苈强心可增强缺氧状态下心肌细胞葡萄糖摄取能力,其效力与曲美他嗪相当。
2.3 芪苈强心抑制缺氧心肌细胞上清液LDH活性,促进细胞ATP生成 缺氧组心肌细胞上清液的LDH活性较对照组显著增强[(246.92±24.66) U/L 比(149.70±20.17) U/L,P<0.01],芪苈强心+缺氧组和曲美他嗪+缺氧组细胞上清液LDH活性值分别为(216.76±15.41) U/L和(198.44±23.51) U/L,较缺氧组的(246.92±24.66) U/L显著降低(P值均<0.01)。缺氧组心肌细胞ATP水平较对照组显著降低[(4.87±1.02) nmol/mg比(8.21±1.40) nmol/mg,P<0.01],芪苈强心+缺氧组和曲美他嗪+缺氧组心肌细胞ATP值分别为(6.61±1.39) nmol/mg和(6.77±0.87) nmol/mg,显著高于缺氧组的(4.87±1.02) nmol/mg(P值均<0.01)。
2.4 芪苈强心调控缺氧心肌细胞葡萄糖代谢关键酶的表达 缺氧组心肌细胞Glut-4、PDH、CS蛋白质相对表达量分别为0.47±0.09、0.41±0.06、0.48±0.09均显著低于对照组的0.98±0.05、0.98±0.04、0.97±0.04(P值均<0.01),而LDH A相对表达量为2.21±0.15显著高于对照组的0.98±0.05(P<0.01)。芪苈强心+缺氧组和曲美他嗪+缺氧组细胞Glut-4、PDH、CS蛋白质相对表达量分别为1.18±0.18和1.17±0.14、0.91±0.08和0.92±0.07、1.10±0.18和1.05±0.12,均显著高于缺氧组的0.98±0.05、0.98±0.04、0.97±0.04(P值均<0.01),而LDH A相对表达量为1.12±0.14和1.18±0.10显著高于对照组的0.98±0.05(P值均<0.01)。见图2。

1 对照组 2 缺氧组 3 芪苈强心+缺氧组 4 曲美他嗪+缺氧组 A 4组心肌细胞葡萄糖代谢关键酶的蛋白质表达情况 B Glut-4蛋白质灰度值分析结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01) C LDH A蛋白质灰度值分析结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01) D PDH蛋白质灰度值分析结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01) E CS蛋白质灰度值分析结果(与对照组比较:①P<0.01。与缺氧组比较:②P<0.01) 图2 不同干预组心肌细胞葡萄糖代谢关键酶蛋白质表达情况
3 讨 论
心脏是人体耗能、耗氧较多的器官之一,心肌能量稳态取决于脂肪酸代谢和葡萄糖代谢间的平衡。心肌活动所需能量的60%~90%来自脂肪酸代谢,10%~40%由糖酵解和乳酸氧化产生的丙酮酸提供;而在线粒体中脂肪酸的氧化可抑制丙酮酸的氧化。心肌缺血、缺氧时,这种不平衡的状态会有所加强,表现为增加线粒体对脂肪酸的摄取,显著抑制葡萄糖和乳酸氧化,其结果是增加了能量产生过程中的氧需求,ATP生成减少,心脏处于“能量饥饿状态”;同时,中重度心肌缺血时脂肪酸氧化和糖酵解不匹配,导致游离脂肪酸堆积、细胞内酸中毒等代谢紊乱,引起心肌细胞凋亡。异常的能量代谢状态是心功能进行性恶化,进而发展为心力衰竭的重要原因之一。
心肌葡萄糖代谢包括底物水平摄取与利用、线粒体氧化磷酸化、ATP的转移与利用3个环节。目前,临床常用的改善心肌能量代谢的药物如曲美他嗪,以抑制脂肪酸β氧化为作用靶点,从而增加葡萄糖代谢,充分利用有限氧,抑制氧化应激反应与心肌细胞凋亡[6]。通络方药芪苈强心中的黄芪、附子、人参等成分,具有改善物质代谢、调节血脂、减少毒性物质堆积、保护心肌细胞等作用,作为复方制剂,具有多途径、多靶点的综合保护效应。Lin等[7]对H9C2心肌细胞给予芪苈强心超微粉干预,发现芪苈强心可使细胞糖酵解水平升高;随着干预时间延长,细胞氧化代谢水平、线粒体含量、线粒体单链DNA结合蛋白1(SSBP1)等线粒体生物合成相关基因表达水平均上调,该作用由过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)及其下游效应物的激活所介导。常丽萍等[8]研究发现,对心肌梗死后心力衰竭大鼠给予芪苈强心干预8周后,大鼠血清游离脂肪酸和心肌组织n-6系多不饱和脂肪酸水平较对照组显著降低,提示芪苈强心可减少毒性脂质堆积,保护心肌细胞,延缓缺血导致慢性心力衰竭的进程。心肌细胞是心脏组织最重要的组成部分,心肌细胞产能的高低直接影响了心脏收缩和做功效率[9-10]。相较葡萄糖有氧氧化,相同底物水平的脂肪酸β氧化可提供更多的ATP,但产生等量ATP需要多消耗10%的氧,使心脏做功效率下降[11];同时葡萄糖酵解获能效率为31.0%,有氧氧化获能效率约为41.5%,故有氧氧化是人体内绝大多数组织细胞获取能量的方式。可见在缺氧条件下,促进心肌细胞葡萄糖摄取和有氧氧化是一种高效的供能方式,减轻心肌细胞在缺血、缺氧环境下的损伤,从而改善心功能。
本研究结果显示,芪苈强心通过底物水平的摄取与利用、葡萄糖线粒体氧化磷酸化2个环节改善缺氧诱导的心肌细胞葡萄糖代谢异常。首先,Glut-4表达水平的升高促进了细胞对葡萄糖的摄取与利用;缺氧条件下,丙酮酸易被还原为乳酸(即糖酵解),LDH A表达水平及活性的下降可使更多的丙酮酸进入线粒体参与有氧氧化过程;PDH、CS相对表达量的增多则分别促进丙酮酸进一步氧化脱羧生成乙酰辅酶A,然后进入三羧酸循环,使其彻底氧化成CO2和水,释放能量。芪苈强心使心肌细胞在缺氧状态下,通过高效的葡萄糖代谢方式产生足够的ATP,使其免受缺氧刺激诱导的细胞损伤,减少心肌细胞凋亡,延缓心力衰竭的进展。
本研究结果表明,通络方药芪苈强心可改善缺氧心肌细胞葡萄糖代谢,其疗效与曲美他嗪相当。然而,芪苈强心还可以通过促进微血管新生、抑制炎症反应等多靶点效应改善缺血心肌的功能与代谢[12-13]。心力衰竭是一种复杂的临床综合征,改善心肌能量代谢是相对新型的治疗靶点。近期的一项临床研究[14]结果表明,使衰竭心脏远离脂肪酸代谢而向碳水化合物的氧化代谢转变,有利于改善心肌舒缩功能,减缓泵衰竭进程。芪苈强心通过多个作用靶点改善心肌细胞葡萄糖代谢,减少了心肌细胞凋亡,具有较好的临床治疗意义。然而,本研究仅在体外心肌细胞水平探讨了芪苈强心的作用,观察指标相对简单,其在实验动物水平上的效应及作用机制尚未明确,故本研究结果存在一定局限性。此外,氧化磷酸化的调控过程、高能磷酸化合物(ATP)的储备和利用,亦是干预心肌能量代谢的重要策略,芪苈强心是否还具有相应的作用靶点,值得进一步研究。

