全氟辛烷磺酸对人胎盘合体滋养细胞影响的研究
张 楠 王 育 程山山
环境内分泌干扰物(endocrine disrupting chemical, EDC)是指能够干扰人体正常激素合成代谢,进而影响机体生长发育和内环境稳定的外源性物质[1]。大部分EDC属于持续性有机污染物(persistent organic pollutant, POP)。全氟化合物(per and polyfluorinated chemical,PFC)是一类合成的含氟化合物,是20世纪重要的化工产品之一,主要应用于纺织品、纸、涂料、消防泡沫、影像材料、航空液压等领域,其中以全氟辛烷磺酸(perfluorooctane sulfonic acid,PFOS)的应用最为广泛。PFOS是全氟碳化物的稳定终产物,是现有较难降解的POP之一,具有化学稳定、热稳定和生物累积特性,其在人体内的半衰期可长达几十年。饮食、饮酒、饮用水摄入[2]及室内灰尘摄入[3]是人类暴露于PFOS的重要途径,高等动物体内PFOS的蓄积水平远高于有机氯农药和二噁英等。
胎儿生长受限(fetal growth restriction,FGR)是一种常见的妊娠期并发症,与多种围产期不良结局的发生相关。过去认为,FGR主要由孕期母体营养不良所致[4]。然而,随着我国经济的发展、人民生活水平的提高,FGR的发生率却未明显下降,某些地区甚至出现升高;因此,孕期女性暴露于环境有害因素与FGR发生的相关性逐步受到学者关注。越来越多的研究探讨了EDC暴露在FGR发病机制中的作用。研究[5]显示,PFOS能够通过胎盘,其在人类羊水中的水平约为3.6~28.7 ng/mL,在人类脐带血中的水平约为3.3~16.4 ng/mL。孕妇血清PFOS水平与胎儿出生体重、头围和身长均呈负相关,其水平升高会显著增加FGR的发生风险[6]。
孕期胎儿暴露于过量的糖皮质激素会诱使胎儿细胞增殖过早停止,导致FGR发生[7]。在妊娠期,表达于胎盘合体滋养细胞层的11β-羟基类固醇脱氢酶Ⅱ型(11-β-hydroxysteroid dehydrogenase type 2, 11β-HSD2)能够将具有生物活性的皮质醇脱氢氧化为无活性的可的松,维持母体与胎儿之间糖皮质激素的水平差,保护胎儿组织免受过量糖皮质激素的危害,被称为胎盘糖皮质激素屏障[8];因此,胎盘中的11β-HSD2是决定胎儿生长的关键因素。研究[9]结果表明,胎儿体重与足月胎盘11β-HSD2的酶活性呈正相关。与正常胎儿胎盘相比,FGR胎儿胎盘中11β-HSD2的表达水平和酶活性均显著降低[10]。
细胞凋亡是一种程序性的细胞死亡方式,天冬氨酸蛋白水解酶3(caspase3)是其主要执行者[11]。研究[12-13]显示,PFOS暴露可以促进多种细胞凋亡,包括神经元细胞和肝细胞等。本研究利用原代培养的人胎盘合体滋养细胞,探究PFOS对人胎盘合体滋养细胞11β-HSD2的表达水平和细胞凋亡的影响。
1 材料与方法
1.1 实验材料 收集2020年在上海交通大学医学院附属仁济医院妇产科行择期剖宫产、无妊娠并发症和合并症的孕期女性足月分娩的胎盘。胎盘娩出后0.5 h内置于装有250 mL PBS的量杯中待用。本研究经医院伦理委员会审核、批准(伦理号为RA-2020-323),所有产妇术前均签署知情同意书。
1.2 实验方法
1.2.1 胎盘滋养层细胞的培养及处理 采用改良的Kliman法[14]分离、提纯胎盘滋养层细胞。用无菌剪剪取母体侧胎盘组织60 g,以4 ℃ 0.9%氯化钠溶液冲洗干净。采用含0.125%胰蛋白酶和0.03%脱氧核糖核酸酶Ⅰ(DNase Ⅰ)的混合消化液消化洗净的胎盘组织,并在37 ℃水浴摇床中消化3次,每次18 min;收集消化液,离心后收集细胞。采用密度梯度离心法,以Percoll试剂(美国辉瑞公司)分离细胞,收集中间层纯化的胎盘滋养层细胞,以含10%小牛血清的DMEM培养液稀释细胞,接种于细胞培养板,放置于37 ℃、含体积分数为0.05的CO2的培养箱中。本团队前期研究[15]证实,分离出的胎盘滋养层细胞在体外条件培养3 d后能够达到最大合体化,成为胎盘合体滋养细胞。待细胞完成合体化后,加入不同浓度的PFOS (0、0.001、0.01、0.1、1、10 μmol/L)分别处理24 h后,收集细胞的RNA、蛋白质和细胞培养上清液,进行后续实验。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)分析 按照UNIQ-10柱式总RNA抽提试剂盒(上海生工生物工程有限公司)说明书提取胎盘合体滋养细胞总RNA,应用紫外分光光度计测定总RNA浓度。按照反转录试剂盒说明书进行RNA反转录反应得到cDNA进行qRT-PCR。qRT-qPCR退火温度设为60 ℃,扩增周期设为40次,建立标准曲线,以GAPDH为反应内参,计算每个样品中mRNA的相对表达量。GAPDH引物序列:正向,3’-CCC CTC TGC TGA TGC CCC CA-5’;反向,5’-TGA CCT TGG CCA GGG GTG CT-3’。11β-HSD2引物序列:正向, 3’-GAC ATG CCA TAT CCG TGC TT-5’;反向,5’-GCT GGA TGA TGC TGA CCT TG-3’。
1.2.3 免疫印迹(Western blotting)实验 本研究使用不同剂量的PFOS(0、0.001、0.01、0.1、1、10 μmol/L)处理胎盘合体滋养细胞24 h后,采用自制蛋白裂解液(RIPA)提取细胞总蛋白。测定蛋白质浓度后,取40 μg蛋白质样品,以含10%十二烷基硫酸钠的聚丙烯酰胺凝胶电泳分离蛋白质,采用湿转法将凝胶中的蛋白质转印至硝酸纤维素膜。转膜结束后,在室温下以5%脱脂牛奶封闭含目的蛋白质的条带1 h,PBS洗涤后以11β-HSD2(1∶2 000)、pro-caspase3(1∶1 000)和cleaved-caspase3(1∶1 000)一抗抗体(均购自美国Santa Cruz生物科技公司)分别在4 ℃下孵育条带、过夜。洗膜后,在室温下与相应二抗抗体孵育2 h,应用化学发光凝胶成像系统检测条带目的蛋白质灰度值。以GAPDH抗体(1∶50 000)(Proteintech中国公司)作为内参,测定各相关蛋白质的相对表达量。
1.2.4 11β-HSD2 酶活性测定 通过检测胎盘合体滋养细胞将皮质醇转化为可的松的转化率来计算11β-HSD2的酶活性。胎盘滋养层细胞经体外培养3 d合体化为胎盘合体滋养细胞后,经不同剂量的PFOS(0、0.001、0.01、0.1、1、10 μmol/L)处理24 h后,更换培养液,分别加入1 μmol/L的皮质醇孵育3 h后,收集细胞培养液。应用人皮质醇免疫测定试剂盒(美国R&D Systems公司)检测培养液中皮质醇水平,应用人可的松化学发光免疫测定试剂盒(美国Innovative Research公司)检测培养液中可的松水平,以皮质醇至可的松的转化率作为11β-HSD2酶活性的指标。
1.2.5 caspase3酶活性测定 使用Caspase-Glo®Assay kit(美国Promega公司)试剂盒测定胎盘合体滋养细胞中caspase3酶活性。将分离的人原代胎盘滋养细胞铺种于96孔板,细胞浓度为2×104/mL,体外培养3 d后,加入不同剂量的PFOS (0、0.001、0.01、0.1、1、10 μmol/L)处理24 h后,将试剂盒中的caspase3缓冲液加入caspase3底物中,混匀后制成caspase-glo3试剂,在每孔细胞加入100 μL(设置空白孔、阴性对照孔、实验孔),轻柔混匀,室温孵育1 h。应用酶标仪检测各孔的数值,计算caspase3酶活性的相对比值。
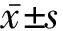
2 结 果
2.1 11β-HSD2的表达水平随着胎盘滋养层细胞的合体化逐渐升高 体外培养第1、2、3天,胎盘滋养层细胞中11β-HSD2的mRNA和蛋白质相对表达量逐渐增高,与未处理时(即体外培养第0天)比较的差异均有统计学意义(体外培养第1、2、3天与未处理时mRNA相对表达量比较:t=3.922,P=0.017;t=6.859,P=0.002;t=7.043,P=0.002。体外培养第1、2、3天与未处理时蛋白质相对表达量比较:t=3.429,P=0.026;t=6.669,P=0.002 6;t=10.279,P=0.000 5)。提示11β-HSD2的mRNA和蛋白质表达水平随着胎盘滋养层细胞的不断合体化而逐渐升高。见表1、图1。
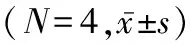
表1 11β-HDS2的表达水平随胎盘滋养层细胞的合体化逐渐升高

1为未处理时,2为体外培养第1天,3为体外培养第2天,4为体外培养第3天图1 11β-HSD2蛋白质表达情况
2.2 PFOS呈浓度依赖性地抑制人胎盘合体滋养细胞 0.01 μmol/L PFOS处理的人胎盘合体滋养细胞11β-HSD2的mRNA和蛋白质相对表达量较未处理时显著降低,且11β-HSD2的mRNA和蛋白质相对表达量随着PFOS剂量的增加(0.1、1、10 μmol/L)显著降低(0.01、0.1、1、10 μmol/L与未处理时mRNA相对表达量比较:t=4.121,P=0.021;t=5.692,P=0.008;t=7.810,P=0.002;t=9.413,P=0.001。0.01、0.1、1、10 μmol/L与未处理时蛋白质相对表达量比较:t=4.682,P=0.009;t=7.669,P=0.002;t=10.786,P=0.000 4;t=12.859,P=0.000 2)。同时,0.01 μmol/L PFOS处理的人胎盘合体滋养细胞11β-HSD2酶活性较未处理时显著降低,并随着PFOS剂量的增加(0.1、1、10 μmol/L),11β-HSD2酶活性受抑制程度显著增强(0.01、0.1、1、10 μmol/L与未处理时酶活性水平比较:t=8.348,P=0.011;t=7.581,P=0.002;t=9.012,P=0.001;t=12.498,P=0.000 2)。见表2、图2。
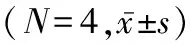
表2 PFOS呈浓度依赖性地抑制人胎盘合体滋养细胞11β-HSD2的表达和酶活性

1为未处理时,2为0.001 μmol/L PFOS,3为0.01 μmol/L PFOS,4为0.1 μmol/L PFOS,5为1 μmol/L PFOS,6为10 μmol/L PFOS图2 PFOS抑制11β-HSD2蛋白质的表达情况
2.3 PFOS呈浓度依赖性地促进人胎盘合体滋养细胞凋亡 0.01 μmol/L PFOS处理的人胎盘合体滋养细胞pro-caspase3蛋白质相对表达量较未处理时显著降低,且蛋白质相对表达量随着PFOS剂量的增加(0.1、1、10 μmol/L)显著降低(0.01、0.1、1、10 μmol/L与处理时比较:t=7.181,P=0.002;t=13.095,P=0.000 2;t=11.150,P=0.000 3;t=15.685,P<0.000 1)。同时,0.01 μmol/L PFOS处理的人胎盘合体滋养细胞cleaved-caspase3的蛋白质相对表达量较未处理时显著升高,并随着PFOS剂量的增加显著升高(0.01、0.1、1、10 μmol/L与未处理时比较:t=3.354,P=0.028;t=5.578,P=0.025;t=8.126,P=0.001 2;t=14.087,P=0.000 1)。进一步实验结果显示,0.01 μmol/L PFOS处理的人胎盘合体滋养细胞caspase3的酶活性较未处理时显著增强,并随着PFOS剂量的增加,其活性显著增强(0.01、0.1、1、10 μmol/L与未处理时比较:t=4.142,P=0.014;t=7.430,P=0.002;t=7.043,P=0.005;t=15.263,P=0.000 1)。见表3、图3。
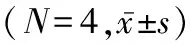
表3 PFOS呈浓度依赖性地促进人胎盘合体滋养细胞凋亡
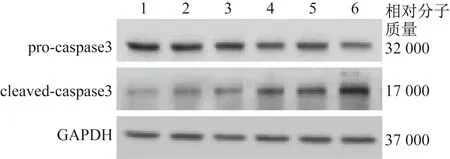
1为未处理时,2为0.001 μmol/L PFOS,3为0.01 μmol/L PFOS,4为0.1 μmol/L PFOS,5为1 μmol/L PFOS,6为10 μmol/LPFOS图3 pro-caspase3和cleaved-caspase3蛋白质表达的情况
3 讨 论
PFOS作为EDC对人体健康有巨大的潜在危害,可诱导多系统毒性反应。本研究发现,PFOS对人胎盘合体滋养细胞11β-HSD2的表达有显著抑制作用,同时能够促进人胎盘合体滋养细胞凋亡。
胎盘是女性妊娠期的特殊器官,主要在胎盘合体绒毛层合成的11β-HSD2不仅能够代谢糖皮质激素,保护胎儿免受过高水平的糖皮质激素作用,还与哺乳动物的许多胎源性疾病密切相关。抑制、敲除或干扰胎盘中11β-HSD2的表达,与妊娠时间缩短、胎儿出生体重下降及子代的生长发育编程受影响有关[16]。本课题组前期的研究[17]结果表明,在胎盘滋养层细胞向合体滋养细胞分化的过程中,11β-HSD2的表达量逐渐增加,在细胞完成合体化后其表达达到峰值。在研究中,应用不同剂量的PFOS(0、0.001、0.01、0.1、1、10 μmol/L)处理胎盘合体滋养细胞,结果发现,PFOS能够抑制胎盘合体滋养细胞11β-HSD2的表达和酶活性,且随着PFOS剂量的增高,抑制作用也逐渐增强。
细胞凋亡是细胞的程序性死亡方式,胎盘滋养细胞的适度凋亡对维持胎盘的正常功能具有重要作用,但是扰乱胎盘滋养细胞的凋亡过程也会对胎盘的功能产生影响,导致妊娠合并症与并发症的发生。caspase3是细胞凋亡过程中最主要的终末剪切酶,其活化的标志是从前体型的pro-caspase3转变为激活型的cleaved-caspase3,也是细胞凋亡的标志性事件。在存在子痫前期和FGR患者的胎盘中,cleaved-caspase3蛋白质的表达明显增加[18]。本研究通过检测不同剂量PFOS(0、0.001、0.01、0.1、1、10 μmol/L)处理后胎盘合体滋养细胞中pro-caspase3和cleaved-caspase3蛋白质表达的变化,发现PFOS能够呈浓度依赖性地下调胎盘合体滋养细胞中pro-caspase3蛋白质表达,上调cleaved-caspase3蛋白质表达,同时caspase3的酶活性随着PFOS浓度的升高而增强。上述结果提示,PFOS能够促进胎盘合体滋养细胞凋亡,且随着PFOS剂量的增高其促进细胞凋亡的作用增强。但是PFOS对11β-HSD2和caspase3作用之间的相关性仍需进一步研究予以明确。
综上所述,本研究证实了EDC PFOS能够抑制人胎盘合体滋养细胞11β-HSD2的表达和酶活性,促进该细胞凋亡,且作用强度随着PFOS浓度的升高而增强。笔者推测,这可能是PFOS暴露导致FGR等妊娠合并症与并发症发生的主要原因之一,其可影响胎儿的生长发育。

