D-阿洛糖减轻缺血再灌注损伤分子机制的研究进展*
付奕豪,张 磊,高大宽
空军军医大学西京医院 神经外科(西安 710032)
缺血再灌注损伤是以器官供血受限,随后血流和供氧恢复,出现明显的结构、功能变化为特征的一种病理过程[1]。血流恢复后可能导致潜在的有害影响,如细胞坏死、细胞肿胀以及组织各部分血流不均匀恢复等。再灌注阶段,血流的恢复导致破坏性炎症反应,产生大量活性氧,细胞内钙离子堆积,引起细胞凋亡蛋白释放,导致大量细胞凋亡[2]。针对缺血再灌注的损伤机制,有研究[3-5]提出,可以使用如缺血预处理、爱帕琳肽、褪黑素等治疗方法或治疗药物减轻缺血再灌注损伤。近年来,D-阿洛糖被发现具有对抗缺血再灌注损伤的作用。最近的研究[6]发现,D-阿洛糖对抗缺血再灌注损伤时,主要在抑制中性粒细胞的激活、减少细胞因子与趋化因子的释放等方面发挥重要作用。因此,D-阿洛糖近年来已成为抗缺血再灌注损伤研究的热点靶向药物,相关基础分子机制研究为临床治疗提供了新思路和实验基础。
1 D-阿洛糖的概况
D-阿洛糖是一种罕见的单糖,化学式为C6H12O6,其化学结构是D-葡萄糖的C-3异构体或D-阿洛酮糖的醛糖异构体[7]。D-阿洛糖在自然环境中很少出现,其甜度是蔗糖的80%,但热量极低,可以作为蔗糖的理想替代品[8]。因为其化学合成过程十分复杂且选择性差,因此酶法合成是目前生产D-阿洛糖最常用的方法[9]。最初,Hossain等[10]报道,D-阿洛糖(美国专利No.5620960, 1997)可以抑制大鼠体内中性粒细胞的产生并降低血小板数量,而对大鼠没有其他明显的不利影响,并且与传统免疫抑制剂FK506(他克莫司 Tacrolimus)相比,D-阿洛糖具有不良反应小的特点。在大鼠体内研究[11]中发现,其半数致死量(LD50)为20 g/kg。最近的研究[12-17]发现,D-阿洛糖在肝脏、肾脏、皮肤、脑等器官的缺血再灌注损伤中发挥着重要的保护作用,其保护作用与抑制相关的炎症因子释放有关,它还可以抑制抗原提呈细胞对抗原的摄取,从而阻止对下游炎症细胞的激活,并且在肝脏的缺血再灌注损伤中,与别嘌醇和超氧化物歧化酶在细胞保护功能和炎症抑制作用上比较,D-阿洛糖是一种功效更强的缺血再灌注损伤保护剂。
2 D-阿洛糖抗缺血再灌注损伤相关分子
2.1 肿瘤坏死因子-α
肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)是由哺乳动物活化的巨噬细胞和单核细胞产生的血清糖蛋白,它可以导致肿瘤细胞坏死,并且抑制肿瘤细胞增殖,在创伤或感染时迅速释放,而且在免疫反应、炎症和凋亡等过程中具有决定性作用[18]。Ueki等[15]研究发现,D-阿洛糖可以减轻炎症反应所导致的急性肾功能损伤,用脂多糖诱导大鼠急性肾损伤的同时注射400 mg/kg D-阿洛糖,与对照组相比,注射D-阿洛糖大鼠的血清中,尿素氮和血肌酐的含量明显降低,这表明D-阿洛糖可以有效减轻急性肾损伤的程度,并且检测了血清以及肾组织中TNF-α的含量后发现,注射D-阿洛糖大鼠的血清中TNF-α含量明显低于对照组,在肾组织中TNF-α含量也较对照组有明显下降,这提示D-阿洛糖的抗炎作用可能与其减少体内TNF-α的释放,从而阻止中性粒细胞活化有关[6]。Huang等[19]在对小鼠大脑缺血再灌注损伤模型的研究中发现,注射D-阿洛糖的小鼠神经功能损伤程度、大脑坏死区域以及脑组织水肿程度都明显低于对照组,并且与注射0.2 mg/g D-阿洛糖的小鼠相比,注射0.4 mg/g D-阿洛糖可以更好地减轻神经功能损伤和脑组织梗死面积,在检测脑组织TNF-α含量时发现在注射0.4 mg/g D-阿洛糖后,脑组织中TNF-α含量与对照组相比有明显降低,这也表明D-阿洛糖在减轻缺血再灌注损伤的炎症反应作用与抑制TNF-α的活性密切相关。Shinohara等[20]对沙鼠进行研究时发现,阻塞沙鼠双侧颈总动脉5 min后再通,在运动功能障碍的表现上,注射400 mg/kg D-阿洛糖组较对照组相比有明显改善,而注射200 mg/kg D-阿洛糖组与对照组相比差异无统计学意义(P>0.05)。研究D-阿洛糖对细胞因子影响的实验[19]发现,缺血动物的海马区的TNF-α、IL-6和IL-1β的表达明显增加,而在缺血后立即经400 mg/kg D-阿洛糖处理的沙鼠中,这些炎症因子的表达较前者明显降低,由此推断D-阿洛糖抑制缺血导致的海马区TNF-α、IL-1β和IL-6上调,从而减轻海马区受到短暂性局部缺血的损伤。但是Shinohara等[20]发现,在对沙鼠注射100 mg/kg D-阿洛糖后没有表现出神经保护作用,而Muneuchi等[14]在大鼠腹部皮肤岛状皮瓣缺血再灌注损伤研究中发现,注射100 mg/kg D-阿洛糖后,明显提高了皮瓣成活率。因而,D-阿洛糖在保护效能与使用剂量之间的关系还需进一步研究阐明。
2.2 谷氨酸
谷氨酸(glutamate,Glu)是一种天然的非必须氨基酸,是存在于中枢神经系统中最常见的兴奋型神经递质。它在神经元中合成,并在神经细胞末端附近的突触囊泡中运输、储存,神经冲动发生时释放到突触间隙,并启动一个受体介导的信号通路[21]。Hirooka等[22]研究了大鼠视网膜的缺血再灌注损伤,他们通过将大鼠眼压增加至130 mm Hg(1 mm Hg=0.133 kPa),并保持45 min来构建实验模型,实验组在构建模型前30 min预先注射了不同浓度的D-阿洛糖溶液(50、100、200、400 mg/kg),D-阿洛糖处理组的神经节细胞层细胞数与内丛状层的厚度较对照组有明显改善,在监测缺血再灌注过程中玻璃体内Glu含量时发现,缺血过程起始阶段Glu含量增高,血流再通后,Glu水平再次升高,约20 min达到最大值,而D-阿洛糖处理组Glu含量的上升在缺血和再灌注阶段都被有效抑制,因此猜想缺血再灌注损伤与这种兴奋性神经递质相关,它们过度活化特别是对Glu受体的刺激,通常会导致细胞死亡,而D-阿洛糖正是通过降低细胞外Glu水平从而抑制缺血再灌注对视网膜的破坏。Liu等[23]研究了沙鼠大脑缺血再灌注损伤,实验组在构建模型前后分别注射200 mg/kg D-阿洛糖,缺血时细胞Glu释放增加,细胞外Glu含量呈尖峰,随后Glu含量小幅下降,再灌注阶段Glu出现二次释放,持续约1 h后回到初始值,D-阿洛糖处理后明显抑制了Glu的释放,并且在再灌注阶段Glu第2次释放峰完全消失,该结果表明D-阿洛糖对缺血再灌注,特别是再灌注过程中细胞外Glu水平有降低作用,从而抑制Glu的兴奋毒性,起到细胞保护作用。
2.3 乳酸
乳酸(lactate,Lac)是糖酵解的最终产物,并且可以作为一种分子信号调节活性氧的生成,高水平的Lac可以导致氧化应激、酸中毒和线粒体依赖的细胞凋亡,Lac信号的级联反应也会加重缺血再灌注损伤[24]。Liu等[23]对沙鼠大脑缺血再灌注损伤的研究中发现,缺血和再灌注阶段,细胞外的Lac水平持续升高,而在经D-阿洛糖处理后,缺血阶段的Lac释放没有明显改变,而再灌注时Lac释放降低,检测细胞外氧分压也发现,D-阿洛糖可以增加再灌注期细胞外的氧分压,通过这项研究结果可以推断D-阿洛糖可能通过抑制Lac合成和释放,从而抑制氧化应激反应,达到细胞保护的作用。
2.4 核因子-κB
核因子-κB(nuclear factor kappa-B,NF-κB)是免疫反应的关键调节因子,可以加速细胞增殖,抑制凋亡,促进细胞迁移和侵袭,并刺激血管生成,驱动炎症反应。病毒和细菌感染、坏死细胞产物、DNA损伤、氧化应激和促炎细胞因子都可以诱导NF-κB的活化[25]。Huang等[19]发现,小鼠在缺血再灌注损伤后,脑组织内NF-κB明显升高,而注射0.4 mg/g D-阿洛糖小鼠与对照组相比,NF-κB的含量明显降低,这表明D-阿洛糖在缺血再灌注损伤过程中发挥的抗炎作用与抑制NF-κB的活性密切相关。进一步研究[26]发现,发挥这一功能可能依赖于过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPARγ)的活化,活化后的PPARγ与NF-κB的p65和p50组分结合,从而抑制NF-κB的激活,降低NF-κB下游靶基因的转录水平。
2.5 环氧化酶-2
环氧化酶(cyclooxygenase,COX)是一组含血红素的同工酶(即COX-1和COX-2),它们可以催化花生四烯酸转化为具有生物活性的前列腺素(prostaglandin PGs),当细胞受到炎症等刺激时,COX-2在炎症细胞中的表达水平升高,主要在大鼠脑中的星形胶质细胞和小胶质细胞中表达增加,某种程度上促进炎症反应的发生[27]。Gao等[28]研究发现,当小鼠注射300 mg/kg D-阿洛糖后,其大脑梗死面积明显小于对照组,进一步研究发现,表达COX-2的细胞主要聚集在坏死区,而实验组中COX-2阳性细胞明显少于对照组,且COX-2与神经元核抗原出现共定位现象,这个结果不但表明COX-2可以作为评价大脑损伤的重要指标,而且也证实了D-阿洛糖在大脑缺血再灌注损伤中发挥了重要的抗炎作用。
2.6 丝裂原活化蛋白激酶磷酸酶-1
丝裂原活化蛋白激酶磷酸酶-1(mitogen-activated protein kinase phosphatase 1,MKP-1)是一种可诱导的核双重特异性蛋白磷酸酶,可以在体外和体内去磷酸化,并且抑制丝裂原或压力激活蛋白的磷酸化[29]。Ju等[30]的研究发现,当小鼠皮肤发生缺血再灌注损伤时,小鼠MKP-1明显升高,但p-ERK1、p-ERK2、p-ERK1/ERK1、p-ERK2/ERK2等蛋白表达降低,这是由于MKP-1是ERK通路的特异性负向调控因子,可阻断其底物活性,产生抑制其抗凋亡的作用,经D-阿洛糖处理后,MKP-1含量降低,MKP-1的抑制机制被抵消,同时ERK1/2抑制剂PD-98059可以通过抑制作用逆转D-阿洛糖对皮瓣存活的保护作用,并且导致氧化应激和坏死相关炎症因子水平升高,因此可以得出,D-阿洛糖可能通过抑制MKP-1的表达,进一步抑制氧化应激、炎症和坏死的发生,从而发挥缺血再灌注损伤的保护作用。但是MKP-1也可以发挥抗氧化,维持氧化还原稳态的作用[31]。因此,对于MKP-1在疾病发生时究竟是产生保护还是损害作用,还需要进一步深入研究来阐明。
2.7 基质金属蛋白酶
基质金属蛋白酶(matrix metalloproteinase,MMP)是一种钙依赖的锌内肽酶超家族,参与大脑和血脑屏障的许多生理、病理过程,通过降解紧密连接蛋白来破坏血脑屏障的完整性,从而增加其通透性,其与神经炎症、脑中风、癫痫、脑肿瘤等多种疾病的发生相关[32]。在炎症反应过程中,白细胞通过细胞因子相互作用黏附到血管壁,产生IL-6和TNF-α,刺激MMP产生,破坏血脑屏障[33]。Gao等[34]研究发现,经缺血再灌注损伤的小鼠MMP-9的表达明显增加。Cheng等[35]将神经元细胞经氧糖剥夺处理后,发现MMP-9较正常状态下明显上升,当经白藜芦醇处理后发现,伴随PPAR-α的表达增加,MMP-9的水平明显下降,提示PPAR-α在抑制MMP-9的表达中发挥重要作用。黄涛等[36]研究同样发现,小鼠大脑遭受缺血再灌注损伤后,MMP-9的表达明显增多,经D-阿洛糖处理后,小鼠大脑坏死面积和水肿程度明显减轻,且MMP-9的表达明显减少,可以说明D-阿洛糖抑制脑缺血再灌注损伤是通过减少MMP-9的表达,起到神经保护的作用。
作为一种理想的神经保护剂,需要具有不良反应少、易于院前应用的特点[37],D-阿洛糖作为一种潜在的神经保护剂,未来可能拥有更加广阔的应用前景(图1)。
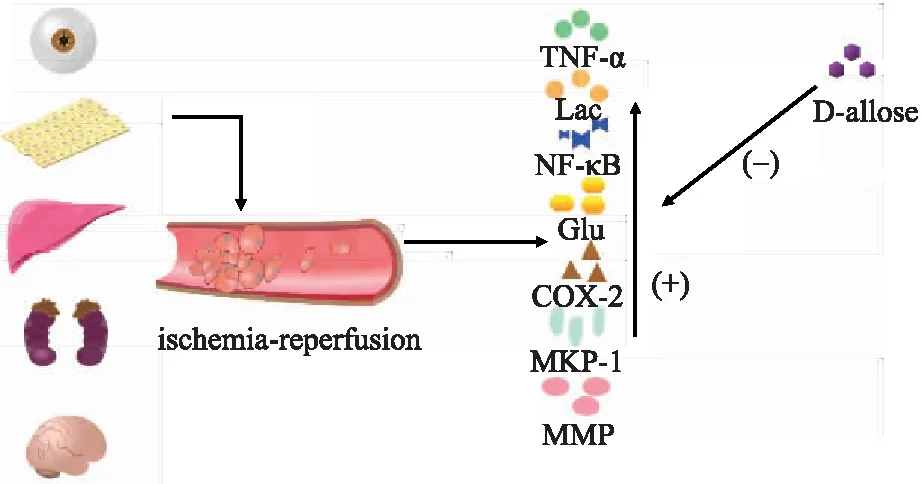
图1 D-阿洛糖抑制在缺血再灌注损伤中表达增加的TNF-α、Glu、Lac、NF-κB、COX、MKP-1和MMP等炎性因子
3 小结
D-阿洛糖在各器官的缺血再灌注损伤中都发挥着重要的保护作用,通过抑制缺血再灌注后某些损伤分子的表达发挥保护作用,但其保护机制尚待进一步研究。目前,尚无关于其在人体中的代谢途径、生理作用、毒性或安全性的系统研究,所以何种剂量在人体中可以发挥保护作用还需进一步研究。另外,D-阿洛糖的化学合成相对昂贵,如何获取成本低廉且纯净的D-阿洛糖,也是在其应用于临床治疗缺血再灌注损伤前需要解决的问题之一。当前,对于D-阿洛糖与其他抗缺血再灌注损伤药物的联合作用的研究还处于空白阶段,因此未来还需要进一步的实验来验证D-阿洛糖与其他抗缺血再灌注损伤药物的联用效果,阐明它们之间的相互作用机制,为解决缺血再灌注损伤开辟新的方向。
综上所述,随着对D-阿洛糖在缺血再灌注损伤保护作用机制研究的不断深入,可以更加全面、完整地了解这种稀有单糖的生理功能,并且为缺血再灌注损伤疾病的治疗、改善其预后提供新思路。