腹部放射学会和欧洲泌尿生殖放射学会关于植入性胎盘谱系疾病MRI检查的联合声明及临床病例解读
赵玉娇,尤丛,沈文
植入性胎盘谱系疾病(placenta accreta spectrum,PAS)系胎盘绒毛在蜕膜基底层以外异常侵袭所致。根据胎盘绒毛侵入蜕膜和子宫肌层的不同深度,可形成胎盘粘连(placenta accreta,PA)、植入性胎盘(placenta increta,PI)和穿透性胎盘(placenta percreta,PP)[1]。既往有剖宫产、前置胎盘、高龄孕妇、高孕率、高产次及多次流产并刮宫等病史都是植入性胎盘的危险因素[2]。近年来,侵袭性胎盘的发病率逐渐增加,主要归因于剖宫产数量的增加和产妇高龄[3]。PAS是围产期子宫切除术的主要原因,甚至可导致无法控制的围产期和产后出血,产妇病死率高达7%,当病变侵犯膀胱时,这一比例甚至更高[4]。
随着我国二胎政策及晚婚晚育政策的发布,剖宫产、宫腔手术和高龄孕妇等相关危险因素的发生率不断增加,PAS的发病率逐年增加,为孕产妇的生命安全埋下巨大隐患。对PAS的最终诊断通常在手术过程中才能明确,而准确的产前诊断可改善治疗计划及患者预后,减少手术风险,具有重要的临床意义。超声检查是评估PAS的一线检查手段[5],但在准确评估PAS类型及胎盘绒毛侵袭深度方面价值有限[6]。磁共振成像的对比度分辨率较高,能准确显示胎盘绒毛侵袭深度及侵袭部位,目前正越来越多地用与PAS的术前诊断及指导临床制订合适的诊疗方案[7]。目前国内不同医疗机构对PAS的特异性MRI征象和病例诊断分析过程尚无统一标准,不能满足临床实践的需求。2020年美国腹部放射学会(SAR)及欧洲泌尿生殖放射学会(ESUR)发布的联合声明提出了PAS的MRI采集、图像解读和报告一致性共识,并肯定了MRI相对于超声的附加价值,尤其是在充分描述胎盘浸润程度和部位方面。本文对共识中推荐的诊断PAS的特异性MRI征象进行了详细解读,并结合临床典型病例分析和总结PAS 的MRI诊断思路,旨在提高对PAS的影像诊断水平。
MRI检查规范化流程
1.硬件及患者准备
共识中推荐的MRI扫描最小磁场强度为1.5T;根据机构设备配置及针对孕妇的MR成像方案,也可选用3.0T的磁共振成像仪进行检查。美国放射学院(American College of Radiology,ACR)制定的MR检查安全指南中规定,使用正常水平的特定吸收率模式(<2 W/kg),在场强为3.0T或更低时,孕妇进行MRI检查是安全的[8-9]。目前,未见有文献报道这一强度的磁场暴露对胎儿有不利影响(如致畸和/或听觉损伤)。建议患者取仰卧位,使用骨盆相控阵线圈,适度充盈膀胱;不需要也不推荐使用静脉注射钆类对比剂[9]。疑似PAS的孕妇进行MRI检查的最佳时间为胎龄28~32周[10]。
2.序列和成像平面
二维半傅立叶单次脉冲自旋回波(half fourier single-shot turbo spin echo,HASTE)序列是评估PAS的必需序列,此序列GE公司的MR扫描仪上称为单次激发快速自旋回波(single-shot fast spin echo,SSFSE),在Phillips公司的MR扫描仪上称为单次激发快速自旋回波(single-shot turbo spin echo,SSH-TSE)或超快速自旋回波(ultra-fast spin echo,UFSE)。成像方位为经子宫的矢状面、冠状面和横轴面。横轴面T2WI序列应垂直于胎盘-子宫肌层界面,建议采用≤4 mm的采集层厚,层间距为0。对于胎盘绒毛侵犯程度的评估,推荐使用非脂肪抑制(nonfat-suppressed sequences)序列T2WI。对于胎盘内或胎盘后出血/早剥,推荐使用横轴面或矢状面脂肪抑制TSE T1WI序列。多平面稳态自由进动(steady-state free procession,SSFP)序列和DWI作为可选序列,有助于确定严重充血的子宫肌层与胎盘的边界,但目前尚缺乏DWI对评估PAS价值的相关文献。对于PAS患者,1.5T和3.0T磁共振扫描仪的推荐扫描方案见表1~2。
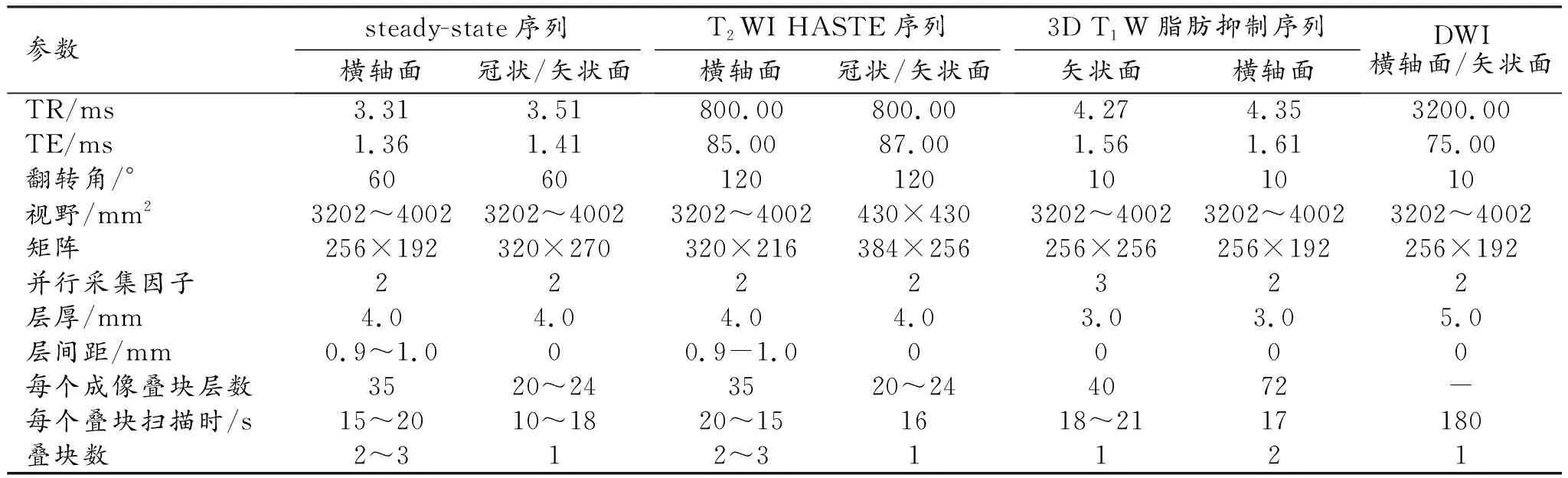
表1 PAS孕妇胎盘检查1.5T MR扫描方案
正常胎盘和子宫肌层的MRI表现
在MR图像上,妊娠子宫呈倒置梨形、边缘光滑、无膨出,子宫肌层信号分层,在妊娠期的不同时期其厚度各不相同。T1WI无法清晰显示子宫肌层的各层结构,推荐采用T2WI来评估子宫肌层的形态及信号特点[11]。妊娠中期,子宫肌层分为3层,内层由基底层蜕膜和子宫内肌层组成,构成子宫-胎盘界面,外层为子宫浆膜,子宫内、外肌层呈低信号,而较厚的中层相对于胎盘呈高信号,随着妊娠进展,其信号强度逐渐增高(图1a~b)[12-14],少数血管流空影通常见于中间层。在妊娠晚期,通常在孕30周后,子宫肌层的各层变薄,因而分层状结构相对不明显,在T2WI上表现为胎盘周围连续的低信号条带(图1c)。

表2 PAS孕妇胎盘MRI检查,3.0T MRI成像方案
正常胎盘呈对称的圆盘状,边缘逐渐变细,不同孕期胎盘信号不一致,推荐24~30周为最佳评估胎盘植入时间。在妊娠12~24周,胎盘在T2WI上呈均匀的中等信号强度,与子宫肌层信号区别明显,在胎盘-子宫内肌层界面显示为连续的低信号线;孕24~30周,胎盘不断增厚,胎盘小叶间隔出现,胎盘异质性增加;孕30周后,胎盘异质性更加明显(图2)。
PAS常见MRI征象及临床病例分析
专家共识小组经文献回顾后总结了11项PAS常见MRI表现,再经ESUR-SAR胎盘工作组成员问卷答复,七项MRI征象≥80%同意,达成共识,推荐为PAS常见MRI影像学征象。为了提高对PAS常见MRI征象的认识及便于临床实践解读,对以上征象根据发生部位进行分组描述:胎盘、胎盘-子宫内肌层界面、子宫肌层和宫外侵犯。
1.PAS常见胎盘MRI征象
T2WI胎盘内低信号带:T2WI胎盘内低信号带是诊断 PA、PI及PP最敏感的MRI征象,但特异性不高[16]。研究证实其形成机制为胎盘内反复出血或梗死引起的纤维蛋白沉积[17],表现为T2WI上位于胎盘边缘或散在分布的低信号带,直径通常为6~20 mm,也可更大(图3~4),常与胎盘母体面接触,其数量增加与胎盘侵袭深度有关[18]。T2WI胎盘内低信号带可合并其它影像学征象,包括异质性胎盘和前置胎盘等。此外,研究证实胎盘内低信号带是不良母体结局的重要预测因子,与术中失血量增加和需采用子宫切除术治疗有关[19]。
T2WI胎盘内低信号带也可见于正常成熟胎盘,尤其是在妊娠30周、先兆子痫和胎儿宫内生长受限之后[18]。在正常成熟胎盘中,T2WI低信号带通常位于胎盘的胎儿面,与异常低信号带通常出现在胎盘的母体面的特点不同[20]。正常胎盘小叶间隔表现为细长、规则分布的T2WI低信号带,区别于PAS胎盘中所见粗大、杂乱分布的T2WI低信号带。
胎盘/子宫膨出:胎盘/子宫膨出(placental/ute-rine bulge)作为评估胎盘浸润子宫肌层的重要征象[11,22,23],与PI和PP的存在高度相关[23],诊断PAS的准确性高,敏感度和特异度分别为76.7%和62.5%[16]。胎盘/子宫膨出的影像学表现为胎盘组织向邻近器官(通常是膀胱和子宫旁)异常膨出,导致子宫轮廓扭曲、浆膜偏离正常位置、子宫下段增宽呈沙漏状,此征象在冠状面和/或矢状面图像上显示较好(图5、6)[16]。PAS孕妇胎盘MRI检查发现胎盘/子宫膨出伴局部肌层中断时,该征象诊断特异性增加[22]。
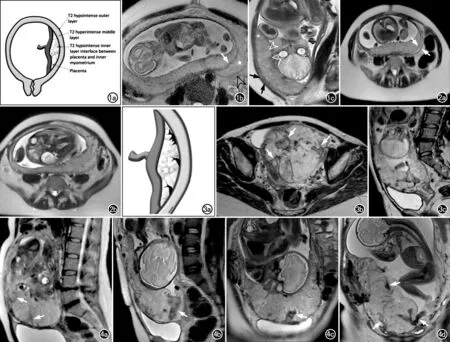
图1 正常胎盘和子宫肌层。a)胎盘和子宫肌层MRI信号特征示意图,显示子宫呈梨形,下部变窄、无隆起改变。正常胎盘呈对称的盘状外观,边缘逐渐变细。在T2W图像上,正常胎盘-子宫内肌层界面为低信号层;子宫肌层呈分层状,内层和外层呈低信号,中间层为高信号。(图例选自Jha P等的文献[5]); b)32岁孕妇妊娠30周时的正常妊娠子宫。横轴面SSFSE T2WI,显示正常子宫肌层的分层状表现:低信号的内层(白箭),较厚的高信号中间层(星号),较薄的低信号外层(黑箭头);c)矢状面SSFSE T2WI,示胎盘厚度正常,轮廓光滑,向两侧边缘逐渐变薄(星号),其内有少量小血管流空影(白箭头),蜕膜基底层与子宫内肌层的界面完整,呈低信号线条影(黑箭),其在妊娠后期显示不明显。(图例选自Srisajjakul S等的文献[15])。图2 不同孕期胎盘在MR T2W图像上的信号特点。a)中孕期,子宫壁分3层的分层状表现显示较为清楚(白箭),胎盘信号相对较均匀;b)孕晚期,胎盘异质性明显增加,胎盘-子宫内肌层界面的低信号线状影显示不清,子宫肌层变薄。(图例选自Masselli G等的文献[12])。 图3 T2WI胎盘内低信号带图例。a)胎盘结构示意图示T2WI胎盘内有低信号条带,常与胎盘的母体面接触;b)横轴面T2WI示胎盘内有多条低信号带(白箭),接触胎盘母体面;c)矢状面T2WI示PAS其它征象,包括异质胎盘和前置胎盘。(图例选自Jha P等[5]的文献)。 图4 PAS孕妇T2WI胎盘内低信号带典型图像。a)43岁PAS孕妇,妊娠32周。矢状面T2WI显示胎盘内不规则低信号带(白箭)的长度大于2cm,位于胎盘母体面,经病理证实为胎盘粘连;b~c)35岁PAS孕妇,矢状面和冠状面T2WI显示胎盘内粗大、不规则的低信号带(白箭)位于胎盘母体面,与胎盘内信号不均匀相关,同时可见前置胎盘,术中病理证实为胎盘植入;d)35岁PAS孕妇,妊娠32周。冠状面T2WI显示胎盘内信号不均匀,可见多条不规则、杂乱分布的低信号带(白箭),部分位于胎盘胎儿面,经病理证实为穿透性胎盘。(图a选自Azour L等[21]的文献;图b~c选自Chen T等[19]的文献;图d选自Srisajjakul S等[15]的文献)。

图5 胎盘膨出。a)胎盘结构示意图示胎盘组织异常膨出,引起子宫浆膜偏离正常位置,通常伴有膨出区域的子宫肌层变薄;b)矢状面T2WI显示胎盘组织异常膨出(白箭),导致子宫浆膜偏离正常位置,子宫轮廓变形。(图例选自Jha P等[5]的文献)。 图6 胎盘/子宫膨出典型病例,32岁PAS孕妇,妊娠27周,剖腹产5次,超声检查怀疑胎盘植入。a)冠状面T2WI清晰显示胎盘右侧及右下段子宫明显膨出,轮廓变形(虚线),膨出部位的子宫肌层明显变薄,同时可见胎盘内低信号带(白箭);b) 横轴面T2WI显示胎盘膨出致右下段子宫外部轮廓(虚线)偏离正常位置,向子宫后部延伸,胎盘内可见低信号带(黑箭),右侧可见不对称性宫旁静脉充血(白箭)。剖宫产术后病理证实为右下段子宫肌层胎盘植入,浸润程度接近100%。(图例选自Jha P等[23]的文献)。 图7 异质性胎盘图例。a)胎盘结构示意图,异质性胎盘表现为胎盘内除T2WI低信号带和胎盘内异常血管之外的信号不均匀改变;b)冠状面T2WI示异质性胎盘,表现为胎盘信号不均匀,可见多个低信号带(黑箭)和异常的流空血管影;c)妊娠32周孕妇。冠状面T2WI示胎盘内信号不均匀,伴有胎盘内异常低信号带(白箭)和胎盘上部紊乱增多的血管影(星号),经病理检查为穿透性胎盘。(图b选自Jha P等[5]的文献;图c选自Srisajjakul S等[15]的文献)。 图8 胎盘不对称增厚/形状图例。a)胎盘结构示意图,在受PAS影响的部位可见胎盘不对称增厚,可伴有PAS其它征象,如胎盘内T2WI低信号带;b)矢状面T2WI,与正常胎盘组织(黑箭)相比,受PAS影响部位的胎盘不对称增厚(白箭)。(图例选自Jha P等的文献[5])。 图9 胎盘缺血性梗死图例。a)胎盘结构示意图,示梗死区因局部胎盘组织丢失而异常变薄;b~c)矢状面T2WI示胎盘内呈低信号的楔形梗死区域(白箭),局部胎盘组织变薄。(图a例选自Jha P等[5]的文献;图b~c选自Kapoor H等[25]的文献)。
胎盘/子宫膨出需要与以下征象进行鉴别。①膀胱静脉曲张:DWI可鉴别膀胱静脉曲张及子宫轮廓膨出,曲张的膀胱静脉在DWI上呈低信号,而胎盘/子宫膨出在DWI上显示为高信号[13,24]。②母体脐部局灶性隆起:母体脐部局灶性隆起是由于妊娠晚期腹直肌鞘分离而导致的子宫肌层前部局灶性隆起(图1b)[24]。此征象可能与子宫轮廓膨出相混淆,但母体脐部局灶性隆起患者的子宫肌层形态正常且正常情况下可见的胎盘-子宫内肌层界面仍可显示。
异质性胎盘:异质性胎盘(placental heterogeneity)内可见不规则的较大血管流空影,呈“虫蚀样”表现(图7)。胎盘的异质性是由T2WI低信号带、胎盘内血管分布异常和胎盘缺血性梗死等多种因素所导致。
胎盘形状不对称/增厚:胎盘不对称增厚/形状(asymmetric shape/thickening of the placenta),表现为在受PAS影响的部位胎盘不对称增厚,这一征象通常与PP有关。可同时伴有PAS的其它征象,如胎盘内T2WI低信号带(图8)。
胎盘缺血性梗死:正常胎盘厚度均匀,边缘光滑,无胎盘深部组织丢失。而受PAS影响的异常胎盘因梗死区胎盘组织局部丢失而异常变薄,表现为胎盘局部楔形低信号区域,可伴有T2WI低信号带(图9)。T2WI低信号带伴缺血性梗死(placental ischemic infarction)征象可提高诊断PAS的特异性。
胎盘内异常血管:正常胎盘内无大的血管流空影。胎盘内异常血管(abnormal intraplacental vascularity)表现为胎盘内曲折、杂乱的血管影,尤其是远离脐带的插入部位(图10)。血管结构在SSFSE序列(黑血)图像上显示为流空影,在SSFP序列(亮血)图像上显示为高信号结构[26]。
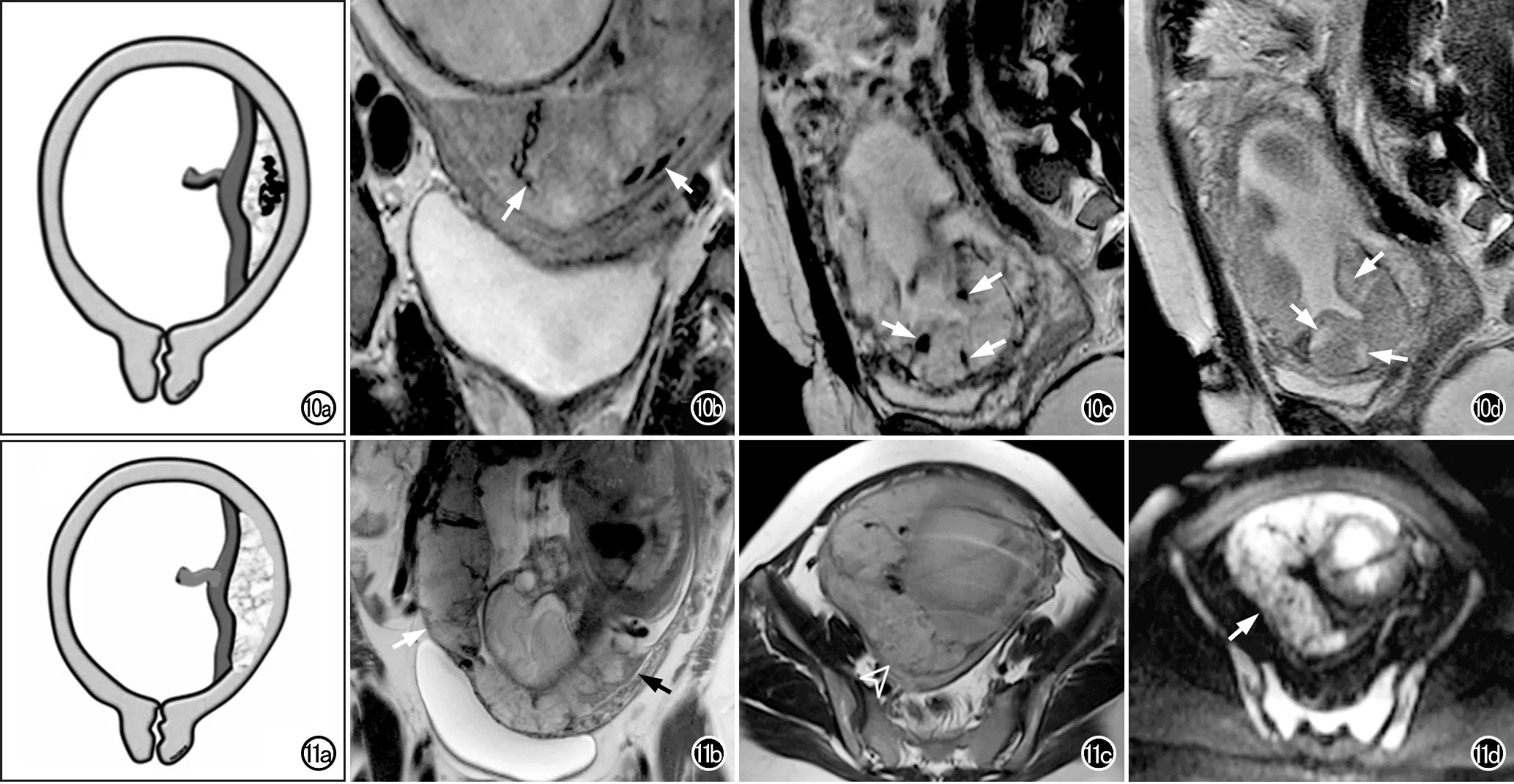
图10 胎盘内血管异常图例。a)胎盘结构示意图,因正常胎盘内无大的流空血管影,故在T2WI上在胎盘深处出现的曲折走行的较大血管流空影与PAS有关;b)冠状面T2WI示胎盘深部有曲折走行的增大血管流空影(白箭);c~d)32岁孕妇,妊娠18周,剖宫产2次。矢状面HASTE序列T2W图像(图c)示胎盘内呈低信号的血管流空影(白箭),其在相应层面的True-FISP图像(图d)上呈高信号(白箭),经病理证实为穿透性胎盘。(图b选自Jha P等[5]的文献;图c~d选自Azour L等[21]的文献)。 图11 T2WI胎盘后低信号线消失图例。 a)胎盘解剖示意图示胎盘-子宫内肌层低信号界面的低信号缺失;b)矢状面T2WI示胎盘后低信号线缺失(白箭),左侧可见正常的呈低信号的胎盘-子宫内肌层界面(黑箭);c)另外一例PAS孕妇的横轴面T2WI,示子宫右后外侧胎盘后低信号线局部缺失(白箭头),疑有肌层侵犯;d)图c相应层面的DWI(b=1000s/mm2)图像,示胎盘轮廓平滑(白箭),呈正常高信号,无子宫肌层侵犯的证据。因此,仅依靠此征象诊断PAS特异性较差。(图b选自Jha P等[5]的文献;图c~d选自Srisajjakul S等[15]的文献)。
在胎盘常见PAS MRI征象的问卷调查中,异质性胎盘、胎盘形状不对称/增厚、胎盘缺血性梗死和胎盘内异常血管这4项MRI征象获得同意的比例<80%,即未达成共识,故在此联合声明中被归类为PAS的“不确定”MRI征象。
2.PAS胎盘-子宫内肌层界面常见MRI征象
T2WI胎盘下缘低信号线消失:MR T2W图像上正常胎盘-子宫界面表现为连续的低信号线。PAS孕妇胎盘向子宫肌层异常侵袭,可见相应位置胎盘-子宫内肌层界面的低信号线局部中断或消失[11](图11)。T2WI上子宫肌层局部缺失或变薄联合胎盘-子宫内肌层界面中断可预测PAS,敏感度高(97.4%),但特异度较低(36.4%)[27]。
胎盘-子宫界面中断或消失在MRI上显示较为困难,而且可能是PAS的非特异性影像学表现。妊娠晚期以及既往有剖宫产史的孕妇在瘢痕部位均可见子宫肌层变薄[28],此时子宫-胎盘界面显示困难,且在足月妊娠期T2WI上胎盘下缘低信号线经常缺失,此征象诊断PAS的准确性较低,当合并子宫肌层变薄等其它异常征象时,可提高诊断敏感度[14]。
3.子宫肌层PAS常见MRI征象
子宫肌层变薄:PAS发生时胎盘向子宫肌层异常侵袭,故可见胎盘后子宫肌层较非胎盘附着处变薄(myometrial thinning)、甚至不可见。子宫肌层变薄是诊断早期PAS的征象[18](图12a~b),但是,仅依据子宫肌层变薄来诊断PAS的特异性较低,因正常妊娠晚期胎盘附着部位及剖宫产术后瘢痕区都可能出现子宫肌层变薄(图13c)。因此,MRI检查显示子宫肌层变薄时,应该寻找其它的影像特征来帮助诊断PAS,当子宫肌层变薄合并有局限性肌层中断时可提高诊断准确性(图13)。
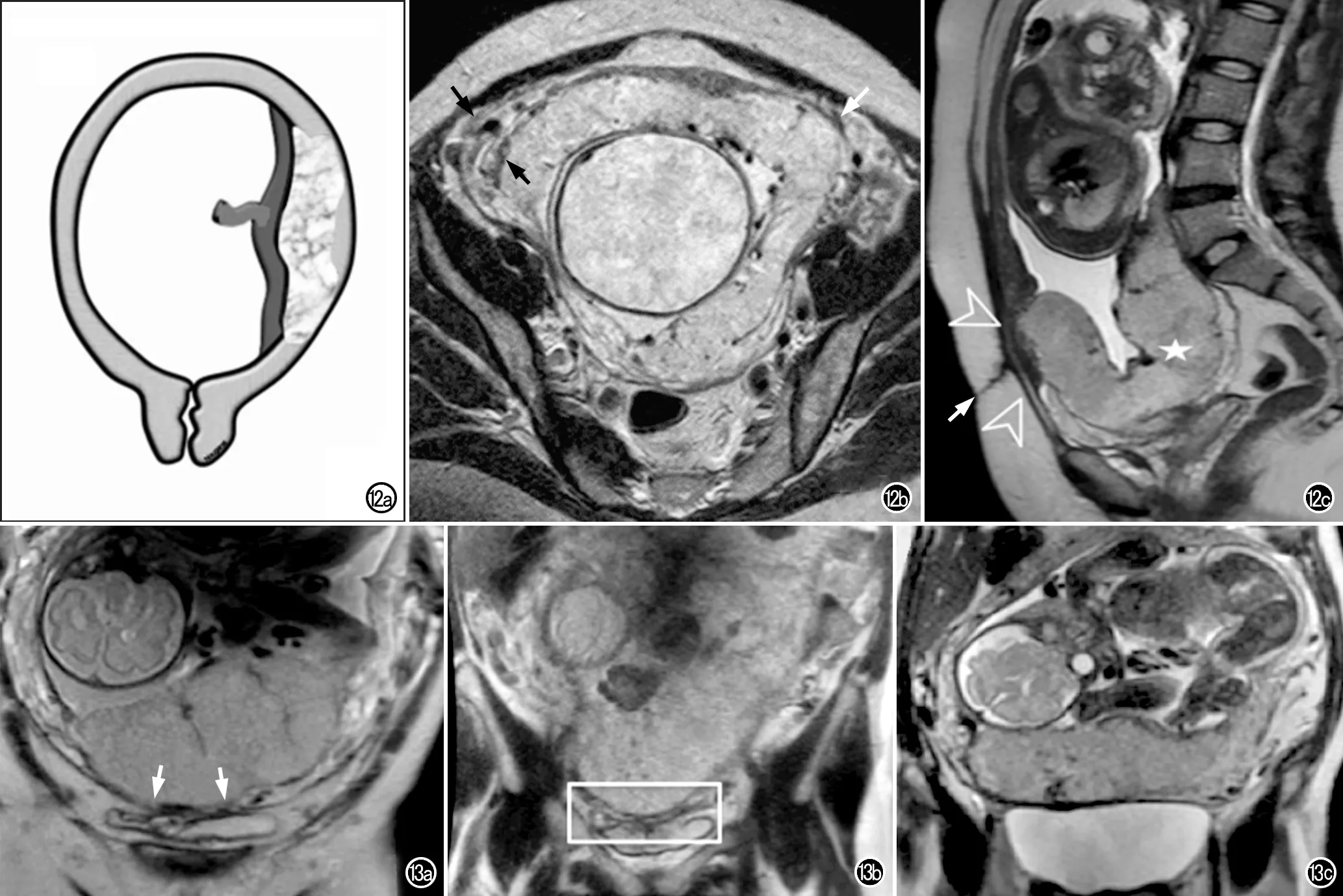
图12 子宫肌层变薄图例。a)胎盘解剖示意图示胎盘附着处子宫肌层变薄,部分肌层甚至不可见。在胎盘植入区域,子宫肌层变薄的程度可能不同;b)横轴面T2WI显示子宫肌层变薄,左侧胎盘-子宫内肌层低信号界面消失,呈低信号的子宫外肌层/子宫浆膜层尚可见(白箭),右侧可见正常肌层的三明治样表现(黑箭);c)30岁孕妇,妊娠29周,完全性前置胎盘(星号)。矢状面T2WI上可见剖宫产疤痕和皮肤切口(白箭),疤痕处肌层变薄,为正常术后改变,局部无肌层侵犯(白箭头)。(图b选自Jha P等[5]的文献;图c选自Srisajjakul S等[15]的文献)。 图13 子宫肌层变薄典型病例,43岁PAS孕妇,妊娠30周,既往有剖宫产、前置胎盘和胎盘粘连病史。a)冠状面T2WI显示子宫前壁肌层变薄(白箭),子宫-膀胱界面显示不清;b)子宫后壁层面冠状面T2WI上清晰显示正常肌层的三层结构(矩形框);c)2周后随访,冠状面T2WI显示膀胱完全充盈,子宫-膀胱界面显示完整,未见子宫肌层中断表现,排除穿透性胎盘可能,经病理证实为胎盘粘连(图例选自Azour L等[21]的文献)。
4.PAS宫外侵犯的常见MRI征象
产前准确识别胎盘绒毛侵袭深度、穿透性胎盘所致宫外侵犯的相关征象至关重要,尤其是膀胱侵袭[29]。膀胱侵袭的MRI征象包括膀胱壁中断、膀胱顶呈帐篷状、子宫-膀胱界面可见紊乱的血管影、以及膀胱内有局限性胎盘组织等。
膀胱壁中断:胎盘组织穿透子宫肌层侵袭至膀胱,在MR T2WI上表现为正常时呈低信号的膀胱壁中断(bladder wall interruption)、出现不规则团块或膀胱“帐篷征”(bladder tenting),浸润深度可至膀胱逼尿肌,甚至深达膀胱黏膜。PAS孕妇胎盘MRI检查显示膀胱腔内出现胎盘组织(图14a~b),此征象诊断膀胱受累有很高的特异度(100%),但是仅在少数PP患者中可见此征象[30]。
膀胱血管征为子宫-膀胱之间可见多个纡曲走行的低信号流空血管影,此征象是预测膀胱壁(包括膀胱浆膜层)受累的另一个准确指标,诊断准确性高达96%(图14c)[30]。膀胱圆顶向子宫突出,呈“帐篷状”,是膀胱壁受侵的另一征象。
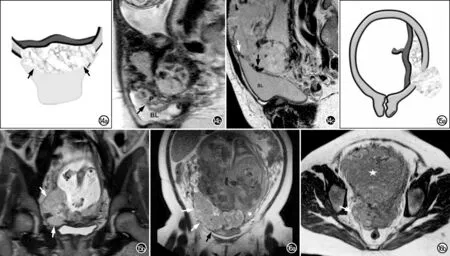
图14 膀胱壁中断图例。a)胎盘及邻近结构解剖示意图,示膀胱壁中断,胎盘侵入膀胱顶(黑箭);b)矢状面T2WI显示呈低信号的膀胱壁局部中断(黑箭),胎盘组织突出到膀胱腔内;c)膀胱圆顶向子宫突出,呈“帐篷征”,膀胱壁旁可见较大的血管流空影(黑箭),膀胱前上部呈帐篷样改变(白箭),均与膀胱侵犯有关(图例选自Jha P等[5]的文献)。 图15 局部外生团块图例。a)胎盘结构解剖示意图示局部外生团块,即胎盘组织穿透子宫肌层向外突出至子宫浆膜层之外;b)冠状面T2WI示局部胎盘组织向子宫旁突出(白箭),表现为宫旁软组织团块(图例选自Jha P等[5]的文献)。 图16 局部外生团块典型病例。a)32岁孕妇,妊娠34周。冠状面T2WI示左侧子宫肌层形态和结构正常(星号),右侧胎盘组织穿透子宫壁向前下侵犯膀胱(黑箭),并向右侧侵犯子宫旁组织(白箭),经病理证实为穿透性胎盘; b)34岁孕妇,妊娠35周。横轴面T2WI显示胎盘组织侵犯右侧子宫旁组织(白箭),其信号强度类似于宫内胎盘组织(星号),经病理证实为穿透性胎盘。(图例选自Srisajjakul S等[15]的文献)。
膀胱静脉曲张也可表现为膀胱周围的紊乱血管影,与PAS患者的膀胱血管征的表现相似。但是,“膀胱血管征”出现的同时往往伴有胎盘下方和胎盘内新生血管以及其它侵袭性胎盘的征象,因此可与之鉴别[13,24]。
局部外生团块:局部外生团块(focal exophytic mass)定义为胎盘组织穿透子宫壁并突向子宫壁外,通常向前突向膀胱或向两侧突向宫旁组织(图15~16)。局部外生团块对诊断PP具有较高特异性[16]。Meta分析显示,局部外生团块和膀胱“帐篷征”与PP高度相关[16]。
胎盘床异生血管:胎盘床由胎盘与子宫界面的底蜕膜及邻近的子宫肌层构成。在胎盘异常的情况下,胎盘床处的血管结构会发生显著变化,血管分布及血管直径极不均匀[31]。胎盘床异生血管(abnormal vascularization of the placental bed)可不同程度地向子宫肌层延伸,甚至可达子宫浆膜层,并可伴有膀胱、子宫和阴道周围广泛分布的大量新生血管。胎盘侵袭性越强,胎盘-子宫界面血管变化越明显[32]。MRI上胎盘床异生血管这一征象对PAS的诊断具有较高的准确性(ROC曲线下面积为0.91,P<0.001)[30],同时这一征象是鉴别PP与PA/PI的重要预测因子,其诊断PP的ROC曲线下面积为 0.76(P<0.001)[33]。产前MRI显示子宫浆膜层血管增多与术中失血量增加以及分娩期间其它并发症有关[33-34]。此外,自子宫浆膜延伸至膀胱-子宫界面或宫旁脂肪组织的大量呈流空信号的血管网(分别称为膀胱血管征和宫旁血管征)是诊断PAS患者膀胱和宫旁受累的非常准确的MRI征象(图17~18),ROC曲线下面积分别为 0.96(P<0.001)和0.80(P<0.003)[30]。
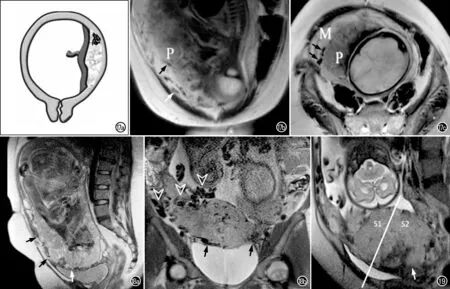
图17 胎盘床异生血管图例。a)胎盘结构解剖示意图示胎盘床下血管增多/胎盘床异常血管化,表现为胎盘床内的异常紊乱血管影,并伴有局部胎盘-子宫内肌层界面中断;b~c)矢状面和横轴面T2WI示胎盘床下血管影增多(黑箭),且向子宫肌层不同程度延伸,部分达子宫浆膜层(白箭),同时伴有胎盘-子宫内肌层界面中断。M=肌层,P=胎盘)。(图例选自Jha P等[5]的文献)。 图18 PAS胎盘床异生血管典型病例。a)39岁PAS孕妇,妊娠32周,前置胎盘。矢状面T2WI示膀胱与子宫交界处的低信号线消失(白箭),子宫肌层明显变薄,子宫前下段和膀胱上部之间(黑箭)血管增多,与正常子宫肌层后部形成对比。术中发现妊娠子宫浆膜面有大量扭曲的血管,病理检查显示穿透性胎盘; b)39岁PAS孕妇,妊娠35周。冠状面T2WI显示膀胱与子宫交界处(黑箭)不规则、血管影增多,病理检查证实为穿透性胎盘(图例选自Srisajjakul S等[15]的文献)。 图19 矢状面T2WI显示S1和S2子宫供血区。垂直于膀胱后壁中点的直线,将子宫供血区分为2个部分,其上方为S1区域(主要对应于子宫体),下方为S2区域(对应于子宫下段、子宫颈和阴道上部);在S2区域可见子宫肌层信号中断(白箭)。(图例选自Jha P等[5]的文献)。
孕妇具有PAS临床危险因素,如前置胎盘、剖宫产史和多次流产刮宫史等,应提高警惕,及早行MRI检查判断有无胎盘植入并评估胎盘植入类型,结合不同界面多种MRI征象进行综合评估,增加对胎盘植入的诊断信息。
5.MRI评估PAS侵袭部位
子宫腹膜返折为划分子宫供血区的实用解剖学标志,它确定S1区域(腹膜返折上方,由子宫动脉供血)和S2区域(腹膜返折下方,由阴部内动脉分支供血)。
术前准确判断胎盘浸润部位可以帮助制订有效治疗方案,可指导临床采用近端血管结扎和选择血管栓塞/球囊阻断位置来控制子宫出血[35]。对于S1区域胎盘侵犯,采用髂内动脉前支结扎可有效控制子宫出血,但对于S2区域的侵袭,需要针对阴部内动脉分支及其吻合支进行处置,最有效的控制出血的的方法是对髂总或主动脉进行处置[36]。MRI矢状面图像可以确定S1和S2区域的位置:于膀胱后壁中点划垂直线,位于其上方的为子宫的S1区域,主要对应于子宫体,此线以下的部位为S2区域,对应于子宫下段、子宫颈和阴道上部(图19)。在PAS合并前置胎盘的大多数病例中,其胎盘位于S2区,这可解释经子宫动脉或髂内动脉来控制出血失败率高的原因。MRI对手术证实为S1和S2侵犯的PAS患者的确诊率为100%[16]。
MRI检查局限性及未来展望
超声和MRI均属于非侵入性和无电离辐射的检查方式,超声由于其较高的空间和时间分辨力、以及价格低等优势,通常作为可疑 PAS 患者的首选影像检查方法。但当孕妇存在PAS临床危险因素,因体型偏胖、胃肠道气体较多或胎盘位于子宫后壁等原因而致超声检查结果不明确时,常需进行MRI检查[37]。MRI具有多序列多方位成像、高软组织分辨力及大视野成像等优点,对于胎盘、子宫肌层及宫外侵犯的显示具有较大优势。 但MRI检查存在无法术中使用、价格高、胎儿及孕妇呼吸运动伪影严重等不足之处,限制了其临床使用[25]。另一方面,尽管MRI诊断PAS的敏感性和准确性很高,但部分征象特异性不高,如妊娠晚期胎盘-子宫肌层界面显示不清/消失、子宫肌层变薄、胎盘内信号不均等亦可见于正常孕妇,单独依靠这些征象很可能导致假阳性结果[11,37]。
DWI是一种相对较新的可用于评估PAS的MRI技术,然而其使用经验有限。DWI有助于确定胎盘与子宫肌层之间的分界[38-39]。当b值为1000s/mm2时,胎盘信号高于子宫肌层,两者信号强度的差异使得DWI可清晰显示胎盘-子宫内肌层界面,有助于更好地检测有无子宫肌层浸润(图12d)。但是,DWI存在一定的局限性:一方面妊娠晚期子宫肌层通常较薄,对于子宫肌层浸润鉴别困难;另一方面,DWI无法准确显示胎盘粘连,因胎盘粘连仅蜕膜层存在缺陷,而无胎盘组织侵入子宫肌层,且无子宫肌层局部变薄[24,39]。目前对于采用DWI评估PAS的研究较少,尚需更多研究来明确DWI对评估PAS的价值。
本文总结和归纳了PAS的MRI征象及MRI使用优势,并通过分析临床典型病例的MRI表现,来分析MRI检查对PAS的临床使用价值及不足之处。对PAS及时和恰当的治疗在很大程度上取决于其产前诊断。当超声检查结果不确定时,MRI可作为诊断PAS的检查手段,能提供有关胎盘浸润部位和深度等方面的信息,对于患者治疗计划的制订具有重要意义。本文对于PAS的MRI表现的详细解读将提高放射科医师的诊断信心和能力,有助于提高对PAS的诊断和治疗水平、改善PAS患者的预后。

