MR超短回波序列在肝铁和脂肪过载情况下定量分析肝铁浓度的实验研究
贾宏茹,王笑笑,胡景卉,刘金韵,黄京城,施斌斌,傅剑雄,孙骏,罗先富
铁过载通过直接或者间接产生活性氧自由基,导致不同程度的细胞损伤和器官功能障碍[1],尤其是在肝脏,严重的铁过载可导致肝硬化,甚至肝癌[2]。肝脏铁浓度(liver iron concentration,LIC)是身体铁浓度的可靠指标[3]。经皮肝穿刺活检是定量LIC的定量的金标准,但其具有抽样误差,且有侵袭性、出血、感染等严重并发症风险而不利于临床推广[4]。
铁作为顺磁性物质,能够缩短组织T1、T2和T2*驰豫时间[5]。驰豫法通过对磁共振成像信号损失的定量评估,来定量测量组织内的铁浓度,基于自旋回波序列计算T2常数,以及基于梯度回波序列计算T2*常数,两者都可以通过在多个TE内获得的信号强度的衰减来计算。重度铁过载时,受第一个TE长短的限制,无法精确捕获信号衰减过程。超短回波序列(ultra-short echo time,UTE)通常指TE<1.00 ms。超短回波序列可用于骨关节系统的研究[6]。Doyle等[7]对UTE序列在3.0T场强下得到的R2*值与常规TE梯度回波序列(GRE)在1.5T场强下测得的R2*值进行比较,结果显示UTE序列定量测量的肝铁浓度范围超出了常规TE梯度回波序列可测范围,为重度铁过载肝铁定量分析开拓了新的视野。
本研究通过建立兔肝脏铁过载模型,旨在探讨UTE序列对肝脏铁过载定量分析的准确性,尤其是对于重度铁过载,同时分析了脂肪沉积对肝铁定量测量的影响。
材料与方法
1.动物模型
本动物实验经本院伦理委员会及实验动物委员会批准。63只雄性健康新西兰大白兔,4周龄,平均体重(2.5±0.4) kg,被随机分为单纯铁过载组(n=30)和铁过载合并脂肪肝组(n=33)。
单纯铁过载组采用标准饲料喂养,经耳缘静脉注射浓度为100 mgFe/mL的右旋糖酐铁溶液建立铁过载动物模型[4]。30只实验兔均分为6组,其中5组每只实验兔的铁注射量分别为0、200、800、1600和2400 mg,剩余的1组共5只兔子备用,以替代建模过程中的死亡动物。若在建模过程中无动物死亡,则对剩余每只兔子的铁注射量为2400 mg。在注射铁剂的过程中,为防止因一次性注射铁剂过多而导致死亡,每只兔子每天最多注射含400 mg铁的右旋糖酐铁溶液。
铁过载合并脂肪肝组采用高脂饲料(标准饲料+2%胆固醇+10%甘油三酯)喂养2~8周,将33只实验兔均分为3组,分别采用高脂饲料喂养2、4和8周,用于获得轻度、中度和重度脂肪肝动物模型[8]。在脂肪肝建模过程中,同时通过经兔耳缘静脉注射浓度为100 mgFe/mL的右旋糖酐铁溶液建立铁过载动物模型,每组中1只兔备用,其余均分为5个亚组,分别采用0、200、800、1600和2400 mg铁注射量,每种剂量注射2只实验兔。
2.MRI检查方法
使用GE Discovery 750W 3.0T磁共振仪进行扫描和16通道表面柔线圈(GE Flex)。扫描前采用3%戊巴比妥钠溶液对实验兔进行麻醉,剂量1.0 mL/kg。采用肝脏脂肪抑制UTE序列,扫描参数:TR 63.4 ms,8个TE分别为0.03、0.08、0.13、0.23、0.43、0.73、1.03和2.03 ms,回波数8,矩阵88×88,层数8,层厚6.0 mm,视野18 cm×18 cm,采集时间18.0 s。
3.图像分析
由2位医师分别在每种TE的UTE序列图像上选取呼吸伪影较小的3个层面,在每个层面的肝实质内勾画一个圆形ROI(面积30~50 mm2),记录测得的信号强度(signal intensity,SI)值,并将其导入Matlab软件,进行R2*值的计算[9]。为保证测量数据的准确性,每个ROI尽量避开肝脏大血管、肝内胆管及肝脏边缘。
4.肝铁化学定量及组织病理学分析
采用电感耦合等离子体光谱仪(inductively-coupled plasma spectrometer,ICP)测量肝实质的铁浓度,具体步骤:取1~2 g的肝脏组织,放入60℃烤箱中烘48h,将水分烘干,用天平秤测量其干重,再放入高温锅炉中进行碳化,将碳化好的组织用王水(浓盐酸和浓硝酸体积比为3:1)进行硝酸化,获得铁离子溶液,使用50 mL容量瓶对溶液进行配平后,使用ICP测量50 mL溶液中的铁离子浓度,经过换算,求得每克干重肝脏组织内的铁含量(mgFe/g)。根据临床铁含量分级标准,对每只兔的肝脏铁浓度进行分级:0级,肝铁含量正常(LIC<1.8 mgFe/g);Ⅰ级,轻度铁过载(LIC为1.8~3.2 mgFe/g);Ⅱ级,中度铁过载(LIC>3.2且<7.0 mgFe/g);Ⅲ级,重度铁过载(LIC为7.0~15.0 mgFe/g);Ⅳ级,极重度铁过载(LIC>15.0 mgFe/g)[4]。
对每只实验兔的肝脏组织标本进行常规普鲁士蓝和HE染色。脂肪含量的评估:每只兔的肝组织病理切片由一位具有十五年肝脏病理检查工作经验的医师使用计算机定量辅助软件Image J V1.48(National Institutes of Health,USA)对肝组织的脂肪含量(fat fraction,FF)进行评估,FF的计算方法为高倍镜视野下单位面积内脂肪所占百分比,并根据Brunt肝脏脂肪含量分级标准进行分级(分组):正常, FF<5%;轻度脂肪肝,FF为5%~33%;中度脂肪肝,FF为34%~66%);重度脂肪肝,FF>66%[10]。
5.统计学分析
所有数据使用SPSS 19.0软件(IBM)和GraphPad Prism 7.04软件进行统计分析,以P<0.05为差异具有统计学意义。采用Kolmogorov-Smirnov检验判断计量资料分布的正态性,满足者以均数±标准差来表示。采用组内相关系数(intraclass correlation coefficient,ICC)评估2位医师测量结果的一致性。采用Spearman相关性分析评估UTE-R2*值与ICP-LIC的相关性。为了评估脂肪含量对铁含量的测量是否有影响,分别建立单纯铁过载组与铁过载合并脂肪肝组R2*值与LIC的线性回归方程,采用协方差分析评估脂肪含量对肝铁定量测量的影响。基于ICP-LIC确定的肝脏铁浓度分级,采用受试者工作特征(receiver operating characteristic,ROC)曲线分析R2*值对不同铁浓度分级的诊断效能,根据约登指数(Youden index)计算各级的最佳R2*截断值和曲线下面积(area under the curve,AUC)。
结 果
1.动物建模结果
63只新西兰兔中最终存活49只(77.8%)并进行了MRI扫描,14只兔(22.2%)在建模过程中死亡,未行MRI扫描。单纯铁过载组与铁过载合并脂肪肝组中分别存活30和19只兔。
病理检查显示,随着注射铁总量的增加,实验兔肝组织内铁颗粒的沉积越来越明显(图1)。采用ICP测量的49只存活兔的LIC为0.9~27.4 mgFe/g。病理检查测量的兔肝组织FF值为1.43%~68.46%,铁过载合并脂肪肝组的实验兔仅1只为正常组,余均发展为不同程度脂肪肝,单纯铁过载组脂肪含量均小于5%。根据肝脏脂肪分级标准,最终肝脂肪含量正常组及轻度脂肪肝、中度脂肪肝及重度脂肪肝组实验兔数量分别为30、9、9和1只。根据临床肝脏铁含量分级标准及Brunt脂肪含量分级标准,单纯铁过载模组和铁过载合并脂肪肝组最终动物模型建模结果见表1。

图1 兔肝组织病理标本普鲁士蓝铁染色病理图像,显示随着铁注射量的增加,肝组织内铁颗粒沉积越明显(×200)。a)未注射右旋糖酐铁;b)铁注射量200mg;c)铁注射量800mg;d)铁注射量1600mg。

表1 铁过载和脂肪肝动物模型建模结果 /只
2.肝脏R2*值及其与肝铁浓度的相关性
铁过载模型的MRI表现:随着铁注射量的增加,在UTE序列图像上肝组织信号强度呈现下降趋势(图2)。

图2 不同程度肝脏铁过载新西兰大白兔8组回波时间的UTE图像,显示随着肝组织内铁沉积程度的增加,肝脏信号强度逐渐减低。
两位医师分别对49只实验兔肝组织的UTE-R2*值进行了测量,两者测量结果的一致性很高(ICC=0.988)。
不同级别铁过载组中FF、LIC及UTE-R2*测量值见表2。

表2 不同肝铁含量分组中肝脏FF、LIC及UTE-R2*测量值
对49只兔模型的UTE-R2*与ICP-LIC进行相关性分析,结果显示UTE-R2*值(y)与肝脏铁含量(x)呈高度线性正相关(r=0.947,P<0.0001),线性方程为y=123.0x+238.6。
3.脂肪对铁定量的影响
脂肪分数、肝铁浓度和UTE-R2*值在单纯铁过载组中分别为3.61%±1.09%、(10.67±7.12) mgFe/g和(1550.83±951.69) Hz,在铁过载合并脂肪肝组中分别为27.39%±15.57%、(9.58±8.14) mgFe/g和(1417.63±1019.83) Hz。单纯铁过载组与铁过载合并脂肪肝组中UTE-R2*(y)与 LIC(x)的线性方程分别为:y=127.3x+192.6(r=0.953,P<0.0001;图3a);y=117.8x+289.7(r=0.940,P<0.0001;图3b)。协方差分析结果表明两组线性方程的斜率无显著差异(P=0.450>0.05),提示脂肪肝对UTE序列定量测量肝脏铁浓度铁无明显影响。
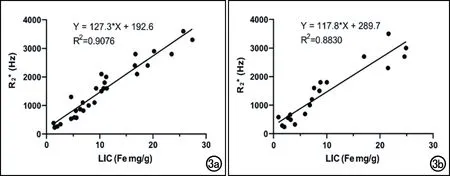
图3 相关性分析点线图。a)单纯铁过载组R2*值与LIC呈显著线性正相关;b)铁过载合并脂肪肝组R2*值呈显著线性正相关。
4.UTE- R2*对肝铁过载分级的诊断效能
分别以临床肝铁浓度分级阈值1.8、3.2、7.0和15.0 mg/g为参考标准,UTE- R2*对不同肝铁过载分级的诊断效能指标值见表3。预测不同肝铁含量分级的UTE-R2*值的最佳截断值分别为623、678、1400和2050 Hz,AUC分别为0.919、0.968、0.992和0.998。

表3 UTE-R2*值预测铁过载分级的诊断效能指标值
讨 论
非对称回波最小二乘估算法迭代水脂分离序列(iterative decomposition of water fat with echo asymmetry and least-squares estimation quantitation sequence,IDEAL-IQ)和mDixon序列虽然能对轻、中度铁过载患者的肝铁浓度及脂肪分数进行精确定量[11-12],但对于重度及极重度铁过载患者,由于采集过程中第一个回波时间超过1.0 ms,难以采集到相应的信号衰减过程,导致了这2个序列评估重度铁过载的精确性下降[13]。Sharma等[14]对在3.0T场强下采用梯度回波序列测得的R2*值与使用超导量子干涉仪测得的磁化率值进行比较,结果显示R2*与磁化率具有高度相关性(r=0.94),但当R2*值大于800 Hz时,对铁浓度值的测量精确性降低。Doyle等[7]采用体外模型的实验研究结果显示,R2*值大于1910 Hz时,常规序列对铁浓度定量分析的精确性下降。
本实验通过在脂肪肝背景下建立铁过载动物模型,在3.0T场强下采用脂肪抑制技术UTE序列进行扫描,所用的最短回波时间仅为0.03 ms,得到的R2*值与LIC具有极高的相关性(相关系数为0.947),验证了UTE 序列在定量分析肝脏铁过载方面的可行性,尤其是对重度及极重度铁过载。Wu等[15]的研究亦验证了UTE序列在3.0T场强下定量测量不同程度肝铁过载大鼠模型的可行性,他们的研究结果显示R2*值与LIC具有很好的相关性,相关系数为0.897,并获得了R2*与LIC的回归方程,通过回归方程预测的肝铁浓度与真实的肝铁浓度具有高度一致性。本研究中还采用ROC曲线分析结合约登指数来分析R2*值对铁含量分级的预测效能,结果显示R2*值对各组(不同铁含量分级)均具有有好的诊断效能,能够区分不同程度的铁过载,尤其是对极重度铁过载的诊断效能,敏感度为1.000,特异度为0.944,曲线下面积为0.998。
为了评估脂肪对铁定量测量的影响,我们构建了铁过载合并脂肪肝模型,本研究中采用脂肪抑制技术,在3.0T场强下采用UTE序列对铁过载动物模型进行图像采集,并将测量结果应用协方差分析联合线性回归分析来评估脂肪对铁定量测量的影响,结果显示单纯铁过载组和铁过载脂肪组组线性回归方程的斜率无显著差异(P=0.450),说明脂肪的存在对肝铁浓度的定量测量无明显影响。Karlsson等[16]研究发现脂肪对R2*值测量的影响是内在的,肝细胞内的一些分子会以不同形式影响水的驰豫,其中肝细胞内的脂肪滴可导致水的驰豫不均匀增宽,进而对R2*值的测量产生影响;在1.5T场强下,MRI图像上质子密度脂肪分数每增加一个百分点,R2*值就会增加约1 Hz。然而对于严重铁过载患者R2*值可达到2000 Hz以上,由脂肪分数引起的R2*值升高可以忽略不计。而且,在合并脂肪沉积的情况下,可以通过脂肪抑制技术来剔除脂肪的干扰,精确计算出肝脏的R2*值[17]。笔者认为,在本研究中之所以脂肪对肝铁含量的测量无显著影响,可能原因为:①我们使用了脂肪抑制技术,剔除了脂肪对肝铁定量的影响;②在本研究中,重度和极重度铁过载的实验兔有28只,而仅有1只兔子为重度脂肪肝,由脂肪分数引起的R2*值的升高可以忽略。
本研究的局限性:①本研究为动物实验,脂肪肝及铁过载模型在病理学改变上与人体疾病进展过程可能存在差异;②本研究样本量较小,尤其重度脂肪肝合并铁过载的实验兔仅只有1只,故尚需在后续的研究中增加重度脂肪肝合并铁过载组的样本量,进行进一步的探究;③本研究中UTE序列采用多个单独的回波时间进行扫描,需要单独的后处理软件;④本研究值未考虑肝铁过载会造成不同程度的肝炎和肝纤维化,随着肝纤维化程度的加重,肝动脉的缓冲不足以调节代偿门静脉灌注量的降低,导致肝实质内血氧分压降低,进而使得R2*值逐渐增加[18],仍需进一步研究来评估肝纤维化对R2*值的影响。
综上所述,通过注射不同量的右旋糖酐铁联合高脂喂养方式,可以构建肝铁过载合并脂肪肝模型。由于UTE序列采集过程中TE非常短(<1 ms),能够对肝铁含量进行精确定量,尤其是对重度铁过载显示出明显优势。同时脂肪抑制UTE序列能够消除脂肪对肝铁含量定量测量的影响,对不同等级铁过载具有很好的诊断效能。

