基线ADC图全容积ROI影像组学模型预测肿块样乳腺癌新辅助化疗后获得病理完全缓解的价值
余雅丽,王晓,查小明,王思奇,娄鉴娟,邹启桂,王聪,蒋燕妮
2020年乳腺癌已成为女性群体中最常见的癌症类型,不仅发病年龄趋于年轻化,且发病率及病死率呈上升趋势,对女性造成严重的身心危害,同时给患者家庭以及社会带来沉重的负担[1]。对于首诊为局部晚期乳腺癌的患者而言,标准治疗方案是手术前进行常规新辅助化疗(neoadjuvant chemotherapy,NAC)[2]。术前化疗的目的在于减轻肿瘤负荷,使肿瘤降期,并增加保乳手术(breast-conserving surgery,BCS)的可能性。既往研究表明在NAC疗程结束后达到病理完全缓解(pathological complete response,PCR)的乳腺癌患者,往往拥有更好的无病生存率(disease free survival,DFS),而化疗结束时有肿瘤病变残留的患者早期复发和死亡的风险明显增加[3]。临床实践中发现,由于乳腺癌生物学行为存在个体差异,肿瘤内部异质性较强,患者对NAC治疗的敏感性相差较大,相当一部分(高达30%)患者并没有从NAC中受益,病理反应差[4]。因此,若能在治疗前识别出疗效不佳的患者,对后续治疗方案的调整并实现个体化治疗,具有重要的临床价值。
目前尚无统一的指标来评估新辅助化疗的疗效,既往研究提示联合使用多种潜在影响因素可进一步提高预测效能[5]。本研究旨在通过基线期ADC图全容积ROI影像组学特征的提取,筛选出反映 NAC疗效的特征子集并构建影像组学预测模型,旨在为精准的乳腺癌个体化治疗策略提供影像学依据。
材料与方法
1.临床资料
本研究通过了本院伦理委员会的批准。
回顾性搜集并分析2016年1月-2017年12月在本院接受新辅助化疗的乳腺癌患者的临床资料和影像数据。纳入标准:①经粗针穿刺活检病理检查证实为浸润性乳腺癌;②在手术前完成新辅助化疗标准方案(中国抗癌协会乳腺癌诊治指南与规范)的治疗;③有完整的化疗前乳腺3.0T MR影像资料;④采用Miller-Payne(M-P)病理系统评估手术标本。排除标准:①在MR图像上表现为非肿块样强化的乳腺病灶;②妊娠期和哺乳期乳腺癌患者;③末次化疗与手术时间间隔在2周以上;④图像质量不合格。研究样本入组筛选流程见图1。最终纳入符合要求的女性患者94例,其中14例(14.9%)NAC后达到PCR,80例(85.1%)未达到PCR。
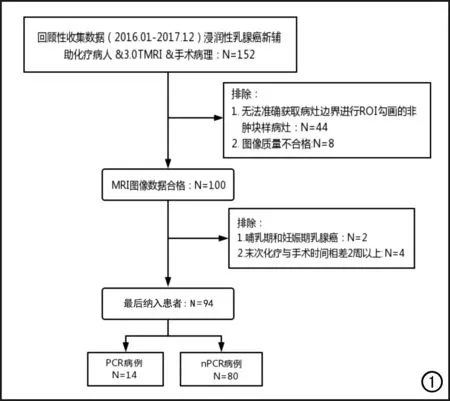
图1 研究样本入组筛选流程图。
94例患者中,51例行AC-T/TAC化疗(蒽环类、环磷酰胺和紫杉类),35例行AC-TH化疗(蒽环类、环磷酰胺和赫赛汀,然后序贯紫杉类和赫赛汀),均为8个疗程;8例行TCH治疗(多西他赛、卡铂和赫赛汀),共计6个疗程。
2.MRI检查方法
所有患者在NAC前行乳腺MRI平扫和增强扫描,使用Siemens Trio Tim 3.0T磁共振仪和乳腺专用8通道相控阵线圈。患者取头先进、俯卧位,双乳位于线圈内并保持自然下垂状态。快速反转恢复(turbo inversion recovery magnitude,TIRM)压脂序列横轴面T2WI,扫描参数:TR 5000 ms,TE 61 ms,层厚4.0 mm,采集矩阵320×320,视野340 mm×340 mm。横轴面DWI序列的扫描参数:TR 5200 ms,TE 65 ms,层厚5.0 mm,采集矩阵110×220,视野323 mm×384 mm,b值分别取0和800 s/mm2。动态增强横轴面T1WI扫描参数:TR 4.23 ms,TE 1.57 ms,层厚0.9 mm,采集矩阵448×448,视野340 mm×404 mm,翻转角10°。注射对比剂前先扫描蒙片,然后经手背静脉使用高压注射器团注对比剂Gd-DTPA,剂量0.1 mmol/kg,注射流率3.0 mL/s,注射对比剂后快速推注20 mL生理盐水;随后连续不间断扫描5期,总扫描时间6 min 23 s。矢状面T2WI压脂序列扫描参数:TR 3000 ms,TE 72 ms,层厚4.0 mm,采集矩阵320×320,视野180 mm×214 mm。
3.组织病理学分析
每例患者在NAC前对乳腺肿瘤病灶进行粗针穿刺活检病理检查,记录病理类型及雌激素受体(estrogen receptor,ER)、孕激素受体 (progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor,HER-2)和肿瘤增殖细胞核抗原ki-67表达情况。ER和PR的检测采用免疫组织化学法,阳性标准为每个高倍镜视野下细胞核染色的肿瘤细胞数≥1%。HER-2的检测采用免疫组织化学检测,HER-2染色阳性细胞数<10%为(-),10%~25%为(+),26%~ 50%为(),> 50%为()。对阳性细胞数为()者进行荧光原位杂交法检查,如检测结果为阴性者,与HER-2检测结果为(-)和(+)者一起归入HER-2阴性组;如荧光原位杂交检测为阳性的患者,与HER-2检测结果为()的患者一起归入HER-2阳性组。Ki-67染色时计算染色阳性的恶性细胞的百分比,Ki-67≤14%定义为低表达,Ki-67>14% 定义为高表达。
按照M-P病理标本分级评价标准,对所有新辅助化疗后得到的手术标本进行化疗疗效的评估[6]。M-P分级标准主要依据NAC后残瘤的肿瘤细胞的数量进行分级,共分为5个等级。1级:浸润性癌细胞的总体数量较治疗前未见减少或差异甚微;2级:浸润性癌细胞的数量仍较多,总体数量仅轻度减少(减少率<30%);3级:浸润性癌细胞总体数量明显减少(减少率为30%~90%);4级:癌细胞总体数量显著减少(减少率>90%),仅少量癌细胞呈散在分布;5级:在切除的乳腺标本的任何切片中均未发现浸润性癌细胞,但允许存在导管原位癌。根据M-P分级,1~4级被归入非病理完全缓解(non-pathological complete response,nPCR)组,5级即病理完全缓解被归入PCR组。
4.影像组学分析
肿瘤图像三维分割:将b=800 s/mm2的DWI图像序列导入ITK-SNAP 3.6.0软件(https://itk. org/),由一位放射科住院医师(具有2年乳腺MRI诊断经验)在DWI图像上沿乳腺病灶边缘逐层勾画ROI,获得病灶的三维容积感兴趣区(volume of interest,VOI)。标记时不超出病灶边缘,ROI略小于肿瘤实际大小,未避开病灶内的出血、坏死、钙化和血管区域(图2a~c)。然后由一位主任医师(具有10年以上乳腺MRI诊断经验)复核确认VOI。有多个病灶时原则上选取最大病灶进行ROI的勾画,复核阶段如医师无法确定主病灶或出现其它意见分歧时,双方通过协商最后达成一致。两位医师在勾画ROI时仅知晓病灶为浸润性癌,其它临床资料均不知悉。由于ADC图像与DWI的几何位置参数一致,故可以将在DWI逐层勾画的ROI直接复制到 ADC图像上,并通过ITK-SNAP软件再次确认VOI(图2d)。
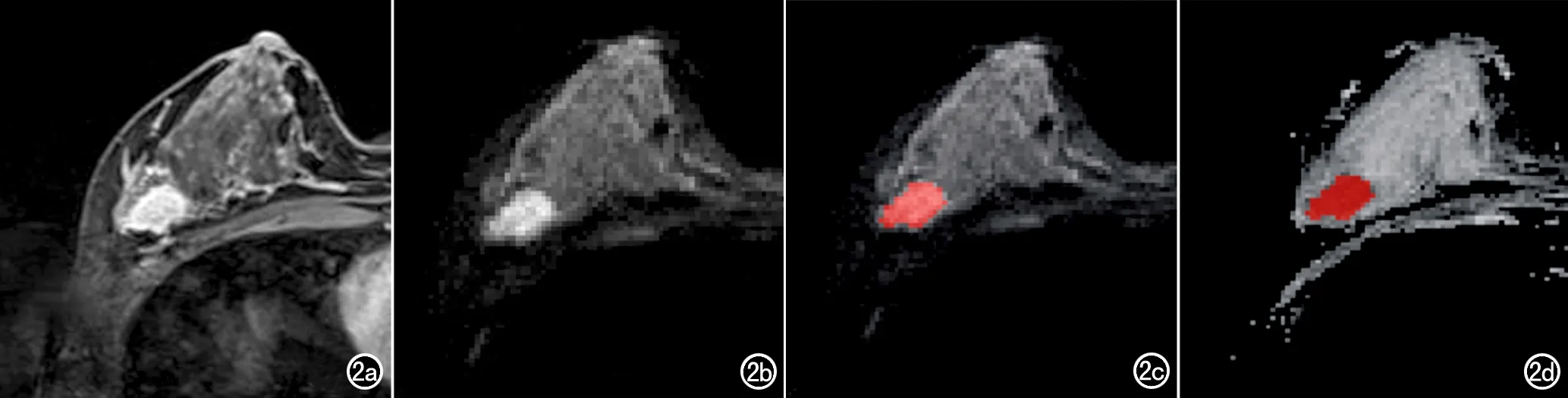
图2 乳腺癌病灶分割示意图。a)动态增强扫描第2期T1WI图像,显示右乳外象限内肿块强化略不均匀,边界尚清晰,边缘可见毛刺;b)DWI图像(b=800s/mm2)示病灶呈稍高信号,提示扩散受限;c)利用ITK-SNAP软件在DWI图像上沿病灶边缘勾画ROI,肿块边界的确定参照动态增强图像(a);d)将DWI图像上逐层勾画的ROI复制到 ADC图像上。
影像组学特征提取:获得肿瘤在ADC图像上的VOI后,采用GE A.K软件(Artificial Intelligence Kit V3.0.0.R)提取其影像组学特征,共提取5大类特征,包括形态学、一阶直方图、灰度大小区域矩阵、灰度共生矩阵和游程矩阵。
影像组学特征的筛选及模型的建立:将所有受试者按7∶3的比例随机分为训练集(training cohort,TC)和验证集(validation cohort,VC)。本研究中TC组66例,VC组28例。依次采用最大相关最小冗余(maximum relevance and minimum redundancy,mRMR)特征选择方法和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)进行特征降维[7-8],筛选出8个最佳组学特征,最后通过LASSO回归分析方法获得Radscore的计算方程,通过该方程计算得出每个患者乳腺肿瘤的 Radscore值。
5.统计学方法
使用SPSS 24.0软件(IBM,Armonk,NY,USA)进行统计学分析。对计量资料先进行正态分布检验,采用两独立样本t检验或Mann-WhitneyU检验进行组间比较;分类变量资料的组间比较采用卡方检验。采用ROC曲线和决策曲线评估影像组学模型对NAC疗效的预测效能。以P<0.05为差异有统计学意义。
结 果
1.临床资料的比较
94例患者的年龄为26~69岁,平均(50.3±9.6)岁。经术前穿刺及手术后病理检查证实,均为浸润性非特殊类型癌,不同亚型肿块样乳腺癌NAC后病理反应结果见表1。PCR组和nPCR组基线期主要临床特征及组间比较结果见表2。其中PCR组的ER和PR阴性率均高于nPCR组,且两组之间的差异均有统计学意义(P<0.05),其余临床特征在PCR组和nPCR组之间的差异无统计学意义(P>0.05)。

表1 不同病理亚型肿块样乳腺癌新辅助化疗后病理反应结果 /例
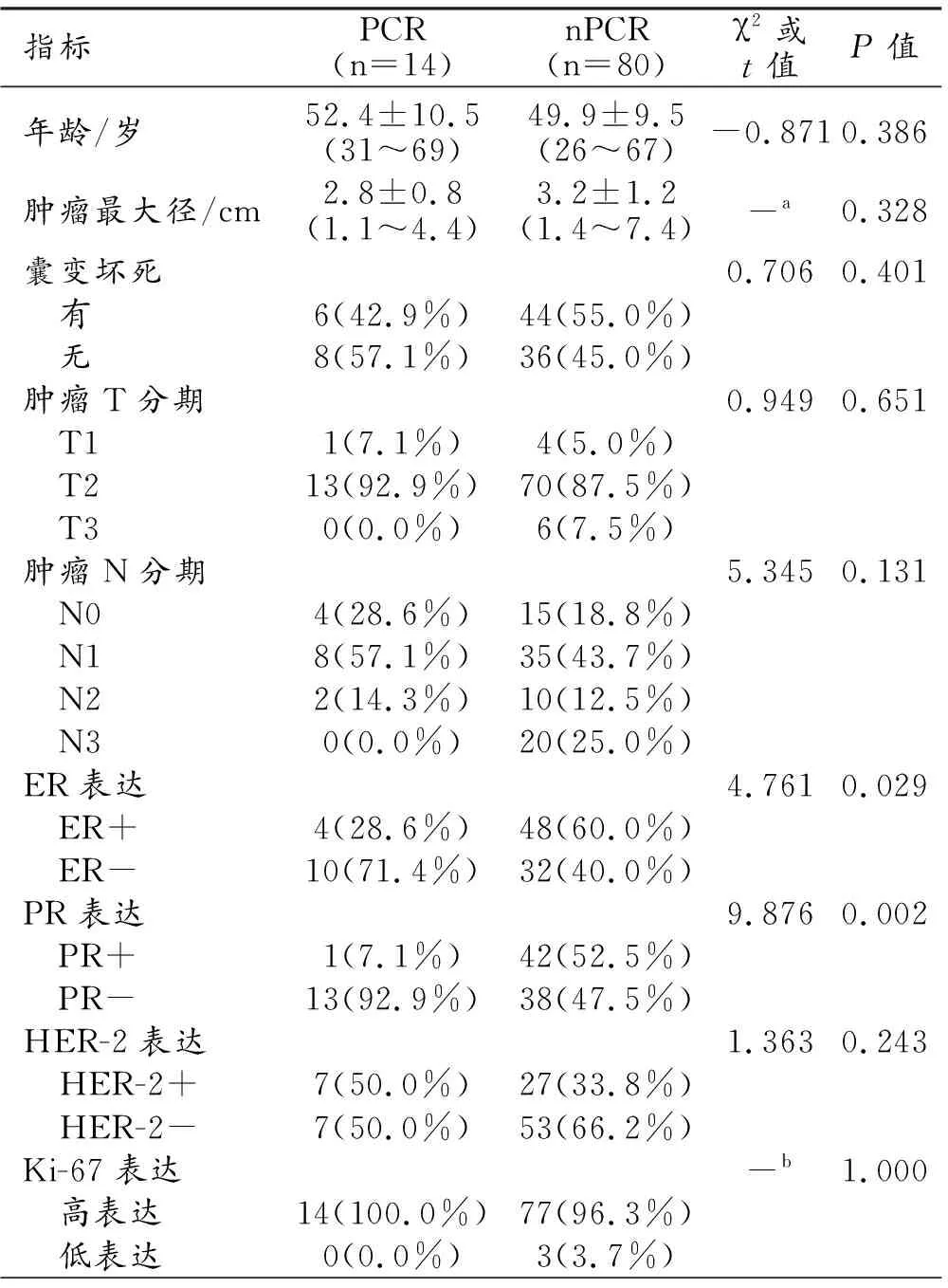
表2 肿块样乳腺癌NAC后PCR组及nPCR组基线期临床特征
2.影像组学特征筛选及诊断模型的构建
每例患者共提取396个ADC影像组学特征,采用mRMR方法去除冗余和不相关后,保留了30个特征;然后经LASSO算法筛选出最优特征子集(图3),最终共筛选出8个最优特征参数,包括其中包括2个形态学特征、3个游程矩阵特征和3个灰度共生矩阵特征(图4);最后,对8个最优特征进行采用LASSO回归分析,获得影像组学标签(Radscore)的计算方程(即诊断模型),其表达式为:Radscore=0.196×Compact-ness1+0.08×LongRunLowGreyLevelEmphasis_AllDirection_offset4_SD-0.286×LongRunHighGreyLevelEmphasis_angle0_offset7—0.174×ShortRunEmphasis_angle45_offset1-0.083×Correlation_angle90_offset7-0.02×ClusterShade_angle0_offset7-0.218×Compactness2-0.062×InverseDifferenceMoment_AllDirection_offset4_SD-1.818。
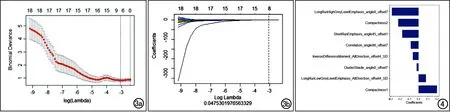
图3 LASSO回归特征筛选图。a)模型偏差参数λ变化曲线图,纵坐标为Binomial Deviance(二分类偏差),即模型的误差的大小,横坐标为log(λ),图中虚线表示选取的最优log(λ)值及1个标准误差所在位置;b)组学特征系数随log(λ)变化的曲线图,纵坐标是系数的值,下横坐标是 log(λ),上横坐标是此时模型中非零系数的个数。虚线表示选取的最优log(λ)值所在位置。 图4 筛选出的最具预测价值的8个特征参数及其系数。
PCR组和nPCR组的影像组学模型评分值及组间比较结果见表3和图5。在训练集中,PCR组的radscore值高于nPCR组(P<0.05),并在验证集中得到验证(P<0.05)。

表3 PCR组与nPCR组的影像组学模型评分的比较

图5 训练组和验证组的Radscore值分布箱式图。蓝色点为nPCR组(label 0)数据,黄色点为PCR组(label 1)数据。 图6 影像组学模型预测NAC后获得PCR的ROC曲线图。a)训练组;b)验证组。
3.影像组学模型的诊断效能
影像组学模型对预测NAC后获得PCR拥有较好的诊断效能,在训练组中的AUC和符合率分别为0.87(95%CI:0.75~0.99)和0.848,在验证组中的AUC和符合率分别为0.85(95%CI:0.71~1.00)和0.821(图6)。经模型预测的PCR组及nPCR组典型病例如图6~7所示。
决策曲线显示,当风险因素的概率阈值为10%~80%时,与假设所有患者都无应答或所有患者都有应答相比,使用此影像组学模型增加了更多的临床收益(图8)。
讨 论
对于局部晚期的浸润性乳腺癌患者来说,循证证据一级治疗方案为术前进行新辅助化疗。研究表明,NAC后达到PCR的患者,其总体生存率及和无病生存率较nPCR患者显著提高。即使组织学类型、TNM分期及分子分型都相同的浸润性乳腺癌,在不同个体间及同一个体不同发病时间之间肿瘤生物学行为亦存在高度异质性,NAC后临床疗效和预后也存在差异。本研究构建的基线ADC图全容积ROI影像组学预测模型有较好的预测效能,可以在化疗前将对化疗敏感性差的患者筛选出来,不仅能够减少化疗毒性,而且在治疗早期就能根据患者的个人情况及时调整治疗方案。
相较于触诊、超声及钼靶检查,MRI对多中心病灶有更高的检出率,且其软组织分辨率更高,是乳腺癌的理想影像学评估方法,常被用于评价NAC疗效和预测病理反应[9]。DCE-MRI是评价乳腺癌患者NAC疗效的一种常用方法[10],可反映肿瘤化疗后形态学改变,或者通过监测血流动力学定量参数来预测化疗疗效[11-12]。既往的一项meta分析表明,DCE-MRI影像组学分析对预测乳腺癌新辅助化疗的疗效有一定价值,AUC为0.74~0.87[13]。但DCE-MRI需要使用对比剂,不仅增加了检查时间和成本,而且在一些对比剂不耐受/过敏患者中难以实现。相较于DCE-MRI,DWI是一种能观察活体水分子微观扩散运动能力的MRI检查方法[14],具有对肿瘤微环境十分敏感、不需要对比剂、无电离辐射、图像采集在相对较短的时间内完成、且易于纳入常规临床评估等优点,常被应用于临床疾病的诊断及疗效评估中[15-16]。从分子层面来讲乳腺癌肿瘤细胞增殖活跃,水分子扩散运动受限,肿瘤组织内的病理改变可以通过病灶的ADC值定量反映,从而对乳腺肿瘤病变性质进行定量评估[17]。既往多个研究结果表明,乳腺癌病变区的ADC值在新辅助化疗后的早期变化与NAC结束后所获得的组织病理学表现之间存在一定相关性[18-19]。本研究中基于基线ADC图进行研究,结果显示基线ADC图可以更早地预测NAC疗效。
在ADC图上勾画的ROI的大小和位置对研究结果有重要影响。既往文献报道的ADC值之间存在较大差异,原因可能是部分研究中采用的是对整个肿瘤全容积进行ADC值的测量[20],而另一些研究中仅对肿瘤最大层面或单层面小ROI进行定量分析[21]。理论上,只有覆盖整个病灶的ROI才能全面反映肿瘤的特征,尤其对于在空间分布上存在高度异质性的恶性肿瘤,如乳腺癌。既往有研究结果显示,肿瘤ADC值和观察者间的变异性高度依赖于ROI分析方法,当测量整个肿瘤体积的ADC时,像素数目分析就越多,ADC值的重复性越好[22]。而在治疗前的MR图像上,全容积和肿瘤最大层面ROI测量的肿瘤ADC值明显高于单层面小范围ROI,可能是由于单层面小范围ROI通常选取的是最有活力的实体肿瘤部分,所以测得的ADC值较低。Roth等[23]的研究也表明,整体肿瘤ADC值的测量比仅从肿瘤存活区域选择ROI能更准确预测疗效。在最近一项乳腺癌化疗疗效分析的研究中,Eun等[24]采用病灶最大层面ROI勾画方法分析多模态MRI纹理特征对乳腺癌NAC后获得PCR的预测能力,结果显示治疗前提取的各项纹理特征预测PCR的AUC均小于0.8,这一结果低于本研究中预测模型在验证集中的AUC(0.85),可能与我们采用了全容积ROI相关。尽管整个病灶ROI的勾画及VOI的获得过程比较耗时,但使用这种方法似乎更具成本效益,因为相对于单层分析它提供了更好的预测价值。
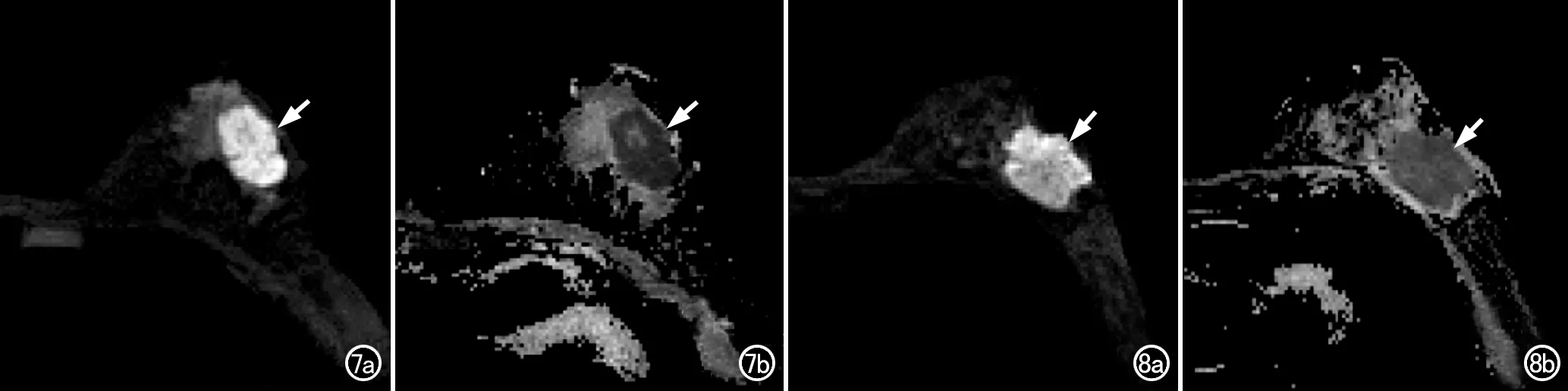
图7 40岁三阴性乳腺癌患者,Radscore=-1.258493075,NAC后手术病理证实为PCR,M-P分级为5级。a)DWI图像(b=800s/mm2)示左乳外侧象限内椭圆形肿块,边缘分叶,信号明显增高(箭);b)ADC图示瘤灶区域的ADC值明显减低(箭)。 图8 66岁三阴性乳腺癌患者,Radscore=-1.906936547,NAC后手术病理证实为nPCR,M-P分级为2级。a)DWI图像(b=800s/mm2)示左乳外侧象限内不规则肿块,边缘分叶,信号明显增高(箭);b)ADC图示瘤灶区域的ADC值明显减低(箭)。
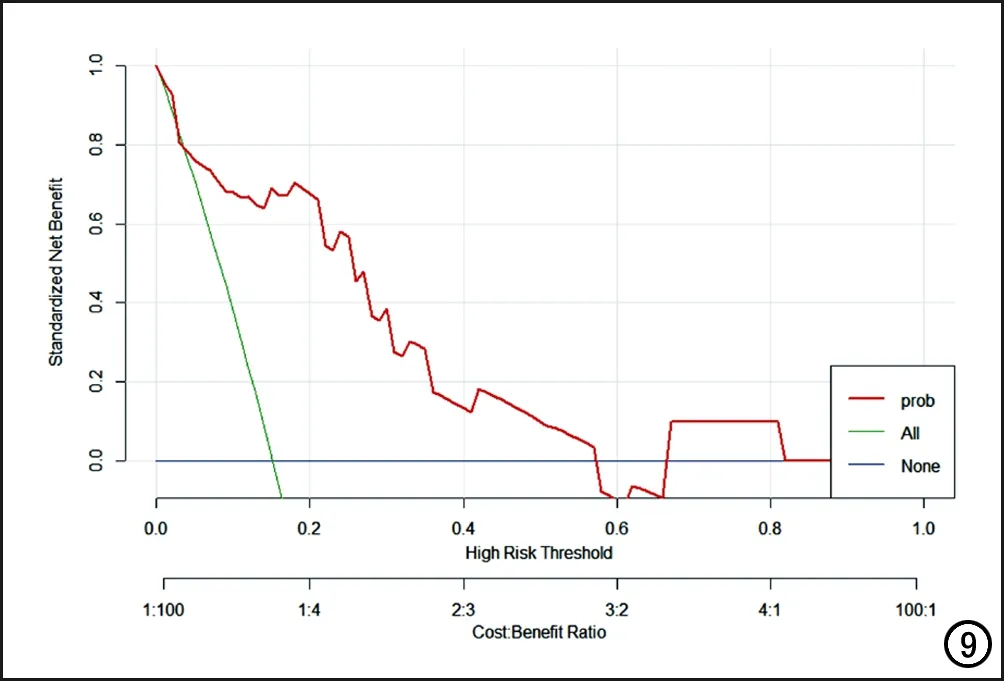
图9 决策曲线评估临床获益。Y 轴是净收益,通过真阳性减去假阳性来计算,X轴表示风险因素的概率阈值。当概率阈值为10%~80%时,与假设所有患者都无应答或所有患者都有应答相比,使用影像组学模型增加了更多的临床收益。
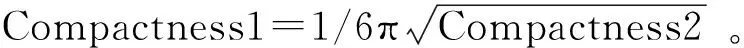
本研究存在以下局限性:①仅进行了单中心回顾性研究,样本数量相对较少,而且未进行外推验证,缺少对结果的泛化性和稳健性的评价,未来需要进一步开展多中心研究,增加样本量,将模型应用到新的数据集以评估其效能;②肿瘤的ROI由放射科医师手工绘制,较为费时,本研究中虽然由两位医师进行确认,但仍无法完全避免主观和客观的误差,未来需要寻找一种自动、可靠且高效的肿瘤分割方法;③未纳入非肿块样病灶,可能存在样本选择偏倚,后续研究将进一步寻找更精准的肿瘤分割方法,使得这一类病灶也能纳入研究中;④本研究仅采用两个b值(b=0、800s/mm2)的DWI序列所产生的ADC图进行特征提取,未能准确反映肿瘤内部扩散和灌注信息的异质性,后续可能需要进行多b值(4个以上)DWI序列分析,例如体素内不相干运动模型等;⑤本研究只对ADC图提取的影像组学特征进行研究,并未提取DCE-MRI、T2WI等多序列影像组学特征,故未能建立基于多模态MRI的综合诊断模型,后续研究中需应用多模态MRI挖掘更多影像组学信息,有望获取更为精准的预测模型。
综上所述,构建基线ADC图全容积ROI影像组学模型,在肿块样乳腺癌新辅助化疗疗效(PCR)预测方面具有一定的临床应用价值,能够为临床提供相应影像学依据,从而实现个体化精准治疗。

