蜂王浆中活性因子对衰老小鼠的保护作用
余贤娴, 汪 玲, 兰 天, 余春涛, 黄文琦,吴泉勇, 肖乾煌, 聂欣可, 谭惠子, 聂少平*
(1. 南昌大学 食品科学与技术国家重点实验室/中国-加拿大食品学与技术联合实验室 (南昌)/江西省生物活性多糖重点实验室,江西 南昌 330047; 2. 江西汪氏蜜蜂园有限公司,江西 南昌 330008)
衰老是指机体内众多组织器官的功能随着时间的推移而衰退,是很多疾病的潜在危险因素。 随着当前社会经济的飞速发展以及人口结构的改变,我国将步入并会较长时间处于老龄化社会,如何延缓机体衰老是近年来越来越多的学者正在研究的问题,并且对于抗衰老的相关产品的需求也在日益增长。 虽然机体衰老是一个不可逆的过程,但已有发现可通过多种不同途径延缓衰老的发展速度。 已有研究报道说明蜂王浆(royal jelly,RJ)具有抗衰老的作用[1],但是对于具有延缓衰老作用的具体成分少有报道。 因此,进一步了解蜂王浆的功能活性因子的保健功效以及开发对应的新型天然产物产品尤为重要。D-半乳糖对小鼠造成的衰老模型是最接近自然衰老的实验模型, 由于其模型操作简单、效果显著等特点,常用于食物、药物的抗衰老功能的研究。
蜂王浆作为一种药食两用的食品,是由青年工蜂下咽头腺和大颚腺分泌,主要作为蜂王和幼虫的食物。其通常呈乳白色、淡黄色或浅橙色弱酸性半透明黏稠浆状物体,有特殊香味[2],味酸、涩、辛,富含蛋白质、糖类、脂肪酸、维生素、游离氨基酸及微量元素等多种生理活性物质[3]。 研究显示蜂王浆具有改善睡眠[4-5]、修复细胞损伤[6-9]、增强免疫力[10-11]、抗菌[12-14]、抗氧化[15-17]、延缓衰老[18]、调节心血管系统[19]及抗肿瘤[20-22]等多种生理活性,具有极高的药用和保健价值,深受国内外消费者喜欢和追捧。
蜂王浆的抗衰老效果显著,能够修复机体的细胞损伤和降低机体的氧化活性[7,17]。10-羟基-2-癸烯酸(10-hydroxy-2-decenoic acid,10-HDA)是蜂王浆中具有功能活性的不饱和脂肪酸,其含量是衡量蜂王浆质量的重要指标之一[23],除了10-HDA 之外,蜂王浆中还含有两种主要的不饱和脂肪酸(10-HDAA和SEA)[24]。蜂王浆蛋白是由水溶性蛋白和非水溶性蛋白构成的,而水溶性蛋白为主要成分,也称蜂王浆主蛋白(major royal jelly proteins,MRJPs)。MRJPs包含MRJP1~MRJP9 九个家族成员[25],其中蜂王浆主蛋白MRJP1 是质量分数最高的蛋白质, 约为48%,其相对分子质量为49 000~60 000,以55 000和57 000 为主[26]。 蜂王浆中的蛋白质及脂肪酸是其多种功能活性的主要来源。 研究报道,MRJP1 可以降低大鼠血清胆固醇水平[27],MRJP2 具有很好的抗菌[28]和抗氧化[29]活性。
因此, 作者采用了D-半乳糖致衰老的动物模型,通过T-迷宫来考察蜂王浆中的功能活性因子对衰老小鼠的工作记忆行为学的影响,再结合小鼠的体质量、肝脏指数、脑指数、脾脏指数以及肾脏指数、肝组织中的丙二醛(malondialdehyde,MDA)的含量等指标,探究蜂王浆及其蛋白质类、脂类功能因子提取物对D-半乳糖诱导的小鼠衰老的延缓作用,为蜂王浆的深度开发利用提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
蜂王浆原浆: 江西汪氏蜜蜂园有限公司产品;BCA 试剂盒: 上海碧云天生物技术有限公司产品;10-羟基-2-癸烯酸标准品、对羟基苯甲酸甲酯标准品透析膜(相对分子质量8 000~14 000):上海源叶生物科技有限公司产品;磷酸盐缓冲液(PBS)片剂:生工生物工程(上海)股份有限公司产品;甲醇(色谱纯):德国Merck 公司产品;无水乙醇(优级纯):西陇科学有限公司产品;超滤管(截留相对分子质量30 000): 美国Millipore 公司产品;VC 片状补充剂:汤臣倍健股份有限公司产品;D-(+)半乳糖(Dgal):北京索莱宝生物科技有限公司产品,其他试剂均为国产分析纯产品;ELISA 试剂盒:南京建成生物工程研究所。
8 周龄C57BL/6J 小鼠 (雌性130 只, 体质量20~25 g): 北京维通利华实验动物技术有限公司提供(北京百善SCXK(京)2021-0006);常规动物饲料:北京维通利华实验动物技术有限公司提供。
电子天平: 瑞士Mettler Toledo 公司产品;LYNX4000 高速离心机: 美国Thermo Fisher Scientific 公司产品;SHB-Ⅲ循环水式真空泵: 巩义市予华仪器有限责任公司产品;PowerPacTMUniversal Power Supply 通用电泳仪: 美国伯乐(BIO-ARD)公司产品;e2695 高效液相色谱仪:美国Waters 科技有限公司产品;1260 高效液相色谱仪:美国Agilent 科技有限公司产品; 真空冷冻干燥机:美国Labconco 公司产品;N1300 旋转蒸发仪:EYELA 东京理化器械株式会社产品; 全波长酶标仪:美国Molecular Devices 公司产品。
1.2 实验方法
1.2.1蜂王浆中蛋白质类功能因子的提取 通过透析法对蜂王浆粗蛋白进行提取纯化,具体实验方法参照文献[30]。 根据BCA 试剂盒说明书,测定粗蛋白中的蛋白质质量分数。并采用SDS-PAGE 蛋白质电泳检测粗蛋白提取物中的蛋白质组成。
通过浓缩超滤法对蜂王浆蛋白质类物质提取纯化,具体实验方法参照文献[31]。 根据BCA 试剂盒说明书, 检测提取物中蛋白质质量分数。 采用SDS-PAGE 蛋白质电泳检测提取物中的蛋白质组成。 采用GPC 液相色谱法[32]检测提取物中各组分的占比。
1.2.2蜂王浆中脂类功能因子的提取 通过有机相萃取法对蜂王浆脂类功能因子进行提取纯化,参照文献[33]。 参照国家标准GB 9697—2008 中高效液相色谱法检测提取物中10-HDA 的相对含量。
1.2.3动物实验分组及处理方法 动物实验选用8周龄的雌性C57BL/6J 小鼠(20~25 g)在正常条件下饲养,温度为(22±2)℃,相对湿度为55±10 和12 h/12 h明暗循环。 本研究中涉及的实验动物所有程序均按照美国国立卫生研究院实验动物管理和使用指南进行,并经南昌大学实验动物科学中心、实验动物伦理委员会批准。实验方法参照已有研究报道[34-35],稍有修改,具体如下(见图1):将所有的C57BL/6J小鼠随机分13 组,每组10 只,分别为空白对照组(B),模型组(M),蜂王浆组(RJ),阳性对照组(VC),粗蛋白提取物的低、中、高剂量组(CL、CM、CH),蛋白质类功能因子提取物的低、中、高剂量组(PL、PM、PH)及脂类功能因子提取物的低、中、高剂量组(AL、AM、AH)。
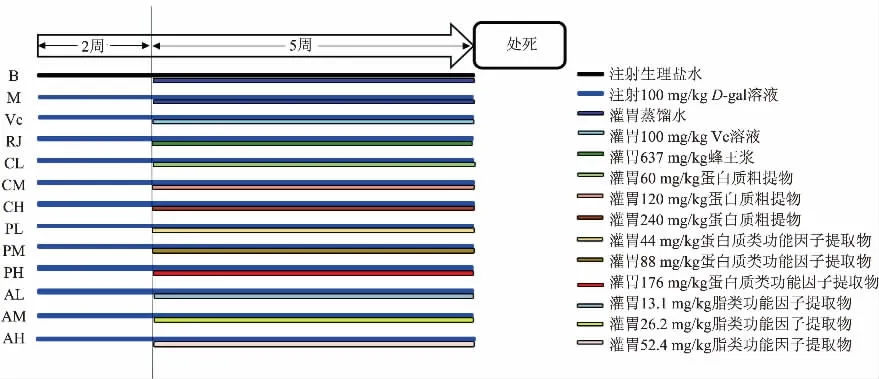
图1 动物实验方案Fig. 1 Protocols of the animal experiment
所有动物经适应期并常规饲养至12 周龄后,除空白对照组外所有小鼠每日由腹腔注射100 mg/kg(以体质量计)的D-gal 溶液[36],空白对照组小鼠注射相同剂量的生理盐水,连续7 周,进行衰老造模。 同时,从第3 周开始,阳性对照组小鼠每天灌胃100 mg/kg 的VC 溶液[37],蜂王浆组每天灌胃637 mg/kg 的蜂王浆原浆(相当于体质量70 kg 成年人每日摄取4.9 g 蜂王浆),粗蛋白提取物的低、中、高剂量组小鼠每天分别灌胃60、120、240 mg/kg 的蜂王浆蛋白质粗提取物,蛋白质类功能因子的低、中、高剂量组小鼠每天分别灌胃44、88、176 mg/kg 的蜂王浆蛋白质类功能因子的提取物, 脂类功能因子的低、中、高剂量组小鼠每天分别灌胃13.1、26.2、52.4 mg/kg 的脂类功能因子的提取物 (所有组分的中剂量组摄入剂量与蜂王浆组中蜂王浆摄入剂量相对应), 空白对照组与模型组小鼠则每天灌胃等体积的蒸馏水,连续5 周。 饲养间温度控制在20~26 ℃,相对湿度控制在40%~70%, 白天与黑夜每12 h 为一个循环。 整个实验过程中监测体质量和精神状况, 所有小鼠在戊巴比妥钠麻醉下颈椎脱臼处死,收集小鼠的血清、肝脏、肾脏、脾脏以及脑组织并称质量,计算各组织的器官指数,并进行后续实验。
1.2.4T-迷宫动物行为学实验 T-迷宫行为学实验基于空间工作记忆原理, 实验方法参照已有报道,稍有调整[38-39]。 在实验最后一周,将小鼠放入T形迷宫适应两天后,开始训练实验和测试实验。
1)训练实验 每一个trial 包括两个部分,即forced run 和test run。 Forced run:任意选择T 形迷宫的一臂,用木闸门将之关闭,小鼠只能进入一臂获取食物。 取食完毕,立即取出,用乙醇清洗去除气味;15 s 后,撤去所有的闸门。 Test run:两臂全部打开,将小鼠放入开始臂中,若小鼠选择未曾进入的臂,为正确选择,给予食物奖励;若重复进入相同的臂,则为错误选择,不给予食物。 每只动物每天进行4 个trial,每次间隔15 min,连续4 d,分别计算每天每组小鼠的准确率。 当小鼠选择准确率达到80%以上,则代表小鼠形成工作记忆,可停止实验。
2)测试实验 延长forced run 和test run 之间的时间间隔至1 min,连续测试16 次,分别计算每组小鼠的准确率。
T-迷宫行为学实验期间,小鼠饮水不限,但每天进食控制在4~5 g, 以使体质量保持在正常进食小鼠体质量的85%[38]。在整个训练和测试期间,小鼠体质量每周增加不超过5 g。
1.2.5肝脏丙二醛(MDA)水平测定 采用ELISA试剂盒按照生产厂家说明书进行检测。
1.3 数据处理
实验数据分析采用GraphPad Prism 软件结合two-tailed unpairedt-test 方法,若P值(Pvalue)小于0.05 则认为数据差异具有统计学意义。
2 结果与分析
2.1 粗蛋白提取物及蛋白质类功能因子提取物
粗蛋白提取物经过BCA 试剂盒测得蛋白质的质量分数约为79.42%。 从SDS-PAGE 蛋白质电泳结果显示(见图2),相对分子质量为50 000~60 000及35 000~45 000 的条带灰度最高, 推测可能是MPRJ1 及MPRJ2 成分。
在此基础上, 进一步提取相对分子质量为50 000~60 000 的蛋白质类功能因子。 结果表明,通过SDS-PAGE 蛋白质电泳检测,发现蛋白质类功能因子提取物的蛋白质条带主要位于50 000~60 000。 且通过GPC 液相色谱发现该方法所得的目标蛋白相对含量能达到93.08%(见图3),得率占蜂王浆蛋白质组分的43.20%。
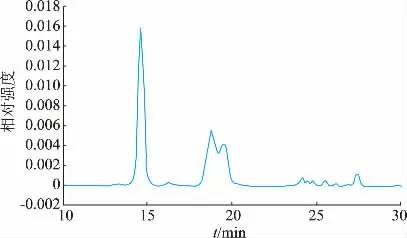
图3 蛋白质类功能因子提取物的GPC 液相色谱图Fig. 3 GPC liquid chromatography of functional protein fractions
2.2 脂类功能因子
蜂王浆冻干样经旋蒸后所得的脂质组分在形态上呈现淡黄色或金黄色,为固液混合物。 经高效液相色谱分析后发现,所得的脂类功能因子提取物中10-HDA 相对含量43.85%(见图4)。得率占蜂王浆脂质组分的38.50%。
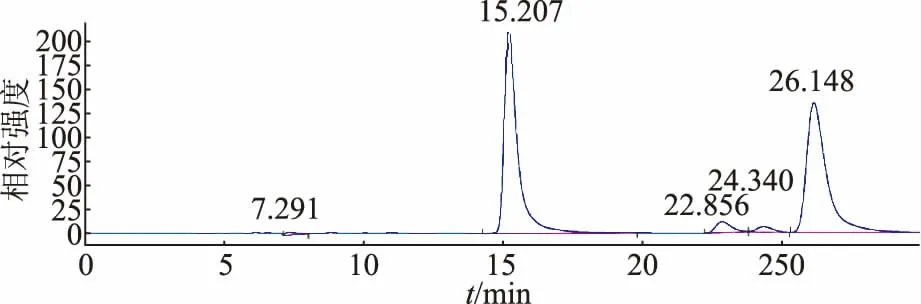
图4 脂类功能因子提取物中10-HDA 相对含量色谱图Fig. 4 Chromatogram of 10-HDA relative content in lipid functional factor extract
2.3 动物实验结果
2.3.1小鼠体质量 由于在实验最后一周的T-迷宫动物行为学实验需要通过饮食控制使小鼠体质量下降为原体质量的85%,所以对小鼠饮食控制前体质量变化(见图5(a)~图5(d))及体质量增长率(见图5(e)~图5(h))进行了统计。 结果显示,Dgal 造模(模型组)会降低小鼠体质量增长量,而所有给药组小鼠的体质量增长量较模型组均有上升,其中阳性对照组,蜂王浆组,粗蛋白提取物低、中剂量组,蛋白质类功能因子提取物低剂量组,脂类功能因子提取物组体质量增长率更趋近与空白对照组。
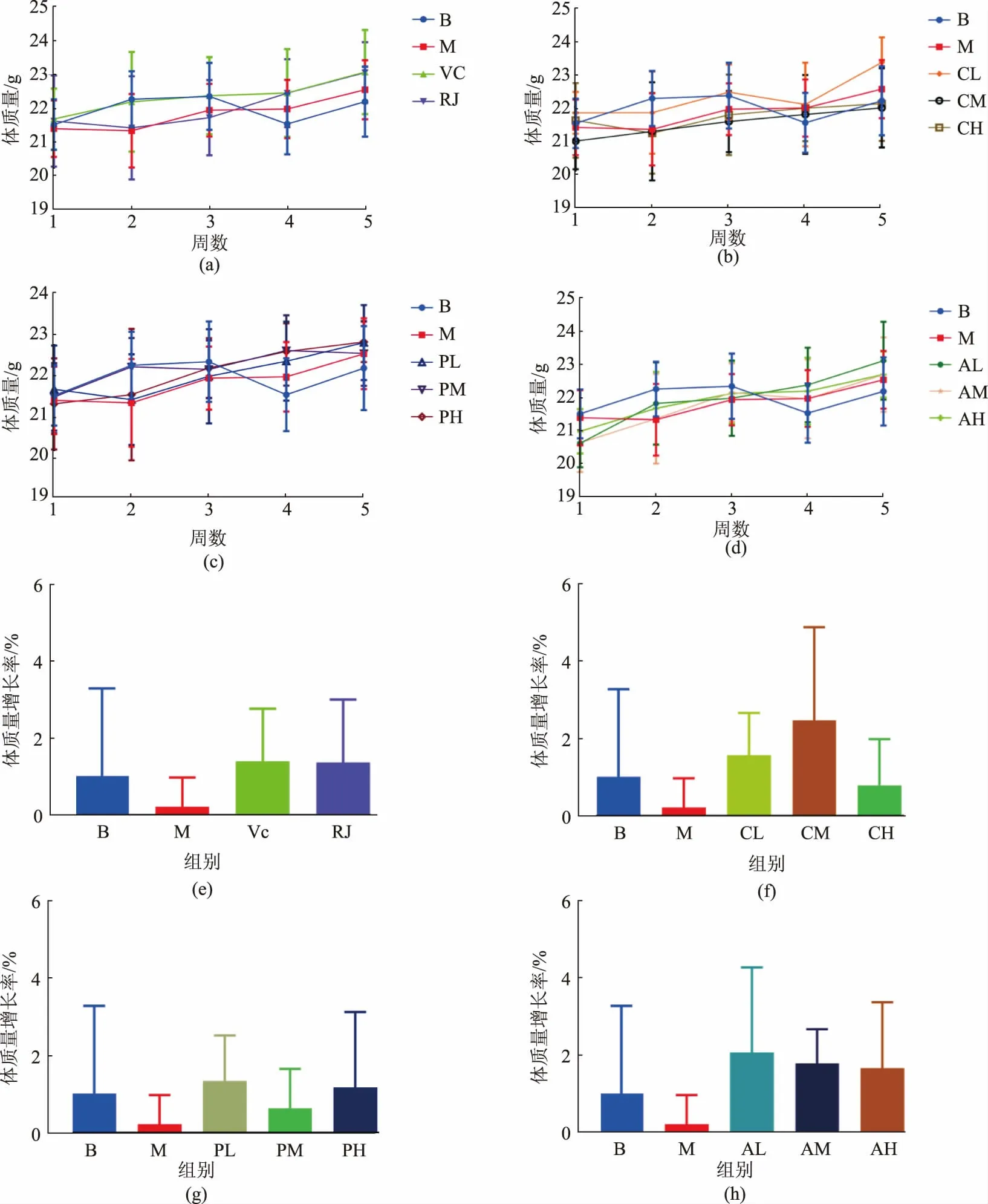
图5 小鼠饮食控制前的体质量变化及增长率Fig. 5 Body weight alterations and body weight gain of mice before alimentary control
2.3.2小鼠的组织器官指数D-gal 造模能够上调雌性小鼠的肝脏组织肿大(见图6),与空白对照组小鼠相比,D-gal 造模小鼠的肝脏组织器官指数显著上升(P<0.05),上升约10%。 所有给药组小鼠的肝脏指数均有下降,其中粗蛋白提取物高剂量组(P<0.05)、蛋白质类功能因子提取物高剂量组(P<0.01)及3种剂量的脂类功能因子提取物组(P<0.01)小鼠的肝脏指数均有显著下降, 接近空白对照组小鼠。推测蜂王浆中蛋白质组分,特别是相对分子质量为50 000~60 000 的组分, 以及脂类组分能够改善衰老模型小鼠的肝脏功能。
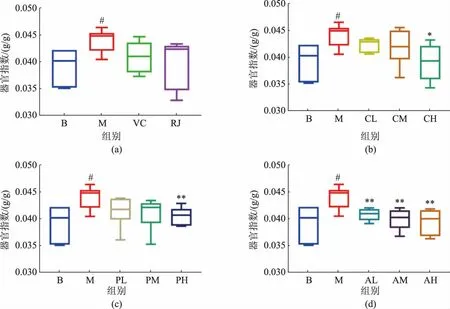
图6 各组小鼠肝脏组织器官指数Fig. 6 Organ index of liver of mice in each group
同时,D-gal 造模使雌性小鼠的脑、脾脏及肾脏组织器官指数均有所增加(见图7)。 蛋白质类功能因子提取物低剂量组小鼠脑组织器官指数低于模型组(见图7(a));粗蛋白提取物高剂量组,蛋白质类功能因子提取物中剂量组及脂类功能因子提取物中、高剂量组小鼠脾脏器官指数低于模型组(见图7(b));蜂王浆组,粗蛋白提取物高剂量组,蛋白质类功能因子提取物中、低剂量组及脂类功能因子提取物组小鼠肾脏器官指数低于模型组(见图7(c))。

图7 各组小鼠脑组织、脾脏及肾脏的器官指数Fig. 7 Organ indexes of brain, spleen and kidney of mice in each group
2.3.3T-迷宫实验结果 与空白对照组小鼠相比,D-gal 造模小鼠在T-迷宫中寻找食物的准确率(与模型组相比)显著下降(P<0.01,见图8),比空白对照组准确率低23.2%。 阳性对照组(VC),蜂王浆组,蛋白质类功能因子提取物中、高剂量组及脂类功能因子提取物组小鼠的准确率均显著高出模型组(P<0.05),增加幅度为18.8%~21.7%,接近于空白对照组。 说明蜂王浆及其中相对分子质量为50 000~60 000 组分、10-HDA 对改善衰老模型小鼠的认知记忆功能具有显著作用。
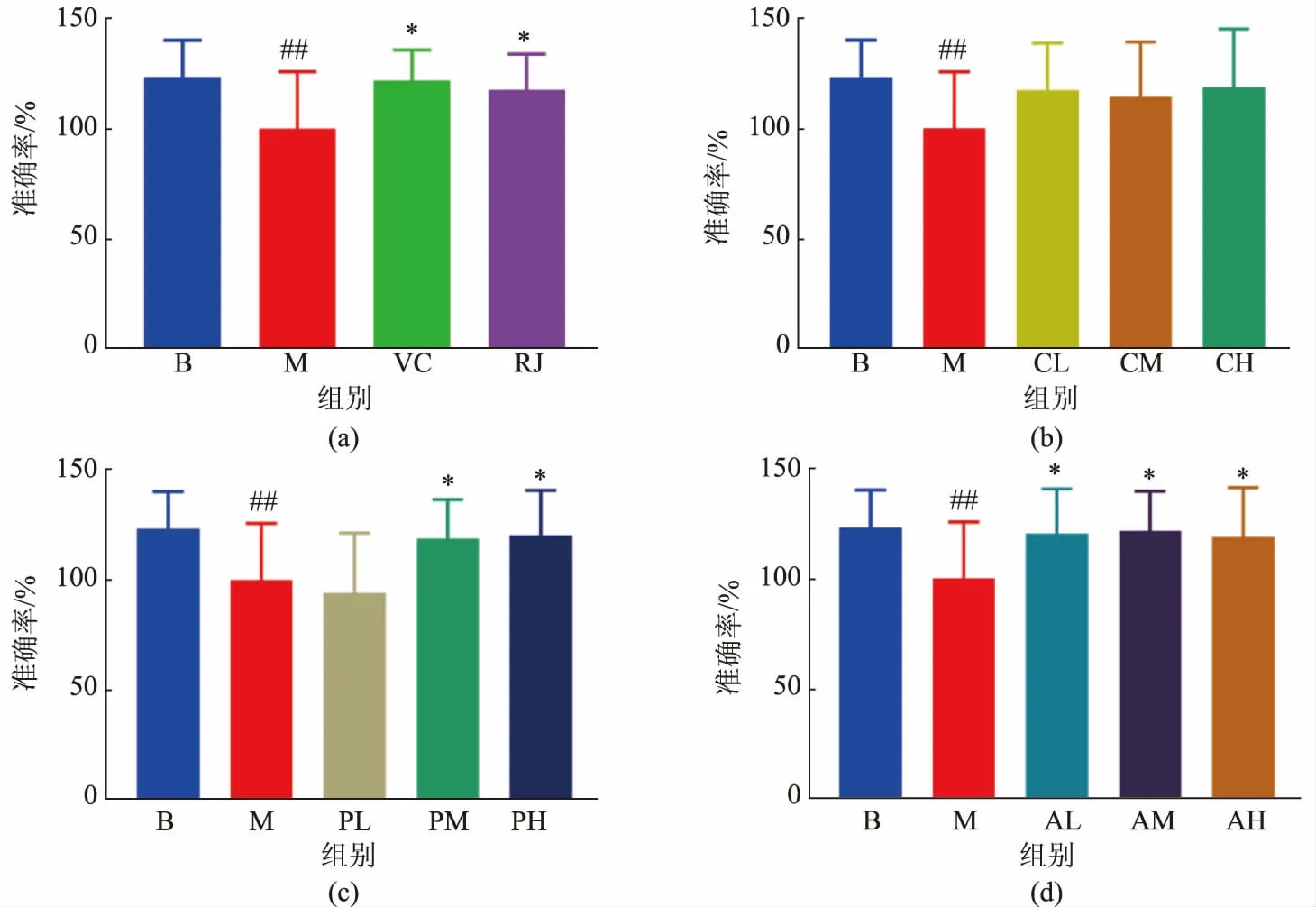
图8 小鼠T-迷宫测试结果Fig. 8 T-maze test results of mice
2.3.4小鼠肝脏MDA 水平D-gal 造模使模型组小鼠的肝组织中MDA 质量摩尔浓度升高(见图9)。蜂王浆组,粗蛋白提取物高剂量组,蛋白质类功能因子提取物中剂量组及脂类功能因子提取物低、中剂量组小鼠的肝脏MDA 质量摩尔浓度则趋近于空白对照组,说明蜂王浆及上述组分能够缓解肝脏组织的氧化应激反应。
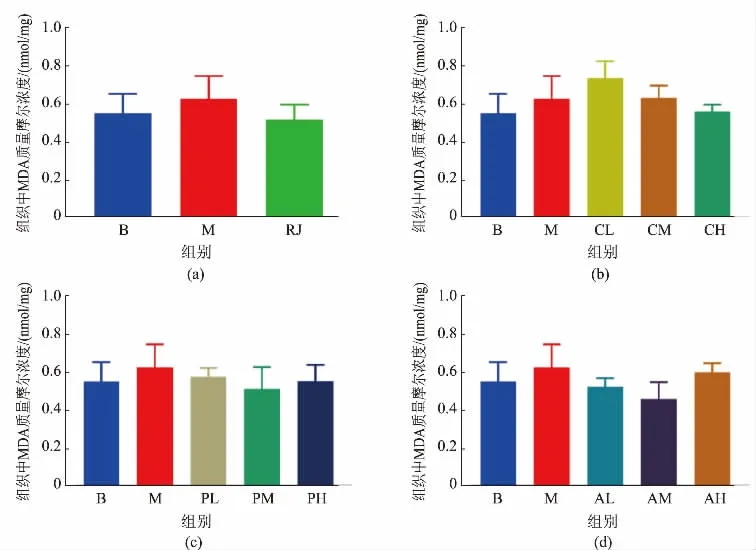
图9 各组小鼠的肝组织中MDA 质量摩尔浓度Fig. 9 MDA molality in liver tissue of mice in each group
2.3.5讨论 衰老是生物随着时间的推移,自发的一种复杂的自然现象,是机体的一个必然过程。 其常常伴随着机体代谢减缓,器官功能的减退以及认知水平的减弱。 当前,社会物质的极大丰富导致人口老龄化进程加速,如何防治脑老化和延缓衰老成为人们备受关注的问题。 作者采用D-gal 造成的小鼠亚急性衰老模型(该动物衰老模型是最接近于自然衰老的过程),参照已有研究报道[37],稍有修改,通过腹腔注射D-gal 溶液连续7 周的方法建立衰老模型,同时进行给药5 周。
记忆水平的显著下降就是脑老化的一种临床表现。 记忆可以广义定义为对先前获取的信息的持久性, 其中工作记忆的能力和持续时间都是有限的,与特定任务的执行密切相关,空间工作记忆最成熟的测试之一是自发交替的T-迷宫实验[40]。 T 形迷宫是一个T 形装置,允许在两个相反的手臂之间进行选择。 小鼠从T 的底部开始行动,并允许选择其中一端的目标臂。 如果快速连续进行两次实验,在第二次实验中,小鼠倾向于选择以前没有访问过的手臂,这反映了对第一选择的记忆,这被称为“自发交替”。 这种倾向可以通过使动物饥饿并在交替时奖励其首选食物来加强[41]。 自发和奖励对海马体功能障碍非常敏感,可以很好地反映小鼠的空间工作记忆能力。通过T-迷宫实验结果显示D-gal 能够显著降低小鼠在T 形迷宫中寻找食物的准确率,说明模型组小鼠的认知水平发生了明显下降,衰老模型造模成功。 经过蜂王浆、蛋白质类功能因子提取物中、 高剂量及脂类功能因子提取物的单独干预,小鼠的准确率显著高出模型组18.8%~21.7%(P<0.05), 粗蛋白提取物组分虽然能够提高准确率,但数据没有显著性差异。 说明蛋白质提取物中相对分子质量为50 000~60 000 组分、 脂类功能因子组分对衰老相关空间工作记忆功能下降的改善作用与蜂王浆原浆效果一致,并且低于等量蜂王浆原浆的脂类功能因子也能够显著增强衰老小鼠的记忆能力。
氧化应激也是生物体衰老的一项重要指标,机体内产生的氧自由基会攻击生物膜中的不饱和脂肪酸, 引起脂质过氧化生成过氧化脂质(lipid peroxidation,LPO),并且其最终的氧化产物是MDA,从而造成核酸和蛋白质等大分子聚合,影响线粒体酶活性和加剧膜损伤,产生细胞毒性,进一步导致机体受损以及人体衰老[36]。 肝脏是参与机体抗氧化和代谢调控的重要器官,已有研究报道,衰老相关的记忆减退与肝脏功能异常密切相关[42]。 在本研究中D-半乳糖造模后的小鼠肝脏器官指数明显上调,MDA 质量摩尔浓度也高于空白对照组,推测D-半乳糖对衰老小鼠肝脏器官造成一定程度的功能损伤,同时,D-半乳糖也轻微降低了小鼠体质量,增加了脑、脾脏及肾脏器官指数,但无显著性,说明衰老症状建立的同时未对小鼠生命健康造成严重损害。 通过干预发现,蜂王浆原浆能够部分降低肝脏器官指数及肝脏MDA 水平, 说明蜂王浆可能减缓小鼠衰老过程中的肝脏功能衰退。 其中,与蜂王浆原浆等量的粗蛋白提取物(中剂量)及蛋白质类功能因子提取物(中剂量)能够降低肝脏器官指数的平均水平,但无显著性。 然而高剂量粗蛋白提取物(P<0.05)及高剂量蛋白质类功能因子提取物(P<0.01)对肝脏器官指数异常有明显的调节作用,低、中、高剂量的脂类功能因子(P<0.01)均能够显著缓解肝脏肿大现象。 另外,除粗蛋白提取物的低、中剂量组外,其他组分对肝脏组织氧化应激水平的调节作用趋近于蜂王浆原浆。 上述结果说明,脂类功能因子抑制肝脏损伤的效果相对较好,粗蛋白及蛋白质类功能因子在高于等量蜂王浆原浆的剂量下能够发挥缓解作用。
3 结 语
作者对蜂王浆及其蛋白质、脂类组分的抗衰老作用和改善学习记忆能力进行了初步探究。 结果表明,蜂王浆发挥延缓衰老作用的主要功效成分可能为脂类物质,因其在等同成人摄入蜂王浆推荐剂量及其一半或两倍的剂量下均有效果,且以两倍效果最佳。 同时,粗蛋白组分仅对衰老相关的肝脏肿大有缓解作用, 相对分子质量为50 000~60 000 的蛋白质组分在高剂量的条件下能够提高记忆水平并缓解肝脏器官指数异常,因此推测蜂王浆中主要蛋白质类功能因子(相对分子质量为50 000~60 000)在抗衰老的过程中能够发挥一定的协同作用。 该研究结果能够为进一步科学解释蜂王浆功能活性的机理打下基础,为蜂王浆及其功能活性因子在改善衰老及相关记忆减退方面的应用提供了理论基础。

