熊本牡蛎、葡萄牙牡蛎和长牡蛎组织菌群构成及功能的比较分析
叶静 ,戴文芳 ,刘圣 ,林志华 ,薛清刚 *
( 1.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;2.浙江万里学院 宁海海洋生物种业研究院,浙江 宁海 315604;3.浙江万里学院 生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
1 引言
动物体内定殖着数量庞大且种群构成复杂的微生物。这些微生物与宿主互相依赖、彼此制约,形成一种相对稳定的共生关系,从而维持宿主的健康状态[1-2]。研究表明,共生微生物在宿主的消化、营养吸收、抗逆和抗菌等方面发挥着重要作用[3-5]。
牡蛎广泛分布于沿海地区,是世界范围内养殖最广、产量最高的经济贝类,也是我国重要的海水养殖种类之一。同时,牡蛎在生物多样性保护、净化水体、修复生态系统的功能等方面发挥重要作用[6]。然而,受生长环境和滤食习性的影响,牡蛎体内的共生微生物构成易受到养殖环境的影响,进而会影响牡蛎的健康状况[7]。因此,稳定的细菌群落可能为牡蛎的健康生长提供有利条件。研究表明,某些益生菌能够降低宿主对疾病的易感性,这已经在贝类的养殖中得到证实[8-9]。例如,投喂益生菌短小芽孢杆菌RI06-95(Bacillus pumilusRI06-95)可 以 提 高 美 洲 牡 蛎(Crassostrea virginica)抵抗溶珊瑚弧菌(Vibrio coralliilyticus)的侵染,从而提高其存活率[10]。另一方面,牡蛎在养殖过程中易受细菌性疾病的影响。如灿烂弧菌(Vibrio splendidus)被证实是导致长牡蛎(Crassostrea gigas)幼体在育苗期间发生大规模死亡的主要病原菌之一[11]。此外,牡蛎还可能携带人类致病性细菌,随着人们食用进入人体,从而影响人体的健康。如食用受副溶血弧菌(Vibrio parahaemolyticus)感染的贝类是导致食物中毒的主要因素[12]。因此,探明牡蛎体内细菌群落的构成显得尤为重要。
相比于传统的细菌培养方法,Illumina高通量测序技术具有通量高、时间短以及能够更全面地反映样本间细菌群落的相关信息等优点,已经成为研究微生物组学的重要手段。该技术目前已用于探究鱼类、虾类和贝类等多种水生动物肠道细菌群落组成及其与宿主互作影响宿主健康的微生态学机制,进而筛选潜在的益生菌或致病菌[13-16]。在高通量测序的基础上,利用 PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)2工具能够进一步获得细菌群落的功能信息。例如,Zhang等[17]利用PICRUSt2工具对肠道细菌群落介导的功能进行分析发现灿烂弧菌感染刺参(Apostichopus japonicus)时导致其中肠的代谢功能途径的相对丰度显著高于后肠,而中肠中涉及信号分子及其相互作用、外源性生物降解和代谢等的功能途径的相对丰度则均低于后肠,这进一步解释了刺参腐皮综合征先发生于后肠的原因。郁维娜等[18]利用PICRUSt2分析健康和患病凡纳滨对虾(Litopenarus vannamei)肠道微生物的代谢功能途径,发现与健康组相比,患病对虾中参与弧菌侵染的过程显著增强,而溶酶体和过氧化物酶等免疫功能代谢过程显著减弱,这些功能途径的丰度变化可能增加了对虾患病的风险。因此,通过PICRUSt2可以很好地解释细菌群落与其功能的相关性,这为阐述牡蛎组织菌群构成与菌群功能的相关性提供了有利工具。
熊本牡蛎(Crassostrea sikamea)、葡萄牙牡蛎(Crassostrea angulata)和长牡蛎分别是我国浙江、福建和北方沿海地区主要养殖的牡蛎品种。然而,目前对于这3种牡蛎体内的微生物组成及是否携带潜在病原菌并没有全面的认识。此外,这3种牡蛎体内的微生物构成是否因其宿主遗传和养殖环境不同而有差异尚未获知。鉴于此,本研究采用Illumina高通量测序技术对熊本牡蛎、葡萄牙牡蛎和长牡蛎不同组织的细菌群落进行研究,比较分析这3种牡蛎不同组织间的细菌群落组成特征、多样性及功能差异。本研究为整体了解熊本牡蛎、葡萄牙牡蛎和长牡蛎组织内的细菌群落构成特征以及牡蛎的健康养殖提供了数据支持。
2 材料与方法
2.1 实验设计和样品采集
选取健康的二龄雌性熊本牡蛎(记为Cs)、葡萄牙牡蛎(记为Ca)和长牡蛎(记为Cg)作为实验对象。其中,熊本牡蛎采自浙江省宁波市宁海县西店镇养殖区(海水盐度为 22.7±3.2、水温为(26.2±2.5)℃、溶解氧浓度为(8.4±0.2)mg/L、pH 为 7.7±0.3);葡萄牙牡蛎采自福建省漳州市漳浦县旧镇镇养殖区(海水盐度为 20.5±3.0、水温为(21.3±4.1)℃、溶解氧浓度为(8.5±0.5)mg/L、pH 为 7.4±0.2);长牡蛎采自山东省青岛市即墨区鳌山卫镇养殖区(海水盐度为19.5±3.0、水温为(20.3±2.1)℃、溶解氧浓度为(8.0±0.5)mg/L、pH为7.5±0.2)。采集的3种牡蛎照片如图1所示。使用灭菌海水清洗牡蛎外壳,再用酒精进行擦拭,接着用解剖刀在绞合部撬开小口,沿壳缘切开牡蛎两侧闭壳肌,在无菌操作条件下使用2 mL注射器从牡蛎围心腔内抽取血淋巴液,置于无菌离心管中,立即于−80℃保存。接着使用无菌手术剪刀取牡蛎的鳃、外套膜、肝胰腺和性腺组织,分别置于无菌离心管中。每种牡蛎各取6组重复样本。采集的组织样品置于液氮速冻后,于−80℃保存,直至DNA提取。

图1 本研究采集的长牡蛎、葡萄牙牡蛎和熊本牡蛎样品图片Fig.1 The pictures of Crassostrea gigas, Crassostrea angulata and Crassostrea sikamea collected in this study
2.2 DNA提取
将收集的组织样本(约500 mg/样本)分别用匀浆机匀浆后,利用细菌基因组DNA提取试剂盒(MOBIO Laboratories, Carlsbad, CA, 美国)按照操作说明书提取DNA。随后用NanoDrop ND-2000分光光度计测定DNA浓度。DNA置于−20℃保存备用。
2.3 PCR扩增和Illumina高通量测序
取每个样品纯化后的40~60 ng gDNA作为PCR扩增模板,使用16S rRNA基因引物338F(5′-ACTCCTACGGGAGGCAGCA-3′) 和 806R(5′-GGACTACHVGGGTWTCTAAT -3′)对细菌 16S rRNA 的 V3−V4 可变区作PCR扩增。PCR扩增反应体系(50 μL)包括Premix Taq TM 25 μL,上、下游引物(10 μmol/L)各1 μL,gDNA 模板 1 μL以及 ddH2O 22 μL。按照如下程序进行PCR反应:94℃预变性5 min;94℃变性30 s,53℃退火 30 s,72℃延伸 30 s,共进行 30个循环;最后72℃延伸10 min。每个样品重复3次以减少扩增过程造成的偏差。扩增产物用PCR片段纯化试剂盒(TaKaRa Biotech,日本)纯化,使用 Agilent 2100(Agilent,美国)生物测定仪检测片段大小。每个样品取等量的PCR产物,于Illumina MiSeq测序平台测序。
2.4 测序数据处理
16S rRNA基因原始测序数据以FASTQ文件形式提交到Dix-seq平台分析[19]。使用FastQC对原始测序序列进行质控。利用FLASH软件对序列进行拼接[20],USEARCH法[21]去除嵌合体序列,并利用MOTHUR软件将相似性大于97%的序列聚类成操作分类单元(Operational Taxonomic Units, OTU)。随后选取丰度和覆盖度最高的序列作为每个OTU的代表序列,用PyNAST[22]在Silva123数据库中比对获得物种注释,同时,利用每个样本的相对丰度对特征丰度进行归一化。为了提高数据的可靠性,序列数据分析时删除了古菌、叶绿体、不属于细菌的序列和仅检测到1次的序列。各样本的α-多样性指标和β-多样性距离均采用Dix-seq平台计算。
2.5 功能预测
PICRUSt2是用来评估预测细菌群落功能通路的重要工具。为了获得细菌群落功能的特征信息,将每个OTU的丰度均一化后,利用PICRUSt2分析获得KEGG(Kyoto Encyclopedia of Genes and Genomes)细菌群落功能信息,并用热图显示其在不同牡蛎组织间的分布情况。
2.6 统计分析
利用韦恩图比较3种牡蛎相同组织间和同种牡蛎不同组织间细菌OTU的差异性。使用 SPSS 22.0软件进行单因素方差分析(One-way Variance Analysis,ANOVA)评估3种牡蛎相同组织间和同种牡蛎不同组织间细菌群落α-多样性和OTU数的差异。采用基于Bray-Curtis距离的非度量多维尺度分析(Non-Metric Multidimensional Analysis, NMDS)和相似性分析(Analysis of Similarity, ANOSIM)评估3种牡蛎整体间及同种牡蛎5种组织间的细菌群落结构差异。在Rv3.6.3软件中用基于“vegan”包的多元置换方差分析(Permutational Multivariate Analysis of Variance,PERMANOVA)定量评估牡蛎种类和组织类型对细菌群落变化的影响程度。
3 结果
3.1 细菌群落组成特征
原始测序下机序列经过质量控制后共获得了5 502 202条优质序列,所得序列经细菌分类数据库比对后归为6 020个OTUs。其中在熊本牡蛎、葡萄牙牡蛎和长牡蛎的5种组织中分别鉴定到4 610、4 382和3 915个OTUs。利用韦恩图比较3种牡蛎相同组织间及同种牡蛎不同组织间细菌群落的组成差异。结果表明,熊本牡蛎、葡萄牙牡蛎和长牡蛎整体间共有细菌OTU数为2 554个(占总OTU数的42.4%),而对应在3种牡蛎中特有的OTU数分别占总OTU数的11.3%、9.8%和7.0%(图2a)。对3种牡蛎相同组织中的细菌进行比较时,发现5种组织中的细菌OTU数存在差异,其中鳃、肝胰腺、外套膜、性腺和血淋巴中的共有OTU数分别占3种牡蛎对应相同组织总OTU数的19.8%、11.8%、19.1%、16.3%和20.9%。此外,在熊本牡蛎的肝胰腺中细菌的特有OTU数最高,占熊本牡蛎所有组织总OTU数的21.6%;而在葡萄牙牡蛎的血淋巴中细菌的特有OTU数最多,占葡萄牙牡蛎所有组织总OTU数的12.4%;在长牡蛎外套膜中细菌的特有OTU数最多,占长牡蛎所有组织总OTU数的7.2%(图2b)。这些结果表明,3种牡蛎整体间及同种牡蛎5种组织间细菌的OTU数存在显著差异(p<0.05)。

图2 韦恩图展示3种牡蛎相同组织间(a)和同种牡蛎不同组织间(b)共有和特有的细菌OTU数Fig.2 Venn diagram displaying the numbers of unique and shared OTU among same tissues from three oysters (a) and different tissues from individual oyster (b)
在细菌(亚)门水平上,3种牡蛎组织中的优势菌主要隶属于 γ-变形菌纲(γ-proteobacteria)、柔壁菌门(Tenericutes)和厚壁菌门(Firmicutes)(图3a)。其中,γ-变形菌纲在熊本牡蛎外套膜中的丰度(平均相对丰度为86.0%)显著高于其他4个组织,而在葡萄牙牡蛎和长牡蛎的血淋巴中丰度最高(平均相对丰度分别为32.8%和39.0%)。柔壁菌门在熊本牡蛎、葡萄牙牡蛎和长牡蛎的肝胰腺中的丰度显著高于同种牡蛎中的其他组织,平均相对丰度分别为25.6%、36.2%和22.4%。厚壁菌门在熊本牡蛎的鳃、葡萄牙牡蛎的血淋巴和长牡蛎的肝胰腺中丰度最高,平均相对丰度分别为14.6%、26.7%和37.7%,显著高于对应牡蛎的其他组织(p<0.05)。
在细菌属水平上,熊本牡蛎5个组织中的优势菌主要隶属于假交替单胞菌属(Pseudoalteromonas)、弧菌属(Vibrio)、嗜冷杆菌属(Psychrobacter)和支原体菌属(Mycoplasma);葡萄牙牡蛎5个组织中的优势菌主要隶属于支原体菌属、嗜冷杆菌属和弧菌属;长牡蛎5个组织中的优势菌主要隶属于支原体菌属、假交替单胞菌属、芽胞杆菌属(Anoxybacillus)和弧菌属(图3b)。其中,假交替单胞菌属在熊本牡蛎的血淋巴中丰度(平均相对丰度为37.4%)最高,而在其肝胰腺的丰度(平均相对丰度为0.3%)最低。支原体菌属在葡萄牙牡蛎的鳃中丰度(平均相对丰度为36.0%)最高,且显著高于其他两种牡蛎的5种组织。芽胞杆菌属在长牡蛎的肝胰腺丰度(平均相对丰度为22.4%)最高,且显著高于其他两种牡蛎的5种组织。嗜冷杆菌属在熊本牡蛎和葡萄牙牡蛎的血淋巴中丰度(平均相对丰度分别为17.7%和15.3%)高于对应同种牡蛎的其他4个组织,但均在3种牡蛎的肝胰腺中丰度最低。弧菌属在熊本牡蛎的鳃、外套膜、性腺和血淋巴中的相对丰度均显著高于其在葡萄牙牡蛎和长牡蛎的各个组织中的丰度。其中,对于熊本牡蛎,弧菌属在其外套膜中的丰度显著高于鳃、性腺、肝胰腺和血淋巴中的丰度。就葡萄牙牡蛎来看,弧菌则是在其血淋巴中的丰度最高,而在长牡蛎中弧菌则是在其性腺中丰度最高,但均在3种牡蛎的肝胰腺中丰度最低(图3b)。
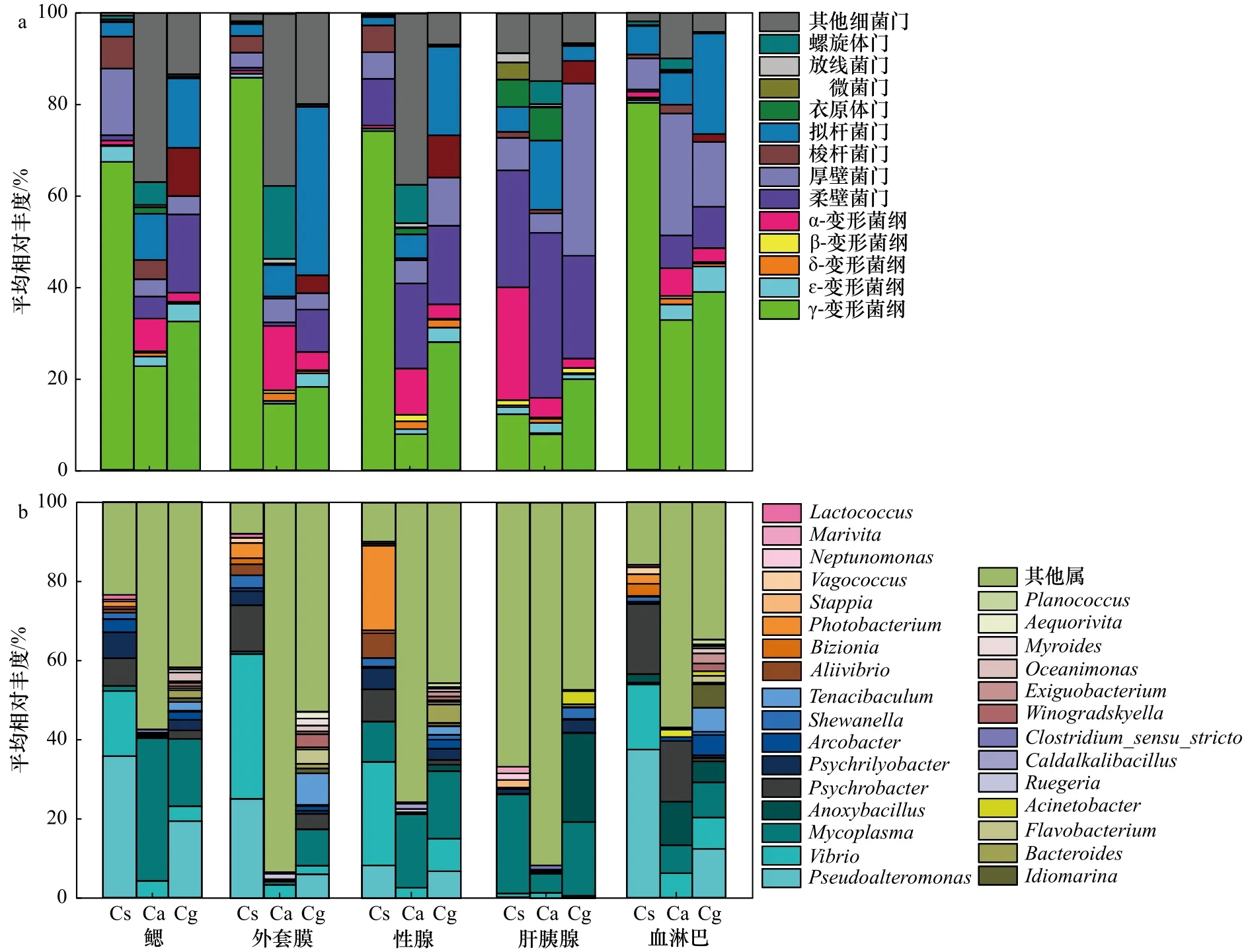
图3 3种牡蛎5种组织中的优势细菌门(变形菌门归类到纲)(a)和细菌属(b)的平均相对丰度Fig.3 Average relative abundances of the dominant bacterial phyla (Proteobacteria were assigned to the class level) (a) and genus (b) in the five tissues form three oysters
3.2 细菌群落多样性差异
进一步比较熊本牡蛎、葡萄牙牡蛎和长牡蛎5种组织中的细菌群落α-多样性,多样性指数包括Chao1指数、物种丰富度(Species richness)和香农指数(Shannon index)。结果表明,Chao1指数、物种丰富度指数和香农指数均随牡蛎种类和组织类型的不同而有所差异(图4)。对同种牡蛎不同组织的细菌群落α-多样性进行比较时,发现Chao1指数和物种丰富度指数在熊本牡蛎的鳃中最高而在血淋巴中最低,在葡萄牙牡蛎的外套膜中最高而在性腺中最低,但在长牡蛎的鳃中最高而在肝胰腺中最低(图4a,图4b)。相反,香农指数在熊本牡蛎的肝胰腺、葡萄牙牡蛎和长牡蛎的血淋巴中最高,而分别在熊本牡蛎的血淋巴、葡萄牙牡蛎的鳃和长牡蛎的肝胰腺中最低(图4c)。对3种牡蛎的相同组织进行比较时,发现Chao1指数和物种丰富度指数在长牡蛎肝胰腺中的细菌群落多样性显著低于熊本牡蛎和葡萄牙牡蛎;香农指数在葡萄牙牡蛎的鳃、性腺和肝胰腺中菌群多样性低于熊本牡蛎和长牡蛎,而在熊本牡蛎的血淋巴中细菌群落多样性低于葡萄牙牡蛎和长牡蛎(图4)。这些发现表明,3种牡蛎的相同组织间除外套膜外,细菌群落α-多样性存在不同程度的差异性。

图4 比较3种牡蛎5种组织中的细菌群落α-多样性差异Fig.4 Comparison of bacterial community α-diversity in five tissues from three oysters
3.3 细菌群落结构差异
在细菌OTU水平上,利用NMDS分析了3种牡蛎5种组织间的细菌群落结构差异,图中各样品间的相对距离能够反映其菌群的相似程度,距离越近,相似性越高。结果表明,在不区分组织的情况下,熊本牡蛎、葡萄牙牡蛎和长牡蛎的菌群结构沿NMDS轴1从左至右明显分离(图5a,图5b);反之,在区分组织情况下,熊本牡蛎和葡萄牙牡蛎5种组织内的菌群结构沿NMDS轴2从下至上明显分离,而长牡蛎5种组织内的菌群结构沿NMDS轴1分离(图5c)。这些结果也进一步通过相似性分析得到证实,表明3种牡蛎5种组织内的细菌群落结构整体存在显著差异(表1)。其中,熊本牡蛎除了血淋巴、鳃和外套膜样本之间以及葡萄牙牡蛎和长牡蛎除鳃和性腺样本之间的差异不显著外,同种牡蛎的其他组织样品之间均具有显著差异(表2)。多元置换方差分析结果表明,牡蛎种类和组织类型分别导致细菌群落发生25.8%和26.6%的变异(表3)。

表1 基于Bray-Curtis距离比较3种牡蛎不同组织间细菌群落的整体差异性Table 1 Comparison of overall differences in bacterial communities among different tissues of the three oysters based on Bray-Curtis distance

表2 基于 Bray-Curtis 距离比较同种牡蛎不同组织间细菌群落的差异性Table 2 Comparison of difference in bacterial communities among different tissues from the same oyster based on Bray-Curtis distance

表3 基于非参数的多元置换方差分析牡蛎种类和组织类型对细菌群落的定量影响Table 3 Quantitative effects of oyster species and tissue types on the variations in bacterial community based on nonparametric permutational multivariate analysis of variance (PERMANOVA)

图5 非度量多维尺度分析(NMDS)展示3种牡蛎5种组织间(a)、3种牡蛎整体间(b)和同种牡蛎5种组织间(c)的细菌群落结构差异Fig.5 Non-metric multidimensional scaling analysis (NMDS) showed the difference in bacterial community structures among five tissues(a), all tissues of three oysters (b), and five tissues of same oyster (c)
3.4 细菌群落功能差异
将熊本牡蛎、葡萄牙牡蛎和长牡蛎的肝胰腺、鳃和血淋巴中的细菌群落进行功能预测,并将相关功能途径的丰度分布特征绘制成热图,结果发现3种牡蛎的鳃、肝胰腺和血淋巴中的菌群功能存在显著差异(图6)。其中由细菌参与的膜转运、复制和修复、信号通路、氨基酸代谢、碳水化合物代谢、脂质代谢和消化与吸收等功能途径在熊本牡蛎的肝胰腺、葡萄牙牡蛎的肝胰腺和鳃、长牡蛎的血淋巴中丰度显著高于对应牡蛎的其他组织。此外,参与溶酶体和过氧化物酶等具有抗菌免疫能力的功能途径在3种牡蛎的鳃、肝胰腺和血淋巴中均具有一定丰度,而参与碳水化合物消化吸收、胰腺分泌、矿物质吸收和蛋白质消化吸收等消化过程以及细菌性感染疾病的功能过程在3种牡蛎的血淋巴中丰度显著高于其他组织(图6)。这些结果表明,细菌介导的功能途径在3种牡蛎的不同组织中存在差异。

图6 热图展示3种牡蛎的肝胰腺、鳃、血淋巴中细菌群落功能途径的丰度(平方根转换)分布Fig.6 Heatmap showing the abundance (sqrt (x) transformed) distribution of functional pathways of bacterial communities in the gill, hepatopancreas, and hemolymph from three oysters
4 讨论
共生微生物在宿主生理、营养吸收和消化及维持宿主健康等方面具有重要作用[1,3-4]。然而,目前关于探究牡蛎内部整体菌群构成特征的研究甚少。本研究首次对熊本牡蛎、葡萄牙牡蛎和长牡蛎不同组织中的细菌群落结构进行探究,分析比较3种牡蛎5种组织间细菌群落的整体差异。
本研究发现,熊本牡蛎、葡萄牙牡蛎和长牡蛎中不同组织的细菌OTU数存在显著差异。类似的研究表明,紫贻贝(Mytilus edulis)肠道内的核心细菌OTU数高于美洲牡蛎肠道内的细菌OTU数[23]。这些发现提示牡蛎组织内的核心菌群可能因其种类不同而有所差异。值得注意是的,这种差异性在不同分类水平上的细菌组成中也较为明显。例如,本研究发现熊本牡蛎、葡萄牙牡蛎和长牡蛎组织中的优势菌门主要隶属于γ-变形菌纲、柔壁菌门和厚壁菌门,但其丰度在对应牡蛎的不同组织间存在显著差异。前人研究表明,这些细菌也是缢蛏内脏团、皱纹盘鲍肠道和美洲牡蛎鳃中的优势菌[24-26]。这些发现表明,γ-变形菌纲、柔壁菌门和厚壁菌门可能是在贝类中普遍共生的细菌。进一步的研究表明,这些细菌在水生动物的生长和发育中发挥关键作用[2,27]。例如,Semova等[3]发现厚壁菌(Firmicutes)在细胞内脂滴的形成中起着重要作用,可以促进斑马鱼肠道吸收脂肪。变形菌能够降解纤维素和琼脂,促进双壳贝类的消化吸收[28-29]。此外,本研究也发现假交替单胞菌属、芽胞杆菌属、支原体菌属、嗜冷杆菌属和弧菌属是3种牡蛎5种组织内的优势菌属,但其丰度在对应牡蛎的不同组织间存在差异。类似的研究发现,假交替单胞菌属、嗜冷杆菌属和弧菌属是虾夷扇贝(Patinopecten yessoensisis)和岩扇贝(Rock scallop)体内的优势菌属[15,30]。研究表明,假交替单胞菌属能够产生多种具有抗菌活性的化合物[31];芽孢杆菌属可分泌多种胞外酶,在宿主的食物消化、营养代谢和抵御病原菌入侵中起着重要的作用[32];而支原体菌属有益于缢蛏(Sinnovacula constricta)的健康生长[33]。因此,这些富集在牡蛎组织中的优势菌属可能在促进牡蛎的生长发育方面发挥了积极作用,而其具体的生物学功能仍需进一步验证。
近年来,由弧菌引起的传染性疾病给牡蛎的养殖带来了严重的危害[34]。弧菌广泛存在于海洋环境中,是一种条件致病菌,且极易引起贝类感染弧菌病[35-38],严重影响贝类的健康生长,而携带弧菌病原体的牡蛎还可能进一步影响人体的健康[39]。本研究发现,与葡萄牙牡蛎和长牡蛎相比,弧菌在熊本牡蛎的组织中丰度最高,这提示熊本牡蛎可能在养殖过程中由弧菌引发的疾病风险更高。值得注意的是,弧菌在肝胰腺组织中的丰度显著低于其他组织,这与肝胰腺微生物参与疾病感染的功能途径丰度较低是一致的。然而,在环境适宜时,弧菌会成为优势菌,尤其是在夏季高温季节,极易造成牡蛎死亡[34]。因此,在牡蛎组织中富集较高丰度的弧菌可能对其后期的养殖起着不容忽视的影响。
本研究发现,这3种牡蛎组织间的细菌群落多样性随着组织不同而存在差异。这可能归因于牡蛎体内微生物间的相互竞争。类似的研究发现,美洲牡蛎的外套膜、鳃和肠道中细菌群落多样性具有高度多样化特征[25]。细菌群落多样性有助于维持宿主内环境的稳定[1-2],高的细菌群落多样性可能是维持宿主健康生长的重要指标。也就是说,细菌群落多样性与宿主的健康状态正相关[1]。这样看来,在熊本牡蛎中鳃存在高的菌群多样性可能对其健康有一定的指示作用。此外,细菌群落多样性在葡萄牙牡蛎的外套膜中较高,而在长牡蛎的5种组织间也存在不同的变化。这些发现表明,熊本牡蛎、葡萄牙牡蛎和长牡蛎组织内的细菌群落多样性存在显著差异。类似的研究也发现,同一养殖环境下的美洲牡蛎和紫贻贝间的菌群多样性存在明显不同[23]。本研究进一步发现,熊本牡蛎、葡萄牙牡蛎和长牡蛎整体组织间存在显著差异,且同种牡蛎的5种组织间也存在不同程度的差异性。已有研究表明,同一亲本孵育的牡蛎苗放在不同的养殖环境中生长,其体内的细菌群落构成会随着宿主生长差异越来越明显[40],类似的结果也在海参肠道微生物研究中被发现[41],这表明养殖环境可能是影响细菌群落构成的原因。Fernández 等[42]研究发现,生长在同一养殖环境下的长牡蛎和美洲牡蛎体内的细菌群落也存在差异,这表明宿主遗传也可能是影响细菌群落构成的原因。值得注意的是,本研究的实验对象是3种不同的牡蛎,且分别采自3个不同的省份,其养殖水质存在一定的差异。特别是牡蛎长期生活在海水环境中,水体中的微生物可能会影响牡蛎体内的微生物构成[7]。由此看来,宿主遗传和养殖环境可能是导致3种牡蛎组织内细菌群落构成差异的原因,但其各自对菌群的贡献程度仍需进一步的验证。
共生微生物在宿主中执行着不同的功能,而宿主内稳态的失衡可能影响微生物的功能潜力,进而影响宿主的健康状况[17-18]。鉴于此,本研究进一步比较了熊本牡蛎、葡萄牙牡蛎和长牡蛎不同组织的细菌群落功能。结果发现,参与氨基酸代谢、脂质代谢、碳水化合物代谢以及消化和吸收的功能途径均在牡蛎的肝胰腺中丰度较高。肝胰腺是牡蛎重要的消化器官[43],较高丰度的功能途径表明微生物可能在牡蛎的营养吸收方面起着重要作用。此外,溶酶体和过氧化物酶等具有抗菌免疫能力的功能途径在熊本牡蛎、葡萄牙牡蛎和长牡蛎的鳃、肝胰腺和血淋巴中具有一定丰度。这些发现表明,在抵抗外界菌群的入侵时,牡蛎的各种组织共同协助,从而维持宿主体内稳定的微生态环境。值得注意的是,细菌性感染疾病主要在牡蛎的血淋巴中富集,这提示血淋巴中的微生物可能在宿主的免疫防御中起着重要作用[1,4]。综上所述,3种牡蛎不同组织中的微生物可以影响其不同功能,在维持牡蛎生长、抗菌和营养吸收等方面起着关键的作用。
5 结论
熊本牡蛎、葡萄牙牡蛎和长牡蛎5种组织中的细菌群落结构整体存在显著差异,而细菌群落α-多样性和群落组成在同种牡蛎的5种组织间和3种牡蛎相同组织间也存在不同程度的差异性,这些发现提示宿主遗传和养殖环境可能是导致3种牡蛎组织内菌群构成差异的主要原因,但哪个是决定性因素还有待进一步实验验证。假交替单胞菌属、芽胞杆菌属和支原体菌属在3种牡蛎组织中的丰度分布情况与其对应的生物学功能相一致,可能作为益生菌促进牡蛎健康生长。值得注意的是,弧菌属在3种牡蛎5种组织中存在不同程度的丰度分布,特别是在熊本牡蛎外套膜、葡萄牙牡蛎血淋巴和长牡蛎性腺中丰度分布最高,可能作为潜在病原菌影响后期牡蛎生长。然而,由于目前16S注释数据库信息有限,无法获得细菌种水平上的分类信息,因此不能确定哪些弧菌菌株以及这些弧菌属中是否存在人的潜在致病菌,建议在今后的研究中利用宏基因组手段进一步明确3种牡蛎组织中弧菌属在种水平上的构成特征及其基因功能组成。在熊本牡蛎肝胰腺、葡萄牙牡蛎鳃和长牡蛎血淋巴中由菌群介导的代谢功能途径如氨基酸、碳水化合物和脂质的代谢等丰度显著高于对应牡蛎的其他组织,提示微生物在促进宿主营养吸收方面发挥着重要作用且具有一定的组织特异性。特别是参与细菌性感染疾病过程的功能通路主要在3种牡蛎的血淋巴中富集,表明微生物可能在宿主的免疫防御中起着重要作用。本研究丰富了我们对熊本牡蛎、葡萄牙牡蛎和长牡蛎组织内细菌群落构成特征的认识,这也为利用微生物调控牡蛎生长,促进牡蛎的健康养殖提供了理论基础。

