深圳湾和茅洲河湿地浅层沉积物孔隙水中营养盐和金属元素赋存特征及其界面扩散通量研究
罗满华 ,张丽聪,李海龙 ,郭跃华,肖凯*
( 1.中国地质大学(北京) 水资源与环境学院,北京 100083;2.南方科技大学 环境科学与工程学院,广东 深圳 518055;3.中交一航局生态工程有限公司,广东 深圳 518107)
1 引言
沉积物−水界面作为水生生态系统最重要的环境界面之一,其理化性质影响着生态系统中物质迁移和贮存。已有研究表明,几乎所有的水环境污染和生态风险问题均与沉积物−水界面过程或效应相关[1-2]。因此,关注沉积物−水界面上溶质迁移过程,对于了解溶质的释放风险以及分析其来源具有重要的研究意义,而有关溶质的跨界面迁移和转化也一直是国际上环境地球化学领域的研究热点[3]。氮、磷是重要的常量营养元素,其在很大程度上控制着湿地初级生产力和水体的营养状态。沉积物作为氮、磷的源或汇,沉积物−水界面之间的氮、磷迁移对于评估湿地生态效应至关重要[4-5]。作为生命必需的微量元素,硫的氧化还原循环是驱动内源磷循环和跨界面交换的关键动力,研究显示,过量的可溶性硫化物不仅对水生生物有毒,而且影响金属元素的循环过程及其生物有效性[6]。重金属作为浮游生物生长必需的微量元素,是典型的累积性污染物,具有显著的生物毒性、持久性和富集效应,其浓度的高低直接影响着浮游生物的生长,进而影响到整个水域的生态环境及动植物健康[7-8]。人类活动产生的大量营养盐和重金属通过地表径流或地下水等途径输入到近岸系统如海湾和河口,重金属通过生物体富集和食物链的传递作用,可能对海洋生态环境和人类健康构成潜在威胁[9-10]。
由于水文条件、沉积物特性、生物扰动强度等因素的影响,沉积物−水界面之间的溶质在空间分布上存在着明显的差异。传统的主动采样技术容易改变样品的原有特性,从而造成较大的分析误差。薄膜扩散梯度(Diffusive Gradients in Thin-films,DGT)技术是一种原位被动采样技术,能够最大限度地减少传统采样技术存在的操作繁琐和分析误差较大等缺点,并且该项技术具有原位、高分辨等独特优势,特别是一些新型原位被动采样技术如ZrO-Chelex DGT和ZrO-AgI DGT技术等,使得该项技术更广泛应用于水体、沉积物和土壤中活性元素含量的测定[11-12]。近年来,该项技术主要是用于湖泊和河流等内陆淡水水体的研究[13-16],对于环境因素复杂多变的海湾和河口湿地等近海区域,通过利用DGT技术同步研究营养盐和金属元素赋存特征及其内在联系的报道相对较少[17-18]。
随着近几十年来城市化和工业化的快速发展,深圳近岸海域出现了不同程度的水体污染、富营养化和生态功能退化等一系列环境问题。人类活动产生的大量生活污水、工业废水及固体垃圾等陆源污染物排入深圳湾和茅洲河,导致这些地区出现了严重的水体富营养化和金属元素污染等水质恶化现象,这已成为制约当地社会经济发展的一个重要因素。目前,关于深圳湾和茅洲河的研究集中于水体及沉积物中金属元素和营养物质等方面[19-21],而对其滨海湿地沉积物−水界面之间的营养盐和金属元素的生物地球化学行为等研究鲜有报道。本文以深圳湾和茅洲河红树林湿地为研究对象,利用DGT技术研究沉积物孔隙水中营养盐和金属元素的空间分布、变化规律及其内在联系,评估其在沉积物−水界面的扩散通量并分析其可能的来源。
2 材料与方法
2.1 研究区概况
深圳属于亚热带海洋性气候,年平均气温为23℃,年降雨量为1 750 mm。深圳湾是一个半封闭型浅水海湾,水域面积约为90 km2;湾的东部(湾顶)较浅,西部(湾口)较深,水深一般小于5 m,平均为2.9 m[22-23]。深圳湾潮汐为不规则半日潮,湾口平均潮差为1.36 m,湾内潮流基本属于西南−东北向往复流;涨潮最大流速为0.97 m/s,落潮最大流速为0.80 m/s[24]。许多研究显示,深圳湾水质长期处于劣Ⅳ类海水水质标准[21,25-26]。深圳河是流入深圳湾最大的河流,河长为37.6 km,流域面积为 312.5 km2,其年径流量为5.3×108m3[27](图1)。深圳河大部分水体中氨氮和总氮浓度超出地表Ⅴ类水质标准,其中深圳市中心城区的生活污水和工业废水及河道底泥是水体污染的主要来源[28]。茅洲河是深圳最大的河流,也是珠三角污染最严重的河流之一,其发源于深圳市境内的羊台山北麓,全长为42.6 km,流域面积为388.2 km2[19-20]。
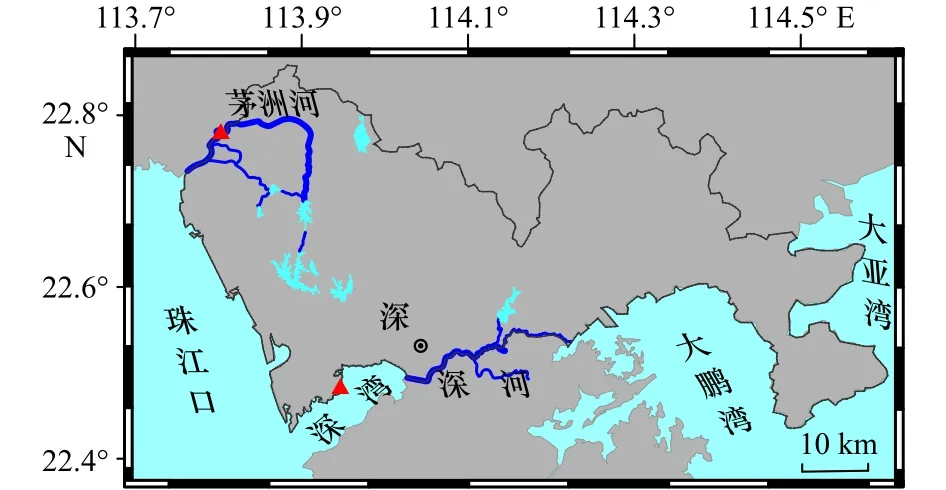
图1 研究区位置及采样点分布Fig.1 Location of the study area and sampling stations
2.2 样品采集
2021年9 月在深圳湾和茅洲河两处红树林湿地开展DGT采样装置野外投放工作,每个站点分别放置一个双面DGT装置(图2)。本文采用新研制的双面DGT装置,包含ZrO-AMP-TH DGT和ZrO-Chelex-AgI DGT装置,分别用于分析沉积物−水界面水体中营养物质和有效态硫(−2价)与金属元素空间分布特征、变化规律及耦合关系。整个采样期间处于大潮低潮期。
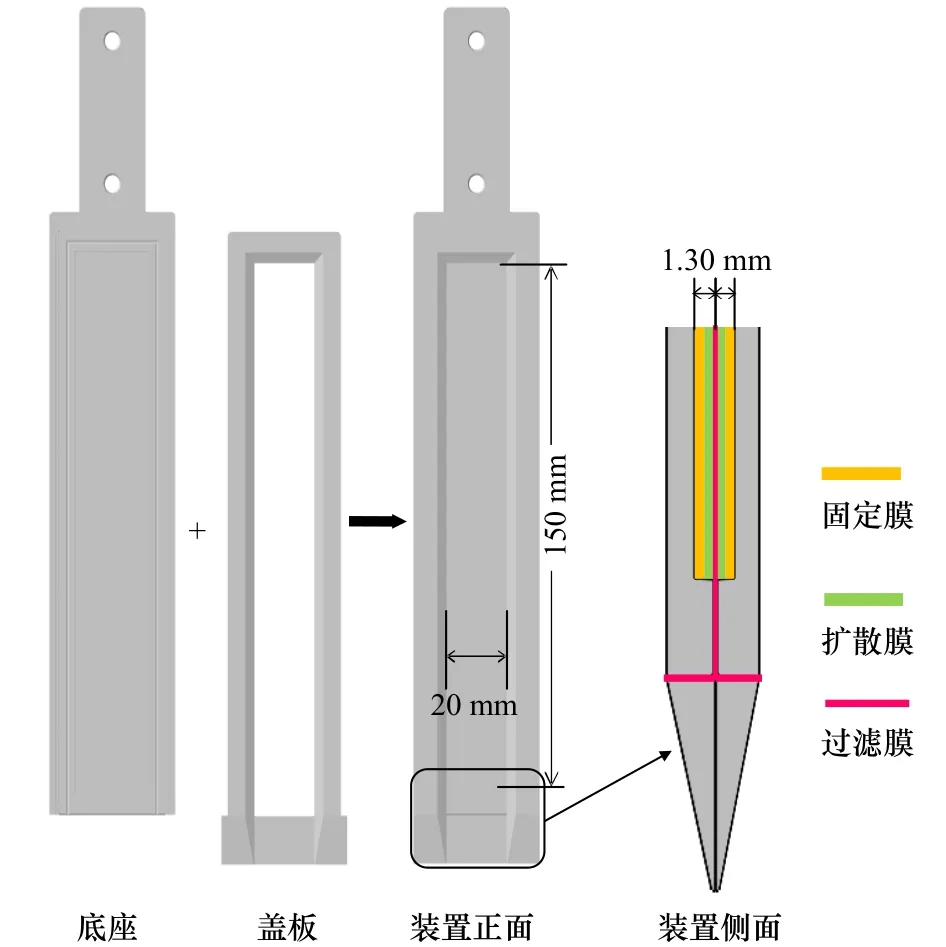
图2 薄膜扩散梯度(DGT)技术装置示意图Fig.2 The diagram of diffusive gradients in thin-films devices
DGT装置在投放前用湿滤纸盖住滤膜保湿,并放入充满氮气(去除氧气)的自封袋保存。选择具有代表性的野外研究站点,将装有不同扩散膜的DGT装置依次垂直且缓慢插入湿地的沉积物中,保持DGT装置中扩散膜上部2~4 cm浸润上覆水,并记录当时水温。放置24 h后取出DGT装置,标记沉积物−水界面位置,充分清洗装置表面泥土直至完全去除,将洗净后的DGT装置放入自封袋中,并加入少量的去离子水保湿,尽快运回实验室待测[12]。
2.3 DGT样品测量
在实验室内从已采集样品的DGT装置中取出扩散膜,并用去离子水冲洗膜表面,然后用陶瓷切刀以2 mm间隔切片。对于氨氮、硝态氮和磷及重金属或过渡金属(Cd、Co、Cu、Fe、Mo、Ni、Pb和 Zn)浓度的测定,分别将其加入10 mL 1.0 mol/L NaCl、0.4 mL 1.0 mol/L NaOH和1.8 mL 1.0 mol/L HNO3提取液,室温下静置24 h后,利用微孔板分光光度法(BioTek, 美国)测定氨氮、硝态氮与磷浓度,利用电感耦合等离子体质谱法(ICP-MS)(Agilent 7700 Series, 美国)测定金属元素浓度[29-30]。对于二维有效态硫的分析采用光学密度计量技术,将扩散膜置于扫描仪上,设置分辨率为 600 dpi(相当于 0.042 3 mm×0.042 3 mm),扫描扩散膜的正面,再利用ImageJ软件将扫描获得的图像转成灰度,最后根据校正曲线转换为有效态硫积累量。
在样品测试时,空白样、平行样和标准物质均被用来进行质量控制和质量保证。每10~20个样品设置一个空白样,每一批样品都做了平行样,所有样品均进行3个重复测试以保证测试结果的准确性,测试结果显示,仪器分析精度的相对标准偏差(RSD)小于10%。本文采用标准材料Agilent P/N 5183-4682和GBW(E)080435来确保分析的准确性和数据质量。金属元素的标准参考物质回收率在94.8%~99.8%之间,差异均在 6%以内。Cd、Co、Cu、Fe、Mo、Ni、Pb和 Zn 的检出限分别为 0.05 μg/L、0.03 μg/L、0.08 μg/L、0.82 μg/L、0.06 μg/L、0.06 μg/L、0.09 μg/L 和 0.67 μg/L。氨氮、硝态氮、磷和硫的检出限分别为1.11 μg/L、1.01 μg/L、0.93 μg/L 和 1.60 μg/L。
2.4 数据处理
2.4.1 二维有效态硫的灰度校正
测量有效态硫浓度时需进行灰度校正,即通过校正曲线将灰度转换成有效态硫积累量,公式为

式中,x是膜单位面积的累积量(μg/cm)。
2.4.2 孔隙水的各种参数浓度(CDGT)
DGT扩散膜中各种参数的积累量M可以根据提取液浓度计算[12]:

式中,M是2 mm扩散膜片段的积累量(mg);Ce是提取液浓度(mg/L);Vg和Ve分别是扩散膜和提取液体积(μL);fe是提取效率(表1)。

表1 各种参数在水体中的提取率和上覆水中的扩散系数Table 1 Extraction rate in water and diffusion coefficient in overlying water of various parameters
孔隙水的各种参数浓度(CDGT)可通过以下公式计算:

式 中 , Δg为 扩 散 层 厚 度 (0.13 mm);D是 溶 质 在DGT 扩散层的扩散系数(cm2/s);t是放置时间(24 h);A是 DGT 开口的膜面积(3.6 mm2)[31]。
2.4.3 扩散通量的估算
根据界面附近的浓度梯度、营养盐与金属元素在沉积物−上覆水界面的扩散系数和表层沉积物孔隙率,可运用Fick第一定律来估算扩散通量,公式为

式中,J为沉积物−上覆水界面溶质的扩散通量(μg/(m2·d)),其中Jw和Js分别表示上覆水和沉积物孔隙水中扩散通量; 为界面处溶质的浓度梯度(mg/(L·cm)),通过对表层沉积物孔隙水或者上覆水中溶质浓度与深度(20 mm)的拟合曲线估算获取;φ为表层沉积物孔隙率,深圳湾和茅洲河取值分别为0.58[32]和0.80[33];Dw和Ds分别为溶质在上覆水和沉积物孔隙水的实际分子扩散系数(10−6cm2/s),具体参见表1。其中Dw和Ds的关系可通过如下公式进行估算[34]:

3 结果与讨论
3.1 沉积物−水界面氮、磷和硫垂向赋存特征

图3 沉积物−水界面上DGT有效态氮、磷和硫浓度垂向分布Fig.3 Vertical distribution of DGT-labile N, DGT-labile P and DGT-labile S concentrations at sediment-water interface

表2 深圳湾和茅洲河在上覆水和孔隙水中DGT有效态氮、磷和硫浓度(单位:mg/L)Table 2 The concentrations of DGT-labile N, DGT-labile P and DGT-labile S in overlying water and pore water of Shenzhen Bay and Maozhou River (unit: mg/L)
相比于不同站点上覆水和孔隙水中营养盐浓度的显著差异,同一站点上覆水与孔隙水中、、P和S2−的浓度也差异明显。在深圳湾,孔隙水中、和S2−平均浓度与上覆水中浓度差异不明显,而孔隙水中P平均浓度为上覆水中浓度约3倍,这表明该站点上覆水中P可能更易于存储在沉积物孔隙水中;从上覆水到沉积物−水界面,和S2−的浓度逐渐增大;相反,在沉积物中,随着深度的增加,和S2−的浓度逐渐减小直至近似稳定状态。在茅洲河,孔隙水中、P和S2−的平均浓度均高于上覆水,这表明该地区上覆水中、P和S2−更易于储存在沉积物孔隙水中。从上覆水到沉积物−水界面,和的浓度逐渐增大;相反,在沉积物中,随着深度的增加,二者浓度逐渐减小直至近似稳定状态;然而,从上覆水到沉积物中,随着深度的增加,P和S2−的浓度显著增大。对于茅洲河中P和S2−分布的明显特征可能是历史沉积的结果,也可能与该地区的岩性以及生物扰动相关,该地区沉积物对于营养盐主要是起到汇的作用。
3.2 沉积物−水界面金属元素赋存特征
图4显示,深圳湾和茅洲河在沉积物−水界面上重金属或过渡金属 Cd、Co、Cu、Fe、Mo、Ni、Pb和 Zn浓度垂向分布情况,具体值见表3。茅洲河和深圳湾上覆水中Cd相差并不大,茅洲河上覆水中Co、Cu、Fe和Ni平均浓度要高于深圳湾中相应的值,最高能达6.36倍,而深圳湾上覆水中Mo、Pb和Zn平均浓度高于茅洲河中相应的值。在沉积物孔隙水中,除了孔隙水中 Mo,茅洲河孔隙水中 Cd、Co、Cu、Fe、Ni、Pb和Zn平均浓度均高于深圳湾中对应的值,最高能达52.36倍。总体而言,除Mo外,其他重金属浓度都呈现出在深圳湾变化范围较小,而在茅洲河变化范围较大的赋存特征。相比于孔隙水中金属元素浓度差异,上覆水中金属元素浓度差别并不明显。

图4 沉积物−水界面上DGT有效态金属元素浓度垂向分布Fig.4 Vertical distribution of DGT-labile metal elements concentration across the sediment-water interface
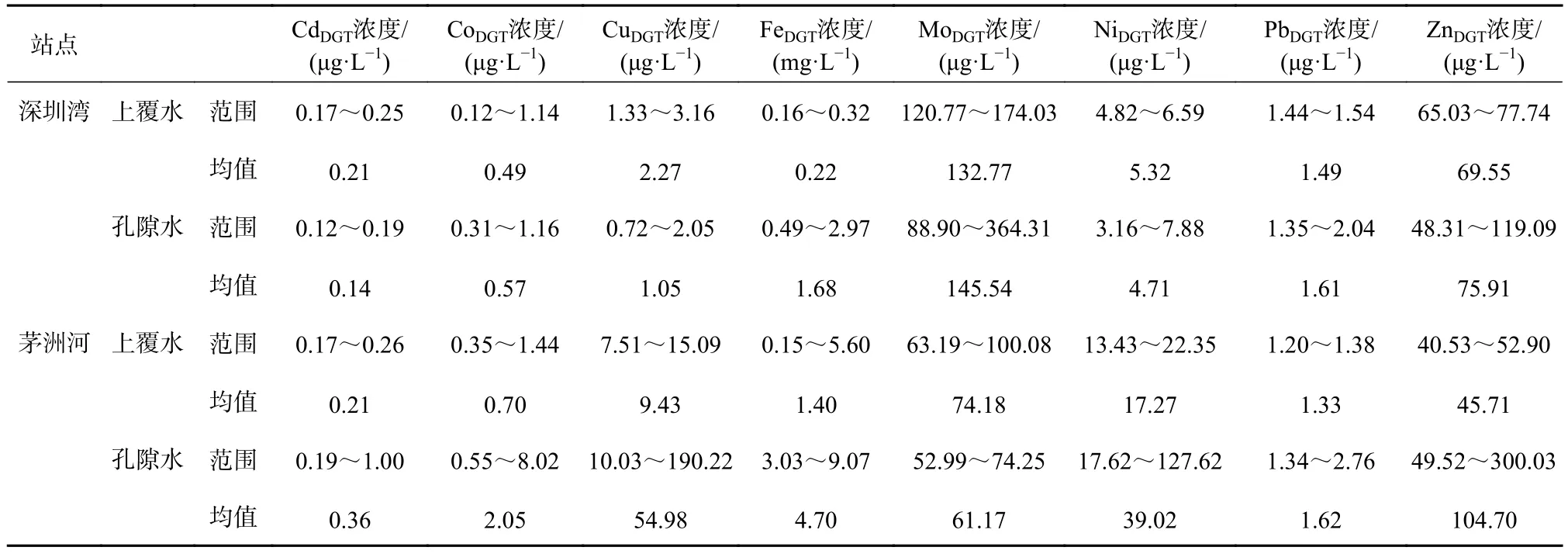
表3 深圳湾和茅洲河在上覆水和孔隙水中DGT有效态金属元素浓度Ta ble 3 The concentrations of DGT-labile metal elements in overlying water and pore water of Shenzhen Bay and Maozhou River
相比于不同站点上覆水和孔隙水中金属元素浓度的明显差异,同一站点上覆水与孔隙水中金属元素浓度也存在不同,主要体现在孔隙水中部分金属元素浓度远高于上覆水中相应浓度。在深圳湾,除了Cu和Fe,沉积物孔隙水中金属元素平均浓度与上覆水中相应浓度总体差别不明显。从上覆水到沉积物−水界面,Co和Pb浓度明显逐渐增大;而Mo、Ni和Zn浓度明显逐渐减小。在沉积物孔隙水中,随着深度的增加,Mo、Ni和Zn浓度逐渐增加,这表明上覆水中Fe、Mo、Ni和Zn更易于储存在沉积物孔隙水中。在茅洲河,沉积物孔隙水中 Cd、Co、Cu、Fe、Ni、Pb和Zn平均浓度高于上覆水,而上覆水中Mo平均浓度高于孔隙水。从上覆水到沉积物−水界面,Co、Fe和Ni浓度明显逐渐增大,而Cd和Pb浓度明显逐渐减小;在沉积物中,随着深度的增加,Cd、Co、Cu、Ni、Pb和Zn浓度逐渐增加,而Mo浓度随着深度增加达到近似稳定状态。除Mo外,其他重金属均易于储存在沉积物孔隙水中。
3.3 营养盐和金属元素时空分布影响因素
已有研究表明,Fe-P-S三者的耦合对于孔隙水中各参数的浓度变化十分重要[17]。图5显示了深圳湾和茅洲河DGT有效态铁、硫、磷和钼浓度的线性相关性。图5a和图5b显示,深圳湾和茅洲河水体中有效态铁和磷的浓度呈显著正相关性,这表明磷的钝化和再活化过程受控于铁氧化还原循环,即在沉积物−水界面上部的氧化条件下,磷易被活性铁氧化物吸附钝化,导致有效态铁和磷浓度均较低;而在沉积物−水界面下部的还原条件下,随着铁氧化物还原的发生,生成的Fe2+丧失了对磷的吸附能力,导致磷被解吸再活化,从而使得有效态铁和磷浓度均升高(图3,图4)。图5c表明,深圳湾水体中有效态铁和硫浓度呈显著正相关性。图5e和图5f显示,深圳湾和茅洲河水体中有效态磷和硫浓度呈显著正相关性,这表明磷的钝化和再活化过程也受控于硫的氧化还原过程。这一耦合过程已被许多研究证实[11,17]。深圳湾和茅洲河孔隙水中盐度分别为28.72和0.59,这表明盐度对于Fe-P-S三者的耦合过程影响并不明显。
图4和表3均显示,过渡金属Mo与其他重金属在深圳湾和茅洲河的分布规律存在明显差异,体现在深圳湾水体中Mo浓度远高于茅洲河。图5g和图5h显示,深圳湾和茅洲河水体中有效态钼和硫浓度呈负相关性,特别是茅洲河。由于Mo的可利用性易被硫化物溶液所限制,导致Mo和有效态硫浓度的垂直分布呈现相反特征[18],这解释了深圳湾水体中有效态硫浓度远低于茅洲河的现象。研究显示潮间带富氧沉积物可作为Mo的汇,而潮下带缺氧沉积物可作为Mo的源[18],这表明不同海岸带取样位置对于Mo浓度也存在着很重要的影响。
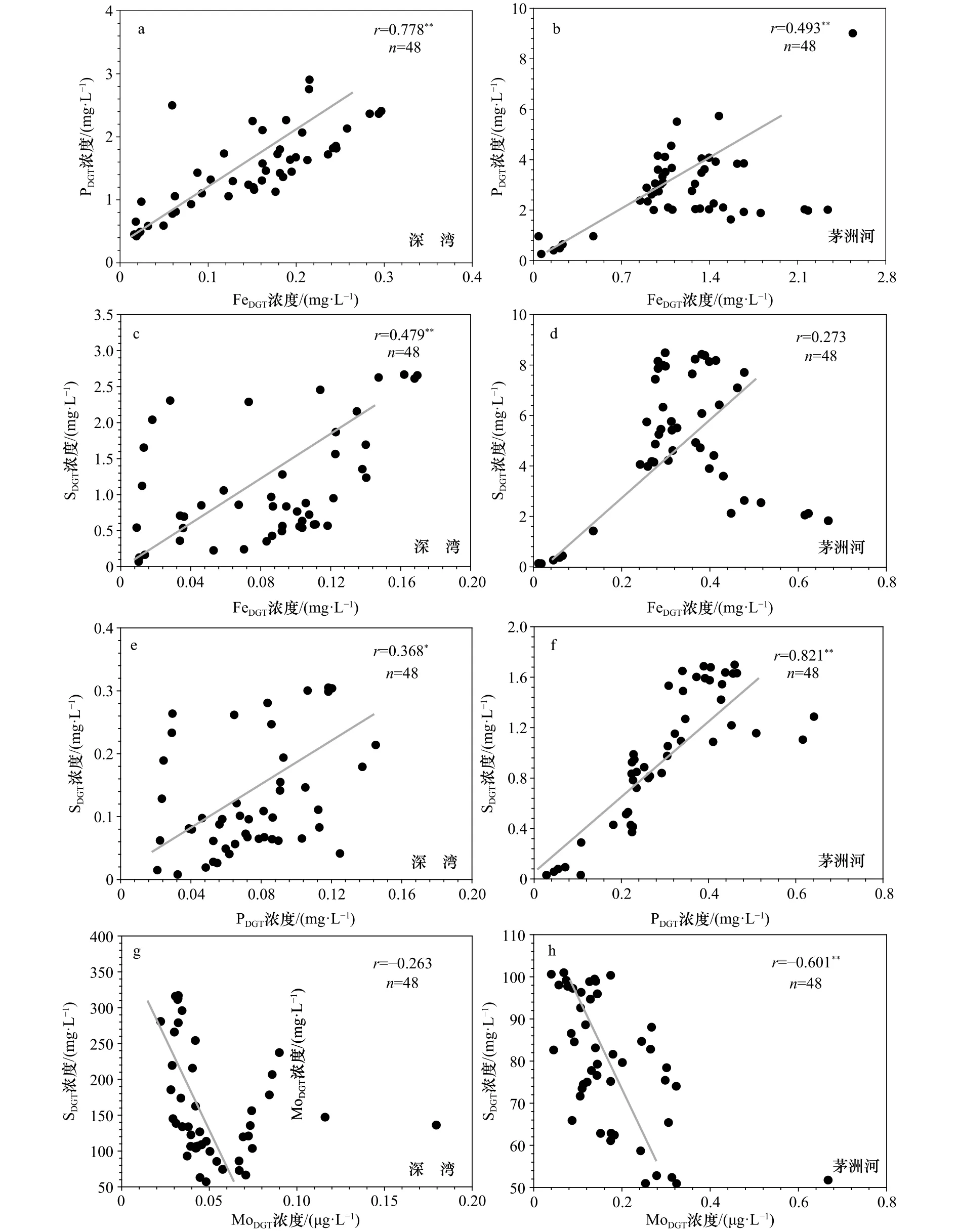
图5 深圳湾和茅洲河DGT有效态铁、硫、磷和钼的线性相关性Fig.5 Linear correlations among DGT-labile Fe, DGT-labile S, DGT-labile P and DGT-labile Mo in Shenzhen Bay and Maozhou River
3.4 DGT有效态硫的空间分布特征
图6显示了二维DGT 有效态硫的空间分布情况,从图中得出两个站点有效态硫空间分布差别明显。整体而言,茅洲河有效态硫浓度远高于深圳湾,特别是沉积物孔隙水中有效态硫浓度。从垂向上看,在深圳湾,−2~0 cm和−11 cm深度附近出现了局部浓度略高现象,最高达到0.29 mg/L。在茅洲河,上覆水有效态硫浓度和深圳湾差别不大,但沉积物孔隙水中有效态硫的浓度随着深度增加而显著增加,大概在−9.6 cm处附近达到最大浓度值为1.07 mg/L,而在−6~−3 cm和−2~0 cm 处出现了局部低浓度区域现象,这是由于生物扰动使得该区域和上覆水相连通,进而造成该区域的有效态硫浓度与其上覆水浓度相当。

图6 深圳湾和茅洲河DGT有效态硫的二维空间分布Fig.6 2D distributions of the DGT-labile S in Shenzhen Bay and Maozhou River
图6显示,有效态硫浓度在沉积物−水界面发生了明显的迁移扩散等作用。从深圳湾来看,虽然整个区域有效态硫浓度较低,但是沉积物−水界面附近存在着较高浓度区域;从茅洲河来看,沉积物孔隙水中有效态硫浓度远高于上覆水中浓度,沉积物−水界面附近有效态硫浓度变化比较强烈,这表明有效态硫更易于富集在该地区沉积物中,而沉积物孔隙水中低浓度区域说明了生物扰动对于沉积物有效态硫的富集可能起到了积极的促进作用。
3.5 沉积物−水界面金属元素和营养盐的扩散通量
图7所示为深圳湾和茅洲河水体中营养盐和金属元素(以阳离子形式存在的金属)在沉积物−水界面上的扩散通量。本文以沉积物−水界面上下2 cm处的各种参数浓度来拟合其浓度梯度,结果为正值表示沉积物内源溶质向上覆水释放。对于营养盐而言,图7a显示深圳湾水体中各种参数的扩散通量为正值而茅洲河为负值,深圳湾、、P和S2−的扩散通量为3.8×10−6~2 272×10−6μg/(cm2·d),茅洲河的扩散通量为−1.6×10−3~−1.0×10−3μg/(cm2·d),这表明深圳湾不同种营养盐在沉积物−水界面上从沉积物向上覆水释放的差别明显,而茅洲河不同种营养物质更易于通过沉积物−水界面储存在沉积物孔隙水中,从而使该地区沉积物孔隙水中营养物质超标。
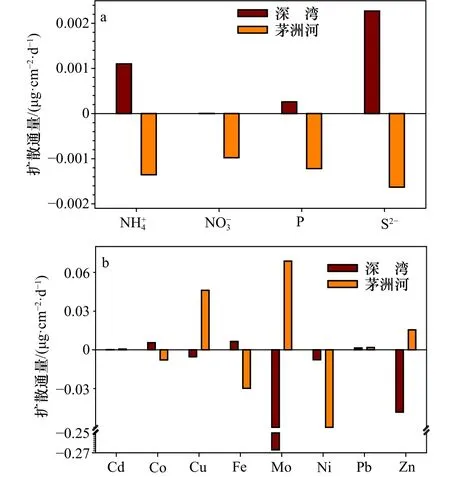
图7 深圳湾和茅洲河营养盐(a)和金属元素(b)在沉积物−水界面扩散通量Fig.7 Diffusion fluxes of nutrients (a) and metal elements (b)at sediment-water interface in Shenzhen Bay and Maozhou River
图7b显示了8种金属元素在深圳湾和茅洲河沉积物−水界面上的扩散通量,各种金属元素的扩散通量差别明显。深圳湾水体中各种金属元素的扩散通量为−267×10−3~6.5×10−3μg/(cm2·d),茅洲河的扩散通量 为 −6.1×10−2~ 6.9×10−2μg/(cm2·d)。 对 于 Mo 和 Cd,其在深圳湾与茅洲河沉积物−水界面上扩散通量的绝对值分别为最大和最小,这与它们的浓度大小相一致。这说明各种参数的扩散通量与该参数的浓度值相关。相比于氮和硫,更多研究集中于评估沉积物−水界面处磷和金属元素的扩散通量,表4显示不同地点在沉积物−水界面处磷和8种金属元素的扩散通量,本研究估计值基本处于已有研究结果的范围之内,其中的差异可能是由于不同采样时间和不同研究区域的结果。
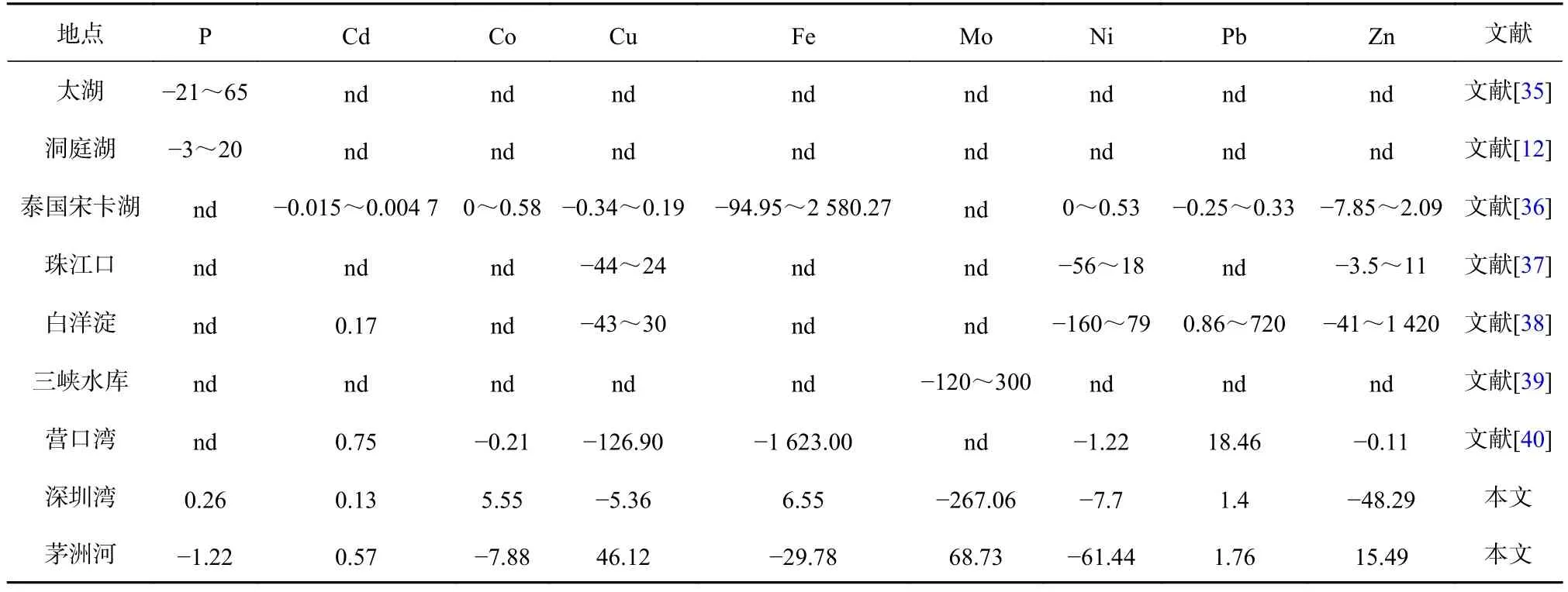
表4 不同地点沉积物−水界面处磷和金属元素的扩散通量(单位:10−3 μg/(cm2·d))Table 4 Diffusion fluxes of phosphorus and metal elements at sediment-water interface in different sites (unit: 10−3 μg/(cm2·d))
3.6 营养盐和金属元素来源分析
水体中营养盐和金属元素的污染程度与其来源关系密切[31,41]。本文利用主成分分析法(PCA)分析深圳湾和茅洲河各种参数的来源相关性,得出深圳湾和茅洲河各种参数的KMO(Kaiser-Meyer-Olkin)检验统计量分别为0.549和0.822,这表明茅洲河水体中各种参数的相关性更强。图8所示为深圳湾和茅洲河水体中12种参数的PCA空间分布情况,其中深圳湾水体中12种参数4个主要成分PC1、PC2、PC3和PC4分 别 与+S2−+Co、+P+S2−+Fe+Pb、Mo+Ni+Zn 和Cd+Cu相关。茅洲河水体中12种参数3个主要成分PC1、PC2和 PC3分 别 与+Fe、P+S2−+Cd+Co+Cu+Ni+Pb+Zn和+Mo相关。图3和图4显示,茅洲河水体中 P、S2−、Cd、Co、Cu、Ni、Pb和 Zn浓度均存在从上覆水到沉积物孔隙水逐渐增加的趋势,其与图8b结果相一致,说明茅洲河水体中8种参数可能存在相似的主要来源。图8显示,深圳湾水体中营养盐和金属元素等污染物来源多于茅洲河;深圳湾水体中营养盐和金属元素等污染物来源可能包括了珠江和深圳河等地表径流以及地下水等方式输入;茅洲河水体中污染物来源相对单一,主要为茅洲河上游输入。

图8 深圳湾(a)和茅洲河(b)沉积物−水界面上各种参数 PCA 图Fig.8 PCA of chemical parameters across the sediment-water interface in Shenzhen Bay (a) and Maozhou River (b)
虽然茅洲河水体中营养盐和金属元素等污染物来源比深圳湾少,但是研究显示,茅洲河沉积物孔隙水的污染程度高于深圳湾水体。一方面,两个站点所处的位置不同,虽然深圳对于深圳湾和茅洲河污染治理的力度都很大,但是深圳湾连接着珠江和深圳河,这对于深圳湾污染水体能起到一定的稀释作用,而茅洲河主要是河流对其的影响,加上该地区处于人类活动的聚集区,更易于产生更多污染物并排入其中,从而加重该地区水体的污染程度。
另一方面,两地区的沉积物岩性等不同,深圳湾的沿海周边主要由填海造陆形成,与茅洲河的岩性可能存在着不同。已有研究表明,生物扰动影响着沉积物中重金属的迁移转化作用[42]。从图6得出茅洲河沉积物中存在着生物扰动的影响,而生物扰动可能使该地区沉积物更能够富集营养盐和重金属。
4 结论
本研究利用DGT技术获取茅洲河和深圳湾湿地浅层沉积物孔隙水中营养盐(、、P和S2−)和重金属或过渡金属(Cd、Co、Cu、Fe、Mo、Ni、Pb和 Zn)浓度的垂向赋存特征,对比了两地区水体的污染程度,并分析了各种参数在沉积物−水界面上扩散通量、影响因素及其来源,主要结论如下:
(2)深圳湾和茅洲河沉积物−水界面水体中磷的钝化和再活化过程受控于铁和硫的氧化还原循环,盐度对于Fe-P-S三者的耦合过程影响并不明显。过渡金属Mo的可利用性易于被硫化物溶液所限制,导致Mo和有效态硫浓度成负相关性。
(3)深圳湾在12种参数的扩散通量范围为−267×10−3~6.5×10−3μg/(cm2·d),而在茅洲河的扩散通量范围为−6.1×10−2~6.9×10−2μg/(cm2·d)。茅洲河沉积物孔隙水中有效态硫浓度远高于其在上覆水中和深圳湾水体中浓度。茅洲河沉积物更能够富集营养盐和重金属,生物扰动对其起到了一定的促进作用。
(4)茅洲河沉积物孔隙水的污染程度高于深圳湾水体,但深圳湾水体中营养盐和金属元素等污染物来源多于茅洲河。深圳湾水体中12种参数的4个主要成分PC1、PC2、PC3和PC4分别与+S2−+Co、+P+S2−+Fe+Pb、Mo+Ni+Zn 和 Cd+Cu 相关。 茅 洲 河 水体中12种参数的3个主要成分PC1、PC2和PC3分别 与+Fe、P+S2−+Cd+Co+Cu+Ni+Pb+Zn和+Mo相关。

