西梅发酵乳酸菌的筛选、鉴定及其抗氧化特性研究
戴志伟,孔令明,刘 伟,张 玥,杨 罡,伊力夏提·艾热提
(新疆农业大学食品科学与药学学院 乌鲁木齐 830000)
西梅(Prunus domestica),是蔷薇科(Rosaceae)李属(Prunus)果树果实[1]。西梅以独特的外形和口感、不含胆固醇和脂肪的特性[2],富含抗氧化物质[3]和骨骼健康的相关物质[4]而获得“奇迹水果”的美称。其中,新疆有野生种西梅的分布[5],是西梅的发源地之一。
蔬菜和水果的内部或表皮上的微生物、当地环境,共同形成一个互生或共生的系统,该系统相对稳定,而不同地域环境的微生物种群也不同[6],其中的乳酸菌是这个系统中微生物区系的一小部分[6-7],甚至是系统的优势菌。一般来说,从果蔬中分离出的本地乳酸菌,在适应当地环境的同时也适应植物的基质,相比于商业乳酸菌更适应以果蔬为发酵基质的不利条件,从而保留果蔬的感官品质及其活性成分。
Raffaella 等[6]在Nancy 等[8]的基础上对自源乳酸菌发酵果蔬进行研究,直投式发酵剂在一定程度上不能完全适应某种果蔬底物,大多需要训化,为得到较理想的发酵终产物,所选菌种必须适应原料的内在特性[9]。研究发现:本地自源乳酸菌在发酵当地萝卜、菜豆等蔬菜时,在色泽、保存期等方面均有一定优势,同时利用本地自源乳酸菌发酵红辣椒和黄辣椒结合一些其它处理,可以最大程度地保护色泽,延长货架期[10]。在利用乳酸菌发酵樱桃泥的过程中,本地乳酸菌对黏度、抗氧化等也有一定的正向影响[11]。在最小加工的前提下,本地乳酸菌可以最大程度地保证菠萝的抗氧化活性和硬度,同时最大程度地保存菠萝的天然颜色和气味[12]。虽然本地乳酸菌在一定程度上优于商业发酵菌种,但并不是所用本地菌种都有预期的发酵效果。
本文以新疆喀什县的“女神”西梅为原料,采用溴甲酚紫MRS 培养基和改良的西梅汁MRS 培养基,从“女神”西梅原浆样品中筛选、鉴定产酸性好,适合西梅发酵的乳酸菌株,从产酸性能及抗氧化性能方面评估5 株乳酸菌,通过pH 值、总酸、总酚含量等指标对比它们发酵西梅浆的性能,为筛选优良的果蔬发酵专用菌种,丰富菌种库,为开发新型西梅深加工产品提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 新疆“女神”西梅,新疆喀什地区伽师县。
1.1.2 培养基 MRS 培养基、MRS 肉汤培养基,北京奥博星生物技术有限公司;溴甲酚紫MRS 培养基[13]:在MRS 培养基的基础上添加溴甲酚紫0.4 g/L;西梅汁培养基[14]:无菌水900 mL、西梅汁100 mL、葡萄糖22 g/L、乙酸钠5 g/L、牛肉膏10 g/L、酵母膏5 g/L、琼脂15 g/L。
1.1.3 试剂 HBI 乳酸菌生化鉴定条(GB),海博生物技术有限公司;福林酚试剂,北京索莱宝科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸),上海源叶生物科技有限公司;其它试剂,天津市北联精细化学品开发有限公司。
1.2 主要仪器与设备
UV-1200 紫外分光光度计,北京普析通用有限责任公司;AIPHAPPHOT-2 YS2 光学显微镜,日本Nikon 公司;DHP-9162 微生物恒温培养箱,上海一恒科技有限公司。
1.3 方法
1.3.1 乳酸菌富集和分离筛选 取适量新疆 “女神”西梅原浆接入液体培养基中,37 ℃恒温厌氧培养对菌种进行富集。
蘸取富集液在溴甲酚紫MRS 固体培养基上划线,于37 ℃恒温厌氧培养36 h,挑取周围黄色面积较大的菌落进行纯化。通过革兰氏染色及酶触试验初筛符合条件的乳酸菌株。将初筛菌株接入西梅汁培养基中,选择生长较好的乳酸菌接入MRS 斜面培养基中,4 ℃低温保藏。
1.3.2 乳酸菌的鉴定
1.3.2.1 生理、生化鉴定 根据文献[15]和[16]对分离的菌株进行碳源消耗试验及明胶液化、产硫化氢试验、吲哚试验等,对筛选出的菌株进行生理、生化综合评定。
1.3.2.2 16S rDNA 分子鉴定 将最终筛选的目标菌株送至上海生工生物工程有限公司测定16S rDNA 序列。
1.3.3 5株自源乳酸菌生长曲线及产酸性能测定
1.3.3.1 乳酸菌生长曲线 以体积分数2%的接种量将活化的菌种接入250 mL MRS 肉汤中,37℃恒温培养,每隔2 h 测定其OD600nm,用同样处理的空白MRS 肉汤调零,绘制5 株菌种的生长曲线。
1.3.3.2 乳酸菌pH 值的测定 用PHS-3C 型pH计测定。
1.3.3.3 乳酸菌总酸含量的测定 参考GB/T 12456-2008[17]测定。
1.3.4 5株自源乳酸菌抗氧化性的测定
1.3.4.1 细胞提取 完整乳酸菌细胞悬液(Intact cell,IC)[18-19]的制备:将5 株活化两代后的菌种接入MRS 肉汤中恒温培养36 h,4 ℃,6 000 r/min 低温离心10 min,取菌体沉淀,用磷酸盐缓冲液(pH 7~7.3)清洗2~3 遍后,配成菌悬液(1.0×108CFU/mL)。
无细胞提取液(Cell-free Extract,CFE)[18-19]的制备:取配制的5 株完整细胞菌悬液,超声冰浴破碎至在显微镜下无完整细胞,10 000 r/min 低温离心20 min,取上清液。
1.3.4.2 菌株DPPH 自由基清除能力的测定 参考文献[20],根据本试验样品特性略作修改。取5株乳酸菌的完整细胞悬液和无细胞提取液各2 mL,加入新配制的0.2 mmol/L DPPH 溶液2 mL(将吸光度调节至1.2~1.3),避光反应30 min,在波长517 nm 处测定吸光值。根据公式 (1) 计算DPPH 自由基清除率。

式中,A1——样品组,完整细胞液/无细胞提取物与DPPH 溶液混合时的吸光度;A2——空白组,完整细胞液/无细胞提取物与2 mL 无水乙醇溶液的吸光度;A3——对照组,为2 mL DPPH 溶液与2 mL 无水乙醇的吸光度。
1.3.4.3 菌株ABTS 自由基清除率的测定 参考文献[21],根据本试验样品特性略作修改。取完整细胞液/无细胞提取物0.2 mL 与ABTS 工作液4 mL 充分混合,在室温避光条件下静置30 min,在波长734 nm 处测定吸光值。根据公式(2)计算ABTS 自由基清除率。

式中,A1——空白组,磷酸盐缓冲液与ABTS工作液混合的吸光度;A2——样品组,完整细胞液/无细胞提取物与ABTS 工作液混合的吸光度。
1.3.4.4 菌株还原力的测定 根据文献[22]并如下修改:在5 个完整细胞液/无细胞提取物样品中分别加入2.5 mL 质量分数为1%的K3[Fe(CN)6],2.5 mL 0.2 mol/L 磷酸盐缓冲液(pH 6.6),振荡均匀后50 ℃水浴20 min,4 ℃冰水冷却5 min,冷却后分别加入2.5 mL 10%TCA 溶液,3 500 r/min 离心10 min,取上清液2.5 mL,逐次加入蒸馏水2.5 mL,0.1%FeCl3溶液0.5 mL,室温静置10 min 后测定吸光值(OD700nm)。吸光值代表还原能力,吸光值越高还原力越强。
1.3.5 筛选乳酸菌发酵西梅浆过程中浆液抗氧化性的测定
1.3.5.1 西梅浆的制备及发酵 挑选新鲜西梅漂洗、沥干,去核。按西梅与水质量比1∶1 打浆。为给菌种提供适宜的发酵环境,用NaHCO3将西梅浆pH 值调至4.50~5.00 范围,用蔗糖将西梅浆的糖度调节至12°Brix。为使杀菌彻底,将西梅浆煮沸3~5 min 灭菌、灭酶,冷却后分别以5%的接种量(体积分数)接种乳酸菌,以未接种的西梅浆为空白对照。在37 ℃恒温培养箱静置发酵96 h,每24 h 取样1 次并测定。
1.3.5.2 发酵西梅浆总酚含量的测定 采用福林-酚比色法[23]测定,以没食子酸为标准品制作标准曲线 (y=0.6289x+0.0192,R2=0.9979)。每1 mL 西梅浆发酵液中总多酚含量以没食子酸记,单位为mg/L。
1.3.5.3 发酵西梅浆DPPH 自由基清除能力的测定 将1.3.4.1 节样品换为离心后的西梅浆上清液。
1.3.5.4 发酵西梅浆ABTS 自由基清除率的测定将1.3.4.2 节样品换为离心后的西梅浆上清液,空白组用蒸馏水和样品混合。
2 结果与分析
2.1 乳酸菌初筛结果与分离纯化
通过溴甲酚紫MRS 固体培养基对富集液中的乳酸菌进行初筛。挑取黄色圈较大的菌株多次划线纯化,经革兰氏染色和过氧化氢酶试验,8 株菌为革兰氏阳性,过氧化氢酶阴性,初步确定为乳酸菌。将这8 株乳酸菌接入西梅汁固体培养基,37 ℃恒温培育24 h,其中3 株菌未生长,5 株菌(E2、C2、D2、M2、P1)生长良好。
2.2 乳酸菌生理、生化鉴定结果
5 株乳酸菌的部分生理、生化试验及糖类发酵试验结果见表1、表2。由表1可知,5 株菌的过氧化氢酶试验、明胶液化试验、产硫化氢试验、吲哚试验、乙酰甲基甲醇试验均为阴性。糖类发酵试验表明,5 株菌均能利用七叶苷、纤维二糖、麦芽糖、水杨苷、蔗糖、棉子糖、菊糖、乳糖等碳水化合物。除E2 外,均能利用甘露醇。

表1 5 株自源乳酸菌的生理、生化鉴定结果Table 1 Physiological and biochemical identification results of 5 self-sourced lactic acid bacteria
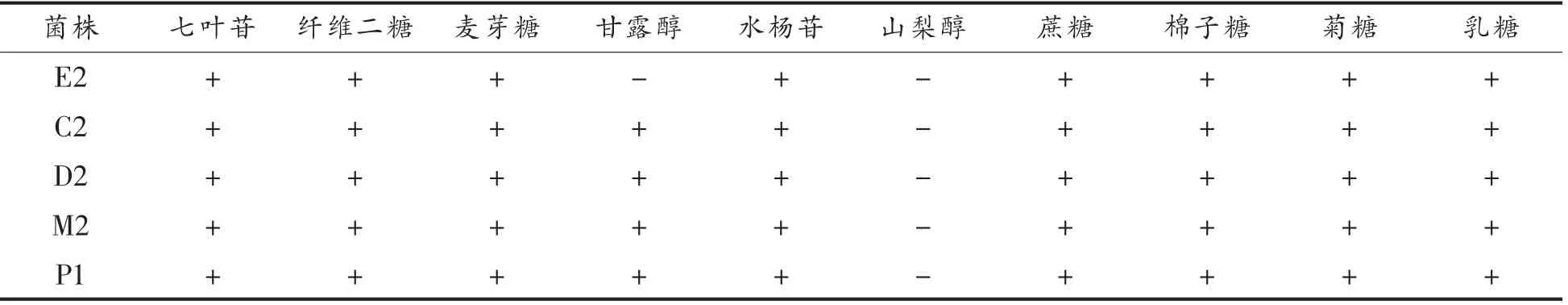
表2 5 株自源乳酸菌的碳源发酵试验结果Table 2 Carbon source fermentation test results of 5 self-sourced lactic acid bacteria
2.3 菌株的16S rDNA 鉴定结果
将5 株菌进行16S rDNA 测序,将测序结果与NCBI 数据库进行BLAST 同源性比对,将菌株序列同源性高于99%的几株菌株进行BLAST 分析,构建系统发育树,见图1。通过分析结果,可确定E2 为肠膜明串珠菌 (Leuconostoc mesenteroides),C2、D2、M2、P1 为屎肠球菌(Enterococcus Faecium)。
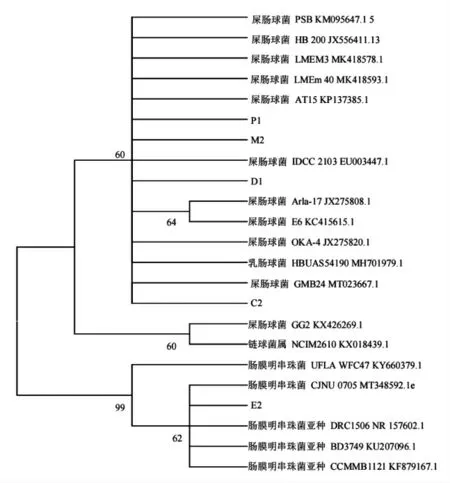
图1 基于16S rDNA 序列5 株乳酸菌的系统发育树Fig.1 Phylogenetic tree of 5 kinds of lactic acid bacteria based on 16S rDNA sequence
2.4 5 株自源乳酸菌的生长曲线及产酸性能
2.4.1 在MRS 肉汤中的生长曲线 5 株自源乳酸菌在MRS 肉汤中的生长曲线如图2所示。屎肠球菌C2、D2、M2、P1 生长趋势大体相似,无明显滞后期,对数生长期内菌体数量增长平稳,25~38 h 逐渐进入稳定期,其中,屎肠球菌P1 在稳定期菌体含量高于其它3 株屎肠球菌。肠膜明串珠菌E2 有2~3 h 的滞后期以适应生长环境,5 h 后迅速进入对数生长期,增长速率显著高于其它4 株屎肠球菌,15 h 时进入稳定期,发酵30 h 仍保持较高的菌体含量且高于其它4 株屎肠球菌。

图2 5 种乳酸菌在MRS 肉汤中的生长曲线Fig.2 Growth curve of 5 kinds of lactic acid bacteria in MRS broth
2.4.2 在MRS 肉汤中的产酸性能 发酵液中的pH 值和总酸含量可以很好地反映菌株的产酸性能,其中pH 值下降速率反映菌株对发酵基质的利用情况[13],发酵终点pH 间接反映菌株的耐酸性。如图3和图4所示,发酵液和产酸量的变化趋势相似,5 株菌的发酵液在0~20 h 内处于对数生长期,pH 值逐渐下降,总酸含量逐渐上升。20 h 后处于稳定期,pH 值趋于平缓,总酸含量上升幅度减缓。相比4 株屎肠球菌,肠膜明串珠菌E2 在MRS肉汤中有更好的产酸性能,40 h 左右将发酵液的pH 值降至4.29,总酸含量升至13.15 g/L,说明利用肠膜明串珠菌E2 接种发酵,可使体系快速酸化,将体系pH 值降至较低水平。
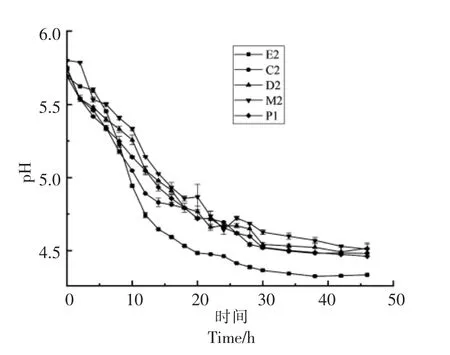
图3 5 种乳酸菌在MRS 肉汤中pH 值的变化Fig.3 The changes of pH value of 5 kinds of lactic acid bacteria in MRS broth
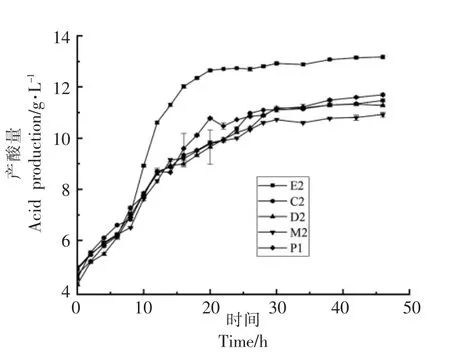
图4 5 种乳酸菌在MRS 肉汤中产酸量的变化Fig.4 Changes in acid production of 5 kinds of lactic acid bacteria in MRS broth
2.5 乳酸菌的抗氧化能力
如图5所示,5 株乳酸菌的IC 组与CFE 组均具有一定的DPPH 自由基清除能力。4 株屎肠球菌的IC 组的DPPH 自由基清除率低于已报道的部分屎肠球菌菌株[19,24]。肠膜明串珠菌E2 的IC 组和CFE 组的DPPH 自由基清除率均远高于屎肠球菌(P<0.05),说明肠膜明串珠菌E2 有较好的DPPH 自由基清除率能力。5 株乳酸菌的IC 组的DPPH 清除率均高于CFE 组,说明清除DPPH 自由基的活性物质主要存在于它们活细胞的表面,与张香美等[19]、夏海燕等[25]的研究结果一致。

图5 5 株自源乳酸菌菌悬液及无细胞提取物对DPPH 自由基的清除率Fig.5 The scavenging rate of DPPH free radicals by 5 strains of self-sourced lactic acid bacteria intact cell and cell-free extracts
如图6所示,肠膜明串珠菌E2 和屎肠球菌C2、M2、P1 的IC 组ABTS 自由基清除率高于CFE组,说明这4 株乳酸菌清除ABTS 自由基的活性物主要存在于菌体表面和代谢物中,其中E2、C2和M2 的IC 组有相对较好的ABTS 自由基清除能力。屎肠球菌D2 的CFE 组的ABTS 清除率高于IC 组,与其它3 株屎肠球菌相反,说明菌株清除ABTS 自由基的活性物质的部位在同属菌种中也有一定差异[26]。
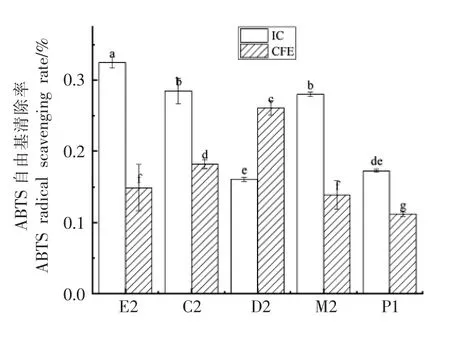
图6 5 株自源乳酸菌菌悬液及无细胞提取物对ABTS 自由基的清除率Fig.6 The scavenging rate of ABTS free radicals by 5 strains of self-sourced lactic acid bacteria intact cell and cell-free extracts
乳酸菌的还原性能力也是衡量其抗氧化活性的指标之一[27]。由图7可知,5 株乳酸菌的IC 组和CFE 组均表现出一定的还原能力,5 株菌IC 组的还原能力差异性较小,肠膜明串珠菌E2 的IC 组还原能力较强,5 株菌IC 组的还原能力均显著高于CFE 组,说明5 株乳酸菌具有还原能力的活性物质均分布在细胞表面或代谢物中,胞内分布较少。
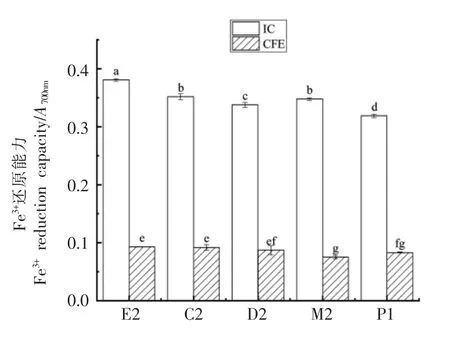
图7 5 株自源乳酸菌菌悬液及无细胞提取物的还原能力Fig.7 Reducing ability of 5 self-sourced lactic acid bacteria intact cell and cell-free extracts
2.6 乳酸菌发酵西梅浆的抗氧化活性
相关研究[28-29]表明,植物组织中的酚类物质通过氢原子转移或单原子传递螯合金属离子清除自由基达到抗氧化效果。西梅汁中酚类物质含量丰富,发酵过程中西梅浆中酚类物质为主要抗氧化成分。乳酸菌发酵过程中通过自身繁殖代谢起到辅助抗氧化或维持抗氧化活性的作用。综上所述,乳酸菌发酵过程中的抗氧化能力是由果蔬中酚类物质与菌种自身决定。
如图8所示,对照组和发酵组总酚含量均呈下降趋势,相较于对照组,5 个发酵组的总酚含量24 h 后下降幅度趋于平缓,且在发酵终点(96 h)的总酚含量均高于对照组,其中肠膜明串珠菌E2发酵西梅浆在96 h 时总酚含量最高 (583.16 mg/L),屎肠球菌C2 次之(568.89 mg/L)。

图8 不同自源乳酸菌在发酵西梅浆过程中总酚含量的变化Fig.8 The changes in the total phenol content of prunes pulp during fermentation of different self-sourced lactic acid bacteria
如图9、图10所示,对照组和发酵组的DPPH自由基清除率和ABTS 自由基清除率均呈下降趋势,肠膜明串珠菌E2 的DPPH 自由基清除率下降速率较为平缓,发酵96 h 时的DPPH 自由基清除率远高于其余4 个发酵组。对照组及屎肠球菌D2、M2、P1 发酵组的ABTS 自由基清除率在发酵48 h 后快速下降,肠膜明串珠菌E2 及屎肠球菌C2 发酵48 h 后ABTS 自由基的清除率下降较为平缓,且在发酵终点(96 h)的ABTS 自由基清除率高于其它组。
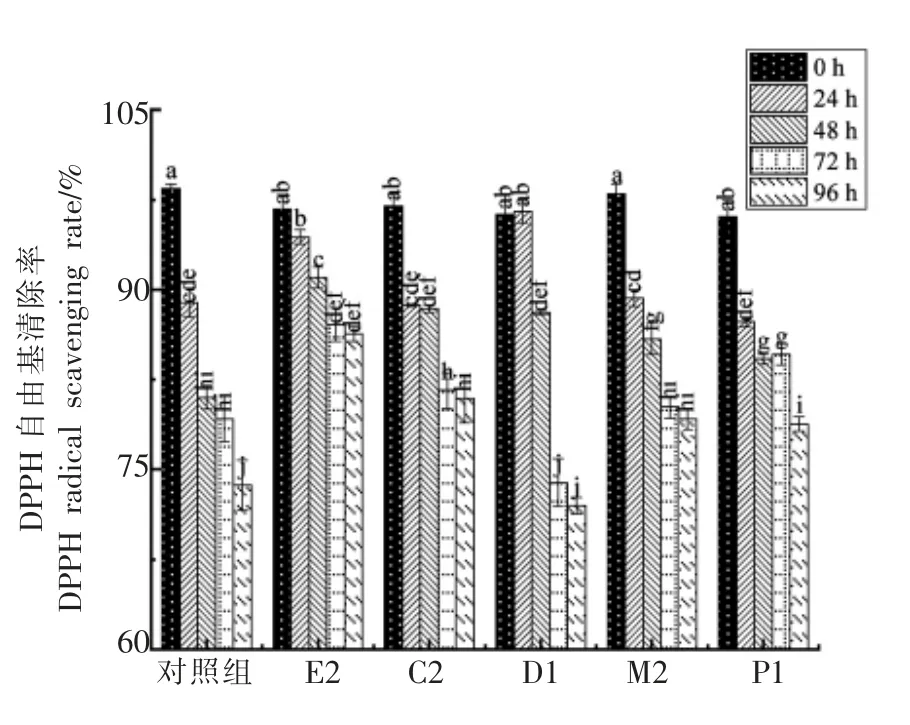
图9 不同自源乳酸菌发酵西梅浆过程中DPPH自由基清除能力的变化Fig.9 The changes in scavenging DPPH radical of prunes pulp during fermentation of different self-sourced lactic acid bacteria
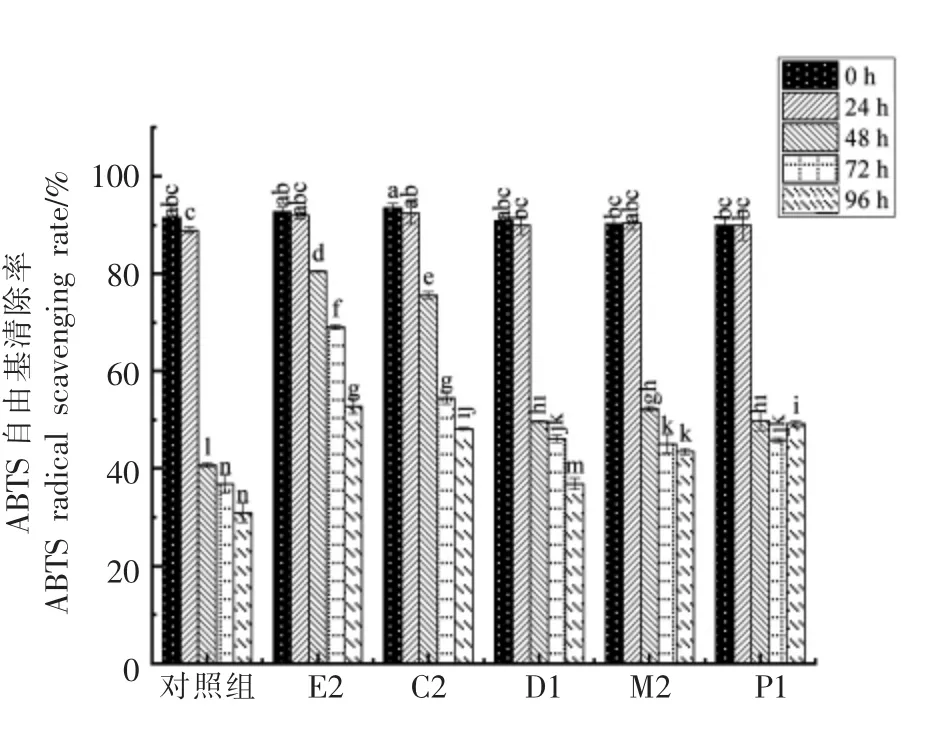
图10 不同自源乳酸菌发酵西梅浆过程中ABTS自由基清除能力的变化Fig.10 The changes in scavenging ABTS radical of prunes pulp during fermentation of different self-sourced lactic acid bacteria
通过对比,肠膜明串珠菌E2 和屎肠球菌C2在发酵西梅汁过程中保持较高的抗氧化活性,推断这2 株更适合西梅浆发酵。
3 结论
1)从新疆“女神”西梅原浆中筛选出5 株产酸性能较好且在西梅汁培养基中生长较好的乳酸菌,经生理、生化鉴定及分子生物学鉴定,确定E2为肠膜明串珠菌,C2、D2、M2、P1 为屎肠球菌。
2)肠膜明串珠菌E2 在MRS 肉汤中生长迅速且产酸性能较好,经综合比对,肠膜明串珠菌E2 和屎肠球菌C2 的完整乳酸菌细胞悬液有较好的抗氧化能力。
3)发酵西梅浆过程中,肠膜明串珠菌E2 和屎肠球菌C2 发酵组的总酚含量较高,抗氧化能力较为突出,适合西梅浆的发酵。

