绞股蓝皂苷饮食干预小鼠肥胖及肠道菌群研究
刘嘉平,王 博,张晓伟,张亚琼*,俞良莉
(1 上海交通大学农业与生物学院 上海 200240 2 马里兰大学营养与食品科学系 美国马里兰 20742)
肥胖被定义为脂肪堆积过多,是机体能量摄入和消耗不平衡的结果[1],会大幅增加罹患Ⅱ型糖尿病、脂肪肝、高血压等疾病的风险[2]。肠道微生物组是微生物及其代谢产物的动态组合[3],在体内发挥一系列重要的生物功能,包括免疫调节,宿主代谢调节,平衡营养素的吸收等[4]。近年来,众多研究表明,与正常个体相比,肥胖个体的肠道菌群组成和结构均发生了显著的变化[5-6],因此如何通过饮食干预肠道菌群以及控制肥胖成为近年国内外的研究热点。
绞股蓝是一种多年生匍匐植物,广泛分布于中国、日本以及东南亚等国家,在世界范围内绞股蓝茶被广泛认为具有降血糖、血脂的功效[7]。绞股蓝皂苷是绞股蓝中主要的活性成分[8],Liu 等[9]研究发现绞股蓝皂苷可以在细胞水平上抑制3T3-L1小鼠前脂肪细胞的分化,从而抑制脂肪的生成,然而在体内水平研究绞股蓝皂苷对控制动物肥胖,以及对动物体内肠道菌群的调节作用还鲜有报道。本研究采用高脂饮食喂食C57BL/6J 小鼠,同时给予不同剂量的绞股蓝皂苷干预,探究绞股蓝皂苷对小鼠肥胖及小鼠肠道菌群多样性和组成的影响,为绞股蓝资源的深度开发提供数据支持。
1 材料与方法
1.1 材料与试剂
实验动物采用SPF 级C57BL/6J 小鼠,6 周龄,雄性,平均体重(21±2)g,实验动物使用许可证号:SCXK(沪)2017-0012,购于上海吉辉实验动物饲养有限公司。
四倍体绞股蓝叶片购于陕西省平利县;动物标准饲料、高脂饲料,江苏省协同医药生物工程有限责任公司;多聚甲醛,上海阿拉丁生化科技股份有限公司;苏木素染液、伊红染液,武汉谷歌生物科技有限公司;甘油三酯、总胆固醇、低密度脂蛋白-胆固醇、高密度脂蛋白-胆固醇、谷丙转氨酶、谷草转氨酶检测试剂盒,上海罗氏制药有限公司;瘦素检测试剂盒,赛默飞世尔科技公司;实验用水为超纯水(18.2 MΩ),其它化学试剂均为分析纯级。
1.2 仪器与设备
BSA4202S-CW 电子天平,德国赛多利斯公司;Milli-Q 纯水仪,美国密理博公司;Centrifuge 5415R 低温高速离心机,德国艾本德公司;涡旋仪,德国艾卡公司;高效液相色谱仪,美国安捷伦科技有限公司;Infinity M2000 Pro 全波长多功能酶标仪,瑞士帝肯公司;-80 ℃超低温冰箱,赛默飞世尔科技公司;生物样本匀浆机,法国Bertin 公司;病理切片机,上海徕卡仪器有限公司;倒置荧光显微镜、成像系统,日本尼康公司;Illumina NovaSeq6000 测序仪,美国Illumina 公司。
1.3 试验方法
1.3.1 绞股蓝皂苷的提取与分离 采用乙醇热提法获得绞股蓝皂苷的粗提物浸膏,然后经石油醚和乙酸乙酯萃取后,使用大孔树脂进一步除杂获得绞股蓝皂苷粗提物粉末,再经半制备型HPLC分离后获得绞股蓝总皂苷(得率约为7.43 mg/g 绞股蓝干叶片)[10]。
1.3.2 动物饲养和分组 小鼠经外包装灭菌处理立即转入上海交通大学实验动物中心,SPF 级屏障系统内进行饲养,温度和相对湿度分别控制在(22±2)℃和50%±10%,12 h 光照和12 h 黑暗交替循环,小鼠自由饮食饮水。在整个实验期间,所有涉及动物的程序均严格按照中国有关实验动物的相关饲养规范和法律规定进行。
小鼠经过1 周的适应性饲养后,每组10 只,随机分为4 组:正常对照组(NC 组)、高脂组(HF组)、低剂量绞股蓝皂苷干预组(JS300 组)和高剂量绞股蓝皂苷干预组(JS600 组)。NC 组用动物标准饲料喂养,HF 组、JS300 组、JS600 组均用高脂饲料喂养。绞股蓝皂苷干预方式:称取一定量的绞股蓝皂苷溶解于生理盐水中,按300 mg/kg bw/d或600 mg/kg bw/d 的剂量对小鼠进行灌胃处理,每日1 次,共持续12 周。为了保持组别间小鼠处理的一致性,每日给予NC 组和HF 组小鼠同时灌胃等体积生理盐水。每周记录1 次小鼠的体重,并计算其平均值。
1.3.3 动物处死及样本收集 小鼠饲养12 周后,提前1 d 用代谢笼收集小鼠粪便用于肠道菌群分析。禁食12 h 后通过颈椎脱臼处死小鼠,立即收集血液样本,并在4 ℃下3 500×g 离心10 min,取上层血清用于生化指标的测定。迅速解剖小鼠,取皮下脂肪、肾周脂肪和附睾脂肪,经生理盐水清洗、称重后,用4%多聚甲醛固定,用于病理切片的制作和H&E 染色。
1.3.4 血清生化指标测定 血清中甘油三酯、总胆固醇、谷丙转氨酶、谷草转氨酶、低密度脂蛋白-胆固醇、高密度脂蛋白-胆固醇和瘦素含量的测定均按照试剂盒说明书操作。
1.3.5 脂肪细胞形貌观察 将脂肪组织在4%多聚甲醛溶液中固定24 h,脱水、石蜡包埋、切片后,用H&E 染料染色,在光学显微镜(400 倍)下观察脂肪细胞形貌,并用IPP 6.0 软件对细胞数目进行计数。
1.3.6 粪便肠道菌群16S rRNA 测序 采用CTAB 方法提取小鼠粪便菌群的DNA,之后利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量的样本DNA 于离心管中,使用无菌水稀释样本至1 ng/μL。以16S 高变区中的V3+V4 区为目标测序片段,采用带Barcode 的特异引物341F (5'-CCTAYGGGRBGCASCAG -3') 和 806R (5' -GGACTACNNGGGTATCTAAT-3') 对目标片段进行PCR 扩增,每个样品进行3 次重复。PCR 扩增产物通过质量分数2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收、纯化。对纯化后的PCR产物使用TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,文库合格后,在NovaSeq6000 进行上机测序。
根据Barcode 序列和PCR 扩增引物序列从下机数据中拆分出各样本数据,截去Barcode 和引物序列后使用FLASH 软件对每个样本的reads 进行拼接,然后采用Qiime 软件过滤嵌合体,得到最终的有效数据(Effective tags)。利用Uparse 软件对所有样本的全部有效数据进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational taxonomic units)。用Mothur 方法与SILVA138 的SSUrRNA 数据库进行物种注释分析,获得分类学信息并在门、科、属分类水平上统计各样本的群落组成。使用R 软件计算Shannon 指数、Simpson 指数、InvSimpson 指数。
1.4 统计分析
所有实验均做3 次平行,结果表示为“平均值±标准差”。使用SPSS 22.0 进行显著性分析,采用单因素方差分析(One-way ANOVA)进行组间比较,P<0.05 则认为具有统计学显著差异。
2 结果与分析
2.1 绞股蓝皂苷干预对小鼠体重、脂肪组织质量及体脂率的影响
绞股蓝皂苷干预对小鼠体重、脂肪组织质量及体脂率的影响见表1。首先,4 组小鼠(NC 组、HF 组、JS300 组、JS600 组)的初始体重值均为21~23 g,各组间无显著差异(P>0.05)。喂养12 周后,NC 组小鼠体重增加到27.07 g,而HF 组小鼠体重与NC 组相比增加更明显,为31.46 g,且这2 组小鼠体重之间有显著性差异(P<0.05)。经绞股蓝皂苷干预12 周后,JS300、JS600 组小鼠最终体重值较HF 组有所降低,分别为29.78 g 和27.86 g,其中,JS600 组小鼠体重降低更为明显,与HF 组相比有显著性差异(P<0.05)。

表1 绞股蓝皂苷干预对小鼠体重、脂肪组织质量和体脂率的影响Table 1 Effects of gypenosides on the body weight,adipose tissue mass and body fat percentage in mice
此外,还对4 组小鼠脂肪组织(皮下脂肪、肾周脂肪、附睾脂肪)的质量以及体脂率进行测定和计算。与NC 组相比,喂食12 周高脂饲料的HF 组小鼠皮下、肾周和附睾脂肪质量显著提高,分别从0.26,0.12,0.42 g 提高至0.45,0.35,0.85 g(P<0.05)。此外,HF 组的这3 种脂肪占体重的比率(体脂率)也较NC 组有显著提高,皮下脂肪率从0.96%提高至1.43%,肾周脂肪率从0.22%提高至1.09%,附睾脂肪率从1.55%提高至2.70%(P<0.05)。然而,绞股蓝皂苷干预组(JS300 和JS600组)小鼠的脂肪组织质量和体脂率均有所下降,特别是JS600 组小鼠,其肾周、附睾脂肪的质量以及3 种体脂率均较HF 组有显著性下降(P<0.05)。上述研究结果表明绞股蓝皂苷饮食干预可以降低喂食高脂饲料所导致的小鼠体重、脂肪组织质量及体脂率的升高,并且这种干预作用与绞股蓝皂苷的剂量有相关性。
2.2 绞股蓝皂苷干预对小鼠血清生化指标的影响
血清中甘油三酯和总胆固醇水平是反映机体血脂代谢水平最常用的2 个生化指标。此外,低密度脂蛋白-胆固醇和高密度脂蛋白-胆固醇分别是运输胆固醇到肝外组织和将胆固醇从肝外组织转运到肝脏进行代谢的主要运载工具。前期研究表明,肥胖对于机体血脂代谢各项生化指标水平有显著影响[11]。由于本研究中观察到绞股蓝皂苷的饮食干预可以降低喂食高脂饲料所导致的小鼠体重、脂肪组织质量及体脂率的升高,因此,为了进一步探究绞股蓝皂苷干预对小鼠血脂代谢相关生化指标的影响,本研究分别对各组小鼠血清中甘油三酯、总胆固醇、低密度脂蛋白-胆固醇和高密度脂蛋白-胆固醇的含量进行了测定 (表2)。与NC 组相比,HF 组小鼠血清中甘油三酯、总胆固醇、低密度脂蛋白-胆固醇的含量显著提高,分别从0.27 mmol/L 提高至0.74 mmol/L,0.51 mmol/L提高至1.47 mmol/L,0.06 mmol/L 提高至0.20 mmol/L(P<0.05),而血清中高密度脂蛋白-胆固醇的含量无显著性差异。此外,经过12 周绞股蓝皂苷干预后,JS300 和JS600 组总胆固醇含量与HF组相比均有所下降,总胆固醇含量从1.47 mmol/L分别降至1.20 mmol/L 和1.33 mmol/L;2 种载脂蛋白低密度脂蛋白-胆固醇和高密度脂蛋白-胆固醇含量也发生了显著性变化,分别从HF 组的0.2 mmol/L 降低至0.16 mmol/L (JS300 和JS600 组),以及从0.46 mmol/L 上升至0.59 (JS300 组)和0.54 mmol/L(JS600 组)(P<0.05);然而绞股蓝皂苷干预对血清中甘油三酯的含量却无显著性影响。陈桂林[12]研究发现对肥胖昆明小鼠进行为期4 周的绞股蓝(50%乙醇浸提物)干预后,可显著降低小鼠血清中甘油三酯、总胆固醇、低密度脂蛋白-胆固醇的含量,并同时升高高密度脂蛋白-胆固醇的含量。本研究未观察到绞股蓝皂苷干预对小鼠血清中甘油三酯含量的影响,这可能是由于实验所用小鼠品系不同,以及绞股蓝的50%乙醇浸提物与本实验所用的绞股蓝皂苷成分不同导致。
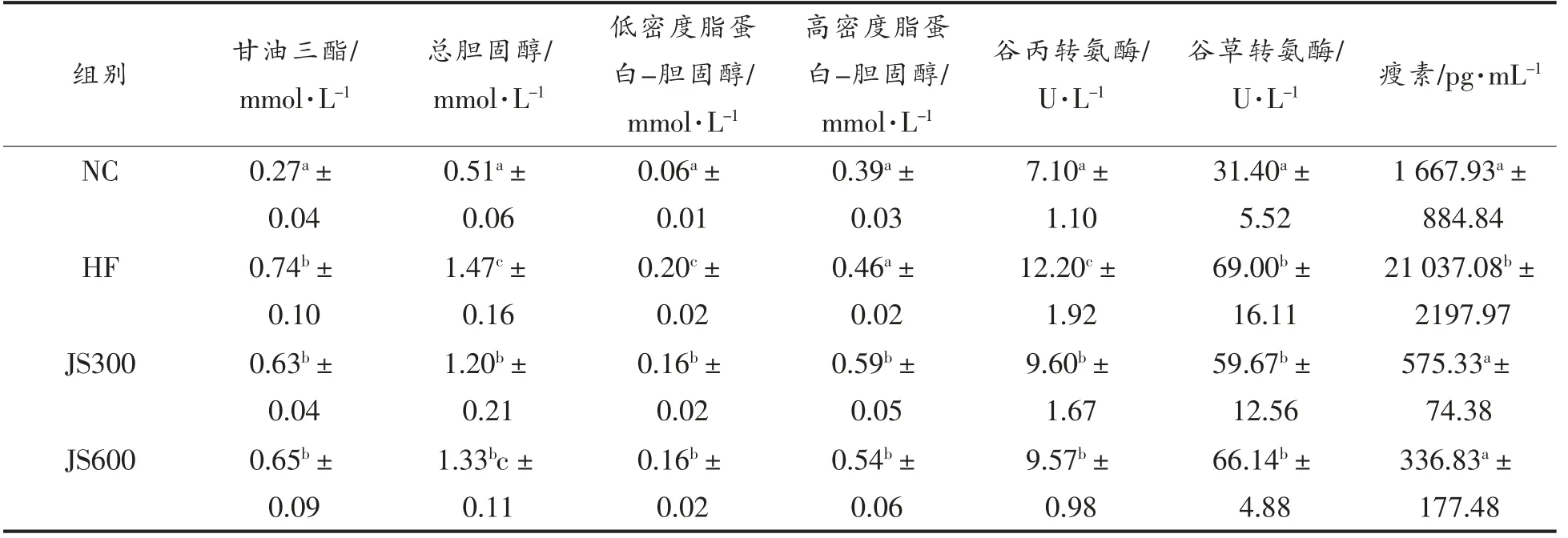
表2 绞股蓝皂苷干预对小鼠血清生化指标的影响Table 2 Effects of gypenosides on serum biochemical indices in mice
此外,谷丙转氨酶和谷草转氨酶是两种肝脏转氨酶,肥胖、血脂代谢紊乱与血清中谷丙转氨酶和谷草转氨酶水平的升高也密切相关[13]。与NC 组相比,HF 组小鼠谷丙转氨酶和谷草转氨酶的含量显著上升,血清中谷丙转氨酶的含量从7.10 U/L上升至12.20 U/L,谷草转氨酶的含量从31.40 U/L上升至69.00 U/L(P<0.05)。经绞股蓝皂苷干预后的JS300 和JS600 组小鼠血清中谷丙转氨酶的含量显著下降,分别下降至9.60 U/L 和9.57 U/L(P<0.05),而谷草转氨酶的含量无显著性改变。Lee等[14]研究发现采用绞股蓝皂苷300 mg/kg bw/d 剂量干预C57BL/6J 小鼠8 周,可以显著降低小鼠血清中谷丙转氨酶的含量,这与本研究所观察到的结果相一致。
瘦素是一种由脂肪细胞分泌的细胞因子样循环激素,大部分肥胖个体会产生瘦素抵抗,表现为瘦素水平升高和敏感性降低[15]。与NC 组相比,HF组小鼠血清中瘦素的含量显著上升,从1 667.93 pg/mL 上升至21 037.08 pg/mL(P<0.05);而经绞股蓝皂苷干预后,JS300 和JS600 组小鼠血清中瘦素含量分别显著下降至575.33 pg/mL 和336.83 pg/mL(P<0.05)。Ahmed 等[16]研究发现高脂饲料喂养的CD-1 小鼠血清中瘦素的含量也显著上升,而经阿拉伯胶饮食干预后瘦素的含量又显著下降。
2.3 绞股蓝皂苷干预对小鼠脂肪细胞形貌的影响
从表1可知绞股蓝皂苷干预可以降低喂食高脂饲料所导致的小鼠脂肪组织质量及体脂率的升高,为了更直观地观察绞股蓝皂苷干预对小鼠脂肪细胞形貌的影响,本研究采用H&E 染色法对各组小鼠的皮下、肾周和附睾脂肪组织切片进行观察。由图1a 可知,在相同放大倍数下,与NC 组小鼠的皮下、肾周和附睾脂肪细胞相比,HF 组小鼠这3 种脂肪部位的脂肪细胞体积均明显增大。而经绞股蓝皂苷干预后,JS300 和JS600 组小鼠这3种脂肪部位的脂肪细胞体积较HF 组均明显减小,这与本研究中所观察到的这2 组小鼠脂肪组织质量和体脂率下降的结果相一致(表1)。Guo等[17]研究发现,脂肪细胞体积大小可以反映个体肥胖的程度。与正常个体相比,肥胖个体的脂肪细胞体积更大,这主要是由于其脂肪细胞中存在更多的脂肪滴导致。此外,本研究还对该放大倍数下,可视区域内不同组小鼠的3 种脂肪细胞进行细胞计数,比较脂肪细胞数量上的差异。从图1b可知,与NC 组相比,HF 组小鼠3 种脂肪部位的脂肪细胞数量均显著下降(P<0.05),皮下、肾周和附睾脂肪的细胞数量分别从54 个/mm2下降至199 个/mm2,从341 个/mm2下降至185 个/mm2,以及从440 个/mm2下降至215 个/mm2。而经绞股蓝皂苷干预后的JS300 和JS600 组小鼠,这3 种脂肪部位的脂肪细胞数量又均显著上升 (P<0.05),说明这2 组小鼠脂肪细胞体积较HF 组显著减小。上述结果进一步证明了绞股蓝皂苷干预对控制高脂饲料所导致的小鼠肥胖的积极作用。
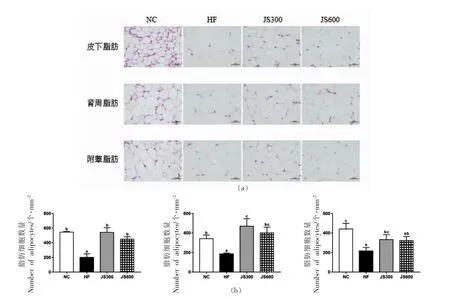
图1 绞股蓝皂苷干预对小鼠皮下、肾周和附睾脂肪细胞形貌(a)和数量(b)的影响Fig.1 Effects of gypenosides on the morphology (a) and number (b) of subcutaneous,perirenal and epididymal adipocytes in mice
2.4 绞股蓝皂苷干预对小鼠肠道菌群多样性和组成结构的影响
肠道菌群的α-多样性可以反映肠道中物种的丰富度和均匀度[18],表3为绞股蓝皂苷干预对小鼠肠道菌群α-多样性指数影响的结果。其中,Shannon 和Simpson 指数是衡量物种多样性的推荐指标[19],Shannon 指数更侧重于物种丰富度,而Simpson 指数更侧重于物种均匀度[20]。InvSimpson指数是Simpson 指数的逆,更侧重于物种丰富度[21]。由表中可知,在物种丰富度方面,与NC 组相比,HF 组小鼠肠道菌群的Shannon 和InvSimpson指数分别从2.88 下降至0.73,从5.58 下降至1.30(P<0.05)。而经绞股蓝皂苷干预后,JS300 和JS600组小鼠肠道菌群的Shannon 指数均较HF 组显著增加(P<0.05),分别从0.73 增加至3.11 和3.68,而InvSimpson 指数却没有显著性变化 (P>0.05)。在物种均匀度方面,与NC 组相比,HF 组小鼠肠道菌群的Simpson 指数从0.81 下降至0.22 (P<0.05),而经绞股蓝皂苷干预后,JS300 和JS600 组小鼠肠道菌群的Simpson 指数均较HF 组没有显著差异(P>0.05),上述结果说明高脂饲料喂养会降低小鼠肠道菌群的丰富度和均匀度,而绞股蓝皂苷的干预可以提高小鼠肠道菌群的丰富度,对均匀度没有显著影响。王家妮等[22]也发现经高脂饲料喂养后,小鼠肠道菌群的Shannon 和Simpson指数显著下降,肠道菌群多样性降低,这与本研究结果相一致。
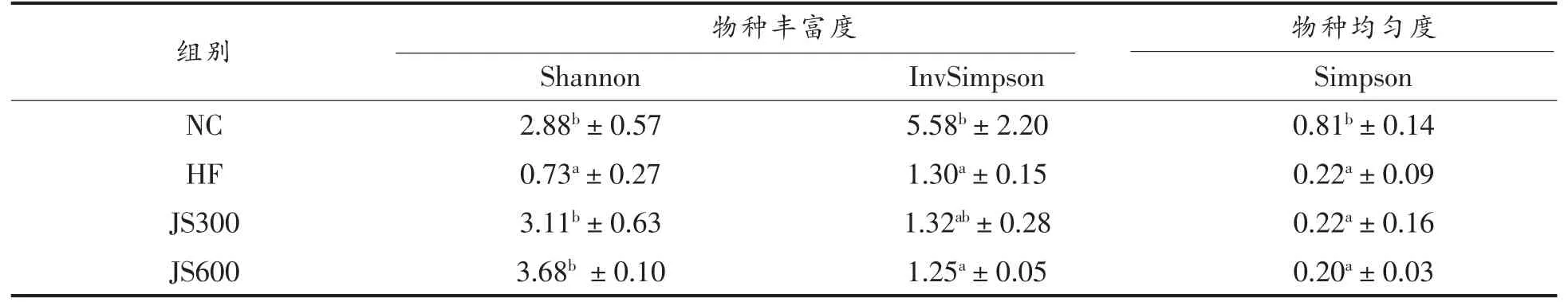
表3 绞股蓝皂苷干预对小鼠肠道菌群多样性的影响Table 3 Effects of gypenosides on the α diversity indices of gut microbiota in mice
为了进一步分析绞股蓝皂苷干预对小鼠肠道菌群组成结构的影响,本研究对不同组小鼠肠道菌群在不同分类水平上优势菌的相对丰度进行统计分析。由门水平的聚类柱状图(图2a)可知,NC 组小鼠肠道菌群中的优势菌群为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和脱硫菌门(Desulfobacterota),其中厚壁菌门占58.10%,拟杆菌门占27.72%,疣微菌门占7.34%,脱硫菌门占4.31%。而HF 组小鼠肠道菌群中厚壁菌门的相对丰度增加至97.28%,拟杆菌门、疣微菌门和脱硫菌门的相对丰度分别降低至1.49%,0.08%,0.33%。小鼠肠道菌群在科水平上的相对丰度如图2b 所示,NC 组小鼠肠道菌群中的优势菌群为杆菌科(Bacilli)、类杆菌科(Bacteroidia)、梭状芽胞杆菌科(Clostridia)和疣微菌科(Verrucomicrobiae)。HF 组小鼠肠道菌群中杆菌科的相对丰度提高了,而类杆菌科、梭状芽胞杆菌科和疣微菌科的相对丰度却降低了。经绞股蓝皂苷干预后,JS300 和JS600组小鼠的肠道菌群在门、科水平上的相对丰度较HF 组变化不显著。

图2 小鼠肠道微生物群在不同分类水平的相对丰度Fig.2 The relative abundance of gut microbiota in mice at different taxonomic levels
图2c 是通过热图来比较属水平上各个菌属的相对丰度变化。NC 组小鼠肠道菌群中的优势菌群为颤螺旋菌科属(Oscillospiraceae)、鼠杆菌属 (Muribaculaceae)、梭状芽胞杆菌属(Clostridium sensu strict)和别普雷沃菌属(Alloprevotella),而HF 组小鼠肠道菌群中颤螺旋菌科属和别普雷沃菌属的相对丰度降低了。经绞股蓝皂苷干预后,颤螺旋菌科属、别普雷沃菌属的相对丰度有所上升,同时狄氏副拟杆菌属(Parabacteroides)、毛螺菌属(Lachnospiraceae DW59)和伯克氏菌属(Burkholderiales YL45)的相对丰度也都增加了,鼠杆菌属的相对丰度却降低了,绞股蓝皂苷的干预剂量对小鼠肠道菌群在属水平的影响不大。前期研究发现颤螺旋菌科属的相对丰度与血清胆固醇含量呈负相关,在肥胖个体中,颤螺旋菌科属的相对丰度较低[23]。别普雷沃菌属、毛螺菌属是肠道短链脂肪酸(如乙酸、丙酸和丁酸)的产生菌,而作为肠道内的代谢产物,短链脂肪酸具有调节肝脏脂质代谢,抑制体重增加的作用[24-26]。绞股蓝皂苷干预可以提高颤螺旋菌科属、别普雷沃菌属和毛螺菌属的相对丰度,这与本研究中观察到的绞股蓝皂苷干预对小鼠体重和血脂水平的积极作用相吻合(表2)。此外,肥胖通常还会导致炎症的发生[27],狄氏副拟杆菌属是可以发挥抗炎作用的菌属,它通过作用于调节性T 细胞和白细胞介素-10 抑制全身性炎症反应[28]。除此之外,在一项儿童肥胖与肠道菌群组成关系的研究中发现,伯克氏菌属与体重呈负相关,在健康儿童中观察到较高比例的伯克氏菌属[29]。本研究发现绞股蓝皂苷干预可以提高小鼠肠道内上述2 种菌属的相对丰度,这可能也与其控制小鼠肥胖的积极作用有所关联。
3 结论
本研究发现绞股蓝皂苷饮食干预能够显著降低因喂食高脂饲料导致的小鼠体重、体脂率的增长以及脂肪细胞体积的增大;同时降低小鼠血清中低密度脂蛋白-胆固醇、谷丙转氨酶和瘦素的含量,提高高密度脂蛋白-胆固醇的含量。此外,绞股蓝皂苷饮食干预还提高了小鼠肠道内肠道菌群的α-多样性,并在属水平上提高了颤螺旋菌科属(Oscillospiraceae)、别普雷沃菌属(Alloprevotella)、狄氏副拟杆菌属 (Parabacteroides)、毛螺菌属(Lachnospiraceae DW590)和伯克氏菌属(Burkholderiales YL45)的相对丰度。因此,绞股蓝皂苷具有潜在的减肥、降脂和调节肠道菌群的积极作用,在功能性食品开发方面具有良好的应用前景。

