B群链球菌液体显色培养基改良及性能评价
楚亚菲,荆楠,肖征,闫文娟
(河南省人民医院 检验科,河南 郑州 450003)
B群链球菌(group B streptococcus,GBS)又称无乳链球菌,通常在超过50%的健康人群下消化道和泌尿生殖道定植。高达40%的健康孕妇在阴道、直肠都存在GBS[1]。有文献指出中国女性GBS定值率高达36%[2]。孕妇GBS定植可引起绒毛膜羊膜炎、胎膜早破、早产和死胎等不良结局,新生儿感染GBS可引起脑膜炎、败血症、肺炎等疾病,且预后差、病死率高[3-4]。目前许多国家建议对怀孕35~37周的孕妇进行阴道和/或直肠携带GBS的普遍筛查[2,5]。2010年美国CDC和2015年欧洲共识均将肉汤增菌鉴定作为筛查GBS的首选方法[6-7],普通细菌培养鉴定不但耗时长,而且要求检测人员有一定的技术,否则容易漏检非特征性菌落,显色琼脂培养基存在较多的假阳性,需要补充触酶试验等相关试验,产橙色素液体培养基存在漏检不产橙色素的GBS问题。本研究旨在改进液体培养基Todd-Hewitt肉汤的成分,提高不产橙色素GBS的检出率。
1 材料与方法
1.1 实验菌株选取河南省人民医院2015年1月至2019年3月临床分离菌株共112株,其中GBS 74株,化脓链球菌6株,屎肠球菌2株,粪肠球菌2株,大肠埃希菌16株,肺炎克雷伯菌1株,白念珠菌2株,光滑念珠菌1株,金黄色葡萄球菌4株,表皮葡萄球菌2株,草绿色链球菌1株,铜绿假单胞菌1株。12株标准菌株为本实验室保存,其中GBS 3株,非GBS 9株。见表1。
表1 本实验所用菌株
1.2 菌悬液制备按需将12株标准菌株和112株临床菌株分次分别转种到血平板上,35 ℃,体积分数为5%二氧化碳孵育过夜后选择单个菌落用MALDI-TOF MS进行鉴定;鉴定后的菌株用生理盐水研磨成菌悬液,浓度为0.5麦氏比浊度。其中GBS菌悬液再用生理盐水进行倍比稀释使其最终浓度为107cfu·L-1。
1.3 培养基的筛选方法Todd-Hewitt基础肉汤按说明书配制,并分别添加庆大霉素8 g·L-1, 萘啶酸15 g·L-1[8],每管4 mL无菌分装后储存在2~8 ℃待用,此培养基命名为培养基一;以培养基一为基础,分别添加不同浓度的吸附剂(羟丙基β-环糊精)、动物血清(绵羊血清)、有机助溶剂(DMF)、还原剂(盐酸半胱氨酸)和牛心浸粉,并各加入菌悬液浓度为107cfu·L-1GBS (ATCC12386) 100 μL,35 ℃孵育24 h,以产橙色素最明显的浓度为其最适浓度,再以此为基础选取2株GBS标准菌株,1株GBS临床菌株,9株非GBS的临床菌株,以同样的方法进行孵育后,经正交试验直观分析表和方差分析,确定产橙色素最明显、杂菌生长最差的最佳配方,此培养基命名为培养基二;以培养基二为基础,分别添加不同浓度的两性霉素B、氯化血红素、L-鸟氨酸、鼠李糖,并选取3株GBS标准菌株、9株非GBS标准菌株、1株溶血GBS临床菌株及11株不溶血的GBS临床株,以同样的方法,确定产橙色素最明显、杂菌生长最差的最佳配方,此培养基为最终培养基,命名为改良液体显色培养基。
1.4 改良液体显色培养基性能的临床菌株评价在4 mL改良液体显色培养基中加入100 μL配置好的菌悬液(62株GBS临床菌株,20株杂菌), 35 ℃孵育24 h观察结果。
1.5 结果判读产橙色素、弱产橙色素均有GBS生长,不产橙色素无GBS生长。
1.6 培养结果定量比较因为培养结果是定性的,所以培养结果被数字化以便于进行正交分析,数字越高培养基的性能越好。见表2、3。

表2 培养基二数字化筛选结果规定

表3 培养基三数字化筛选结果规定

表3(续)
2 结果
2.1 培养基二筛选结果及正交试验结果羟丙基β-环糊精盐酸半胱氨酸和牛心浸粉最适质量浓度分别为1.25、2.5、5 g·L-1,绵羊血清和DMF的最适体积分数为0.1%,0.025%。不同成分和浓度的具体结果见图1~3。本研究使用正交表进行羟丙基β-环糊精、绵羊血清、DMF、盐酸半光氨酸和牛心浸粉的正交试验和方差分析,其中绵羊血清和牛心浸粉的P值分别为0.013、0.005,表明两者浓度对培养基性能有影响。见表4。最后得到最优组合,即培养基二的最终组成为:在培养基一的基础上,添加绵羊血清0.1%、牛心浸粉6.5 g·L-1、羟丙基β-环糊精1.25 g·L-1、DMF 0.005%、盐酸半胱氨酸3.5 g·L-1。
2.2 改良液体培养基筛选结果及正交试验结果L-鸟氨酸、鼠李糖和氯化血红素的最佳浓度分别为1.25 g·L-1、0.25 g·L-1、10 mg·L-1。各成分不同浓度结果见图4、5。本研究将L-鸟氨酸、鼠李糖、氯化血红素采用L9(33)正交表进行正交试验和方差分析,结果见表5,其中L-鸟氨酸P值是0.012,其浓度对培养基有影响。为抑制念珠菌生长,添加两性霉素B 4 mg·L-1综合正交试验表改良液体培养基最终成分为:以Todd-Hewitt肉汤为基础,添加庆大霉素8 g·L-1、萘啶酸15 g·L-1、绵羊血清0.1%、牛心浸粉6.5 g·L-1、羟丙基β-环糊精1.25 g·L-1、DMF 0.005%、盐酸半胱氨酸3.5 g·L-1、L-鸟氨酸1.1 g·L-1、鼠李糖0.4 g·L-1、氯化血红素12 mg·L-1、两性霉素B 4 mg·L-1。
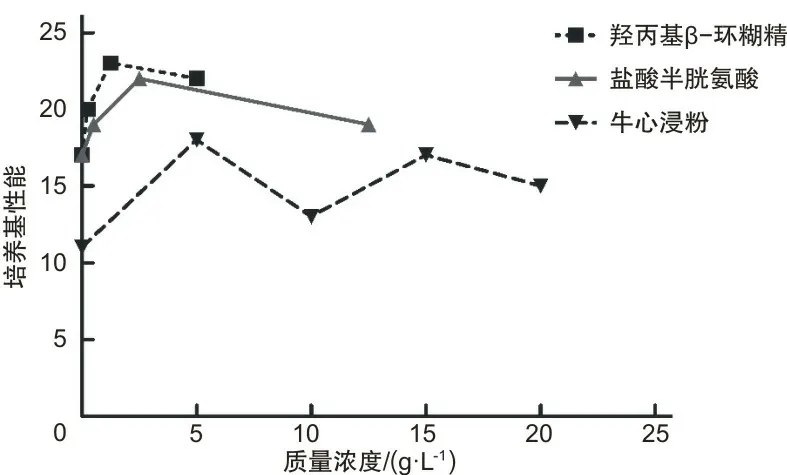
图1 不同质量浓度牛心浸粉、盐酸半胱氨酸、羟丙基 β-环糊精对培养基性能的影响
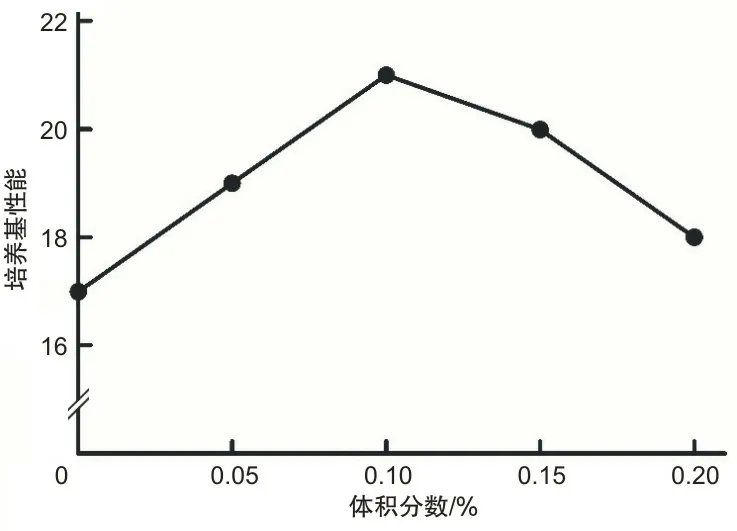
图2 不同体积分数绵羊血清对培养基性能的影响
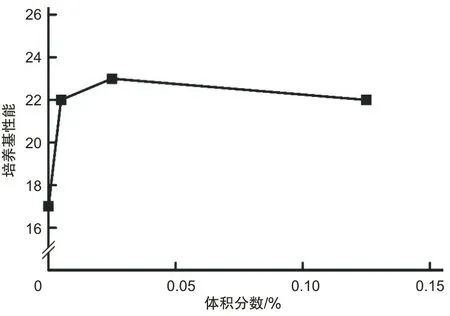
图3 不同体积分数DMF对培养基性能的影响
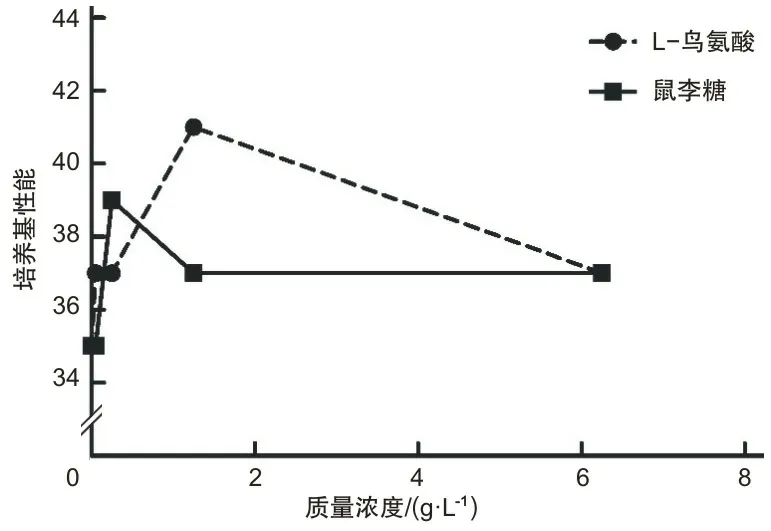
图4 不同质量浓度鼠李糖、L-鸟氨酸对培养基性能的影响

图5 不同质量浓度氯化血红素对培养基性能的影响
2.3 临床菌株评价改良液体显色培养基结果用改良液体显色培养基检测62株GBS临床菌株,共检测出61株, 检测38株非GBS临床菌株均未显示橙色,该培养基灵敏度为98.3%,特异度100%。其中有4株变浑浊,分别是2株屎肠球菌、1株溶血葡萄球菌、1株光滑念珠菌。
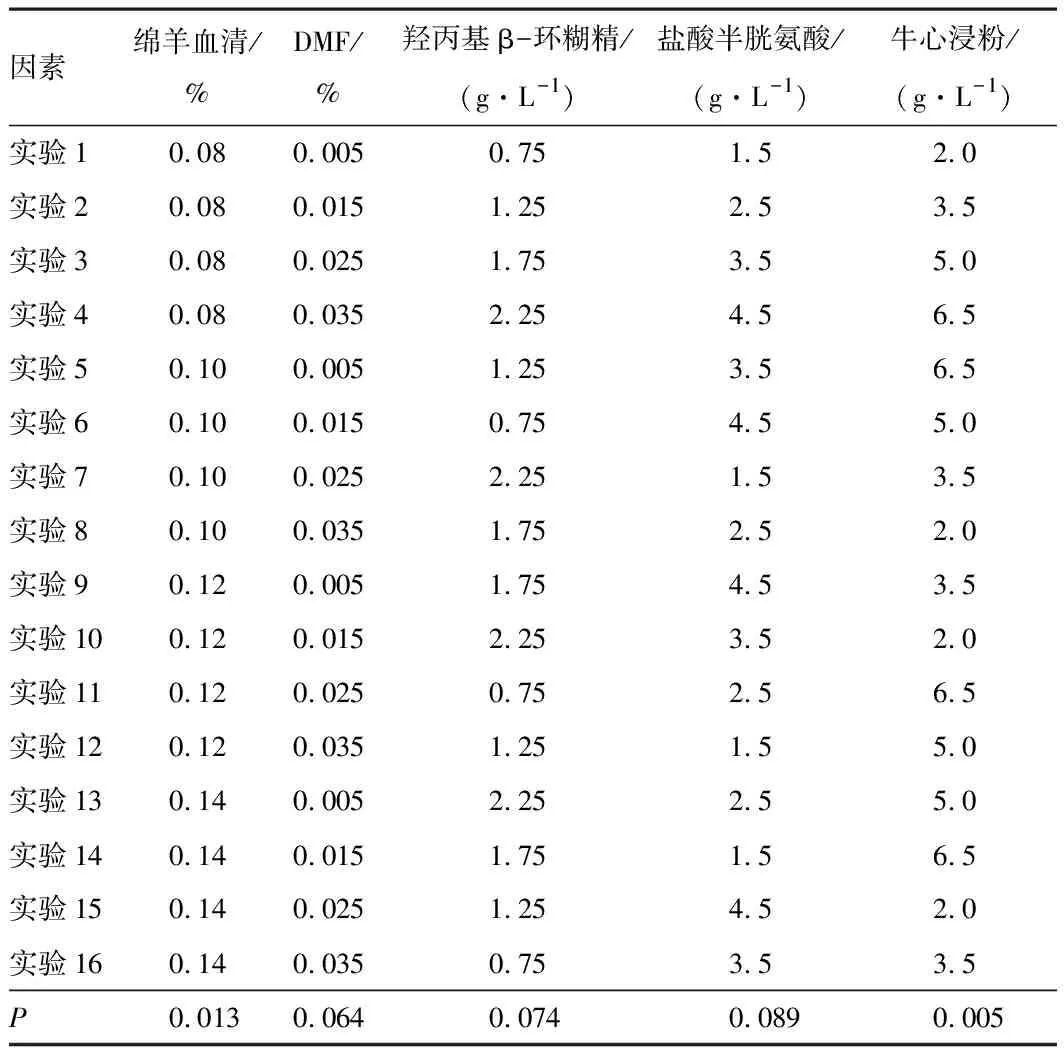
表4 培养基二正交试验及方差结果

表5 培养基三正交试验及方差结果
3 讨论
自20世纪80年代以来,以细菌特异性酶为基础的显色培养技术得到了很大的发展,包括检测GBS的显色培养基[9-12]。特异性酶会因细菌生长环境、表达量不足、分泌不够、活性不足等因素而影响显色培养基的灵敏度,另外不同细菌可有相似的同工酶或酶系统,从而导致特异性不高产生假阳性,因此以特异性酶为基础的显色培养基是有局限性的。产橙色素是GBS特有的性质,仅极少数细菌例如屎肠球也产橙色素[13]。以产橙色素为基础的培养基与狭义的显色培养基(特异性酶相关显色培养基)不同,它直接利用细菌所产生的橙色素显色,而不是作用于显色底物,因此避免了狭义显色培养基的相关缺陷,但此方法只能检测产橙色素的GBS, 6%~8%不产橙色素或少产橙色素的GBS容易漏检[14]。
研究发现,GBS是否溶血和其是否产橙色素息息相关,即溶血的GBS产橙色素,不溶血的GBS不产橙色素[15-17]。橙色素是一种鸟氨酸鼠李糖脂,该色素是一种类胡萝卜素,由cyl操纵子编码,一旦不能表达或表达不足就可导致GBS不产橙色素或弱产橙色素,如果增加诱导物即可促进橙色素的产生[18-19]。改良后的液体培养基在Todd-Hewitt肉汤的基础上添加了绵羊血清0.1%、牛心浸粉6.5 g·L-1、羟丙基β-环糊精1.25 g·L-1、DMF 0.005%、盐酸半胱氨酸3.5 g·L-1、L-鸟氨酸1.1 g·L-1、鼠李糖0.4 g·L-1、氯化血红素12 mg·L-1,牛心浸粉可以促进GBS生长,绵羊血清可以促进GBS溶血,羟丙基β-环糊精、DMF、盐酸半光氨酸均能促进GBS橙色素的产生,特别是L-鸟氨酸和鼠李糖不仅可促进溶血GBS 产生橙色素,还可促进不溶血的GBS产生橙色素。本研究在临床菌株评价实验中有3株不溶血的GBS应用改良的液体培养基培养有2株被检出,改良液体显色培养基明显提高了不溶血即不产橙色素GBS的检出率。狭义的显色培养基对于念珠菌的抑制作用较差,改良的液体显色培养基添加了两性霉素B,能够有效抑制念珠菌的生长,且实验中有3株念珠菌均未显橙色。然而这项研究的缺点是只评价了临床菌株且数量有限,本实验共收集临床标本46株,同时做了改良液体显色培养基筛查和普通细菌培养鉴定,两种方法均未检出GBS。

