柚皮素抑制创伤性颅脑损伤后炎性反应机制研究
任 彬,袁 福
(空军军医大学唐都医院急诊科,陕西 西安 710038)
创伤性颅脑损伤(Traumatic brain injury,TBI)是一种兼具高致死率和致残率的常见创伤性神经类疾病,患者多伴认知障碍、偏瘫等不同程度后遗症导致其预后情况较差,给患者及其家庭带来沉重的精神压力和经济负担[1-3]。TBI分为由机械外力导致的原发性颅脑损伤和由炎性反应、细胞死亡以及凋亡、氧化应激、Ca2+-Fe3+稳态受损等一系列级联反应引发的继发性颅脑损伤[4-5]。大量研究[6-7]证实,过度的炎性反应是TBI后继发性损伤的重要机制之一。脑损伤后,早期的小胶质细胞活化在炎性反应中起重要作用,其分泌抗炎症因子修复重建神经组织;然而随着病情的发展,炎症因子过度地表达使细胞膜破裂、细胞毒性物质释放,进一步引发脑水肿、胶质增生、血脑屏障受损等连锁反应,最终导致神经功能损伤或缺失[8-9]。因此,抑制损伤后过度炎性反应可能是改善TBI预后情况的重要研究方向。柚皮素(Naringenin,NGN)一种柚皮甙中的甙元单体,广泛存在柑橘香科和于芸类植物中的黄酮类化合物[10]。NGN有抗菌、抗氧化、抗肿瘤、清除自由基等作用,具有很大的药用价值[11]。研究发现NGN可通过降低白细胞介素(Interleukin,IL)-1β、IL-6等促炎症因子的表达参与抑制机体炎症,并且已有研究表明其在缺血性脑卒中具有降低脑水肿、改善神经功能的作用[12]。然而,目前关于NGN在TBI中的作用尚缺乏足够的研究证据。因此,本研究旨在探讨NGN在TBI后机体炎性反应中的是否发挥作用及其相关作用机制。
1 材料与方法
1.1 实验材料 雄性成年SPF级C57小鼠,体重20~25 g,在温度20~25 ℃、自由进食、自然光照、无病原体的环境下进行1~2周适应性饲养。纯化的NGN提取物以及NGN溶剂。
1.2 实验分组 50只小鼠随机均分为五组:假手术组(Sham组)、TBI组及NGN干预低剂量组、中剂量组和高剂量组。NGN低剂量组、NGN中剂量组和NGN高剂量组分别注射NGN 10、20、30 mg/kg,每天同时间点给药1次,共7 d,Sham组和TBI组小鼠注射等量柚皮素溶剂。
1.3 实验方法
1.3.1 TBI模型制备:腹腔注射4%水合氯醛麻醉小鼠,进行消毒、备皮,将其头部定位于立体定向仪上,在中线旁1.5 mm和人字缝上1.5 mm交界处做一直径为3 mm的骨窗,用脑皮质撞击仪进行打击,设置相关参数:打击深度2 mm,速度5 m/s。打击后封闭骨窗、缝合皮肤。Sham组只开窗不打击,其余操作无异。打击后1 h NGN给药组腹腔内注射药物,Sham组和TBI组同时间注射等量柚皮素溶剂,此后在相同时间注射直至实验结束。
1.3.2 神经功能缺损(mNSS)评分:在损伤后第1、3、7天根据mNSS评分表从意识、水平凝视功能、前后肢肌力等方面评分,得分越高功能缺失越严重,最低0分,最高18分。
1.3.3 ELISA检测炎症因子含量:分别于伤后第7天取创伤灶附近脑组织制备脑组织匀浆,以4000 r/min高速离心15 min,分离上清液,然后按照ELISA试剂盒说明进行操作,检测匀浆中IL-1β、IL-6、肿瘤坏死因子(TNF-α)三种炎症因子的含量。检测3次取平均值。
1.3.4 神经细胞凋亡率检测:损伤7 d后,小鼠灌注取脑,30%蔗糖浸泡沉底,然后用Themo切片机冰冻切片,切片厚度16 μm。使用商用试剂盒碧云天生产的一步法TUNEL凋亡检测试剂盒,选用固定液4%多聚甲醛处理40 min,磷酸盐缓冲液(PBS)洗10 min,共2~3次,加入含0.5% Triton X-100的PBS液打孔10 min,根据说明书配置检测液,避光37 ℃水浴1 h,PBS充分清洗后,加入Hoechst孵育15 min,封片后观察,拍照后计算TUNEL阳性细胞的百分比=(TUNEL阳性细胞数量/Hoechst阳性细胞数量)×100%。
1.3.5 免疫荧光检测小胶质细胞状态:损伤7 d后,灌注取脑,然后用Themo切片机制作厚度为16 μm的冰冻切片。取实验用冰冻切片常规过夜,4%多聚甲醛固定切片15 min,PBS充分漂洗,在切片上滴加0.3% Triton X-100溶液和Iba1一抗(封闭血清稀释)混合后,4 ℃过夜。PBS漂洗5 min共3次,与相应二抗以及Hoechst混合,室温孵育2 h,封片,观察期间注意避光。
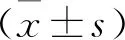
2 结 果
2.1 各组小鼠TBI后不同时间mNSS评分比较 见图1。损伤后第1、3、7 天,TBI组小鼠mNSS评分明显高于Sham组,说明Sham组小鼠的神经运动功能受损明显;NGN给药组评分较TBI组明显降低但仍高于Sham组(均P<0.05),说明NGN可以改善TBI小鼠的神经功能。

注:与Sham组比较,*P<0.01,**P<0.001 ;与 TBI组比较,#P<0.01,##P<0.001
2.2 各组小鼠TBI后第7 天脑组织内炎症因子含量比较 见图2。小鼠TBI后第7天,ELISA法检测脑组织炎症因子含量显示,与Sham组比较,TBI组小鼠脑组织中TNF-α、IL-6、IL-1β的表达水平均有明显升高(均P<0.05);与TBI组比较,NGN低、中、高剂量组小鼠组织中TNF-α、IL-6、IL-1β浓度显著下调,并且炎症因子表达程度的下降趋势呈明显的剂量依赖性(均P<0.05)。

注:与Sham组比较,*P<0.05,**P<0.01,***P<0.001 ;与TBI组比较,#P<0.05,##P<0.01,###P<0.001
2.3 各组小鼠TBI后第7天脑组织神经细胞凋亡率比较 见图3。在TBI建模7 d后,应用Tunel法评估各组小鼠神经细胞凋亡情况,结果显示,相比于Sham组,TBI组小鼠中伤后脑组织神经元细胞的凋亡率显著上调(P<0.05);对比TBI组,NGN给药组小鼠神经元凋亡率显著下降,并且呈现出剂量依赖性(均P<0.05)。

注:与Sham组比较,*P<0.05,***P<0.001;与TBI组比较,##P<0.01
2.4 各组小鼠TBI后第7 天脑组织小胶质细胞活化情况比较 见图4。在TBI建模7 d后,检测小鼠脑组织小胶质细胞活化情况。与Sham组相比,TBI组小鼠损伤区周围出现大量活化的Iba1阳性小胶质细胞,出现明显的胞体较大且增厚、突起变短的特征;而在给药组中,胞体较TBI组变小,突起变长,即说明NGN干预明显抑制了Iba1阳性细胞的活化。

图4 各组小鼠TBI后第7天脑组织小胶质细胞活化情况比较
3 讨 论
在本研究中发现,NGN可以抑制受损后脑组织小胶质细胞过度活化,降低TBI小鼠脑组织内炎症因子IL-6、IL-1β、TNF-α的表达,进而抑制损伤后脑组织内过度炎性反应,减少细胞凋亡坏死,改善神经功能。现有研究证实,炎性反应是继发性损伤核心机制,原发性颅脑损伤发生后,患侧组织内迅速激活炎性反应,上调炎性因子,加剧神经元的凋亡、坏死以及血脑屏障的破坏,从而加重神经功能损伤[13]。因此,我们认为柚皮素可以调控炎症因子的表达,抑制过度炎性反应的发生,从而达到修复重建神经组织、改善TBI预后情况的目的。
NGN是一种黄酮类化合物,临床实践中常被用于治疗动脉硬化和冠心病以及降血脂[14-15]。研究表明,NGN可以上调乙醛还原酶、乙醛脱氢酶活性,增加高密度脂蛋白胆固醇与总胆固醇的比例,降低甘油三酯含量,促进胆固醇的转运、抑制高密度脂蛋白向极低密度脂蛋白或低密度脂蛋白转化,从而降低动脉硬化指数,治疗冠心病[10];有动物实验证实,一定剂量的NGN可显著下调血清胆固醇、低密度脂蛋白胆固醇、血浆高密度脂蛋白胆固醇、甘油三酯,同时在一定程度上提高血清高密度脂蛋白胆固醇的含量,最终达到降血脂作用[16]。另有研究显示,蛋白激酶C(Protein kinase C,PKC)-δ是一种炎症调节因子,可以调节促炎基因的表达以及趋化因子的释放,而NGN可通过抑制PKC-δ的表达减轻大鼠脑出血后炎症损伤[17]。鉴于此,我们推测NGN能否在TBI后继发性炎性反应中发挥作用,尤其是其是否可抑制TBI后过度的炎性反应,进而减轻继发性脑损伤,改善患者预后发挥作用。但NGN在TBI的炎性反应中的作用机制仍缺乏研究报道,因此本研究针对于此设计相关实验并尝试解释其作用机制。
炎性反应是诱发继发性脑损伤的重要机制之一,已有研究证实:脑组织损伤后小胶质细胞发生极化,其极化状态可分为经典激活表型(M1型)和交替激活表型(M2型)两种表型[18]。而在损伤早期,小胶质细胞首先极化为M2型小胶质细胞,其可分泌IL-10等抗炎性因子,同时上调神经保护因子含量,修复损伤组织[19]。随病情发展,TBI中后期M2型小胶质细胞向M1型小胶质细胞转化,分泌大量M1型相关细胞因子IL-6、IL-1β、TNF-α,过度IL-6促炎性因子抑制IL-10等抗炎症因子表达诱发炎性反应,导致继发性脑损伤或致使其加重[20]。我们的实验结果显示,在TBI小鼠模型中L-6、IL-1β、TNF-α表达明显上调,NGN给药组中,受损组织的炎症因子的含量明显下降,且下降程度与剂量呈正相关,说明NGN干预可以下调组织中的多种重要炎症因子的表达,进而起到抑制TBI后继发性炎症损伤的作用。既然NGN干预可以下调炎症因子的表达,我们推测是否跟小胶质细胞的数量以及活化状态有关。因此,我们接下来检测了TBI后脑组织小胶质细胞的活化情况。镜下观察结果证实,损伤处周围组织中出现大量活化的小胶质细胞,胞体较Sham组增大且增厚,突起较短,证明了小胶质细胞参与了TBI后的继发性损伤;而NGN干预后,小胶质细胞的活化状态受到了显著抑制,其胞体变小,突起变长,证实NGN可有效地抑制小胶质细胞过度活化。接下来,我们认为NGN可以有效地抑制小胶质细胞的过度活化下调因子的表达,那是否可以降低细胞的凋亡。细胞凋亡率检测结果证实,NGN可以抑制受损脑组织周围细胞的凋亡,缓解继发性脑损伤,最终改善小鼠的神经功能,这从mNSS评分结果可以得出,NGN给药组评分较TBI组明显降低且治疗效果与给药剂量有关。
综上所述,NGN可以通过抑制炎症因子分泌,减轻TBI后过度炎性反应,降低损伤后细胞凋亡率,进而对TBI小鼠起到神经保护的作用,其机制可能与NGN的干预能够抑制小胶质细胞活化有关,但其具体调节机制将是我们下一阶段的研究重点。

