重离子诱变选育高产核黄素枯草芽孢杆菌
胡建华,张兆昆,李永丽,兰辉,刘占英
(1.内蒙古工业大学 化工学院,呼和浩特 010051;2.内蒙古自治区发酵产业节能减排工程技术研究中心,呼和浩特 010051)
核黄素又称维生素B2是一种水溶性维生素,不能直接参与细胞代谢,但其衍生物能够调节机体的多种生理活动,因此具有重要的生理功能,在医药领域应用较为广泛[1-2],此外还可作为色素、营养添加剂等在食品行业被普遍应用。此外由于人体自身不能合成核黄素,需要从外界摄取,所以核黄素的生产具有重要的社会意义。最早的生产方法为化学合成法,后来发展为化学半合成法,当今的生产方法采用微生物发酵法,常用的工程菌种为棉囊阿舒氏酵母和枯草芽孢杆菌[3]。棉囊阿舒氏酵母能够天然积累核黄素,枯黄芽孢杆菌则具有生长期短产能高的优点,湖北广济药业利用枯草芽孢杆菌生产核黄素其产量可达26.5 g/L[4],文献报道的菌株也多以枯草芽孢杆菌为主[5],高产菌株的选育及改造仍是研究的热点之一。
重离子束是通过剥离或部分剥离原子序数>2的原子核外围电子形成具有能量的带电离子束,照射生物细胞进行诱变,是一种有别于其他辐射源的诱变育种方式,具有突变率高、突变谱广、诱变效果好、不易回复突变等特点[6-7]。目前世界上仅有几个国家有重离子加速器装置,我国的设备在中国科学院近代物理研究所,重离子辐照诱变技术在植物及微生物育种中有广泛应用且有较好的发展前景[8]。杨阳等[9]利用12C6+离子束辐照诱变丙酮丁醇梭菌CICC 8012,筛选获得高产且高抗丁醇胁迫的丙酮丁醇梭菌突变株,产量较出发菌株提高33%。本课题组筛选得到复合酶活力最高的菌株B.subtilisKC-1,其滤纸酶、内切葡聚糖酶、β-葡萄糖苷酶、外切葡聚糖酶、蛋白酶及α-淀粉酶等活力均有较高增加[10],崔金娜[11]采用二次重离子诱变B.subtilisKC-1,其α-淀粉酶活力提高42.34%。本文通过重离子诱变选育高产核黄素的枯草芽孢杆菌,为进一步探讨重离子的诱变机理及调控高产核黄素的机制奠定基础。
1 材料和方法
1.1 材料
菌株:产核黄素的枯草芽孢杆菌B.subtilisC0,本实验室保存。
LB培养基(g/L):蛋白胨10.0,酵母提取粉5.0,氯化钠10.0,pH自然,固体培养基加1.8%琼脂。
Spizizen基本培养基(g/L):葡萄糖8.0,(NH4)2SO40.2,KH2PO41.31,Na2HPO40.6,MgSO4·7H2O 0.2,柠檬酸三钠二水 0.25,谷氨酰胺 2.0,色氨酸 0.05,VB1溶液0.01,1 000×微量元素溶液 1 mL;1% VB1溶液:0.1 g维生素B1溶解于10 mL去离子水中,无菌无机滤膜过滤除菌[12]。
酵母粉培养基(g/L):酵母粉20.0,Na2HPO46.8,KH2PO43.0,MgSO40.5去离子水溶解混匀调至所需pH灭菌;配制500 g/L D-葡萄糖糖溶液,115 ℃灭菌30 min;配制200 g/L尿素溶液,过滤除菌;培养基使用前添加尿素最终浓度为6 g/L和D-葡萄糖最终浓度为60 g/L及补充适量无菌水至体积为1 L。
发酵罐种子培养基(g/L):酵母浸粉1.0,酵母粉9.0,Na2HPO40.5,KH2PO40.5,MgSO40.5,调至所需pH值灭菌,使用前加入尿素(终浓度为2 g/L)和D-葡萄糖(终浓度为10 g/L)。
发酵罐培养基(g/L):酵母浸粉2.0,酵母粉18.0,Na2HPO46.8,KH2PO43.0,MgSO40.5,调至所需pH值,培养基装入发酵罐中121 ℃灭菌30 min,使用前加入尿素(终浓度为6 g/L)和D-葡萄糖(终浓度为60 g/L)[13]。
上述pH值为6.2~8.2,灭菌条件没有特殊说明均为121 ℃ 20 min。所用试剂均为分析纯。
1.2 方法
1.2.1 诱变处理
在中国科学院近代物理研究所兰州重离子加速器国家重点实验室完成重离子诱变处理。在辐照皿内放入2 mL对数期的枯草芽孢杆菌液,用能量为80 MeV/u的12C6+离子束以140、180及220 Gy的辐照剂量进行处理,束流速度为30 Gy/min。
对第一次重离子诱变选育出的高产核黄素的菌株进行第二次重离子诱变,选择180 Gy及220 Gy的辐照剂量,束流速度为30 Gy/min。
1.2.2 核黄素高产菌株的选育及培养条件的优化
(1)致死率计算。将原始菌株培养液进行梯度稀释后取100 μL涂布于LB平板培养基上,对菌落个数进行计数,经实验后选择10-5为最佳稀释浓度。不同辐照剂量后的菌悬液稀释至10-5,取100 μL涂布到LB平板培养基上(每个样品3个平行样),37 ℃培养48 h,致死率计算公式如下:

(2)选择性培养基平板初筛。将原始菌株的菌悬液经适度稀释,取100 μL涂布在含有 20、25、30、35、40、45和50 mg/L 8-氮鸟嘌呤(8-NA)的Spizizen基本盐培养基平板上,37 ℃培养48~72 h,以不含筛选拮抗物平板上菌体的生长状况为对照并记录菌体个数,观察并记录未长出菌落的筛选拮抗物的最低浓度,即为该筛选拮抗物的 MIC[12]。将重离子诱变后的菌液稀释至10-3,取稀释液涂布在抗性平板上,37 ℃培养至长出菌落为止,根据菌落周围的黄色痕迹的大小深浅,划线分离后保存单菌落到斜面培养基上得初筛菌种。
(3)摇瓶复筛。取一环初筛菌株及原始菌株接于8 mL pH 7.2酵母粉培养基的试管中,37 ℃、180 r/min 培养72 h后检测核黄素的含量。将初筛得到的菌株及原始菌株接到50 mL pH 7.2的酵母粉培养基中(250 mL三角瓶),起始OD600均调为0.06,37 ℃、180 r/min培养,每24 h测定核黄素含量及生长曲线。
(4)二次重离子诱变选育。对二次重离子诱变的菌株重复第一次筛选的过程,选育出新的核黄素高产菌株。
(5)培养条件优化。选择核黄素产量最高的菌株进行研究。取1 mL种子液接入到50 mL pH 7.7的酵母粉培养基中,不同温度(34 ℃、37 ℃、40 ℃)下,220 r/min培养;取1 mL种子液接入到50 mL不同pH值(6.7、7.2、7.7、8.2)的酵母粉培养基中,37 ℃、220 r/min培养;取1 mL种子液接入到50 mL pH 7.7的酵母粉培养基中,37 ℃在不同转速下(180、220、260 r/min)培养。每个样品均为3个平行样。
1.2.3 发酵罐放大实验
300 mL pH 7.7的种子培养基接入15 mL的菌液,37 ℃ 220 r/min培养14 h,接入到3 L pH 7.7的发酵培养基中,在5 L的双联平行发酵罐(上海迪毕尔生物)中发酵,37 ℃,控制pH 7.7,通气量为1~3 vvm,转速在200~800 r/min,溶氧浓度(DO)分别控制为20%、30%及40%,每个条件重复3批。
1.2.4 遗传稳定性测试
将获得的高产菌株在斜面培养基上连续传代6次,每隔2代接入发酵培养基中测定核黄素产量。
1.2.5 测试分析方法
(1)生物量测定方法。以空白培养基为参比溶液,发酵液静置15 min后取上清液测定OD600的吸光度值,吸光度值为0.3~0.8,如超出该吸光度值,用空白培养基适当稀释后测定值在该线性范围内为宜[13]。
(2)核黄素测定方法。尽量摇匀摇瓶或发酵罐中的核黄素结晶,取100 μL发酵液加入900 μL 0.5 mol/L NaOH溶液后混匀,将稀释后的待测溶液与乙酸-乙酸钠溶液等体积混匀,13 800 r/min离心2 min,取上清液,以乙酸-乙酸钠缓冲液作为参比溶液,OD444应在0.3~0.8范围之内,如果超出此范围,则继续用乙酸-乙酸钠缓冲液进行稀释,直到吸光度值落入线性区间。计算公式:核黄素浓度(mg/L) =稀释倍数×(吸光度-0.005 7)/0.032 1[13]。
2 结果与分析
2.1 重离子诱变及平板初筛结果
不同辐照剂量对枯草杆菌的致死率如图1所示。通过致死率分析可知,重离子辐照诱变产核黄素枯草芽孢杆菌的作用较明显,随着辐射剂量的增加,致死率也在增加。在60~140 Gy的辐照剂量范围时,致死率曲线会呈现类似“马鞍形”的变化趋势[10],这种存活效应即低剂量辐射超敏感效应及增强的辐射抗性[14],本实验采取较高的辐射剂量,未出现此种效应。
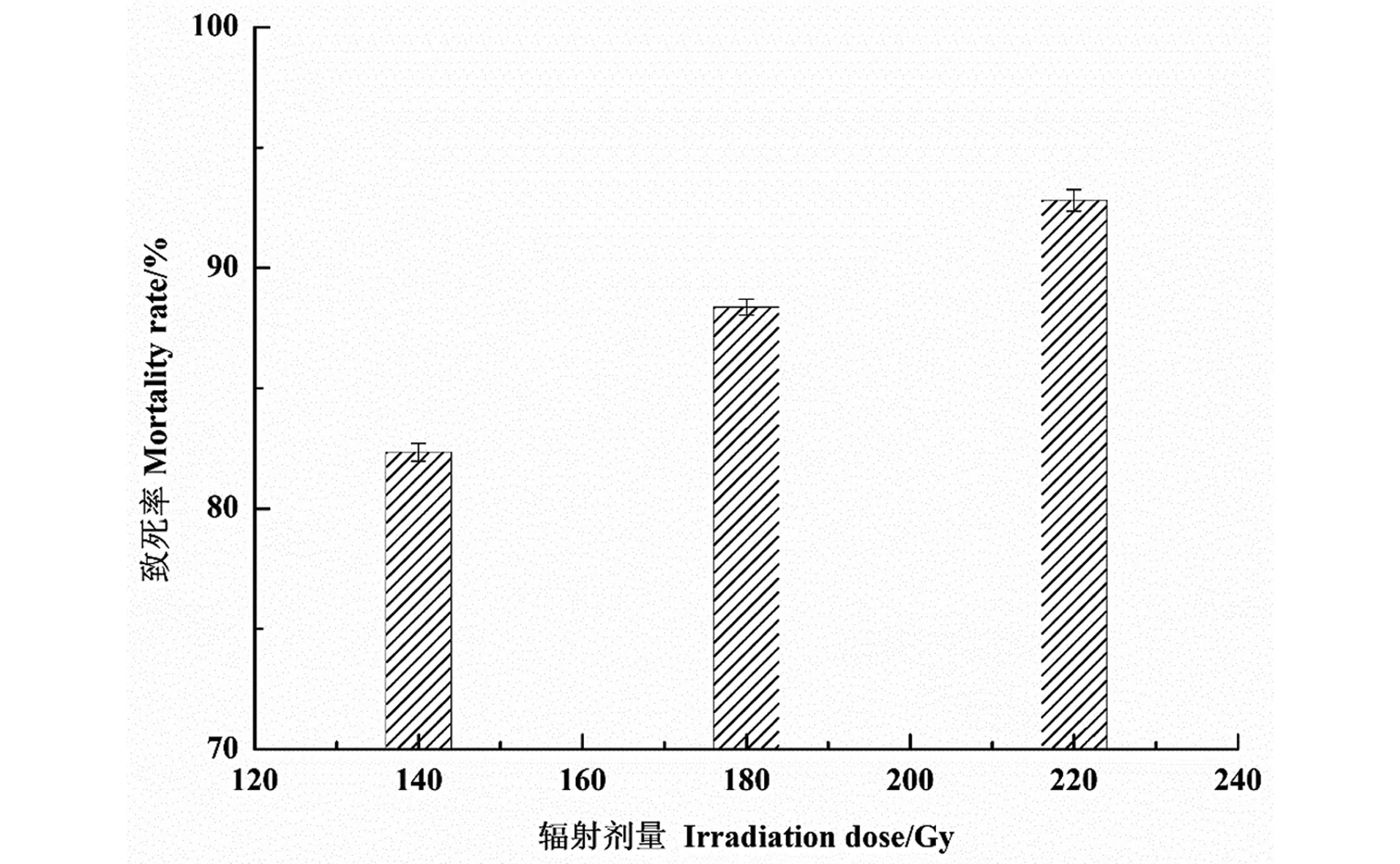
图1 辐照剂量对菌株致死率的影响Figure 1 Effection of irradiation dose on mortality rate of B. subtilis
8-NA是核黄素合成途径中核黄素的前体物质GTP的结构类似物,能够阻断磷酸核糖焦磷酸合成酶对GTP的反馈抑制,从而积累GTP进一步促进核黄素的高效生成。30 mg/L的8-氮鸟嘌呤是该菌株的MIC。郭佳欣等[12]的研究结果是40 mg/L MIC,这表明不同的菌株其MIC值也有所差别。将诱变后的菌液稀释涂布在此最低MIC的筛选平板上,图2为平板上长出的菌落,能够观察到诱变菌株的菌落没有明显变化,但诱变菌株的菌落周围有明显的橙黄色,说明核黄素产量较高,通过加入拮抗物能够明显看出菌株的核黄素产量,从而降低筛选的工作量,是选育高产菌株的有效手段之一。
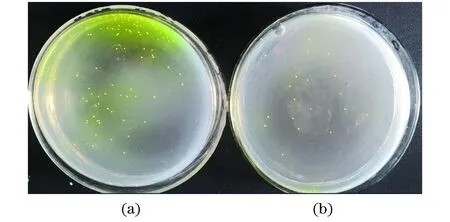
(a)诱变菌株;(b)原始菌株。图2 菌落形态Figure 2 The colony morphology of B. subtilis
2.2 摇瓶复筛
挑选菌落周围颜色较深,菌苔较厚的菌落进行保存,由于平板上高产菌株的核黄素染色将相邻的菌落蕴染成一片,无法通过单菌落周围颜色的深浅准确判断高产菌株,所以将初步选择的60个单菌落接入试管培养后测定核黄素产量进一步筛选高产菌株,结果表明有4株菌核黄素产量明显高于原始菌株。将此4株菌及原始菌株分别接入摇瓶进一步验证,验证结果如图3所示。由图3可以看出,原始菌及诱变后的菌生长规律相似,在72 h到达峰值,而核黄素是生长相关型,产量随着菌株的生长而增加,筛选的4株诱变菌比原始菌株要高,提高最明显的是诱变菌株B13,产量为(401.8±9.2)mg/L,比原始菌株(339.1±10.5)mg/L提高18.5%,由此可见,重离子辐射诱变具有较好的诱变特性。
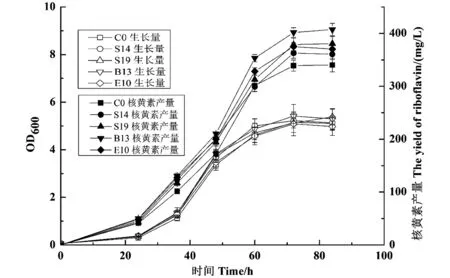
图3 不同菌株在72 h的核黄素产量Figure 3 The yield of riboflavin in 72 h of different strains
2.3 二次重离子诱变及选育高产菌株
选择B.subtilisB13作为新的出发菌株对其进行二次重离子诱变,从平板上挑取边缘光滑周围颜色深的菌落80个,经试管及摇瓶发酵筛选,获得3株核黄素产量较高的菌株,72 h产量如图4所示。菌株BII7核黄素产量(818.8±17.3)mg/L,比一次诱变菌株B3的产量提高77.7%,可作为新的研究菌株,其余两株菌分别提高55.4%、37.8%,表明二次重离子诱变仍具有较好的效果,本课题组对产淀粉酶的枯草芽孢杆菌进行重离子二次诱变,也获得高酶活菌株[11]。
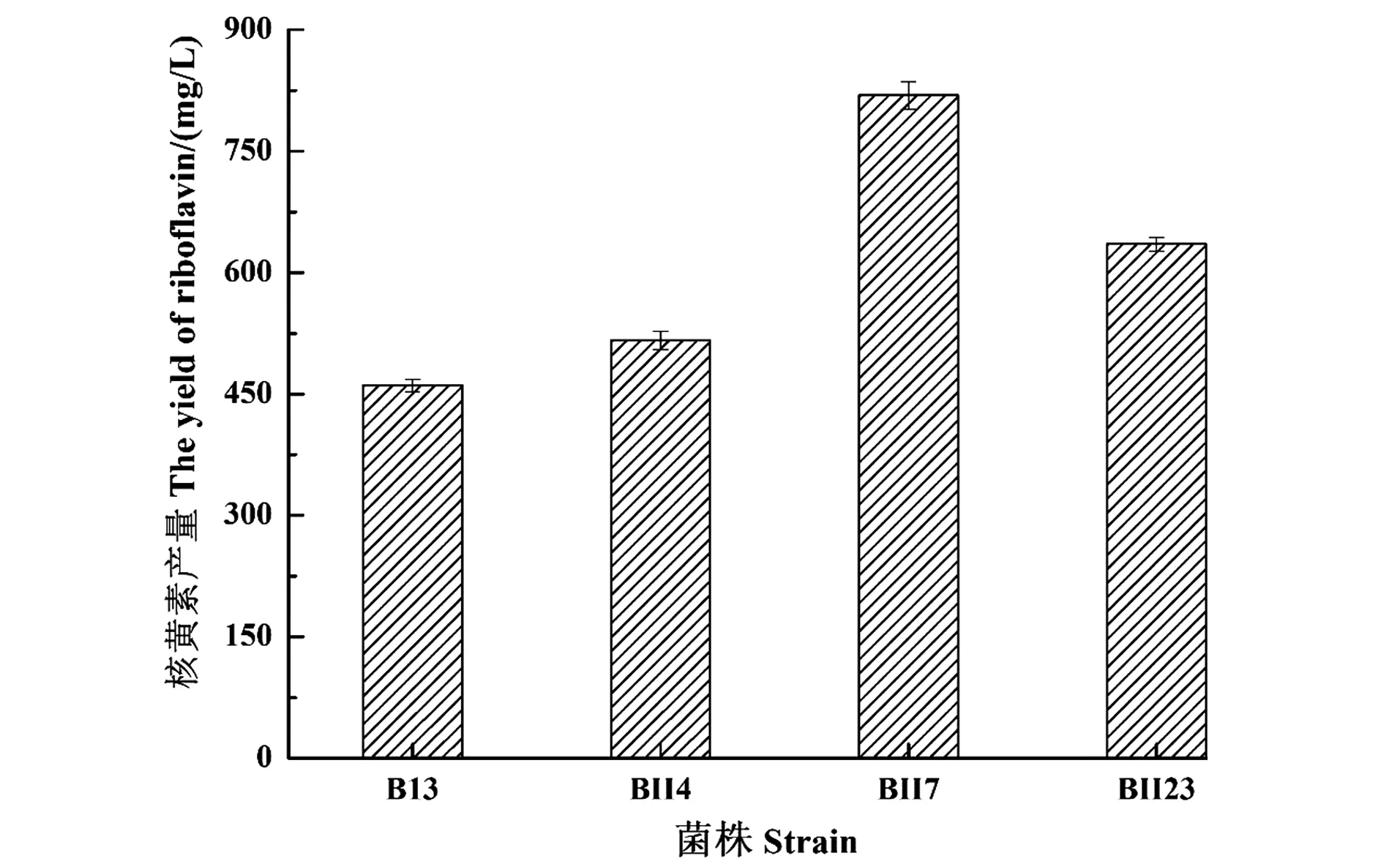
图4 二次诱变菌株的核黄素产量Figure 4 The yield of riboflavin of secondary mutagenic strains
2.4 培养条件的优化
一次重离子选育的高产菌株B13也进行过培养条件的优化(数据略),优化后的最佳条件为37 ℃、pH 7.7及220 r/min,优化后的核黄素产量从(401.8±9.2)mg/L提高到(460.8±7.7)mg/L,对二次诱变菌株BII7再次进行培养条件的优化,优化结果图5所示。图5(a)表明高产菌株的最适发酵温度没有发生变化,仍然为37 ℃;图5(b)为37 ℃时在不同的pH值条件下诱变菌株的核黄素产量,在pH值为7.2~7.7时,酶活较高,弱碱性的条件有利于核黄素的生产;图5(c)为37 ℃、pH 7.7时在不同转速下的核黄素产量,220 r/min以上核黄素产量较高。二次诱变菌株同一次诱变菌株最适发酵条件一致,没有明显变化。
2.5 5 L发酵罐放大培养
控制不同溶氧条件下的5 L发酵罐培养结果如图6所示,诱变菌株B.subtilisBII7的发酵周期比在摇瓶中提前12 h即在60 h时达到核黄素最高生产时间,在发酵罐中,核黄素产量也有较大提高。溶氧水平明显对核黄素产量有较大影响,溶氧控制40%时60 h核黄素产量达到1 385.3 mg/L,但是与溶氧浓度30%时没有显著差异,因此维持30%以上的溶氧浓度,核黄素产量不受影响,比摇瓶发酵提高69.2%,表明此诱变菌株具有较好的发酵罐适应能力。经过两次重离子诱变后,核黄素的产量有了较大的提高,推测菌株的代谢途径或者一些关键酶的合成发生了变化,具有深入研究的意义。
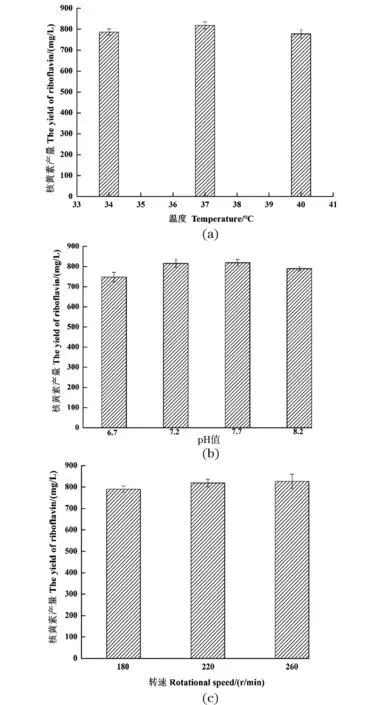
(a)温度;(b)pH值;(c)转速。图5 培养条件的优化Figure 5 Optimization of culture conditions
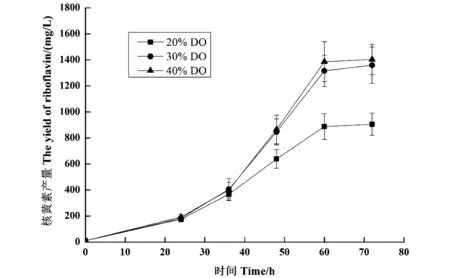
图6 5 L发酵罐扩培Figure 6 The riboflavin fermentation profile in 5 L fermenter
2.6 诱变菌株的遗传稳定性
工业生产需要生产菌株具备良好的遗传稳定性,诱变菌株的遗传稳定性如图7所示,由图7可以看出,诱变菌株传代6次后依然具有较好的遗传稳定性,因此具有工业应用的潜力。
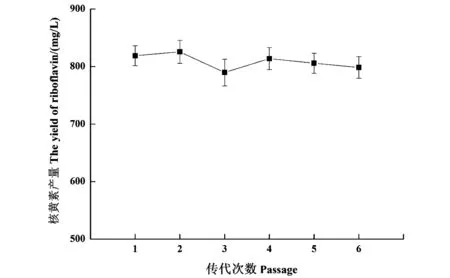
图7 枯草芽孢杆菌BII7遗传稳定性Figure 7 Genetic stability of B. subtilis BII7
3 结论与展望
重离子辐射具有较好的诱变特性,产核黄素的枯草杆菌经二次诱变选育及培养条件优化后,在发酵罐中有较高的产量,最高产量1 385.3 mg/L,且具有稳定的遗传特性,但是菌株的发酵培养基可用较低成本或其他物质代替,张续等[15]以木糖为主的木糖/蔗糖共代谢发酵枯草芽孢杆菌产核黄素,产量具有显著提高效应。还有学者应用不同的方法进行诱变选育,祝金山等[4]用常压室温等离子体诱变选育核黄素,获得枯草杆菌高产突变株产量达9 447 mg/L,比原始菌株提高16.8%,而郭佳欣等[12]在用等离子体诱变后筛选得到的高产菌株比原始菌株产量提高83.59%,又将核黄素操纵子表达质粒pMX45 转入诱变菌株,得到稳定性的高产菌株产量高达(4 467.08±99.47)mg/L,比原始菌株提高140.94%。张续等[15]采用ribA-ribH基因共表达的方法获得高产菌株核黄素产量达到 3.6 g/L。此外诱变菌株的选育方法也可大幅提高效率,郭佳欣等[12]采用第一轮以 8-氮鸟嘌呤为筛选拮抗物进行筛选,第二轮以寡霉素为筛选拮抗物进行筛选得到高产诱变菌株。付首颖等[16]采用工业菌种选育与高通量筛选技术相结合,对流式细胞分选、液滴微流控分选和96孔板筛选在核黄素工业菌株筛选中的应用进行研究,并对96孔板筛选方法进行了优化,得到高产菌株产量为2.53 g/L,比原始菌提高了15%,这些都是提高核黄素产量的研究方向。
重离子辐射诱变的机理也是值得深入探讨的内容,辐照过程中重离子能致细胞表面穿孔,进而引起DNA损伤和变异[17],还会引起DNA断裂,片段的数量随辐射剂增加而增多[18]。不同类型的重离子诱变,引发如倒置、易位、缺失、重排、点突变等[19]。高质量的重离子辐射更可能引起基因缺失的现象[20]。本课题组在前期的研究中使用重离子诱变产α-淀粉酶枯草杆菌获得高产菌株,发现淀粉酶基因表达量提高了1.64倍,诱变前后的基因组序列分析发现有63处突变位点[11]。因此对重离子诱变的高产核黄素菌株进行机理研究,有助于对核黄素代谢途径进行改造,从而获得更高产量的菌株。
致谢:感谢中国科学院近代物理研究所对本研究的支持和帮助。

