安徽省翘嘴鲌野生群体的遗传多样性分析
胡玉婷,侯冠军
(安徽省农业科学院水产研究所 水产增养殖安徽省重点实验室,合肥 230031)
翘嘴鲌(Culteralburnus)俗称翘嘴、鲌鱼、大白鱼等,属鲤科(Cyprinidae)鲌亚科(Culterinae)鲌属(Culter),是鲌亚科中体型最大的鱼类,广泛分布于除青藏高原以外的中国各大水系[1],具有较高的经济价值。然而近年来,翘嘴鲌野生资源因环境污染、过度捕捞等遭到严重破坏,性成熟个体呈小型化、低龄化趋势[2-5]。由于有意的增殖放流或无意的养殖逃逸事件不断发生,许多地区翘嘴鲌野生资源基因库受到了严重干扰[6]。黄小彧[5]基于线粒体控制区的研究发现,长江水系14个翘嘴鲌群体没有形成明显的谱系结构和地理结构。另外,随着翘嘴鲌繁殖与养殖业的无序发展,盲目繁育、引种、杂交及累代养殖,导致养殖群体也出现生长慢、小型化、性成熟早等种质衰退或混杂现象[7-8]。雷双永[8]利用微卫星(SSR)标记对翘嘴鲌4个育种群体(黑龙江水系群体、淮河水系群体、长江上游和下游水系群体)的遗传差异进行了分析,结果显示4个育种群体均存在杂合子缺失现象,群体内近亲繁育程度较高,群体遗传多样性水平较低。优良的翘嘴鲌种质是其繁养殖业持续健康发展的物质基础,野生亲本的管理不当可能导致近亲繁殖的增加和遗传多样性水平下降,从而影响种质资源的保护效果与进一步利用。目前国内关于翘嘴鲌微卫星标记的开发及利用微卫星标记研究群体遗传变异的研究已有一些报道[8-11],但尚未见对来自长江、淮河、新安江翘嘴鲌群体比较研究的报道。为了揭示翘嘴鲌野生群体的遗传背景及遗传变异现状,研究采用10对微卫星标记研究安徽省翘嘴鲌4个野外采样群体的遗传多样性与遗传分化,对其种质资源状况进行科学的遗传评估,可为翘嘴鲌的种质资源保护和利用工作提供参考。
1 材料与方法
1.1 材料
2020年4月—8月,分别在长江水系的武昌湖(WCH)、淮河干流凤台峡山口(HH)、新安江休宁县溪口镇(XAJ)和巢湖(CH)采集翘嘴鲌样品,样品数分别为30尾。剪取新鲜样品鱼肌肉保存于95%乙醇中用于后续实验。
1.2 方法
1.2.1 基因组DNA的提取、PCR 扩增及测序
使用试剂盒(DB324,北京天根)按照指定的步骤提取基因组DNA,经琼脂糖凝胶电泳检测合格后低温备存。参考相关文献[9-11],筛选10对扩增条带清晰、多态性高且片段长度适宜的微卫星引物,见表1。委托上海生工生物公司合成含荧光标记(HEX和6-FAM)的引物。
PCR扩增总体系20 μL:10 μL的2×TaqPCR MasterMix(含buffer,TaqDNA Polymerase,Mg2+,dNTPs),上下游引物(10 μmol/L)各1 μL,模板DNA(约50 ng)1 μL,7 μL的ddH2O。PCR扩增程序:94℃预变性5 min;94℃变性30 s,53℃~63℃(表1)退火30 s,72℃延伸40 s,32个循环;72℃再延伸10 min。扩增产物经ABI 3730XL自动测序仪检测后由软件Genemarker 2.2读取等位基因大小。

表1 翘嘴鲌微卫星引物特征Table 1 Characteristics of microsatellite primers of C. alburnus
1.2.2 数据分析
使用软件CONVERT 1.31[12]把等位基因数据转换为后续软件分析所需的各种格式。PopGene 1.32软件[13]统计各微卫星位点和群体的等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、群体间Nei’s遗传距离(Da)和Hardy-Weinberg平衡检验,Hardy-Weinberg平衡检验偏离指数的计算公式为D=(Ho-He)/He。软件Cervus 3.0[14]计算多态信息含量(PIC)。基于软件MEGA X[15]中的Nei’s遗传距离构建群体UPGMA聚类树。软件Arlequin3.5[16]用于检测群体遗传分化指数(Fst)和分子方差分析(AMOVA),群体间基因流(Nm)计算公式为Nm=0.25(1-Fst)/Fst。利用Structure 2.3.4[17]软件进行遗传聚类分析并使用CLUMPP1.1.2软件[18]对结果比对和整合,确定最佳分组K值,再用DISTRUCT程序[19]对聚类结果绘图,最后使用Adobe Illustrator CS 6打开绘图数据可编辑保存为各种图片格式。
2 结果与分析
2.1 微卫星位点多态性
10对微卫星位点在翘嘴鲌群体的遗传多样性参数数值见表2,说明所选10对微卫星适宜于4个翘嘴鲌群体的遗传研究,以多态信息含量PIC为例,除位点EST13(0.469)外,其他微卫星位点数值范围为0.546~0.947,平均值0.781,均大于0.5的微卫星高度遗传多样性标准[20]。
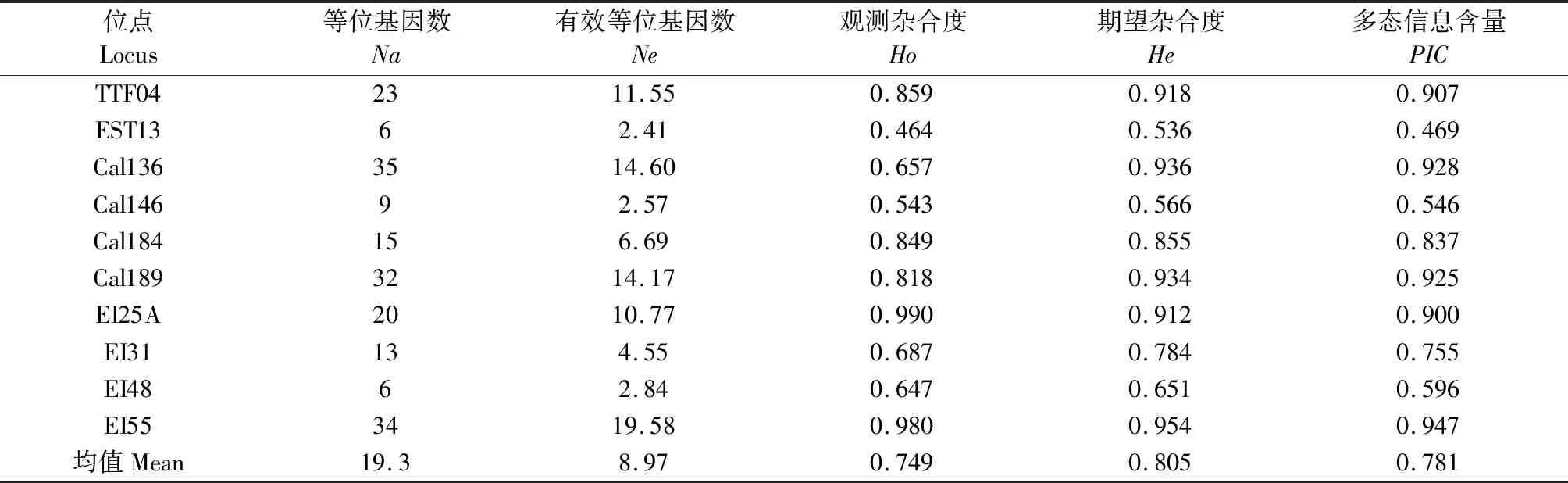
表2 翘嘴鲌10对微卫星位点遗传多样性Table 2 Genetic diversity parameters among 10 loci of C. alburnus
2.2 不同采样群体翘嘴鲌遗传多样性
表3显示:各采样群体平均等位基因数(Na)为10.4~12.2,其中巢湖(CH)群体最少,武昌湖(WCH)群体最多;平均有效等位基因数(Ne)为5.9~6.9,其中淮河(HH)群体最少,巢湖(CH)群体最多;3个群体的观测杂合度小于期望杂合度,说明群体内存在杂合子缺失现象;而新安江(XAJ)群体观测杂合度大于期望杂合度,说明存在杂合子过剩现象;所有群体的平均多态信息含量(PIC)较高,均大于0.5。
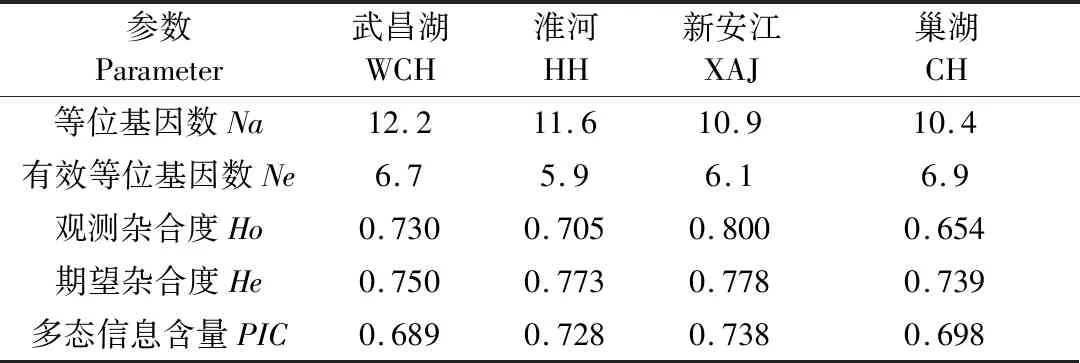
表3 翘嘴鲌的群体遗传多样性参数Table 3 Genetic diversity parameters of C. alburnus populations
2.3 不同采样群体翘嘴鲌遗传结构
2.3.1 遗传距离、遗传分化指数及基因流
表4显示,群体间遗传距离为0.147~0.290,其中新安江和巢湖群体遗传距离最小,新安江和淮河群体遗传距离最大。群体间遗传分化指数(Fst)普遍较低,除两对群体间略大于0.05外,其余群体间均小于0.05,显示了较低的遗传分化程度;同时所有群体间的基因流Nm均大于4。
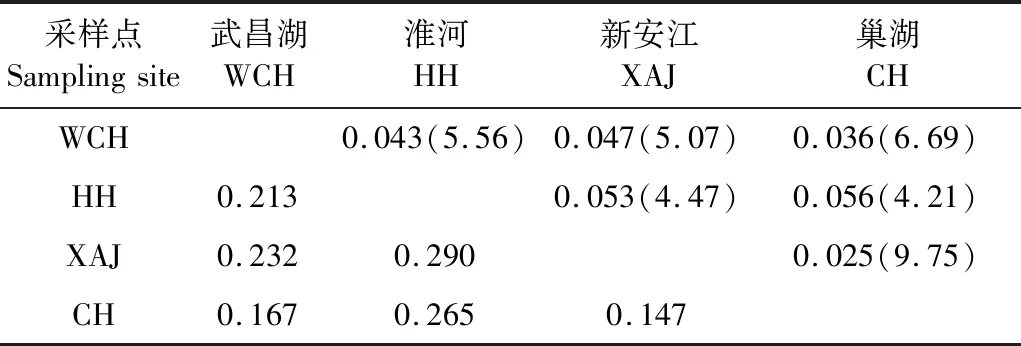
表4 翘嘴鲌群体间遗传距离(左下方)、遗传分化指数Fst(右上方)及基因流Nm (括号中)Table 4 Pairwise genetic distances (bottom left),F-statistics (top right) and gene flow values among C. alburnus populations
2.3.2 分子变异分析
AMOVA结果(表5)显示,仅4.29%的遗传变异来自采样群体间,而采样群体内的遗传变异高达95.71%。基于群体间Nei’s遗传距离构建的UPGMA聚类树(图1)显示:新安江群体与长江水系的巢湖群体聚为一支,再依次与武昌湖群体、淮河群体聚集。
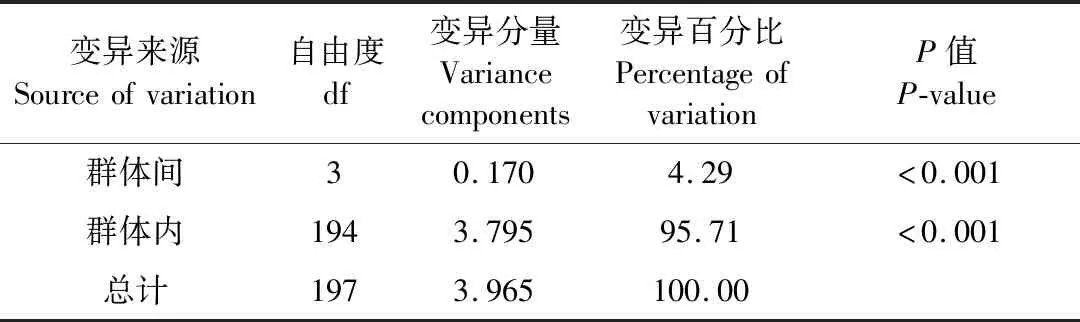
表5 翘嘴鲌群体遗传结构的分子变异(AMOVA)分析Table 5 AMOVA analysis of genetic structure of C.alburnus
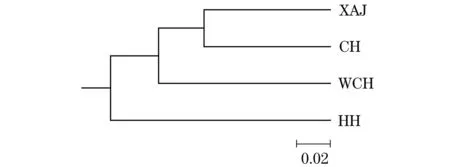
图1 翘嘴鲌群体间UPGMA聚类树Figure 1 UPGMA clustering tree of four populations of C. alburnus based on genetic distance
2.3.3 Structure软件遗传聚类分析
遗传聚类分析结果(图2)显示,最佳遗传聚类分组为K=4,但这些遗传组与4个采样点不相对应,不同采样群体的样本间遗传相似个体交叉较多。比较而言,新安江和巢湖群体遗传相似个体较多,淮河群体较为独立,武昌湖群体中遗传组成较为复杂。
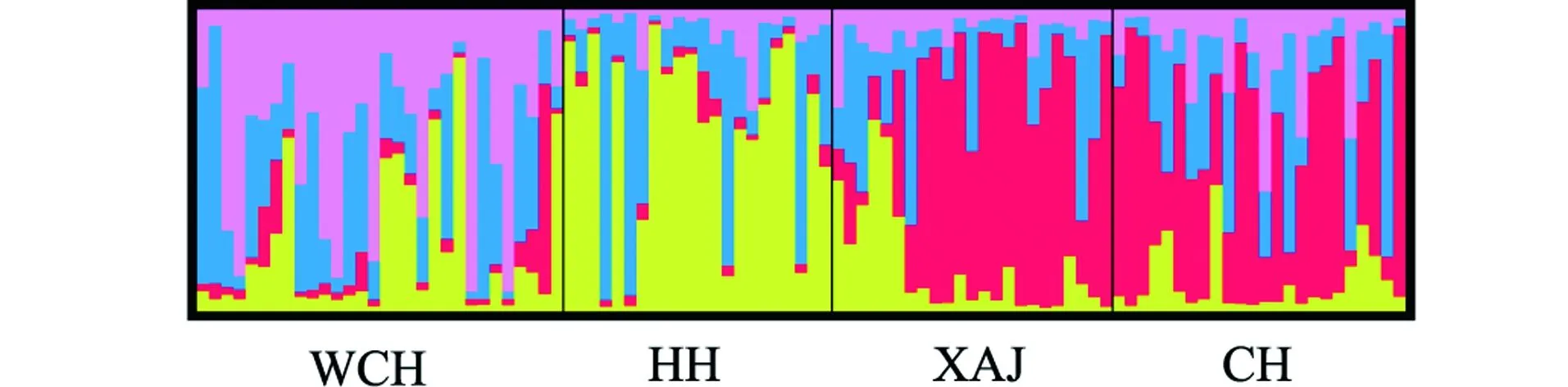
图2 基于微卫星数据的翘嘴鲌群体遗传结构图Figure 2 Population genetic structure of C. alburnus sampled based on microsatellite analysis
2.4 Hardy-Weinberg平衡分析
表6表明,显著偏离Hardy-Weinberg平衡(P<0.05)的12个群体与位点的组合中,10个存在杂合子缺失现象(D<0),2个存在杂合子过剩现象(D>0)。
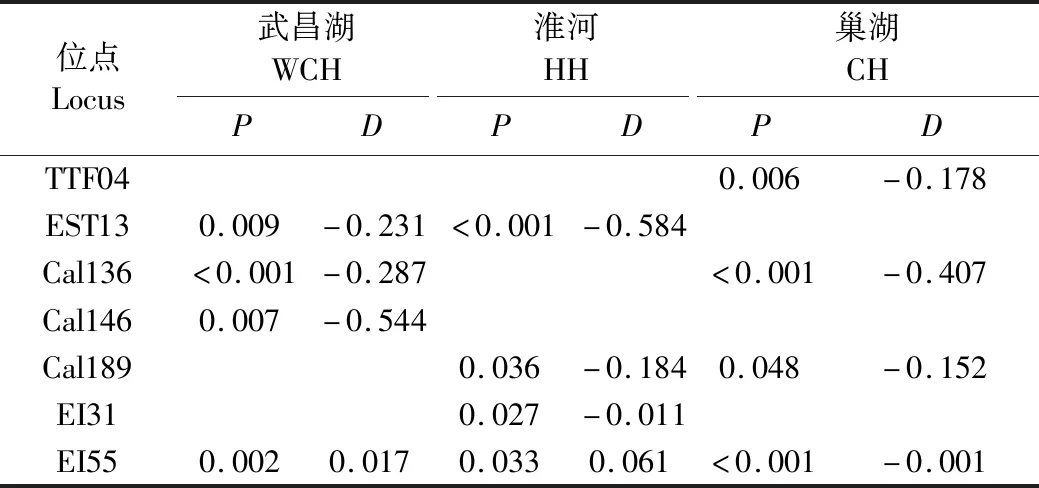
表6 Hardy-Weinberg平衡的卡方检验概率值(P)与遗传偏离指数(D)Table 6 Hardy-Weinberg equilibrium Chi-square test probability value (P) and genetic deviation index(D)
3 讨论
3.1 翘嘴鲌遗传多样性
遗传多样性是生物多样性的重要组成部分,是物种或群体长期进化的产物,也是其生存适应和发展进化的前提,其遗传多样性越高,适应环境变化的能力越强。因此关于遗传多样性的研究,不仅可以揭示物种或群体过去的进化历程,也能进一步分析其进化潜力和未来命运。
采用微卫星标记检测遗传多样性时,一般用等位基因数、杂合度和多态信息含量等遗传参数衡量大小。通常每个微卫星位点至少有4个等位基因才能较好地用于遗传多样性评估;与观测杂合度(Ho)相比,期望杂合度(He)不易受到样本量影响,能更好地反映遗传多样性水平[20-22];当多态信息含量PIC>0.5时一般认为其为高度多样性[23]。研究所用10对微卫星的等位基因数(Na)范围为6~35、He为0.536~0.954,PIC中除位点EST13(0.469)外,其他均大于0.5,说明这些微卫星位点能有效评估翘嘴鲌群体的遗传多样性。4个采样点翘嘴鲌样本的Na、Ne、Ho、He、PIC分别介于10.4~12.2、5.9~6.9、0.654~0.800、0.739~0.778和0.689~0.738,明显高于雷双永[8]基于8对微卫星(SSR)标记对翘嘴鲌4个育种群体(黑龙江水系、淮河水系、长江上游和下游水系群体)的多样性参数值,其4个群体的等位基因数(Na:3.8~5.5) 和有效等位基因数(Ne:2.6~3.7)均较低,观测杂合度(Ho)(0.265 0~0.317 5)也明显低于其期望杂合度(He)。而其他基于线粒体基因序列的相关研究[4-6]也表明,翘嘴鲌野生群体遗传多样性多数处于中低程度。尽管存在不同分子标记的检测差异,该研究中的翘嘴鲌群体遗传多样性依然较高,尚具有较大选育价值。
3.2 翘嘴鲌群体遗传结构
遗传分化指数Fst是目前广泛评价群体间遗传分化程度的重要指标,当Fst<0.05时,群体间遗传分化程度较低;当0.05
黄小彧[5]基于线粒体控制区的研究发现,长江水系14个翘嘴鲌群体没有形成明显的谱系结构和地理结构;伊西庆[6]基于线粒体ND2基因对中国东部6个主要湖泊的研究结果显示:洞庭湖与洪泽湖、巢湖群体间不存在明显遗传分化。武昌湖位于长江中下游的洞庭湖和巢湖之间,洪泽湖位于淮河下游,表明新安江翘嘴鲌群体可能受到巢湖翘嘴鲌引种的影响,导致其与长江群体遗传差异不显著。
3.3 Hardy-Weinberg平衡偏离原因分析
武昌湖、巢湖和淮河干流3个群体的观测杂合度小于期望杂合度,说明这些群体存在明显杂合子缺失现象,而新安江(XAJ)群体观测杂合度大于期望杂合度,说明该群体存在杂合子过剩现象。导致野生群体杂合子缺失的因素一般是与自然选择、种群内交、无效等位基因和稀有等位基因丢失等有关[25],如近亲繁殖、环境胁迫、过度捕捞等因素;而导致野生群体杂合子过剩的因素一般出现在研究对象与其他群体间基因交流频繁,如人为引进携带不同等位基因的外来个体。翘嘴鲌武昌湖和淮河两个群体同时存在杂合子缺失或过剩的现象,表明它们近期可能既经历过如过度捕捞等因素导致的多样性下降问题,也经历了外来引种的过程,且以前者为主;而巢湖群体则主要经历了过度捕捞等导致的杂合子缺失问题,而新安江群体则受到了巢湖群体的引种影响。国内其他地区翘嘴鲌研究结果[4]显示:翘嘴鲌历史上曾经历了不少地区的相互引种,导致一些野生群体存在种质混杂现象,而有意无意地人工引种,都势必会增加群体间的基因流动,从而减小引入群体和土著群体之间的遗传差异,导致地理距离较远的群体遗传进化关系较近。
综上,安徽省4个翘嘴鲌采样群体(巢湖、武昌湖、新安江和淮河干流)的遗传多样性高,群体间遗传分化不显著,但群体间可能存在种质混杂。

