干扰TLR4对LPS感染鸡HD11细胞免疫炎症的影响
李 欢,孙红艳,于智勇,孙长花,2
(1.扬州市职业大学 生物与化工工程学院,扬州 225012;2.扬州大学 动物科学与技术学院,扬州225009;3.中国教育部国际农业与农产品安全研究联合实验室,扬州 225009)
Toll样受体(toll-like receptor,TLR)是存在于免疫细胞(B细胞、巨噬细胞或树突状细胞等)膜上或细胞内的信号传递受体,它们通过识别细胞外病原体相关分子结构而发挥非常重要的作用[1]。例如,树突状细胞可通过Toll样受体识别病原体结构,激活适应性免疫,确定T细胞介导的免疫类型、特异性和持续时间[2]。巨噬细胞表面受体TLR可识别结核分枝杆菌的结构以激活胞内NF-κB等信号转导,诱导特异性基因表达,促进天然和特异性免疫炎症反应[3-4]。目前,在鸡中已鉴定出10个Toll样受体家族成员[5]:其中TLR2A、TLR2B、TLR3、TLR4、TLR5和TLR7与哺乳动物同源;TLR21与鱼类和两栖动物相似;而TLR1LA、TLR1LB和TLR15是鸡中特有的Toll样受体。
家禽生产中常见疾病(禽大肠杆菌病、禽白痢、禽霍乱等)均由革兰氏阴性细菌引起,发病率高达30%~60%,死亡率为10%~30%,每年造成数亿元损失[6]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌致病关键因子,可激活炎性细胞表达,产生免疫炎症反应。研究表明LPS感染雏鸡后,肝脏中促炎因子基因TNF-α、IL1β和抗炎因子基因TGF-β表达水平均发生显著性变化[7]。目前,已发现Toll样受体家族成员TLR4是识别革兰氏阴性菌LPS的主要受体[8]。在人和鼠中,TLR4既可通过髓样分化因子88(MyD88)依赖性信号转导通路参与免疫反应,产生炎性因子IL-6、IL-8和IL1β,又能通过MyD88非依赖性信号转导通路产生IFN-β。随后,Richze团队[9]发现LPS感染小鼠时TLR4可通过MyD88依赖和非依赖信号通路产生IFN-α细胞因子进行免疫。但与哺乳动物不同,LPS感染仅能激活鸡中TLR4的MyD88依赖性信号通路,产生炎性因子IL-1β和IL-8;不能激活MyD88非依赖性通路,不能产生IFN-β[10]。这说明鸡体内缺乏功能性LPS-特异的TLR相关分子-TLR相关干扰素活化子(TRAM-TRIF)信号通路,只能依靠MyD88依赖性信号通路在免疫炎症反应中发挥作用。
鸡TLR4位于17号染色体,包含3个外显子,CDS区长度为2 532 bp,编码843个氨基酸,在骨髓、胸腺、脾脏、法氏囊、卵巢、肝脏、肺脏、气管等组织或器官中都有高表达[11-17]。早期关于TLR4的研究主要集中在人和小鼠中的免疫反应[18-19],之后多集中于TLR4在癌细胞的增殖和凋亡、器官移植、伤口愈合等过程中的作用[20]。尽管TLR4在人和鼠中已经有了较多研究,但其在家禽中的功能机制还尚未开展。鸡TLR4和人TLR4的同源性小于50%,存在物种特异性且其信号通路有差异。近期的转录组测序发现鸡TLR4及其信号通路在禽致病性大肠杆菌或禽肠炎沙门氏杆菌感染时都会发生显著性变化[15-17],但对鸡TLR4在免疫细胞中的功能机制研究较少。
以鸡巨噬细胞HD11和鼠伤寒沙门氏杆菌衍生的脂多糖LPS为研究材料,利用TLR4基因过表达和干扰、qRT-PCR、Western Blot和细胞凋亡检测等技术和方法分析鸡TLR4在细胞免疫炎症中的作用,为控制过度炎症反应提供新思路和干预靶点,对缓解应激性病理损伤和提高家禽健康具有实践意义。
1 材料与方法
1.1 材料
鸡巨噬细胞HD11来自扬州大学动物科学与技术学院遗传实验室。RPMI-1640培养基、优质胎牛血清(FBS)、0.25%胰蛋白酶消化液均购自美国Gibco公司;Silencer®select siRNA试剂盒、NE-PERTMNuclear and Cytoplasmic Extraction Reagents试剂盒、Pierce®BCA Protein Assay Kit试剂盒、RNAlater®RNA Stabilization Solution购自Thermo Fish Scientific公司;RNAqueous®Kit 试剂盒和DNA-freeTMDNA Removal Kit购自Gibco公司;Thermoscript RT-PCR试剂盒、LipofectamineTMRNAiMAX、BLOCK-iTTMAlexa Fluor®购自Invitrogen;QuantiTect SYBR Green RT-PCR Kit试剂盒购自Qiagen公司;Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;LPS购自Sigma公司;兔抗鸡TLR4及兔抗鸡 β-actin抗体购自Abcam公司,羊抗兔IgG二抗购自康为世纪生物科技有限公司。
1.2 方法
1.2.1 细胞培养
鸡巨噬细胞HD11移入RPMI-1640培养基,于37 ℃、5% CO2培养箱中培养。经台盼蓝染色后显微镜下观察细胞形态。细胞活力为90%~95%时用于后续试验。
1.2.2 RNA干扰
根据鸡TLR4基因的不同外显子,利用BLOCK-iTTMRNAi Designer设计3个siRNA,分别为siRNA-1、siRNA-1-2和siRNA-1-3。siRNA-1:5′-CAGUCUGGUCUUGCUAGACAUUUUCU-3′,siRNA-2:5′-CAGUAGCAUGCUCAGUGACUGUGUGU-3′,siRNA-3:5′-CCGAU-AUCUGAGGAGGAACACUUAU-3′。引物由上海生工生物公司合成。按照Silencer®select siRNA试剂盒说明书,将5组siRNA(siRNA-1,siRNA-2,siRNA-3,siRNA-1、-2、-3混合和阴性对照)(0.1 μmol/L)分别转染细胞。LipofectamineTMRNAiMAX转染6 h后荧光显微镜下用BLOCK-iTTMAlexa Fluor®红色荧光质控剂(20 μmol/L)评估转染效率。
1.2.3 LPS刺激HD11细胞
转染24 h后,不同浓度(0.1、0.5、1.0或5 μg/mL)LPS感染鸡巨噬细胞HD11,0 μg/mL LPS为对照组。感染2、4、8和12 h后,收集细胞并放入RNAlater®RNA Stabilization Solution,4 ℃过夜;后将样品储存于-80 ℃,以备后续RNA提取实验。
1.2.4 RNA分离和DNA酶处理
利RNAqueous®Kit试剂盒分离RNA。后用DNA-freeTMDNA Removal Kit处理总RNA。RNA质量和数量分别通过Nanodrop、琼脂糖凝胶电泳和紫外分光光度计进行检测。
1.2.5 qRT-PCR实验
用Thermoscript RT-PCR试剂盒将不同处理组总RNA反转录为cDNA。利用7300实时PCR仪和QuantiTect SYBR Green RT-PCR试剂盒,以cDNA为模板,进行实时荧光定量RT-PCR扩增。qRT-PCR分析候选基因TLR4、IL-1β、IL-6、TNF-α、TGF-β、IL-8、IFN-α以及标准化基因GAPDH的mRNA表达量。扩增体系(总体积为25 μL):cDNA 1 μL,QuantiTect SYBR Green RT-PCR Master Mix(2×)12.5 μL,QuantiTect RT Mix 0.25 μL,上游下游引物(表1)各1 μL,ddH2O 9.25 μL。扩增程序:95 ℃预变性15 min;94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。每个循环结束时检测荧光信号,以每1 s上升1 ℃的速度从70 ℃升高到90 ℃,进行熔解曲线分析,获得每个样本的Ct值,根据公式ΔΔCt=40-[(检测基因的平均Ct值)+(GAPDH的中位Ct值-GAPDH的平均Ct值)×(检测基因的斜率/GAPDH的斜率)]。通过2-ΔΔCt法计算各基因mRNA的相对表达量。

表1 引物序列信息Table 1 Primer sequence information
1.2.6 Western Blot实验
根据NE-PERTMNuclear and Cytoplasmic Extraction Reagents试剂盒说明书提取细胞总蛋白。主要过程为去除培养瓶中上清培养液,PBS清洗3次,分别用包浆蛋白裂解液I和II漂洗细胞,去除裂解液。转入1.5 mL离心管,14 000 r/min离心5 min后取上清液。利用BCA Protein Assay Kit试剂盒测定蛋白浓度。对检测后的蛋白质样品进行120 V、4 ℃条件的SDS-PAGE电泳,转膜PVDF 90 min,3%牛血清白蛋白封闭2 h;加入目的蛋白(TLR4和β-actin)一抗(1∶1 000)4 ℃孵育过夜;后TBST洗涤(3~4次,10 min/次),加入辣根过氧化酶标记抗体(二抗,1∶2 000)孵育2 h,经ECL试剂显色,化学发光显影。以β-actin作为内参对照基因,用凝胶成像系统进行显影检测TLR4蛋白表达情况。
1.2.7 流式细胞仪检测细胞凋亡
利用碧云天Annexin V-FITC细胞凋亡检测试剂盒分析不同处理组细胞凋亡率。将细胞接种于6孔培养板,48 h后吸取细胞培养液至离心管,PBS洗涤,加入胰酶消化细胞;收集细胞培养液并吹打细胞,3 000 r/min离心5 min,弃上清液,PBS重洗细胞并计数;取5~10万个细胞,3 000 r/min离心5 min,弃上清液,加入195 μL Annexin V-FITC结合液重悬细胞;加入5 μL Annexin V-FITC,混匀;加入10 μL PI染色液,混匀;室温避光10~20 min后立即用流式细胞仪检测细胞凋亡情况。
1.2.8 数据统计分析
经qRT-PCR检测后,利用JMP统计软件分析数据。固定效应为siRNA、处理组、时间以及各效应间的相互作用。随机效应为样品批次。利用JMP软件对siRNA、处理组、时间效应最小二乘(Least squares method,LS)平均值进行多重比较。采用图基真实显著差异[Tukey’s honestly significant difference(Tukey HSD)]算法来确定显著性差异。显著水平为P<0.05;极显著水平为P<0.01。
2 结果与分析
2.1 LPS剂量和处理时间对鸡TLR4及其相关基因表达的影响
为确定鼠伤寒沙门氏杆菌衍生的LPS感染鸡巨噬细胞HD11的最佳剂量和时间,通过qRT-PCR检测TLR4、IL-1β、IL-6、TNF-α、TGF-β、IL-8和IFN-α基因在不同感染时间和感染剂量时mRNA表达水平。结果显示,LPS不同剂量和感染时间均可显著性影响细胞免疫应答反应,剂量和时间之间无显著互作(表2)。

表2 LPS剂量和感染时间对鸡HD11细胞中免疫相关基因应答的影响Table 2 Effect of LPS dose and infection time on the expression of immune related genes in chicken HD11 macrophages (P values)
与对照组相比,0.5 μg/mL LPS可显著性诱导鸡巨噬细胞HD11发生免疫应答反应(图1);1 μg/mL LPS诱导基因TLR4、IL-1β、IL-8和IL-6表达量在感染8 h后达到峰值(图1);5 μg/mL LPS在感染8 h后使基因TNF-α、TGF-β和IFN-α的表达量达到最高值,但与剂量为1 μg/mL LPS相比差异不显著(图1)。因本研究旨在验证LPS感染时鸡巨噬细胞HD11中TLR4基因功能,故选择LPS剂量为1 μg/mL、感染时间为8 h用于后续功能鉴定实验。
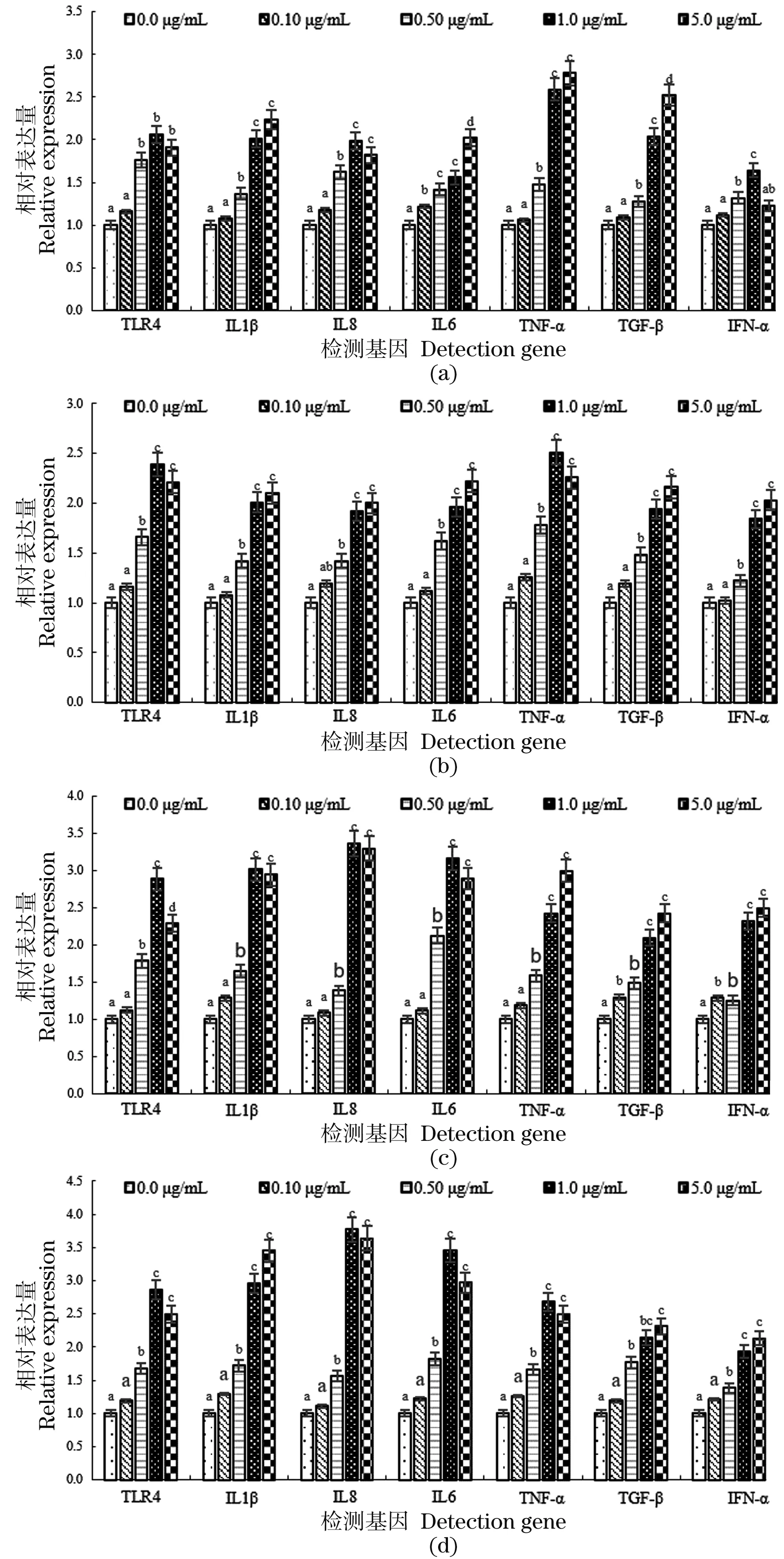
(a)LPS感染2 h后免疫相关基因表达量;(b)LPS感染4 h后免疫相关基因表达量;(c)LPS感染8 h后免疫相关基因表达量;(d)LPS感染12 h后免疫相关基因表达量。图中不同字母(a、b、c和d)代表不同组间差异显著(P<0.05);相同字母代表差异不显著(P>0.05)。图1 LPS感染鸡巨噬细胞HD11后TLR4、IL-1β、IL-6、TNF-α、TGF-β、IL-8和IFN-α 基因的表达量变化Figure 1 Changes in gene expression of TLR4,IL-1β,IL-6,TNF-α,TGF-β,IL-8 and IFN-α in chicken HD11 cells infected by LPS
2.2 siRNA干扰TLR4基因
siRNA转染细胞后,荧光显微镜观察,转染效率为86.28%±1.08%(图2);存在荧光标记,表明siRNA已成功转染至鸡巨噬细胞HD11[图2(c)]。不同干扰载体转染细胞后,结果显示基因TLR4mRNA表达量在TLR4-siRNA-2和空白对照组之间存在显著性差异(P<0.05);在TLR4-siRNA-3和空白对照组之间存在极显著性差异(P<0.01)。TLR4-siRNA-2和TLR4-siRNA-3均能对TLR4基因产生不同程度的沉默,干扰效率分别为62%和76%[图3(a)],TLR4-siRNA-3沉默效果最为显著。同时,进一步检测到TLR4-siRNA-3组TLR4蛋白表达量显著性降低[图3(b)和(c)]。因此,TLR4-siRNA-3沉默基因TLR4表达的效果最佳,最终确定TLR4-siRNA-3用于后续实验。

(a)普通灯下细胞状态;(b)荧光灯下细胞状态;(c)为(a)和(b)的合并图像。图2 荧光siRNA转染24 h后的细胞状况(标尺100 μm)Figure 2 The morphology of cells after fluorescent siRNA transfection 24 h (scale 100 μm)
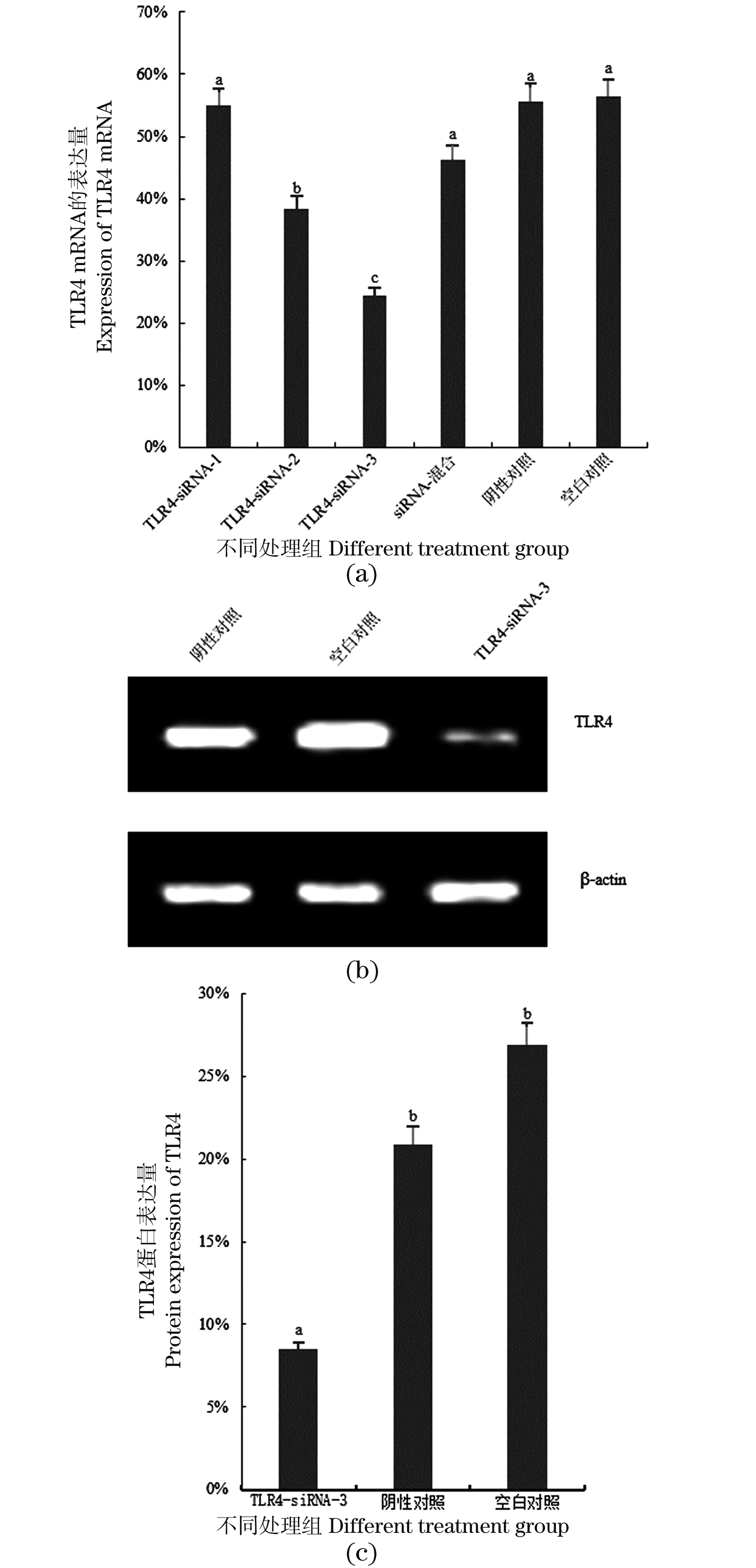
(a)不同处理组转染鸡HD11细胞后TLR4 mRNA的表达水平;(b)TLR4-siRNA-3转染鸡HD11细胞后Western Blot检测TLR4蛋白的表达;(c)Western Blot评估TLR4-siRNA-3转染的鸡HD11细胞和两个对照细胞中TLR4蛋白表达的水平。图中不同字母(a、b、c和d)代表不同组间差异显著(P<0.05);相同字母代表差异不显著(P>0.05)。图3 siRNA敲低TLR4后在鸡HD11细胞中的表达Figure 3 The expression of TLR4 in chicken HD11 cells after siRNA knockdown
2.3 LPS感染时干扰TLR4对细胞免疫炎性基因表达的影响
以GAPDH为内参基因,qRT-PCR检测 LPS感染siRNA干扰TLR4基因的鸡HD11细胞免疫和炎性相关基因表达量的影响。由图4可知,与对照组相比,基因IL-1β、IL-6、IL-8和TNF-α的表达量在TLR4-siRNA-3转染的鸡HD11细胞中显著性下降,其表达模式与基因TLR4一致(P<0.05);而基因TGF-β和IFN-α相对表达量下降不显著(P>0.05),见图4。LPS感染时,TLR4-siRNA-3组中TLR4表达量显著性低于对照组;IL-1β、IL-6、IL-8和TNF-α的表达趋势与TLR4一致;而TGF-β和IFN-α的相对表达量差异不显著。
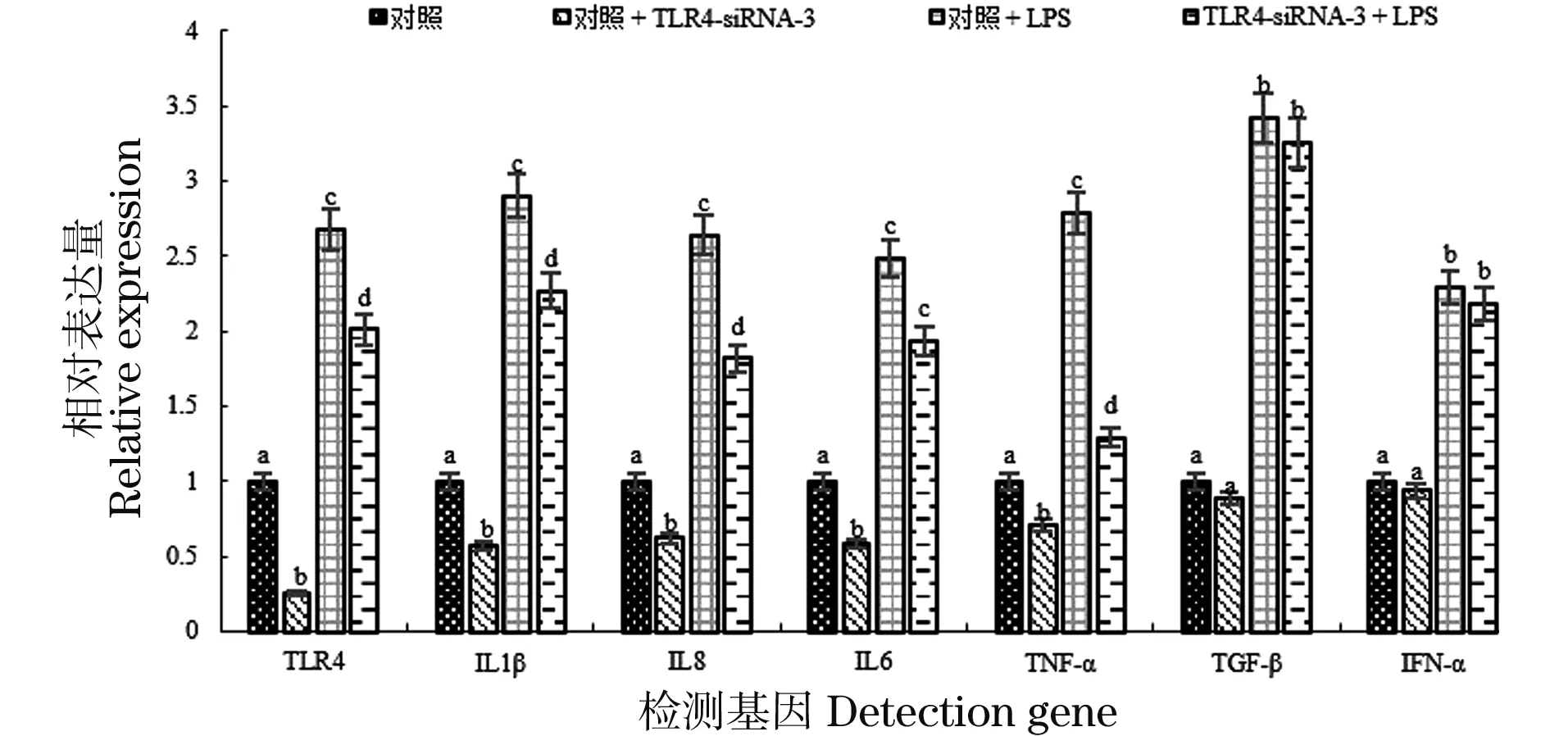
图中不同字母(a、b、c和d)代表不同组间差异显著(P<0.05);相同字母代表差异不显著(P>0.05)。图4 LPS(1 μg/mL)感染8 h后,TLR4-siRNA-3转染的鸡HD11细胞中TLR4、IL-1β、IL-6、IL-8、TNF-α、TGF-β和IFN-α基因表达量变化Figure 4 The expression level of TLR4,IL-1β,IL-6,IL-8,TNF-α,TGF-β and IFN-α in chicken HD11 macrophages transfected with TLR4-siRNA-3 after 8 h of LPS (1 μg/mL) infection
2.4 干扰TLR4基因抑制LPS感染的鸡HD11细胞凋亡
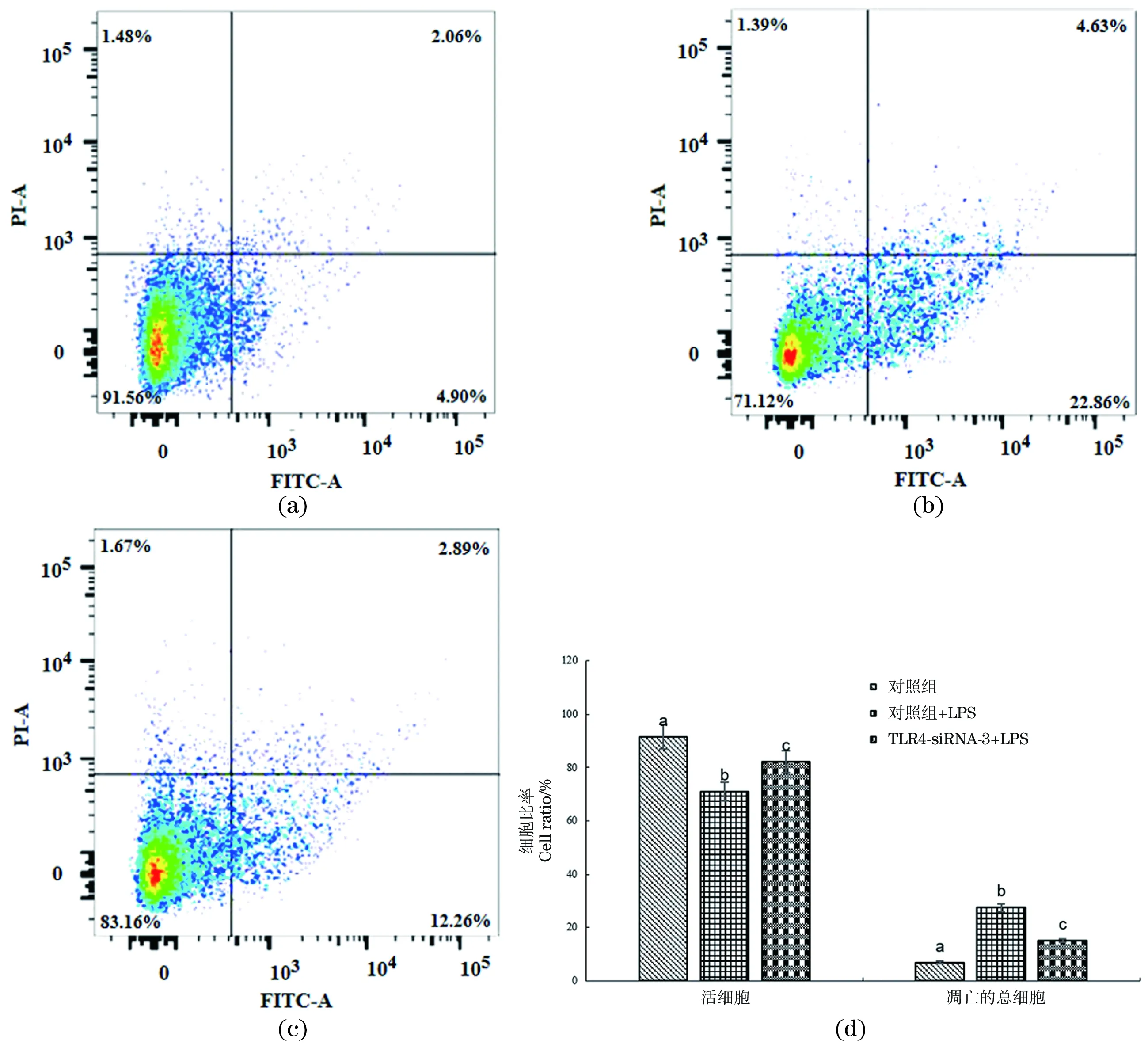
(a)对照组细胞凋亡分布;(b) LPS感染组细胞凋亡分布;(c)干扰TLR4基因的LPS感染组细胞凋亡分布;(d) 对照组、LPS感染组和干扰TLR4的LPS感染组细胞凋亡率。图中不同字母(a、b和c)代表不同组间差异显著(P<0.05);相同字母代表差异不显著(P>0.05)。图5 干扰TLR4基因对LPS感染的鸡HD11细胞凋亡的影响Figure 5 Effect of interference with TLR4 gene on apoptosis of chicken HD11 macrophage after LPS infection
利用流式细胞仪检测LPS感染前后干扰TLR4后细胞凋亡率。相比对照组(91.56%),LPS感染组活细胞数量(71.12%)显著下降,而干扰基因TLR4后活细胞数量(83.16%)有所增加(图5)。LPS感染组总细胞凋亡率为27.49%,相比对照组的6.96%差异显著(P<0.05);而干扰TLR4后感染LPS,总细胞凋亡率降为15.15%,与LPS感染组和对照组均差异显著(P<0.05)。
3 讨论与结论
LPS是革兰氏阴性细菌细胞壁外壁的组成成分,作为内毒素可作用于人或动物的各种细胞,激活免疫反应。Zhang等[21]发现0.5 μg/mL大肠杆菌O55:B5衍生的LPS可显著激活肉鸡免疫反应;而Van Goor等[22]的研究显示0.2 μg/mL肠炎沙门氏杆菌衍生的LPS诱导鸡巨噬细胞和树突状细胞产生免疫反应的效果最佳;Michailidis等[23]证实1 μg/mL大肠杆菌O111:B4衍生的LPS对鸡睾丸支持细胞的感染效果最优。这些研究表明不同来源的LPS以及不同剂量的LPS对细胞免疫反应激活程度不同。研究通过剂量梯度试验证明1 μg/mL鼠伤寒沙门氏杆菌衍生的LPS能最有效激活TLR4信号通路并促进炎症细胞因子基因表达。同时,前期已证实鸡巨噬细胞HD11在感染禽致病性大肠杆菌6 h后开始大量凋亡[24]。Sipos 等[25]研究发现LPS感染细胞6、12和24 h后,可激活TLR4信号传导。研究通过时间梯度试验证明1 μg/mL 鼠伤寒沙门氏杆菌衍生的LPS在感染8 h 后TLR4及其相关的免疫炎症基因表达水平变化极显著且达到峰值。
目前,研究已证明敲除TLR4基因的小鼠会降低免疫反应,改善同种异体移植排斥反应[7]。同时发现干扰TLR4可调节肝癌细胞的增殖和凋亡[8],表明TLR4可能是肝癌治疗的潜在靶标。在伤口修复中发现,小鼠中敲除TLR4基因可显著性降低TNF、IL6和IL10基因的表达水平[19],有利于伤口愈合。在LPS感染的小鼠中发现过表达TLR4可以加剧肺脏炎症的损伤[26]。上述研究结果表明,TLR4对炎症反应的缓解以及其TLR4/MyD88通路对宿主免疫的调节都发挥着关键作用,且能调节细胞的增殖和凋亡。因此,本研究成功干扰TLR4基因后,发现LPS感染鸡巨噬细胞HD11时促炎因子基因IL-1β、IL-6、IL-8和TNF-α表达量显著性降低,且有效抑制鸡HD11细胞的凋亡。这些结果表明鸡TLR4基因对促炎性因子基因的表达有正向调节作用;干扰TLR4基因可以积极缓解鸡HD11细胞的炎症反应。此结果与前期研究结果一致,即鸡TLR4基因只能依赖TLR4/MyD88信号传导通路参与免疫,进而激活NF-κB信号通路,产生免疫炎性因子IL-8、IL-6、IL-1β和TNF[27-28]。TLR4作为LPS的受体之一,干扰TLR4基因可能降低了内毒素LPS结合受体的能力,减少了感染概率,从而降低了免疫反应和炎性因子基因的表达。具体鸡TLR4基因以何种方式发挥调控功能,仍需进一步研究。
尽管前期已有报道证明在各种疾病中TLR4与TGF-β或IFN-α基因之间存在联系。例如:在膀胱移行细胞癌T24中存在TLR4与TGF-β的相互作用[29];TLR4可通过TGF-β介导前列腺增生[30];TLR4可增强IFN-α的抗病毒效益[31];在LPS感染小鼠时TLR4信号通路可产生IFN-α细胞因子参与免疫反应[32]。然而,本研究发现LPS感染干扰TLR4基因的鸡巨噬细胞HD11时,抗炎因子基因TGF-β和IFN-α的表达水平均不受影响,其趋势与TLR4不同。此结果进一步验证鸡TLR4只能通过TLR4/MyD88信号通路发挥作用,且与鼠TLR4作用机制不同,不能调控IFN-α基因的表达;同时,从侧面证明鸡TLR4基因可能是通过调节促炎性因子基因的表达,而非抗炎性因子基因的表达,来缓解过度炎症反应。
总之,干扰鸡TLR4基因能够负向调节鸡巨噬细胞HD11中促炎因子基因表达,抑制细胞凋亡;但不调节抗炎性因子基因表达。研究结果同时表明鸡TLR4基因的表达水平是内毒素LPS引起细胞炎症反应的一个限制性因素。调节TLR4基因的表达可直接影响细胞对内毒素LPS的炎症反应。小分子化合物局部抑制TLR4基因的表达可能为控制过度炎症反应提供新思路和干预靶点,对缓解应激性病理损伤和提高家禽健康具有实践意义。

