多花黄精果糖激酶和GDP-甘露糖焦磷酸化酶的基因克隆及酶结构性质
赵历强,赵德蕊,单春苗,张声祥,施圆圆,吴家文
(1.安徽中医药大学 研究生院,合肥 230012;2.安徽中医药大学科研实验中心新安医学教育部重点实验室,合肥 230038;3.安徽道地中药材品质提升协同创新中心,合肥 230012;4.安徽省中医药科学院,合肥 230012)
多花黄精(PolygonatumcyrtonemaHua,PC)为百合科黄精属植物,多生于林下、灌丛和山坡阴处[1],是我国著名中草药,其药用部位为根状茎,具有健脾、润肺、益肾等功效[2]。多花黄精中含有多种药用成分,主要包括多糖、黄酮、甾体皂苷等化合物[3]。多糖在多花黄精所有成分中含量较高[4],具有抗炎、抗肿瘤、抗氧化等药理作用[5-7]。
目前研究认为多花黄精的多糖主要由葡萄糖、甘露糖、半乳糖等单糖构成[8],其生物合成途径起始于蔗糖[9],在果糖激酶、己糖激酶和GDP-甘露糖焦磷酸化酶等共同作用下合成黄精多糖[10]。果糖激酶(FRK)是黄精多糖生物合成途径中第二个关键酶,催化果糖磷酸化生成6-磷酸果糖,其对果糖的亲和性远大于同样催化果糖的己糖激酶[11-12];GDP-甘露糖焦磷酸化酶(GMPP)催化1-磷酸甘露糖生成GDP-甘露糖,GDP-甘露糖在黄精中广泛参与多糖、抗坏血酸等的生物合成[13-14]。
近年来,FRK在枸杞[15]、苹果[16]、杨梅[17]等植物中被相继发现和克隆,同时石斛[18]、茶树[19]、拟南芥[20]等植物的GMPP也被成功克隆与鉴定,但多花黄精的FRK和GMPP还尚未见报道。研究通过对多花黄精的转录组数据分析,发掘黄精多糖生物合成途径中一系列关键酶基因,并利用RT-PCR技术成功克隆出关键酶FRK和GMPP的完整开放读码框,通过分析其理化性质和结构特点,为揭示黄精多糖生物合成途径中酶蛋白的作用机制奠定基础。
1 材料与方法
1.1 材料
实验多花黄精于2018年采自安徽中医药大学药物园,经中药鉴定学专业杨青山老师确认。将新鲜的多花黄精根、块茎、叶用纯水洗净擦干后置于50 mL离心管中,并放入液氮中速冻2 h后置于-80 ℃保存。
1.2 方法
1.2.1 总RNA提取和cDNA合成
实验器具经高温灭菌后,将多花黄精的各器官分别放入研钵中,加入液氮研磨至粉末,用RNA提取试剂盒(北京天根生化科技有限公司)对RNA进行纯化,用Agilent 2100生物分析仪检测其浓度及完整性,高质量的RNA作为模板进行cDNA的合成。
1.2.2 引物设计
PCFRK和PCGMPP序列来源于多花黄精的转录组数据库,使用Primer 5.0软件在ORF两端设计出一对特异性扩增引物。
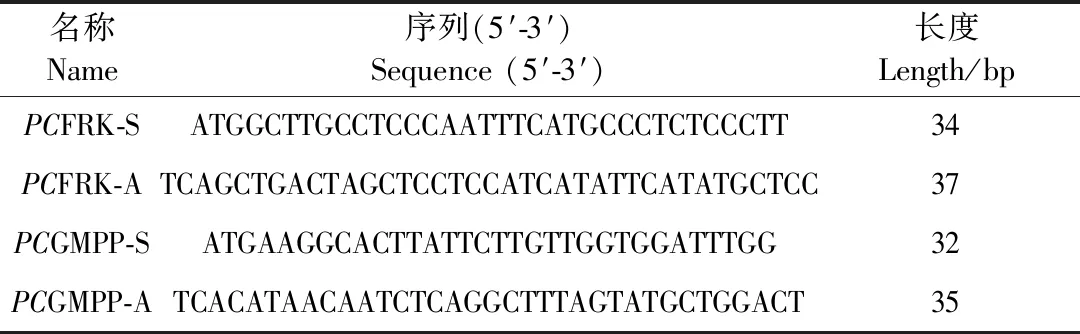
表1 PCFRK和PCGMPP引物序列Table 1 PCFRK and PCGMPP primer sequences
1.2.3PCFRK和PCGMPP的克隆
首先利用Oligo(dT)磁珠富集多花黄精mRNA,再以mRNA为模板逆转录合成cDNA,以cDNA为模板通过PCR对PCFRK和PCGMPP进行扩增。PCFRK基因较长,先用高保真酶(TOYOBO生物公司)进行PCR扩增,后以此PCR的产物为模板、用ExTaq酶(TAKARA生物公司)体系再次进行PCR扩增;PCGMPP基因则直接使用ExTaq酶进行PCR扩增,PCR的产物用试剂盒(AxyPrepTM DNA Gel Extraction Kit)进行胶回收,从而使目的基因片段PCFRK和PCGMPP得到纯化。
1.2.4 克隆载体的构建
将pMD19-T载体与纯化后的PCFRK和PCGMPP基因片段连接后转化至感受态细胞(E.coliDH5α)中培养,挑选经菌液PCR鉴定正确的克隆进行测序。
1.2.5 生物信息学分析
利用TransDecoder(v3.0.1)软件分析Unigene开放读码框(ORF),用在线工具ExPASy(https:∥web.expasy.org/protparam /)计算编码蛋白氨基酸种类、数目、相对分子质量和等电点等理化性质;用MEGA 5.0和CLUSTALX 1.83软件对筛选出的PCFRK和PCGMPP的氨基酸序列进行比对并构建其系统发育进化树,采用Swiss-Model(https:∥swissmodel.expasy.org/)模拟PCFRK和PCGMPP的空间结构,使用Pymol软件描绘其空间结构。
2 结果与分析
2.1 总RNA提取与PCFRK、PCGMPP基因的克隆
琼脂糖凝胶电泳的结果显示,在28 S,18 S,5 S处分别有3条清晰明亮的条带,说明多花黄精的总RNA提取的纯度和完整性较高,可用于cDNA的合成。将富集的mRNA作为模板逆转录生成cDNA,再利用PCR技术对目的基因扩增,并进行琼脂糖凝胶电泳鉴定,结果显示在约2 000 bp和1 000 bp处各出现一条亮带,这与通过转录组分析获得的目的基因片段(PCFRK:Un20408,PCGMPP:Un7094)长度一致(图1)。

(a)总RNA纯化;(b)PCFRK基因的克隆;(c)PCGMPP基因的克隆。(b)和(c)中箭头示意目的基因片段。图1 总RNA纯化及PCFRK和PCGMPP基因的克隆Figure 1 Extraction of total RNA and cloning and identification of PCFRK and PCGMPP
2.2 生物信息学分析
生物信息学分析结果表明PCGMPP相对分子质量为39 650.38,理论等电点为6.33,为偏酸性蛋白质,ORF为1 086 bp,编码361个氨基酸,其中亮氨酸数量最多,为35个,占9.7%;PCFRK相对分子质量为64 413.25,理论等电点为6.18,也是偏酸性蛋白质,ORF为1 725 bp,编码574个氨基酸,其中丝氨酸数量最多,为52个,占9.1%(图2)。
2.3 PCFRK和PCGMPP基元和结构域分析
利用Motif Scan软件对PCFRK和PCGMPP蛋白的基元和结构域进行分析(图3),结果显示PCFRK具有 3个糖基化位点,5个N-蛋白质豆蔻酰化位点,16个酪蛋白激酶II磷酸化位点,19个蛋白激酶C磷酸化位点,2个酪氨酸激酶磷酸化位点;PCGMPP具有1个糖基化位点,4个N-蛋白质豆蔻酰化位点,4个酪蛋白激酶II磷酸化位点,3个蛋白激酶C磷酸化位点,1个酪氨酸激酶磷酸化位点(表2)。

(a)PCFRK读码框序列和编码的蛋白质序列;(b) PCGMPP读码框序列和编码的蛋白质序列。 图2 PCFRK和PCGMPP读码框序列和编码的蛋白质序列 Figure 2 ORFs and amino acid sequences of PCFRK and PCGMPP
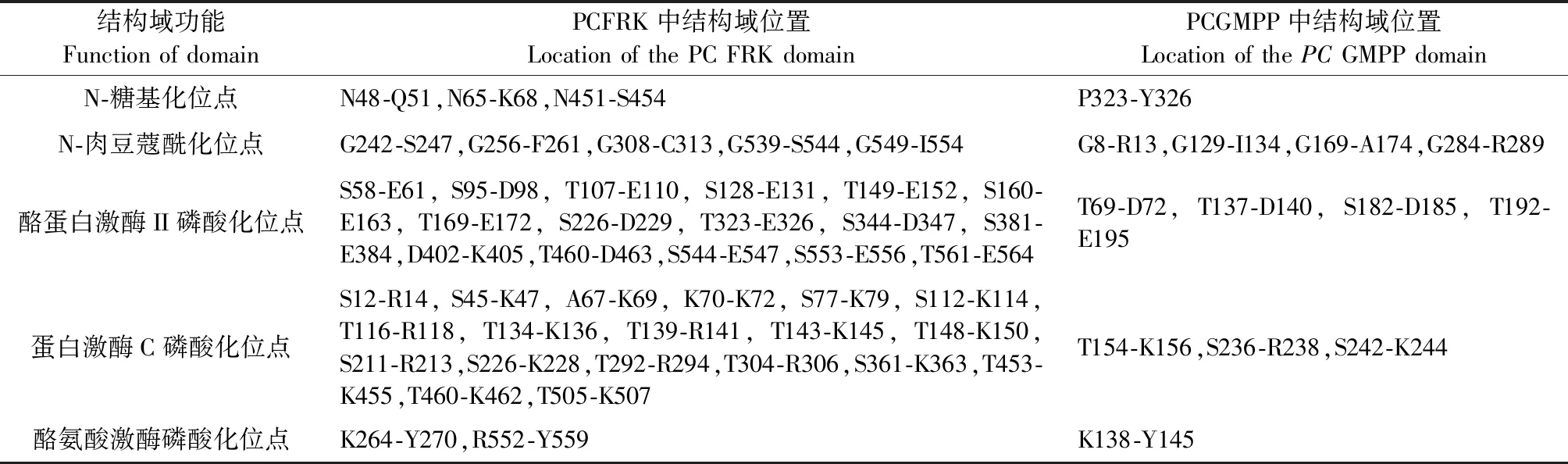
表2 PCFRK和PCGMPP蛋白的基元和结构域分析Table 2 Analysis of motifs or domains of PCFRK and PCGMPP
2.4 PCFRK和PCGMPP的同源关系及进化树分析
将PCFRK和PCGMPP与不同植物中的FRK和GMPP进行亲缘关系比对,结果显示在已知数据库中PCFRK与深圳拟兰(Apostasiashenzhenica)亲缘关系最近,PCGMPP与芦笋(Asparagusoffcinalis)亲缘关系最近(表3、表4和图3)。
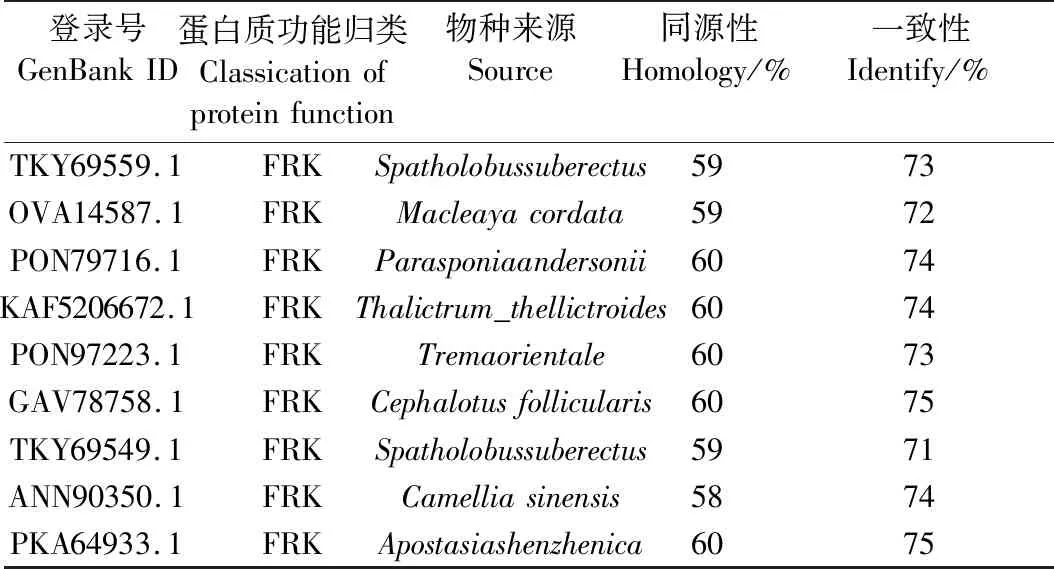
表3 PCFRK与不同物种的FRK比对Table 3 Homologous alignment of FRK proteins
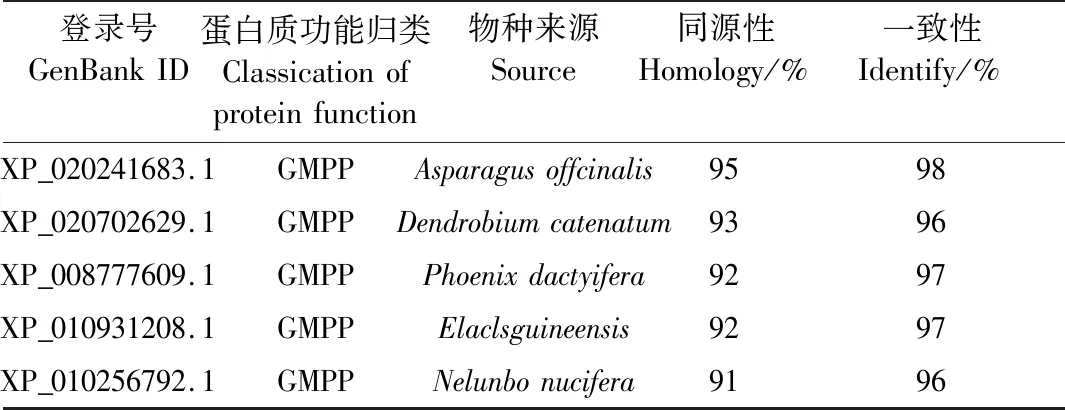
表4 PCGMPP与不同物种GMPP比对Table 4 Homologous alignment of GMPP proteins
2.5 PCFRK和PCGMPP二级结构及空间结构分析
利用Pymol软件,分别以蛋白质数据库(PDB)中的5ey7.1.B和5z0a.1.A的晶体结构为模板模拟出PCFRK和PCGMPP的三维结构。PCFRK二级结构包含13个β折叠、10个α螺旋和5个TT结构,空间结构由一个大结构域和一个小结构域组成,大结构域是由9个β-折叠和10个α-螺旋构成,α-螺旋位于β-折叠的两侧,构成“夹心饼干”状结构,其中“β3-α1-β4-α2-β5”构成了Rossmann折叠,是NAD结合区域[21];而小结构域也被称作盖状结构域,独立于大结构域之外,由4个β-折叠构成[图4(a)]。此外,PCFRK具有磷酸果糖激酶B家族共同的保守位点“GG”和“DMSXSGD”[22][图4(b)和(c)]。

(a)PCFRK进化树;(b) PCGMPP进化树。下方坐标表示遗传距离;黑色三角形突出显示多花黄精中的PCFRK和PCGMPP。图3 PCFRK和PCGMPP系统进化树Figure 3 Phylogenetic analysis of PCFRK and PCGMPP
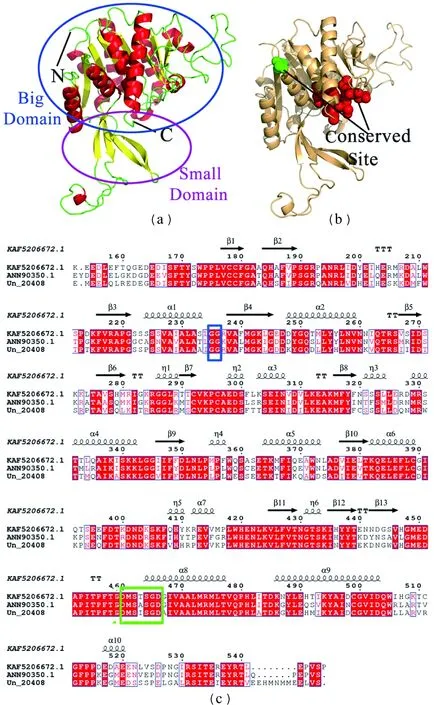
(a) PCFRK三级结构模型(蓝色和粉色圆圈分别表示大结构域和小结构域);(b) PCFRK三级结构模型(红色球形和绿色球形分别表示保守位点);(c) PCFRK二级结构(蓝色和绿色方框分别显示保守位点)。图4 PCFRK二级结构和三级结构模型Figure 4 The secondary structure and tertiary structure model of PCFRK
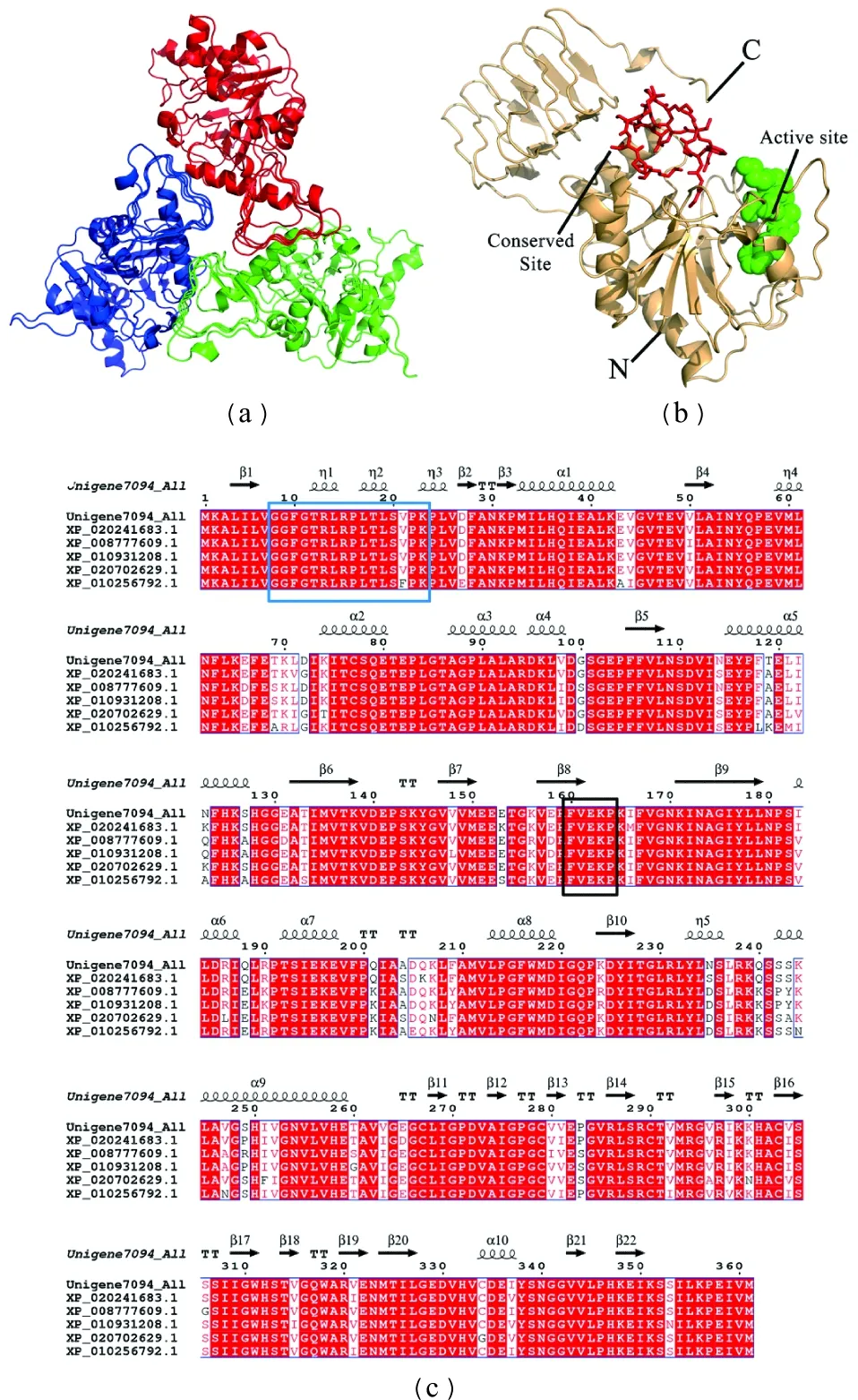
(a) PCGMPP三聚体结构模型(红色、蓝色、绿色分别示意一个单体);(b) PCGMPP单体结构模型(红色棍棒结构示意保守位点,绿色球形结构示意活性位点);(c) PCGMPP二级结构(蓝色方框内显示保守位点氨基酸,黑色方框内显示活性位点氨基酸)。图5 PCGMPP二级结构和空间结构模型Figure 5 The secondary structure and tertiary structure model of PCGMPP
PCGMPP空间结构为三聚体,其单体包含22个β折叠、10个α螺旋和10个TT结构,单体的C末端有数个规则的左手螺旋式β-折叠,构成“杯状”结构,其N端具有焦磷酸化酶家族“GGXGXRLXPLX5PK”保守序列,同时也具有特异性活性位点“FVEKP”[23](图5)。
2.6 PCFRK和PCGMPP基因在多花黄精不同组织中的表达
选取具有完整读码框且unigene的标准表达量(FragmentsPer Kilobase per Million,FPKM)大于1的基因绘制热图,结果显示在根状茎中PCFRK和PCGMPP基因的总体表达量要高于叶和根,这一结果与根状茎中多糖含量高于其他组织一致[24](图6)。
3 讨论与结论
多花黄精是我国著名的药食同源的药材,具有健脾、补气养阴、益肾、润肺等功效[25-26],其中黄精多糖是多花黄精的主要药用成分之一,具有抗氧化、降血糖和抗病毒、抗肿瘤等药理作用[27-29]。
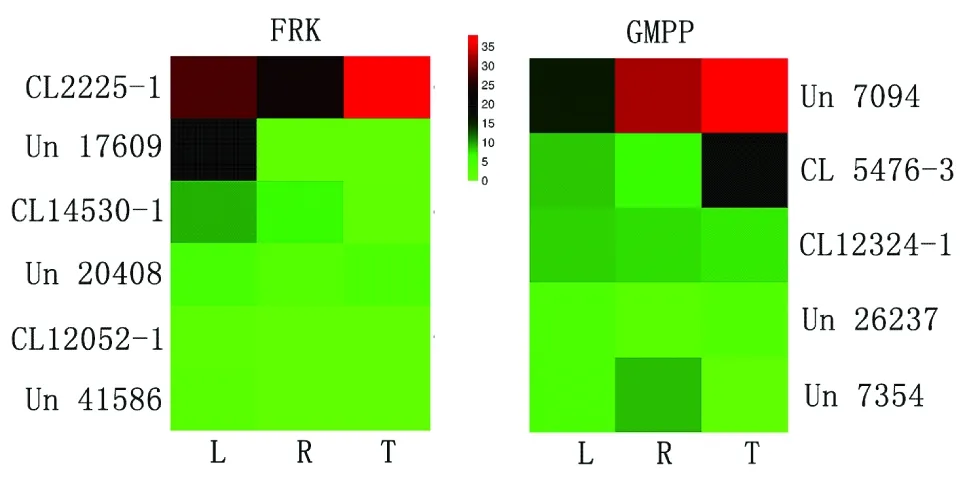
L:叶;R:根;T:块状茎;热图中红色为高表达;绿色为低表达。图6 FRK和GMPP在多花黄精不同组织中的基因表达Figure 6 Gene expression of FRK and GMPP in different tissues of PC
课题组基于高通量测序对多花黄精多糖生物合成途径进行了分析,鉴定了一系列与此途径相关的关键酶[24],研究成功克隆出其中PCFRK和PCGMPP两种关键酶基因。PCFRK的ORF为1 725 bp,编码574个氨基酸,其三维结构由一个大结构域和一个小结构域构成,活性中心位于这两个结构域之间的裂隙中[30-31]。PCFRK具有两个磷酸果糖激酶B家族的特征保守基序“GG”和“DMSXSGD”[22],其中GG为二甘氨酸构象开关,当腺苷与酶的特定位点结合时,保守基序GG会发生弯曲,完成催化前构象改变[32];而“DMSXSGD”在构象发生改变后形成一个阴离子通道结构,使ATP上的磷酸转移到腺苷上,完成6-磷酸果糖的生物合成[33-34]。目前研究表明,FRK是多糖生物合成中重要的关键酶之一,可以控制植物中果糖和蔗糖比值[35],当番茄中FRK过表达时,会导致生长和光合作用受损,影响多糖的合成,从而导致番茄果实和种子变小[36]。Yang等[37]从苹果多糖生物合成中发现当FRK代谢合成增加时会导致蔗糖含量下降和山梨醇的增加;赵建华等[16]对枸杞的研究发现当果糖被FRK磷酸化后含量降低,会促进蔗糖的分解转化。
PCGMPP的ORF为1 086 bp,编码361个氨基酸,空间结构模型为三聚体,PCGMPP单体的C末端有β-折叠构成的“杯状”结构,“杯体”内部为疏水结构,有大量脂肪族残基[38]。PCGMPP具有焦磷酸化酶家族保守位点“GGXGXRLXPLX5PK”和活性位点“FVEKP”[23]。其中保守位点上的精氨酸和赖氨酸与焦磷酸盐基团通过静电相互作用而结合[23],而活性位点“FVEKP”与甘露糖相互作用,并在辅助因子Mg2+的共同作用下催化1-磷酸甘露糖生成GDP-甘露糖[39],GDP甘露糖可参与细胞壁多糖合成、蛋白质糖基化和维生素C合成等多种反应[40-41]。Keller等[42]研究发现抑制土豆中GMPP的表达会引起甘露糖含量降低30%~50%;王维鹏等[20]利用农杆菌介导法将拟南芥GMPP酶基因导入生菜中,结果显示其维生素C的含量明显高于对照组;对霍山石斛GMPP研究发现,GMPP在不同组织中的表达水平与其组织中的多糖含量呈正相关[43];研究表明PCFRK和PCGMPP在多花黄精块茎中高表达与黄精多糖在块茎中的高积累是一致的,因此推测在黄精多糖的生物合成和积累中PCFRK和PCGMPP同样也发挥了关键作用。
研究通过对多花黄精多糖生物合成途径两种关键酶PCFRK和PCGMPP的基因克隆和结构、性质分析,为进一步探究PCFRK和PCGMPP在黄精多糖生物合成中发挥的作用提供了实验基础。

