补骨脂素逆转GST-π介导的多药耐药的研究
花义同 侯长冉 张浩杰 杲霄源
滨州医学院附属医院乳腺外科,滨州 256600
乳腺癌被认为是一种全身性疾病,是世界上最常见的女性恶性肿瘤,对女性的健康造成严重损害[1]。目前,乳腺癌的主要治疗方法包括手术、化疗、放疗、内分泌治疗和靶向治疗[2]。尽管乳腺癌治疗取得了一定进展,但多药耐药仍然是癌症相关死亡的主要原因[3]。探索多药耐药的分子基础,开发临床试剂或策略来预防耐药性的发生是非常重要的。
有许多机制可以诱导癌细胞对细胞毒性药物不敏感,如药物靶点的突变或过表达、药物失活或药物从细胞流出[4]。一些证据强烈支持GSTs的过度表达是耐药的主要机制之一[5]。GST 酶家族可分为α、μ、π、δ 等几类[6]。谷胱甘肽s-转移酶π(GST-π)参与解毒的作用,被认为是导致耐药性的机制之一[7]。有研究发现,GST-π 在乳腺癌耐药细胞系MCF-7/ADR 细胞中的表达量较高,其活性为原细胞系的 45 倍[8]。目前有研究表明,使用 GST-π 抑制剂逆转GST-π介导的多药耐药对于提高化疗药物的灵敏度以及药代动力学和药效学特征是可行的[9]。到目前为止,GST-π的特异性逆转剂非常少,利尿酸成为世界上研究较多的药物之一[10]。然而,利尿、代谢紊乱和严重的过敏反应限制了其临床应用[11]。因此,有必要找到合适的逆转剂来逆转GST-π介导的多药耐药。
补骨脂素是一种天然产物,存在于几种植物中,是补骨脂的主要活性成分[12-13]。有研究表明其具有广泛的生物活性,包括细胞毒性、药物毒性等[14]。现代研究表明,补骨脂素对许多动物和人的肿瘤生长有显著抑制作用[15]。在本研究中,我们分析了补骨脂素对MCF-7/ADR 细胞具有较强的细胞毒性,并发现补骨脂素在体外对MCF-7/ADR 细胞也具有抗肿瘤作用[16]。提高了MCF-7/ADR 对阿霉素的灵敏度,这与之前在人类其他癌细胞系中进行的研究一致[17]。
我们实验室前期的研究发现,补骨脂素实际上可以逆转乳腺癌 MCF-7/ADR 细胞[16,18]。补骨脂素对多药耐药的逆转作用已经明确,但其机制尚不清楚。我们发现补骨脂素并没有降低多药耐药基因(MDR1)、多药耐药相关蛋白(MRP)和肺耐药蛋白(LRP)的表达,但是发现它可以显著降低GST-π 的表达,对基因和蛋白水平有明显影响。我们推测逆转多药耐药的机制可能与GST-π 有关,因此提出了补骨脂素可以作为GST-π 的抑制剂的假说,然后进行了进一步研究,以确定可能的相关调控途径。
材料与方法
1、试剂
RMPI-1640完全培养基、CCK-8试剂盒、核蛋白提取试剂盒购自南京凯基生物有限公司。Maxima SYBR Green qPCR 及 ReverTra Ace qPCR RT Kit 购自美国 Thermo scientific 公司。GST-π 基因正、反向引物购于上海生工生物有限公司。补骨脂素购于中国生物制品鉴定所。抗体购于美国Proteintech公司。
2、细胞系
细胞系购自南京凯基生物有限公司。
3、细胞培养
将MCF-7/ADR 细胞培养在阿霉素浓度为1 mg/L 的RMPI-1640 完全培养基中,在37 ℃、湿度100%、体积分数5% CO2和95%空气的培养箱内培养。所有试验均在细胞对数生长期进行。
4、细胞活力分析
采用CCK-8法测定补骨脂素和SN50的药物作用浓度。我们将实验组分为 4 组(MCF-7/ADR、MCF-7/ADR+P、MCF-7/ADR+SN50、MCF-7/ADR+P+SN50),初步实验是确定补骨脂素的浓度,并将其应用于后续的实验,SN50(18 μmol/L)的浓度是从其他文献中参考而来的[19]。使用CCK-8试剂盒检测了阿霉素对细胞增殖的影响。将呈对数生长期的 MCF-7/ADR 细胞(5×103/孔,100 μl)在 96 孔板中培养约8.0 h,使得粘附在培养板上的细胞生长到约50%。磷酸盐缓冲液(PBS)洗涤2 次后,用含有不同药物的新鲜培养基继续培养 48 h。加入 10.0 μl CCK-8 溶液,37 ℃条件下孵育3.0 h。在酶标仪上选择450 nm 波长检测吸光度值。
5、蛋白免疫印迹分析(Western blot)
采用Western blot 研究不同浓度补骨脂素对GST-π 蛋白表达的影响。用不同浓度的补骨脂素(4 μg/ml、8 μg/ml、12 μg/ml 和 16 μg/ml)处理细胞后,用冷 PBS 洗涤细胞 2 次,然后用裂解液裂解,取上清液测定总蛋白浓度。将等量的蛋白加入聚丙烯酰胺凝胶电泳(SDS-PAGE)中,然后进行转膜(100 V,2.0 h),用5%脱脂牛奶室温下在摇床上封膜1.5 h。将膜与一抗(1:2 000)孵育约8.0 h然后用TBST洗涤3 次,每 5 min 1 次,用稀释的二抗(1:2 000)在室温(25 ℃)下孵育约2.0 h。在3 次清洗后(每次5 min)后,使用化学发光试剂盒对膜进行分析。
6、实时聚合酶链反应(RT-PCR)
采用RT-PCR 技术检测不同浓度的补骨脂素对GST-π基因表达的影响。以Oligo-dTPrimer 为引物按照ReverTra Ace qPCR RT Kit 说明书进行操作反转录合成第一链cDNA。基因引物序列见表1。制作标准曲线,根据标准曲线扩增效率的一致性,采用 2-ΔΔCt法计算 GST-π 基因的相对表达量。

表1 基因引物序列
7、免疫荧光
采用免疫荧光技术探讨补骨脂素逆转GST-π介导的多药耐药的作用机制。NF-κB的活性与肿瘤的耐药性密切相关,我们重点关注NF-κB 信号通路。补骨脂素已被证明是NF-κB 的抑制剂。在MCF-7/ADR 及补骨脂素处理后的MCF-7/ADR细胞中检测到细胞核NF-κB的表达。
8、统计学分析
所有数据均用SPSS 22.0 统计软件处理。所符合正态分布的计量资料采用均数±标准差()表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
1、不同治疗组间阿霉素半抑制浓度(IC50)的比较
CCK-8 结果显示,SN50(18 μmol/L)[19]和补骨脂素(8 μg/ml)[16]对细胞增殖没有影响(P>0.05)。CCK-8结果表明,补骨脂素可以呈现剂量依赖性地抑制MCF-7/ADR 细胞的增殖,这与之前的研究一致。研究了补骨脂素在8 μg/ml和 16 μg/ml 浓度下对 MCF-7/ADR 细胞的 MDR 逆转能力。不同治疗组的阿霉素IC50具有不同的结果。分别为:MCF-7/ADR=(85.15±2.16)μg/ml,MCF-7/ADR+P=(74.55±3.10) μg/ml, MCF-7/ADR+SN50= (56.93±1.19) μg/ml,MCF-7/ADR+P+SN50=(45.31 ±3.10)μg/ml。补骨脂素和SN50可增加阿霉素对MCF-7/ADR细胞的毒性(图1)。
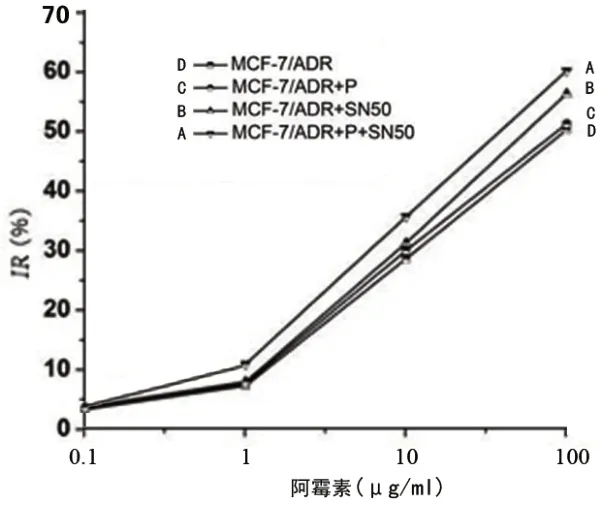
图1 阿霉素抑制MCF-7/ADR细胞增殖,且呈剂量依赖性
2、补骨脂素在mRNA 和蛋白水平上均下调GST-π 的表达
通过PCR(图2A 和2B)和Western blot(图2C 和2D)检测GST-π 的表达。图2A 和2B 中的数据表明补骨脂素抑制GST-π 的基因表达水平,不同浓度的药物治疗组之间的基因表达差异无统计学意义。IC10(8 μg/ml)和IC20(16 μg/ml)被认为是低毒浓度,而低于IC10的浓度被认为是无毒浓度。因此,在后续的实验中,我们选择4 μg/ml、8 μg/ml、12 μg/ml和16 μg/ml的浓度作为工作浓度。通过检测GST-π介导的多药耐药的蛋白及基因的表达水平,发现MCF-7/ADR+P细胞表达均显著下调。
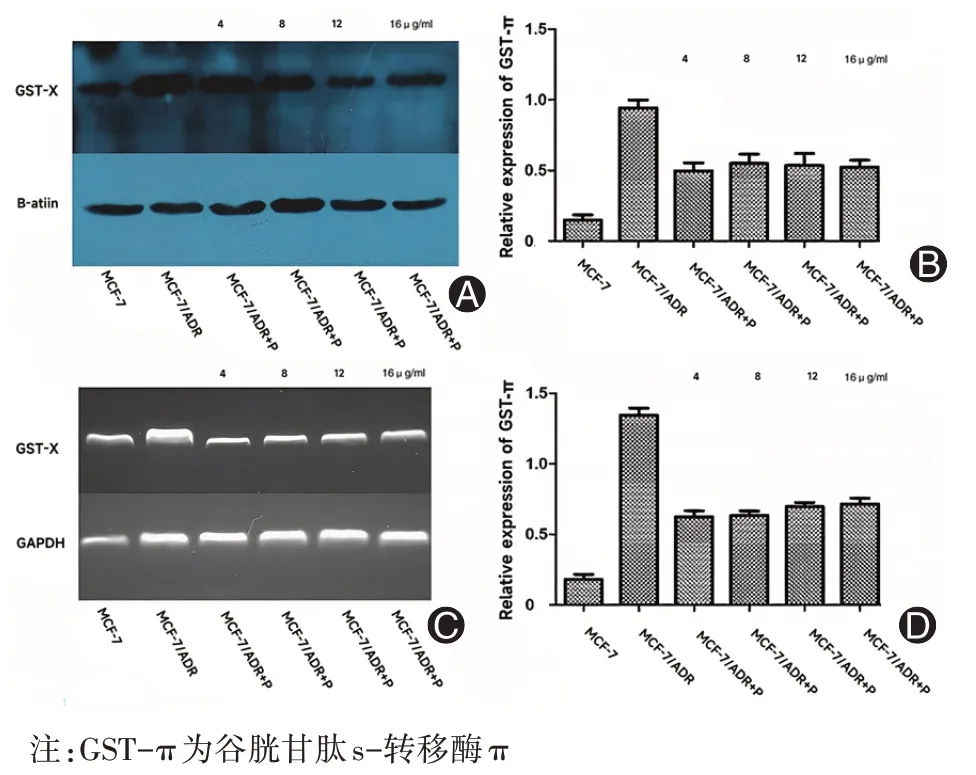
图2 补骨脂素抑制MCF-7/ADR 细胞中GST-π 的表达水平(A为不同浓度补骨脂素对GST-π 的基因表达水平影响的PCR 结果;B 为不同浓度补骨脂素对GST-π 的基因表达水平影响的PCR 数据;C 为不同浓度补骨脂素对GST-π 的基因表达水平影响的Western blot结果;D为不同浓度补骨脂素对GST-π的基因表达水平影响的Western blot数据)
3、免疫荧光检测NF-κB活化水平被补骨脂素抑制
通过免疫荧光法研究了NF-κB的活化情况,图3A和图3B 中的数据显示,补骨脂素抑制了NF-κB 的核移位。在MCF-7/ADR+P 细胞中,细胞核NF-κB 的表达水平显著下调。这些结果提示补骨脂素可能通过抑制NF-κB的活化来逆转多药耐药。
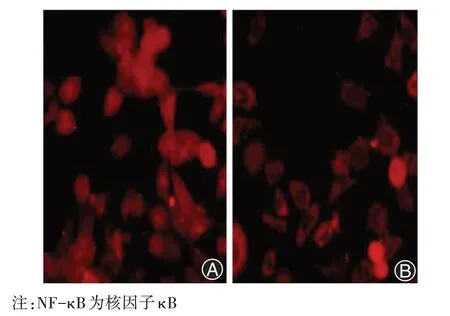
图3 NF-κB 通路的激活状态(A)。NF-κB 在MCF-7/ADR 细胞中各位置均有表达(免疫荧光染色 ×200)。MCF-7/ADR细胞的NF-κB 主要在细胞核中表达。被补骨脂素阻断的NF-κB 的激活主要发生在细胞质中,抑制了其向核内移位(B),免疫荧光染色 ×200
4、采用RT-PCR检测GST-π的表达
采用RT-PCR 检测补骨脂素对GST-π 基因表达的影响。用补骨脂素或SN50 处理MCF-7/ADR 细胞,均能抑制GST-π 的 mRNA 水平。SN50 作为一种特异性抑制剂,它的抑制作用比补骨脂素的抑制作用明显(图4)。
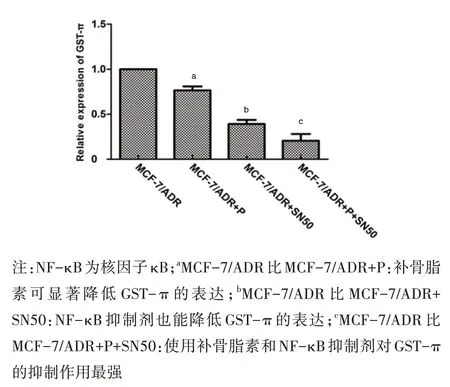
图4 分离总RNA(采用实时聚合酶链反应方法进行分析)
5、采用Western blot检测细胞核中NF-κB的表达
提取细胞核蛋白,检测NF-κB 的表达水平。不同处理组间NF-κB 在细胞核中的表达非常明显(图5)。补骨脂素(8 μg/ml)处理组细胞核中NF-κB 的表达确实降低。补骨脂素的作用非常明显,这与免疫荧光检测的结果一致。

图5 用补骨脂素培养细胞24 h,NF-κB表达水平明显降低
讨 论
本研究旨在探讨补骨脂素逆转GST-π介导的MCF-7/ADR细胞多药耐药的机制。本实验室前期研究发现补骨脂素可以逆转多药耐药,但不能降低MDR1、MRP 和LRP 的表达,因此我们需要探索逆转MDR的作用机制[16,18]。
在本研究中,我们发现GST-π 的表达在药物处理48 h后被抑制(补骨脂素处理24 h和48 h没有差异)。这些结果进一步提示补骨脂素与抗癌药物联合使用可通过抑制GST-π 的表达来提高化疗药物的细胞内浓度,补骨脂素可作为GST-π 的抑制剂或逆转剂。补骨脂素对GST-π 的抑制程度没有剂量依赖性,可能受到其他途径的影响,其一可能通过细胞周期影响细胞增殖。我们还需要进行进一步的研究和讨论,这也是我们实验的缺点。
高度多样化的GST 超家族的所有成员都能够结合三肽谷胱甘肽[20]。GST-π 是参与化疗药物代谢的第2 阶段解毒酶家族的成员[21]。GST-π 的高表达和GST-π 的核定位与肿瘤细胞的侵袭性和患者的低生存率相关[22]。多证据表明,GST-π在肿瘤细胞中的作用不是对细胞增殖的影响,而是获得对抗癌药物的耐药性[23]。Kamada 等[24]研究了过氧化氢处理引起的氧化应激条件下GST-π 的功能,GST-π 通过减少DNA 损伤来阻止细胞凋亡。在我们的实验中,发现补骨脂素治疗组中GST-π的表达明显降低。有证据表明补骨脂素可显著降低NF-κB 的表达。采用免疫荧光法检测NF-κB的活化情况,数据与既往研究一致[16]。在MCF-7/ADR细胞中使用 NF-κB 抑制剂 SN50 后,实验组 GST-π 的表达量低于正常对照组。我们认为GST-π 可能是NF-κB 下游信号通路的关键因子。随后的结果证明了该假设的成立。
NF-κB信号通路参与应激反应和免疫细胞激活、增殖、分化、凋亡,是调控肿瘤发生发展的重要转录因子[25]。NF-κB 存在于大部分细胞质中,只有当它从细胞质到细胞核被激活后,才能发挥重要作用[26]。近年来,研究发现NF-κB的异常激活与肿瘤的耐药性密切相关[27]。根据一项新的研究,使用NF-κB 抑制剂可以使传统的抗肿瘤治疗更有效果[28]。我们之前的实验表明,补骨脂素可以降低细胞核中NF-κB 的表达,这是补骨脂素可以减少NF-κB 从细胞质进入细胞核的有力证据。
在抗肿瘤方面,由于中药不良反应较小近年来引起了人们的关注。本研究旨在开发新的逆转肿瘤细胞耐药性的药物。该实验也存在许多缺点,如没有体内实验,需要进一步研究。
综上所述,本研究表明补骨脂素通过抑制NF-κB 信号通路的激活,显著地在MCF-7/ADR 细胞中抑制了GST-π介导的多药耐药。补骨脂素的这种作用可以使其作为一种化学增敏剂,通过一种有效的途径逆转肿瘤细胞的多药耐药,从而为肿瘤的治疗提供新的治疗局面。
利益冲突所有作者均声明不存在利益冲突

