传承经典是基础,利剑出鞘再创新
——例谈2022年高考化学命题的5大创新
孙 晶
(山东省日照市莒县第四中学)
创新是一个民族永葆进步的灵魂,是一个国家兴旺发达的不竭动力,也是高考命题永葆生机的源泉,本文对2022年高考题中呈现的创新点予以剖析.
1 有机命题与“碳达峰”无痕对接
例1(2022年全国乙卷)一种实现二氧化碳固定及再利用的反应如图1所示.

图1
下列叙述正确的是( ).
A.化合物1分子中的所有原子共平面
B.化合物1与乙醇互为同系物
C.化合物2分子中含有羟基和酯基
D.化合物2可以发生开环聚合反应

化合物1分子中含有亚甲基结构,其中心碳原子采用sp3杂化,所有原子不可能共平面,选项A 错误.结构相似,分子组成相差n个CH2的有机物互为同系物,化合物1为环氧乙烷,属于醚类,而乙醇属于醇类,二者结构不相似,不是同系物,选项B错误.根据化合物2的分子结构可知,分子中含酯基,不含羟基,选项C 错误.化合物2分子可发生开环聚合形成高分子化合物选项D 正确.答案为D.
【真题品读】本题以二氧化碳固定及再利用为命题背景,考查的落点涉及有机物的共面分析、同系物概念辨识、官能团判断和聚酯结构简式的书写.题目用字凝练,涵盖的知识贯穿选择性必修3«有机化学基础»的始终,在落实基础知识和基本能力考查的同时,潜移默化地向学生传递绿色化学和可持续发展思想,有助于我国实现“碳达峰”的目标,体现了科学态度与社会责任的学科素养,达成了命题的社会价值.
2 定性推断与定量计算相结合
例2(2022年全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造.W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21.YZ2分子的总电子数为奇数,常温下为气体.该化合物的热重曲线如图2所示,在200 ℃以下热分解时无刺激性气体逸出.下列叙述正确的是( ).

图2
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物对应的水化物的酸性:Y<X
C.100~200 ℃阶段热分解失去4个W2Z
D.500 ℃热分解后生成固体化合物X2Z3

根据题意可知失去的是水,而不是氨气,即W 为H,Z 为O,YZ2分子的总电子数为奇数,常温下为气体,则Y 为N 元素,根据“原子序数依次增加,且加和为21”可知,X 为B 元素,其单质在常温下为固体,选项A 错误.根据非金属性越强,其最高价氧化物对应的水化物酸性越强,可判断选项B 错误.若100~200 ℃阶段热分解失去4个H2O,则质量分数为

故说明不是失去4 个H2O,选项C 错误.化合物(NH4B5O8·4H2O)在500℃热分解后若生成固体化合物X2Z3(B2O3),根据B 元素守恒,则得到关系式2NH4B5O8·4H2O~5B2O3,则固体化合物B2O3的质量分数为

说明假设正确,选项D 正确.答案为D.
【真题品读】传统的物质结构与元素周期律的推断题一般有三大经典呈现形式:1)以文字叙述形式给出信息.2)结合表格形式列举元素信息.3)给出某化合物的结构示意图,通过化学键信息进行推断.2022年高考题将热重分析曲线和元素推断融为一体,使元素“位、构、性”推断与元素化合物性质、定量计算浑然一体,一道题承载了多种知识,较好地落实了宏观辨识与微观探析、证据推理与模型认知的学科素养.
3 电解质压轴选择题的创新
例3(2022年全国乙卷)常温下,一元酸HA 的Ka(HA)=1.0×10-3.在某体系中,H+与A-不能穿过隔膜,未电离的HA 可自由穿过该膜(如图3).

图3
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( ).
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4


溶液Ⅱ中c总(HA)=1.01c(HA),未电离的HA 可自由穿过隔膜,故溶液Ⅰ和溶液Ⅱ中的c(HA)相等,c总(HA)之比为

选项D 错误.答案为B.
【真题品读】纵览历年高考选择题的压轴题大都以图像的形式考查离子浓度排序或者沉淀溶解平衡的分析.这些图像和数学对数运算、曲线变化、离子浓度交错在一起,令许多考生无所适从,不知从何处破题分析,一直是学生高频失分的题目.该题将传统的电化学命题中经常出现的离子交换膜“嫁接”到电解质命题中,这是该题的第一个创新,第二个创新的地方是未电离的HA 可自由穿过隔膜,导致溶液Ⅰ和Ⅱ中的c(HA)相等,如果考生不能很好地领悟图中的这一信息,该题很容易解错.
4 体现传承,由水立方到冰立方,落实绿色环保理念
例4(2022年全国甲卷)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2═CH2)与四氟乙烯(CF2═CF2)的共聚物(ETFE)制成.回答下列问题:
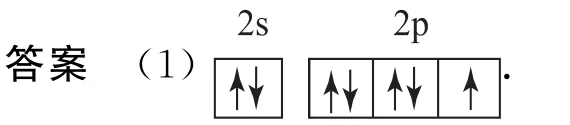
(1)基态F 原子的价电子排布图(轨道表示式)为________.
(2)图甲、乙、丙分别表示C、N、O 和F的逐级电离能I变化趋势(纵坐标的标度不同).第一电离能的变化图是_________(填标号),判断的根据是________;第三电离能的变化图是_________(填标号).

图4
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_________.
(4)CF2═CF2和ETFE分子中C的杂化轨道类型分别为_______和_______;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_________.
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图5所示,X 代表的离子是_________;若该立方晶胞参数为apm,正负离子的核间距最小为_________pm.

图5

根据基态原子的电子表示式书写价电子排布式;根据电离能的排布规律分析电离能变化趋势和原因;根据氢键的表示方法书写(HF)3的结构;根据键能影响物质稳定性的规律分析2种物质的稳定性差异;根据均摊法计算晶胞中各粒子的个数,判断粒子种类.
(1)F 为第9号元素,其电子排布为1s22s22p5,则其价电子排布图为
(2)C、N、O、F4种元素在同一周期,同一周期从左到右第一电离能的总体趋势是依次升高的,但由于N 元素的2p能级为半充满状态,因此N 元素的第一电离能比C、O2种元素高,因此C、N、O、F4种元素的第一电离能从小到大的顺序为C<O<N<F,满足这一规律的图像为图甲.气态基态+2价阳离子失去1个电子生成气态基态+3价阳离子所需要的能量为该原子的第三电离能,同一周期原子的第三电离能的总体趋势也依次升高,但由于C原子在失去2个电子之后的2s能级为全充满状态,因此其再失去1个电子需要的能量稍高,则满足这一规律的图像为图乙.
(3)固体HF中存在氢键,则(HF)3的链状结构为
(4)CF2═CF2中C原子存在3对共用电子对,C原子为sp2杂化,但共聚物ETFE 中C 原子存在4对共用电子对,其C 原子为sp3杂化;由于F 元素的电负性较大,因此在与C 原子的结合过程中形成的C—F键的键能大于聚乙烯中C—H键的键能,键能的强弱决定物质的化学性质,键能越大,化学性质越稳定,因此聚四氟乙烯的化学稳定性高于聚乙烯.
(5)根据萤石晶胞结构,X 分布在晶胞的顶点和面心上,则1个晶胞中X 共有8×=4个,Y分布在晶胞内部,则1个晶胞中共有8个Y,因此该晶胞的化学式应为XY2,结合萤石的化学式可知,X代表的离子为Ca2+;由晶胞结构示意图可知,若将氟化钙晶胞平均分割成8个小立方体,则与F-等距且最近的Ca2+形成的空间构型为正四面体,F-位于该四面体的体心,所以晶体中正负离子的核间距的最小距离为体对角线长的
(2)甲;同一周期第一电离能的总体趋势是依次升高的,但由于N 元素的2p能级为半充满状态,因此N 元素的第一电离能较C、O2种元素大;乙.

(4)sp2;sp3;C—F 键的键能大于聚乙烯中C—H的键能,键能越大,化学性质越稳定.
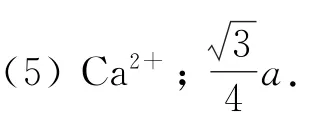
【真题品读】该命题由2008年的夏季奥运会的场馆“水立方”到2022年的冬奥会场馆“冰立方”切入命题,向考生传达了我国的科技奥运、绿色奥运理念,将命题烘托得如此诗意,将美丽的透光气囊材料的元素构成巧妙地融入试题之内,考查F 的轨道表示式、第一电离能递变规律、氢键、分子杂化和含氟矿石的晶体结构分析,知识点贯穿«物质结构与性质»的三大章节,体现考点的基础性和传承性,其中,对于(HF)3链状结构的表示、氟化钙晶胞中正负离子核间距最小距离的(注意单位是pm)计算更是知识点的创新考查.该试题完美地再现了命题背景新、考查形式新的双重创新,较好地诠释了高考立德树人、为国选拔创新型人才的命题理念.
5 关注最新科技成果,践行不对称性催化合成
例5(2022 年全国甲卷)用N-杂环卡宾碱(NHCbase)作为催化剂,可合成多环化合物.图6是一种多环化合物H 的合成路线(无须考虑部分中间体的立体化学).

图6
回答下列问题:
(1)A 的化学名称为_________.
(2)反应②涉及两步反应,已知第一步的反应类型为加成反应,第二步的反应类型为_________.
(3)写出C 与Br2/CCl4反应产物的结构简式_________.
(4)E的结构简式为_________.
(5)H 中含氧官能团的名称是_________.
(6)化合物X 是C的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X 的结构简式_________.

【真题品读】2021年诺贝尔化学奖授予科学家本亚明·利斯特和戴维·麦克米伦,以表彰他们在发展不对称有机催化中的贡献.回眸不对称性有机催化的诺贝尔奖的获奖历程,手性分子的考查是高中化学知识很好的呈现形式,该题最后一问完美地呈现了这一知识点,且手性分子这一知识点源自人教版教材选择性必修2的第60页和鲁科版教材选择性必修2的第52页,试题很好地落实了源于教材、高于教材的命题理念,将教材知识和诺贝尔奖进行了无缝对接.
此外,2022年全国甲卷第8题辅酶Q10的性质和全国乙卷第36题药物合成的试题情境均表现化学研究成果在保障人类健康中的作用,让学生认识到化学在预防疾病、保护身体健康中不可或缺的作用.2022年全国乙卷第28题通过呈现工业上硫化氢的不同处理方法,引导学生关注化学对生态环境和社会发展的影响,增强学生的社会责任感.
(完)
——以物质结构与性质模块“元素周期律”教学为例

