鳐鱼肝油的制备及其脂肪酸组成分析
林春波,吴 鹏,唐 旭,林锡煌,徐长安
(1.福建农林大学,福建 福州 350002; 2.自然资源部第三海洋研究所, 福建 厦门 361005)
鱼肝油主要含有脂溶性维生素A、D3以及DHA、EPA等多种ω-3多不饱和脂类。近年来,越来越多的研究显示,鱼肝油还具有更加广泛的临床应用,如抗炎、软化组织血管、改善情绪和认知功能、降低II型糖尿病风险、保护骨健康、增强生殖系统功能、营养皮肤、降低癌症风险、保护视力、促进自然减肥等功能[1]。纯天然未经深度加工的鱼肝油含有其他天然成分和有利于人体吸收的活性物质,能促使人体更好地吸收、利用、代谢天然维生素。
我国鱼肝油市场潜力巨大,但目前行业内还存在一些亟待解决的问题,比较突出的问题就是天然鱼肝脂肪油来源紧缺。我国目前所使用的《2015版药典》规定鱼肝油来源于鲛类动物肝脏。但由于可捕捞的鲨鱼种类及数量日益减少,且多数属于保护种,导致可用原料日益萎缩[2]。因此寻找鲨鱼肝脂肪油天然替代来源十分重要。
鳐鱼是板腮类多种软骨鱼的统称,属于鳐形目,主要分鳐科、魟科和鲼科,是鲨鱼的近亲[3]。近年来,我国鳐鱼的捕捞量逐年增加,已经成为主要出口水产品。国内现阶段水产加工企业在加工鳐鱼的过程中,会产生高比例的肝脏副产物,其中肝脏占比超过10%[4],是经济易得的鱼肝油加工原料。但由于脂质成份不明确和技术水平的限制,使得国内企业在鳐鱼肝脏高值化利用领域尚处于空白[5]。另一方面,鳐鱼加工副产物富含多不饱和脂肪酸,容易氧化酸败从而变质。如不及时利用处理,会造成资源浪费、环境污染[6]。本研究建立了鳐鱼肝油的提取及精炼工艺并分析了理化性质、脂肪酸组成,为合理开发鳐鱼加工副产物资源、降低环境污染、扩充天然鱼肝脂肪油来源提供科学依据[7]。
1 材料和方法
1.1 实验材料
鳐鱼肝由秦皇岛市新港水产有限公司提供,置于-20 ℃冰箱冻藏。鲨鱼肝油及鳕鱼肝油均由国药控股星鲨制药(厦门)有限公司提供。混合脂肪酸甲酯标准品与单一脂肪酸甲酯标准品,均购于Sigma公司。本实验所用试剂如氢氧化钠(NaOH)、磷酸、柠檬酸、活性白土、盐酸(HCl)、焦性没食子酸(C6H6O3)、2,6-二叔丁基对甲酚、甲醇(CH3OH, 色谱纯)、石油醚、三氟化硼甲醇溶液(浓度14%)、正己烷(色谱纯)、无水硫酸钠等,除另有说明,均为国产分析纯,购于厦门市绿茵试剂玻仪有限公司。
1.2 主要仪器和设备
GCMS-QP2010型气相色谱-质谱联用仪(SHIMADZU,日本岛津),分析天平[精确度0.000 1 g,赛多利斯科学仪器(北京)有限公司],N-1100型旋转蒸发仪(上海爱朗仪器有限公司),TG16-WS型离心机(长沙维尔康湘鹰离心机有限公司),KQ-300E型超声波清洗机(昆山市超声仪器有限公司),JMLB-50型胶体磨(上海科劳机械设备有限公司),DF-101S型集热式恒温磁力搅拌器。
1.2 实验方法
1.2.1 粗鳐鱼肝油的提取 粗鱼油提取工艺在实际生产中常用碱法和酶法。碱法工艺简单、提取率较高,但废液处理会增加成本且造成环境污染。酶法提取条件温和,但蛋白酶添加量高,一般添加量在原料的2%(质量分数)以上[8-9],且需加入较多NaOH来调节pH,在分离鱼油时也存在油水两相乳化的问题,酶解后废料内蛋白质含量很低,无法作为饲料添加剂再利用。除此之外,酶解法还会使鱼肝油带有异味,为后期除臭增加工作量[10]。本研究探索了一种新方法,利用“冷冻-解冻”的方法提取粗油,即利用冻结、解冻加之物理粉碎,同时超声辅助提取的方法,原理是利用温度场的循环变化使乳状液中的油水两相发生反复相变,破坏其乳状的液体系,从而使得油脂从乳状液中分离出来。此方法与上述碱法和酶法相比,无任何添加物,既降低成本,又无多余杂质残留,也无多余反应,不会造成环境污染。
理论鱼肝油含量为鳐鱼肝脏的粗脂肪含量,利用索氏提取法进行测定。精密称取5~10 g鳐鱼肝,研细,全部移入滤纸筒内。将滤纸筒放入脂肪萃取器的样品室内,连接已干燥至恒重的收集瓶,从萃取器冷凝管上端加入无水乙醚或石油醚至瓶内容积的2/3处,水浴加热,使乙醚或石油醚不断回流提取6~12 h。取下收集瓶,回收乙醚或石油醚,待收集瓶内乙醚剩1~2 mL时水浴蒸干,再于95~105 ℃干燥20 min,放干燥器内冷却0.5 h后称量M总。理论鱼肝油含量=[(M总-M瓶)/M样]×100%。
取-18 ℃冻藏的鳐鱼肝1 kg,以超声辅助自然解冻,用胶体磨粉碎后装入离心瓶后放入超声锅,在40 kHz下超声处理2 h,目的是利用超声的功率特性和空化作用,加速水油分离;静置12 h后将其置于大容量离心机中,在转速10 000 r/min、25 ℃下离心10 min,分离得上层粗鱼肝油,计算提取率。粗鱼肝油提取率=(提取的粗鱼肝油质量/理论鱼肝油质量)×100%。
1.2.2 粗鳐鱼肝油精炼 ①脱胶。准确称取100 g粗鳐鱼肝油于锥形瓶内,加入5 g配制好的脱胶剂(85%磷酸和40%柠檬酸, 体积比为1.5∶1.0),50 ℃水浴加热搅拌30 min后,10 000 r/min离心10 min (24 ℃)[11],将上层脱胶鱼肝油移置干净锥形瓶内。称量并计算提取率。
②脱酸。以NaOH添加量(以油重的百分比计,下同)、加热时间、加热温度为主要影响因素,鱼肝油提取率(%)为评价指标,采用3因素1水平响应面法对鱼肝油脱酸工艺进行优化。为了综合多指标考察鱼肝油脱酸工艺,首先对鱼肝油脱酸工艺影响较大的单因素(NaOH添加量、加热时间、加热温度)进行考察,确定优化范围。将脱胶鱼肝油准确称量于干净锥形瓶内,在其他处理条件一致的情况下,分别设置合适的NaOH添加量、加热时间、加热温度,以脱酸鱼肝油提取率为指标[12],考察其对鱼肝油脱酸效果的影响。
③脱色。将脱酸鱼肝油准确称量于干净锥形瓶内,加入一定量的活性白土在70 ℃下脱色20 min,然后10 000 r/min、24 ℃下离心10 min,获得上层清油,即脱色鱼肝油。称量并计录数据。
④脱臭。将脱胶鱼肝油准确称量于干净蒸馏瓶内,40 ℃,60 r/min下减压蒸馏不等时间进行脱臭处理[13],获得脱臭鱼肝油。称量并计录数据。
1.2.3 理化指标的检测 水分及挥发物含量按照《动植物油脂水分及挥发物的测定》[14]中电热干燥箱法测定。酸值按照《食品中酸价的测定》[15]中冷溶剂指示剂滴定法测定。碘值按照《动植物油脂碘值的测定》[16]中的方法测定。过氧化值按照《食品中过氧化值的测定》[17]中的滴定法测定。不皂化物按照《动植物油脂不皂化物测定》[18]中己烷提取法测定。
1.2.4 脂肪酸组成分析 ①样品前处理。取0.08 g鱼肝油于15 mL离心管中,加入2 mL0.5 mol/L的KOH-CH3OH溶液,在65 ℃下皂化30 min,然后冷却至室温。加入20滴0.5 mol/L的HCl调节pH,使pH小于2,再加入4 mL的BF3·MeOH溶液,煮沸3 min,进行甲酯化[19]。冷却至室温后加入4 mL饱和NaCl溶液,用2 mL正己烷萃取,有机相用无水硫酸钠干燥,用0.22 μm的有机滤膜过滤所得样品后,使用GC-MS测定脂肪酸相对含量[20]。
②气相色谱条件。色谱柱:Rtx-5MS (60 m×0.25 mm, 0.25 μm);载气:高纯 He;分流进样;进样量1 μL;检测温度:280 ℃;程序升温:起始柱温设定为60 ℃[21],以15 ℃/min升至160 ℃,保持1 min,再以5 ℃/min升至220 ℃,保持10 min;最后以5 ℃/min升至280 ℃,保持5 min。
2 结果与讨论
2.1 鳐鱼肝油精炼工艺参数的确定
2.1.1 粗鳐鱼脂肪油提取 冻融法的原理是利用温度场的循环变化,使鱼肝油中的油水两相发生反复相变,破坏其乳化体系,从鱼肝中分离出油脂。本研究利用冻融法得到的粗油,既无任何添加物,又无多余杂质残留,且提取率(表1)高于臧丽芹等(2013)利用酶解法得到的粗油的提取率(86%)[22],具有极大的应用价值。
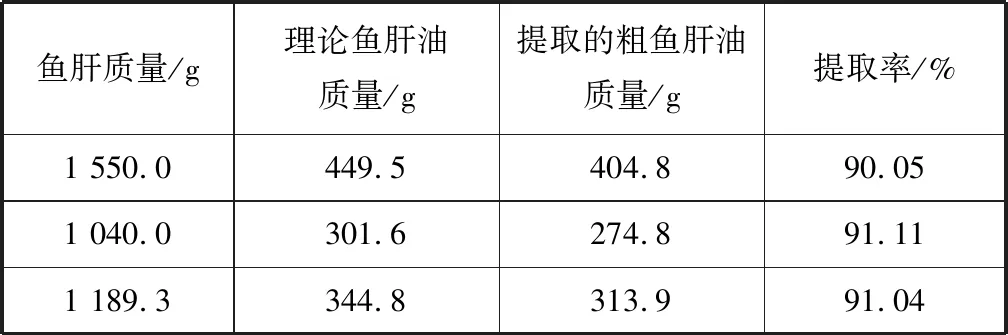
表1 冻融法提取粗鳐鱼肝油的提取率
2.1.2 脱酸工艺参数确定 粗鳐鱼肝油的脱酸主要是游离脂肪酸与足量的NaOH发生中和反应,使游离脂肪酸皂化[23]。为了降低精炼油的颜色和确保去除痕量成分,须向体系中加入过量NaOH,通过离心和水洗可去除皂和磷脂。实验发现NaOH的添加量是影响脱酸效果的主要原因,温度及加热时间也有一定影响。为确定最优工艺,分别考察了NaOH添加量、加热温度及加热时间3个因素对脱酸提取率和酸值的影响。单因素实验结果及酸值测定结果详见图1。

图1 各因素对提取率及酸值的影响Fig. 1 Influences of different factors on extraction yield and acid value根据标准《鱼油》[24]可知,对于精制鱼油,酸值≤1为一级鱼油,酸值≤3为二级鱼油。
①NaOH添加量的影响。固定加热温度为85 ℃、加热时间为20 min,考察不同NaOH添加量对脱酸鱼肝油提取率和酸值的影响。准确称量40 g脱胶鱼油,分别加入8、10、12、14 g NaOH进行脱酸。实验结果如图1(a)所示,鱼肝油提取率随着NaOH添加量的增加呈现下降的趋势,下降趋势为一个百分点左右,表明NaOH添加量对提取率的影响较大。酸值随着NaOH添加量的增加也呈现下降趋势。
②加热温度的影响。固定NaOH添加量为20.0%、加热时间为20 min,考察不同加热温度对脱酸鱼肝油提取率和酸值的影响。准确称量40 g脱胶鱼油,分别在65、70、75、80、85 ℃下进行脱酸。实验结果如图1(b)所示,鱼肝油提取率随着温度的升高呈现极小的下降趋势,表明加热温度对提取率影响不大。酸值随着温度的升高呈现下降趋势。
③加热时间的影响。固定加热温度为85 ℃、NaOH添加量为20.0%,考察不同加热时间对脱酸鱼肝油提取率和酸值的影响。准确称量40 g脱胶鱼油,分别加热15、20、25、30 min进行脱酸。实验结果如图1(c)所示,鱼肝油提取率随着加热时间增加呈现下降趋势,但变化极小,表明加热时间对提取率的影响也较小。酸值随着加热时间增加也呈现下降趋势。
④响应面实验方案设计。在单因素考察的基础上,以加热温度(℃,A)、加热时间(min,B)、NaOH添加量(%,C)3个因素作自变量,以脱酸鱼肝油提取率(%,Y)作因变量,采用响应面法优化最佳提取工艺。实验设计如表2,共17组,每组分别称取脱胶鱼肝油约36 g,实验结束后称量计算提取率。

表2 脱酸鱼肝油提取率响应面实验数据
⑤模型拟合和提取工艺优化。采用Design-Expert 8.0.6对鱼肝油脱酸工艺实验结果进行多元回归拟合。经过运算后得到鱼肝油脱酸提取率(%,Y)、对加热温度(℃,A)、加热时间(min,B)、NaOH添加量(%,C)的模型,其拟合回归模拟方程如下,其回归模型的方差分析见表3。Y(提取率)=0.94-7.639×10-3A-8.736×10-3B-0.030C+9.395×10-5A·B+9.197×10-4A·C-1.878×10-3B·C-9.772×10-4A2+1.596×10-3B2+0.013C2。
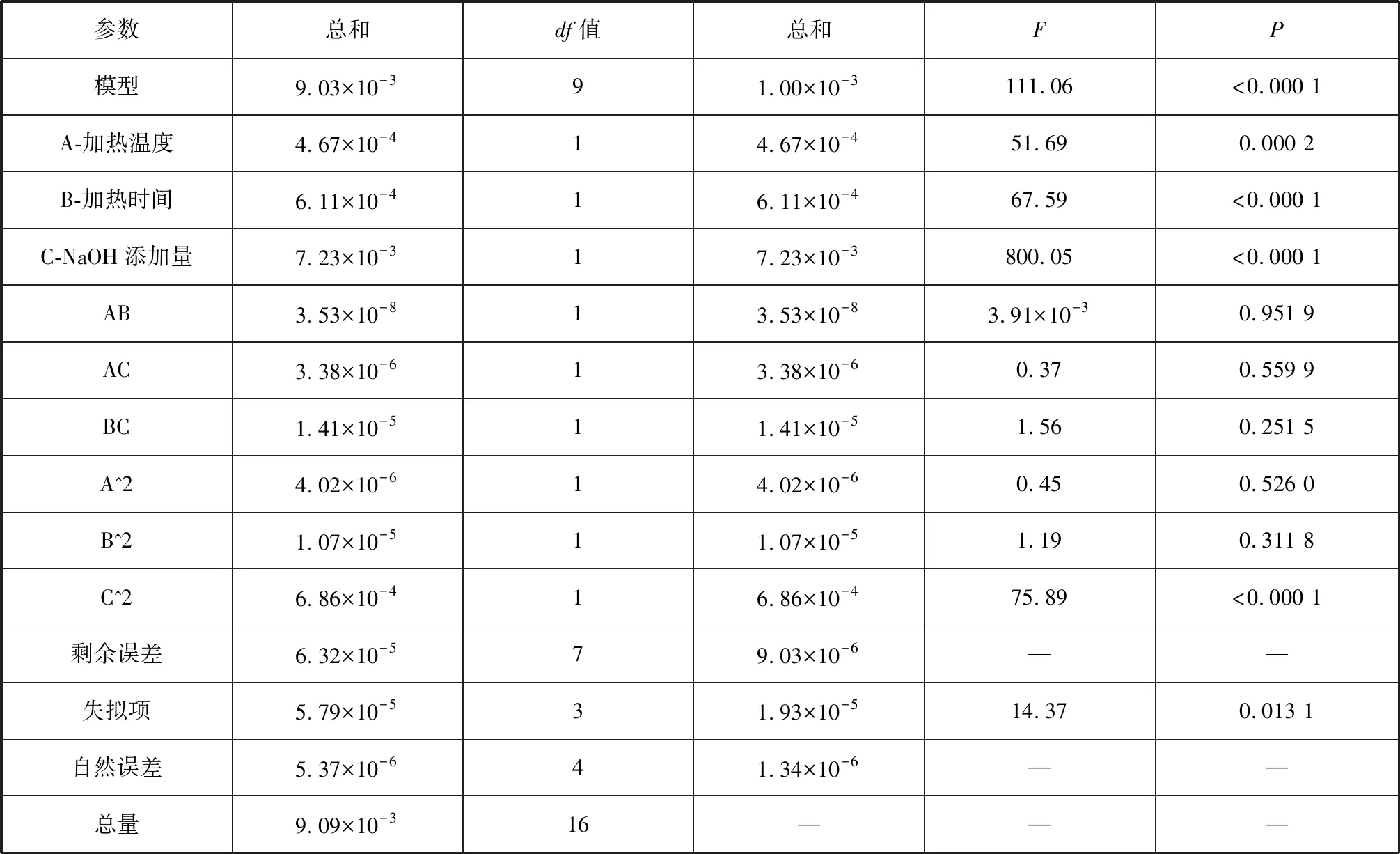
表3 回归模型的方差分析结果
图2显示了各因素对鱼肝油提取率交互作用的响应面实验结果。根据图2(a)可知,升高温度对提取率影响不明显,且加热时间与加热温度相互作用不紧密,因此二者相互不显著。图2(b)中,升高温度对提取率影响不明显,但NaOH添加量对提取率的影响较大。同时可见二者具有一定的相互作用。由图2(c)可知,延长加热时间对提取率影响不明显,但NaOH添加量对提取率的影响很大,且二者具有一定的相互作用。
利用Design-Expert 8.0.6软件对上述实验结果进行优化,以Y最大化为原则,得到优化的最佳脱酸工艺条件为:NaOH添加量为20.0%(质量分数),温度为69.78 ℃,时间为15.72 min。但结合实际操作的可行性,同时考虑到酸值不仅需要满足一级鱼油标准,也需使游离脂肪酸尽可能去除,由单因素实验可以得出,加热温度为75 ℃时游离脂肪酸基本被完全去除,故确定最优工艺条件为:NaOH添加量20.0%(质量分数),加热温度75 ℃,加热时间20 min,预测提取率为70.16%。用以上条件参数进行平行实验3次,平均提取率为70.08%,相对误差值为0.11%。
2.1.3 脱色工艺参数的确定 脱色过程是破坏或吸附一级氧化产物,色素和痕量的金属离子均可以使用活性白土加以去除[25]。活性白土添加量(以油重的百分比计,下同)是影响脱色效果的重要原因,因此本研究重点考察了活性白土不同添加量对鱼肝油的脱色效果、损失率及提取率的影响,从而确定脱色工艺参数,详见表4。

表4 活性白土添加量对颜色、损失率及提取率的影响

图2 各因素对鳐鱼肝油提取率交互作用的响应面图Fig. 2 Response surface diagram of the interaction of various factors on the extraction yield of skate liver oil
由表4可知,当活性白土添加量为6%与5%时,得到的脱色鱼油较浑浊;当活性白土添加量为10%与8%时,得到的脱色鱼油均为澄清。随活性白土添加量的增多,损失率增加。再结合表1,发现活性白土添加量为8%时的损失率低且提取率较高,故确定脱色最佳工艺参数为活性白土添加量为8%。
2.1.3 脱臭工艺参数的确定 脱臭主要是在高真空条件下,经过蒸馏去除油中微量的脂肪酸、醛类、酮类和其他挥发性化合物,得到口感及气味温和的油[26]。根据文献资料,本研究固定蒸馏温度为40 ℃,主要考察蒸馏时间对脱臭的影响,详见表5。

表5 蒸馏时间对颜色、气味及提取率的影响
由表5可知,当蒸馏时间为20 min及30 min时,虽提取率高,但腥臭味较大,当蒸馏时间为60 min时,提取率较高且腥臭味很小,故确定脱臭最佳工艺参数为在40 ℃、60 r/min下减压蒸馏60 min。
2.2 精炼鳐鱼肝脂肪油的理化性质
常规生产鱼肝油过程中得到的粗鱼肝油含有不同量的非甘油酯共存成分(如蛋白质、磷脂、色素等)[27]。这些杂质通过脱胶、脱酸、脱色、脱臭等精炼工艺进行脱除,得到酸值、过氧化值等理化指标合格的精制鱼肝油(表6)。

表6 精制鳐鱼肝油的理化性质及与标准的比较
由表6可知,精炼后的鳐鱼肝油的理化性质均满足一级鱼油标准,其中不溶性杂质、不皂化物、酸值、过氧化值以及茴香胺值均远远优于一级鱼油标准的质量要求。由此可知,本研究所采用的精炼方法能获得品质较高的鱼肝油,获得的精炼鱼肝油颜色为金黄、澄清,略有鱼腥味。
2.3 不同来源天然鱼肝油的脂肪酸组成分析
鱼肝油功能多样归因于其丰富的活性物质。脂肪酸是鱼肝油的主要功能成分,各种动植物油脂中脂肪酸组成及含量均存在较明显的差异,尤其是特征脂肪酸更是如此[28]。确定不同来源的天然鱼肝油脂肪酸组成及其相对含量,能为扩大天然鱼肝油来源种类提供理论依据。图3为鳕鱼肝油、鲨鱼肝油、精制鳐鱼肝油、粗鳐鱼肝油的脂肪酸组成图谱。对照标准品的目标离子、参考离子以及保留时间进行逐个定性,再利用面积归一法计算每种脂肪酸的相对含量,结果如表7所示。

图3 四种鱼肝油脂肪酸组成图谱Fig. 3 Fatty acid composition map of four fish liver oils

表7 四种鱼肝油的脂肪酸组成分析

续表
由表7可知,几种鱼肝油均含有C14~C22脂肪酸23种,其中有饱和脂肪酸5种,单不饱和脂肪酸7种,多不饱和脂肪酸11种。对比粗鳐鱼肝油与精制鳐鱼肝油的脂肪酸成分,发现粗鳐鱼肝油的不饱和脂肪酸占88.24%,其中多不饱和脂肪酸占45.10%。较为重要的多不饱和脂肪酸EPA和DHA的含量也较高,分别为10.17%与13.61%。精制鳐鱼肝油的脂肪酸组成变化不大,不饱和脂肪酸占87.62%,其中多不饱和脂肪酸占44.48%。EPA和DHA的含量也基本无改变,分别为8.65%与15.04%。这说明鳐鱼肝油精炼过程对其脂肪酸组成影响较小。
对比鳕鱼肝油、鲨鱼肝油以及精制和粗鳐鱼肝油的脂肪酸组成数据(表7),鳕鱼肝油中DHA和EPA含量分别为11.09%和8.78%,鲨鱼肝油中DHA和EPA含量分别为12.10%和2.74%,由此可知,本工艺生产的鳐鱼肝油中的EPA含量及DHA含量均较高。
2.4 讨论
采用冻融法提取鳐鱼肝粗油与臧丽芹等利用酶解法提取鳐鱼肝油[22]相比,冻融法无任何添加物,成本低,无多余反应,无杂质残留,且提取率高达90%,高于酶解法的86%,具有极大的应用价值。由脱酸实验可知酸值在某些特定条件下变化较大:当改变NaOH添加量时,加入的碱与游离脂肪酸反应,随着NaOH添加量的增加,油脂中的游离脂肪酸更多地被清除,从而导致酸值降低。加热温度由75 ℃变为80 ℃时酸值下降最为明显,其中的原因可能是随温度上升,分子运动加速,分子间的碰撞几率增加[5]。温度继续升高,变化不大,由此可推测在75~80 ℃之间碱炼反应速度达到最佳,使油脂中的游离脂肪酸在相同时间内被较多地清除。加热时间延长一倍,对酸值的影响在1.0~1.5倍之间,其原因可能是随着加热时间的增加,加入的碱与鱼肝油中游离脂肪酸进一步反应,导致酸值降低。而在25~30 min酸值变化极小,可能是鱼肝油中游离脂肪酸基本已反应完全。对精炼鳐鱼肝油进行检测分析,同时与粗鳐鱼肝油、鳕鱼肝油以及鲨鱼肝油进行对比,发现精炼后的鳐鱼肝油呈澄清、金黄色,稍有鱼腥味,各项理化指标均达到了一级鱼油标准;精炼前后脂肪酸组成基本没有太大变化,DHA与EPA含量均较高。但市售鳕鱼肝油与鲨鱼肝油颜色会更浅一些,因此在鳐鱼肝油脱色方面还需要进一步研究。
3 结论
本研究采用冻融法提取鳐鱼肝粗油,无添加物,无杂质残留,提取率达到90%,远高于酶解法。通过响应面实验获得鳐鱼肝油精炼工艺的最佳参数,用5%(质量分数)的脱胶剂脱胶(40%柠檬酸与85%磷酸按体积比1.0∶1.5混合),用20%(质量分数)NaOH脱酸(75 ℃,20 min),用8%(质量分数)的活性白土脱色,在40 ℃、60 r/min条件下减压蒸馏60 min脱臭。在此条件下精炼,脂肪酸组成变化十分不明显,精炼后的鳐鱼肝油呈澄清、金黄色,稍有鱼腥味,各项理化指标均达到了一级鱼油标准。同时对精制鳐鱼肝油进行了脂肪酸成分分析,得到精制鳐鱼肝油含有C14~C22脂肪酸23种,其中饱和脂肪酸7种,单不饱和脂肪酸5种,多不饱和脂肪酸11种;饱和脂肪酸和不饱和脂肪酸分别占脂肪酸总量的12.39%和87.61%;饱和脂肪酸主要是C14:0(豆蔻酸)与C18:0(棕榈酸),分别占脂肪酸总量的6.42%和4.47%;单不饱和脂肪酸主要是C16:1-9c与C18:1-9c,分别占脂肪酸总量的7.38%和10.84%;多不饱和脂肪多烯酸主要是C20:5(EPA)与C22:6(DHA),分别占脂肪酸总量的8.65%和15.04%。与市售鳕鱼肝油及鲨鱼肝油对比,脂肪酸种类相同且含量相差不大,但主要脂肪酸DHA及EPA含量更高,可为扩大天然鱼肝油来源提供科学依据。

