乳酸乳球菌XP-15对仿刺参生长、免疫及肠道菌群结构的影响
杨求华
(福建省水产研究所、福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
仿刺参(Apostichopusjaponicus)隶属于海参纲、辛那参目、刺参科、仿刺参属(Apostichopus),自然分布于北太平洋浅海,是我国海水养殖中重要的养殖品种之一。2020年全国海参养殖面积为24.28万公顷,养殖产量为19.66万吨,全产业链产值突破600亿元[1]。福建省自2003年起开展“北参南养”实验,近年来发展迅速,至2020年全省养殖产量为2.81万吨,居全国第三,是我国南方最大的海参养殖产地,并形成了集苗种、养殖、加工、交易、存储和产业金融为一体的全产业链体系[1]。然而,随着养殖规模的不断扩大,仿刺参养殖疾病也时有发生,其中塔氏弧菌(Vibriotubiashii)、伯麦罗氏弧菌(V.pomeroyi)、灿烂弧菌(V.splendidus)等细菌性病原被先后报道[2-4]。常规的抗生素治疗虽然在一定程度上缓解了水产养殖生物疾病的发生,但过度依赖和滥用抗生素已导致水产养殖业出现严重问题[5-6]。闫倩倩等(2020)的研究结果显示,在山东地区仿刺参肠道内存在一定数量的耐药菌,如弧菌属(Vibrio)、嗜冷杆菌属(Psychrobacter)等,其中耐药相关基因tetA、tetG、qnrA等的拷贝数要高于16S rDNA的相对含量[7]。因此,开展抗生素替代品的研究已成为水产养殖中的一个迫切任务。益生菌是在宿主体内可发挥益生功能的微生物类群,可提高宿主免疫力,提高环境应激和疾病抵御能力,提高宿主生长和改善肠道菌群稳态[8-9],成为当前水产病害防治研究的热点[10]。目前水产养殖中常用的益生菌种类有乳酸菌,芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)等[11-12]。Maeda等(2014)采用1×105CFU/g菌浓度的乳酸乳球菌(Lactococcuslactis)D1813投喂日本对虾(Marsupenaeusjaponicus),而后用杀对虾弧菌(V.penaeicida)浸泡攻毒,结果表明实验组对虾的累计成活率为61.7%,显著高于对照组的28.3%[13]。Adel等(2016)的研究结果表明,乳酸乳球菌可显著提高南美白对虾(Litopenameivannamei)的生长速度、存活率和肠道酶活性[14]。本研究以仿刺参为实验对象,以乳酸乳球菌XP-15为候选菌株,研究乳酸乳球菌对仿刺参生长、免疫及肠道菌群结构的影响,以期为该菌作为候选益生菌种在水产养殖特别是仿刺参养殖上的应用提供参考。
1 材料和方法
1.1 材料
实验菌株:乳酸乳球菌XP-15为本研究从福建吊笼养殖仿刺参肠道中分离,并采用生理生化等方法进行鉴定、保藏。
实验动物:健康仿刺参共240头,购买自漳州某海参养殖基地。
1.2 方法
1.2.1 饲料制备 菌株XP-15添加饲料:将过夜培养的XP-15菌液用无菌生理盐水调至OD600值为0.1,取150 mL菌液与300 g粉状海参基础饲料(威海金牌生物科技有限公司)混合,30 ℃、180 r/min摇床中震荡混合2 h,使菌株XP-15的有效菌浓度为1×108CFU/g。
基础饲料:将150 mL新鲜配制培养基添加至300 g海参基础饲料,30 ℃、180 r/min摇床中震荡混合2 h。
1.2.2 实验管理 将240头健康的仿刺参饥饿处理2 d后暂养7 d(基础饲料投喂),随后随机分成两组,其中实验组(XP-15组)平均体质量为(42.10±1.93) g,对照组(CK组)平均体质量为(43.63±2.15) g,每组设3个平行,每个平行40头。将仿刺参置于长宽高分别为1.2、0.5、0.8 m的水槽中进行养殖,不间断充气,采用定时(08:00、20:00)、定量(日均投喂量约为体重的3%)投喂,实验组投喂菌株XP-15添加饲料,对照组投喂基础饲料。采用流水养殖,投喂期间不流水,于投喂前用虹吸管清除残余饲料和排泄物,每天观察仿刺参摄食和生长情况。实验期间水温为18~20 ℃,盐度为26~28,pH为7.4~8.0,实验周期为8周。
1.2.3 生长指标 至实验结束时,仿刺参停止投喂24 h后随机抽取30头测定平均体质量,计算增重率(RWGR),其公式为
(1)
式(1)中:Wt为终末体质量(g),W0为初始体质量(g)。
1.2.4 肠道菌群结构分析 参照文献[15],采用MiSeq高通量测序方法分析仿刺参肠道菌群结构。于每周每组随机挑选9头仿刺参(每个平行取3头),无菌条件下取肠道及其内容物,进行混样,提取DNA并电泳检测,切胶回收产物送Illumina公司进行微生物多样性分析。
1.2.5 肠道免疫酶活力测定 第6周在每组随机挑选9头仿刺参(每个平行取3头),无菌条件下去除肠道内容物,采集肠壁,每个平行的3头仿刺参肠道进行混样,称重后在预冷的研磨皿中进行研磨,随后按照免疫酶活力测定试剂盒(南京建成生物工程研究所)方法进行酶活力测定,测定指标包括:一氧化氮合成酶(nitric oxide synthase, NOS)、酸性磷酸酶(acid phosphatase, ACP)、溶菌酶(lysozyme, LZM)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)等,每个实验组设3个生物学重复。
1.2.6 人工感染实验 第8周时取部分仿刺参进行免疫保护率实验,每组随机挑选30头仿刺参(每个平行取10头),随机分成3个重复,采用体腔注射法进行攻毒感染实验,选用半致死浓度(LD50)为2.05×105CFU/mL的南移仿刺参病原菌塔式弧菌[2]为实验菌株(菌浓度为1.00×108CFU/mL),注射剂量为0.1 mL/头,每天观察并记录仿刺参状态及死亡情况。
1.3 数据统计与分析
实验结果采用SPSS 19.0软件单因素方差(ANOVA)进行差异性显著分析,并用Origin 8.0软件和Excel 2017软件进行作图分析。
2 结果与讨论
2.1 菌株XP-15对仿刺参生长的影响
菌株投喂后的生长情况如表1所示,选择初始体重分别为(43.63±2.15) g和(42.10±1.93) g的XP-15组和CK组仿刺参,经过为期8周的投喂实验,至实验结束时XP-15组和CK组的终末体重分别为(96.91±3.34) g和(88.16±4.08) g,平均增重率分别为122.19%和109.46%;XP-15组的增重率显著高于CK组(P<0.05),表明菌株XP-15对仿刺参的生长具有一定的促进作用,这可能是由于饲料中的乳酸乳球菌通过刺激仿刺参肠道消化酶的产生,从而提高饲料利用率,进而提高仿刺参的生长性能。有研究结果表明,在水产动物中投喂益生菌可以改善其肠道菌群结构并对饲料中一些营养因子进行预消化,从而起到促进宿主生长的效果[16-17]。周慧慧等(2010)在稚参期的仿刺参基础饲料中添加芽孢杆菌属菌株GSC-1、GSC-2和肠球菌属菌株GSC-3等益生菌株,能有效提高其特定生长率[18];Kong等(2020)在乌鳢(Channaargus)饲料中添加乳酸乳球菌,对鱼体生长具有显著的促进作用[19];此外在南美白对虾[20]、拟穴青蟹(Scyllaparamamosain)[12]等物种的配合饲料中添加益生菌株,均起到了较好的生长促进作用。
2.2 菌株XP-15对仿刺参肠道菌群结构的影响
菌株投喂后的仿刺参肠道微生物测序结果如图1所示,在门水平上,XP-15组和CK组的细菌菌群结构组成包括厚壁菌门、变形菌门、拟杆菌门、放线菌门、蓝细菌门等,其中以厚壁菌门、变形菌门和拟杆菌门等3个门类为主。从菌群结构变化趋势上看,XP-15组的厚壁菌门和拟杆菌门呈现由低丰度向高丰度转变的过程。其中厚壁菌门的相对丰度在7.82%~78.38%范围内,呈现先升高后下降的趋势,其中第5周时最高,为78.38%;至第8周时厚壁菌门的相对丰度为54.92%;其次为拟杆菌门的32.87%,而变形菌门的相对丰度由第1周的73.95%降至第8周的11.29%[图1(a)]。在CK组则呈现不一样的变化趋势[图1(b)],其中厚壁菌门相对丰度呈现时高时低,比例基本维持在21.87%~93.06%不等,其中在第1周的相对丰度最高,达到93.06%,为肠道微生物组成的主要类群;而变形菌门呈现出增加趋势,在第8周时相对丰度达到52.84%。高通量测序技术能够摆脱传统培养条件的限制,快速、准确地对环境或者样品中的细菌群落组成,特别是对不可培养细菌具有较好的鉴别能力[21]。有研究结果表明,厚壁菌门菌株至少含有44种与抗性淀粉酶降解有关的基因,因此厚壁菌门和拟杆菌门菌株可以帮助宿主降解其不能降解的多糖类物质,从而为宿主生长提供能量[22]。

图1 门水平上XP-15组和CK组肠道菌群结构组成Fig. 1 Composition of intestinal flora in XP-15 and CK groups at phylum level
在属水平上,XP-15组的菌群结构组成包括乳球菌属(Lactococcus)、雷尔氏菌属(Ralstonia)、不动杆菌属(Lutibacter)、弧菌属、片球菌属(Pediococcus)、红球菌属(Rhodococcus)等[图2(a)],随着投喂时间的增加,仿刺参肠道中乳球菌属的相对丰度逐渐增加,在第7周时达到最大,占比为76.23%,随后有所下降,在第8周时占比为54.00%,明显高于CK组的7.33%,表明乳酸乳球菌XP-15能较好地在仿刺参肠道中定殖。夏耘等(2019)在罗非鱼(Oreochromisniloticus)的研究中也得到类似结果,其在饲料中添加1×108CFU/g的乳酸乳球菌,连续投喂42 d后进行高通量测序,发现其中乳酸乳球菌的比例也显著增加[23]。此外,同步增加的还有不动杆菌属的细菌群落,在第8周时占比为31.95%;而片球菌属、普雷沃菌属(Prevotella)等细菌组成呈现下降趋势[图2(a)]。CK组中细菌组成主要包括有肠球菌属、雷尔氏菌属和不动杆菌属,其中又以肠球菌属的细菌占比最高[图2(b)]。肠球菌属也是水生生物中常见的益生菌种,周慧慧等从健康仿刺参肠道中分离到肠球菌属菌株GSC-3,表明其能促进仿刺参的生长和提高抗病能力[18]。

图2 属水平上实验组和对照组肠道菌群结构组成Fig. 2 Composition of intestinal flora in experimental (a) and control (b) groups at genus level
2.3 菌株XP-15对仿刺参免肠道疫力的影响
2.3.1 菌株XP-15对仿刺参肠道免疫酶活力的影响 参照文献[12, 23]对益生菌投喂实验周期的设计,本研究实验共8周,于第6周测定乳酸乳球菌投喂后仿刺参肠道免疫酶活力的变化,随后进行人工感染实验测定免疫保护率。菌株投喂后的免疫酶活力测定结果如表2所示,仿刺参肠道的5个免疫酶活力指标中,XP-15组中一氧化氮合成酶、酸性磷酸酶、超氧化物歧化酶的酶活力值分别为(9.61±0.17) U/mg、(49.80±5.87) U/g、(188.99±4.06) U/mg,均显著高于CK组(P<0.05),表明菌株XP-15对仿刺参具有一定的免疫促进作用。研究结果显示,在仿刺参、乌鳢等水产动物饲料中添加肠球菌、乳球菌等菌株可有效提高酚氧化酶、溶菌酶、酸性磷酸酶和超氧化物歧化酶等免疫酶活性[18-19]。常杰等(2011)的研究结果表明,一氧化氮合成酶是机体非特异性免疫系统的重要组成部分,能被诱导产生NO[24],NO能够介导炎症和免疫系统,从而对病原生物起到抑制作用[25];溶菌酶是一种碱性酶,能水解致病细菌中的粘多糖[26];酸性磷酸酶能够维持细胞正常代谢活动,参与消除生物大分子,降解入侵的病原体[27];而超氧化物歧化酶和过氧化氢酶也是防止自由基形成的重要抗氧化酶[28]。本研究结果表明,XP-15组的免疫酶活力明显高于CK组,可能与宿主投喂的XP-15菌株在肠道中定殖,并激活的肠道黏膜免疫有关[29]。

表2 菌株XP-15对仿刺参肠道免疫酶活力的影响
2.3.2 菌株XP-15对仿刺参抵御病原的影响 研究结果表明,在饲料中补充益生菌可通过调节宿主的细胞免疫和体液免疫的水平改变宿主肠道菌群结构,或者增强宿主对入侵病原菌的免疫反应,从而增强宿主对入侵病原体的抵抗能力[30-33]。在本研究中,投喂至第6周后,从XP-15组和CK组中随机挑选30头进行塔氏弧菌人工感染实验[2],结果表明,CK组在注射后的第2天仿刺参开始出现吐肠、摇头,吸附力降低,体表溃烂等症状,至第7天成活率降至43.33%,至第14天时成活率为33.33%。XP-15组从第3天开始有个别仿刺参出现吐肠、体表溃烂等症状,至第14天时成活率为73.33%,显著高于CK组(P<0.05),表明投喂菌株XP-15后可以在一定程度上提高仿刺参抵御塔氏弧菌的能力(图3),这可能与一氧化氮合成酶、酸性磷酸酶、溶菌酶和超氧化物歧化酶等免疫酶活力的高水平表达有关[34]。
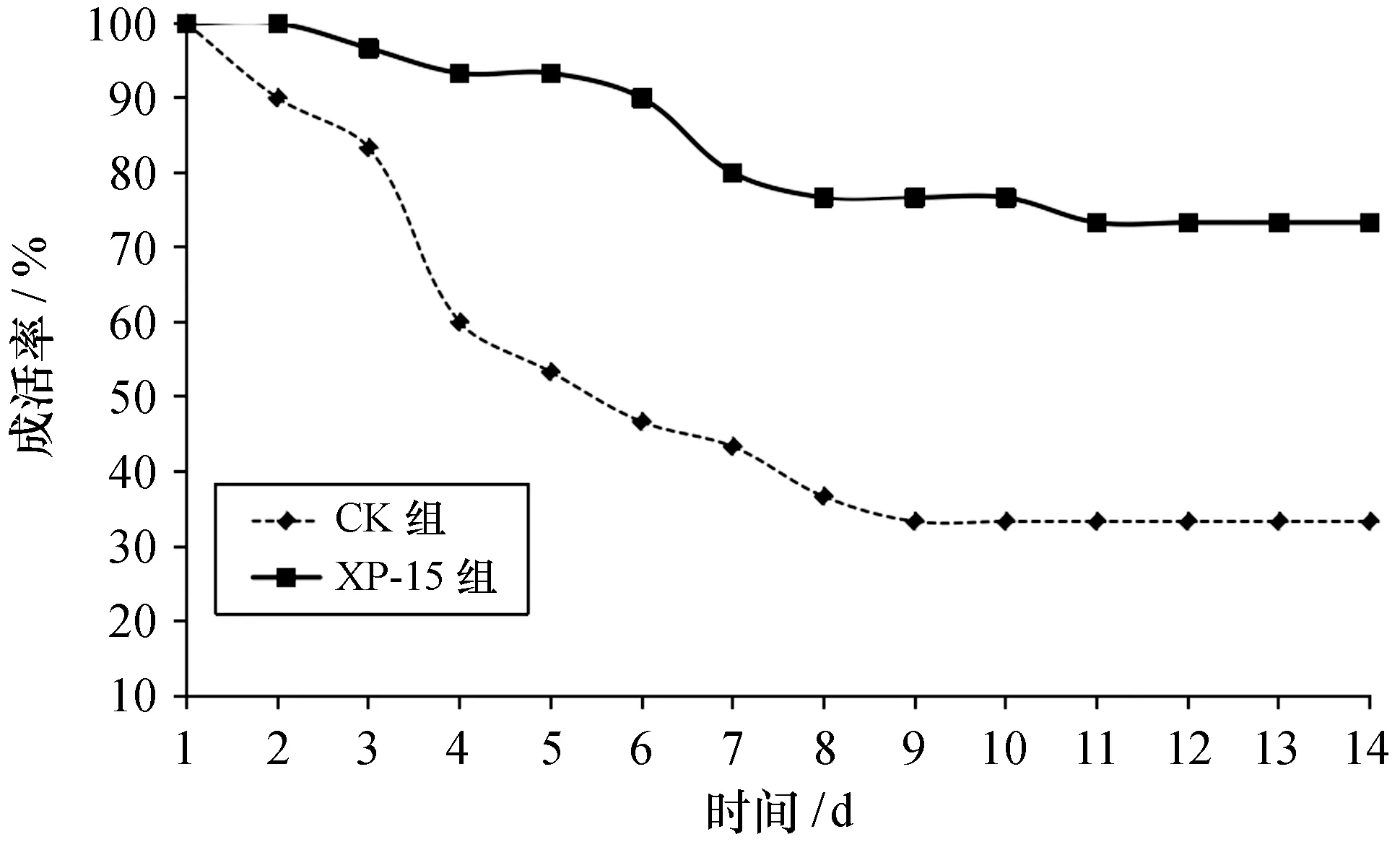
图3 XP-15组和CK组投喂后采用塔氏弧菌攻毒感染下仿刺参成活率Fig. 3 Survival rate of sea cucumber infected with V. tubiashii in XP-15 and CK groups
3 结论
随着对水产品质量安全的关注度越来越高,水产绿色养殖正在成为行业发展方向,替抗产品的开发也得到越来越多学者的关注。本研究表明,经连续8周的投喂,乳酸乳球菌XP-15能够较好地在仿刺参肠道内定殖,在一定程度上提高宿主的生长,并通过提高宿主的非特异性免疫酶活力水平增强抵御病原侵染的能力;研究结果可以为乳酸乳球菌在水产养殖特别是仿刺参养殖中的推广应用提供了基础资料。

