中国亚热带-热带3个海区微型鞭毛虫群落优势种和稀有种的分布特征和建群机制
郭 馨,林晓晴,郑欣怡,刘 强,黄 成,逄萌雯,2,陈星星,黄凌风*
(1. 厦门大学 环境与生态学院、滨海湿地生态系统教育部重点实验室,福建 厦门 361102;2. 香港科技大学 海洋科学系,香港特别行政区 999077 )
海洋微型鞭毛虫 (microbial flagellates) 是海洋原生生物中一类高度异质化的类群,物种多样性高,具有多种营养方式,在全球海洋生态系统中占据广阔的生态位,在生物地球化学循环中发挥着关键作用[1-2]。根据浮游生物粒径谱的概念[3],可以将粒径小于20 μm的鞭毛虫划分为0.2~2.0 μm的微微型鞭毛虫(pico-flagellates)和2~20 μm的微型鞭毛虫(nano-flagellates)。为了描述简便,全文统称为“微型鞭毛虫”(microbial flagellates)。近年来,分子生物学技术(如高通量测序技术)的飞速发展大大加快了我们对海洋微型鞭毛虫等微型生物的认识,尤其是大量稀有物种被发现,并展现出相当高的生物多样性[4]。
一般而言,优势种是群落中数量最多、生物量最大的群体,是群落能流、物流的主要纽带[5]。与高丰度的优势种相比,稀有生物圈(rare biosphere)表现出与其低丰度不成比例的高多样性[6],同样是生态系统中不可或缺的重要角色,并且可能在某种特定环境条件下转变为优势种[7-8],使一个地区的群落结构和功能发生改变[4]。稀有类群通过提供生态缓冲和功能冗余而被认为在维持生态系统的功能和稳定性方面是不可替代的[9],但其生态作用和复杂的生物地理过程却被大大忽略。稀有种与优势种具有完全不同的内在特征如生长速率、代谢活性等[10],也会受到确定性因素如环境选择、物种间相互关系等作用以及随机性因素如扩散、漂变等作用的不同影响[5,11-13],但两种亚群落在海水中的长期共存现象非常普遍[14-15]。因此,稀有类群可能具有与优势类群相似或不同的生物地理分布格局,在整体群落中具有不同的生态地位[4,16]。
本研究采用高通量测序技术,调查了中国近海亚热带-热带3个典型海区(东海、台湾海峡和南海东北部海区)中两个粒级微型鞭毛虫群落中的优势种和稀有种的分布特征,并探讨了两种亚群落与环境因子和空间因子之间的关系,利用中性模型揭示出中性过程在群落塑造过程和生物地理分布中的潜在作用,最后通过共现网络解析了两种亚群落在总体群落中的生态地位。通过较大的空间研究尺度以及对不同粒级微型鞭毛虫的深度测序结果的研究,旨在解决以下两点科学问题:微型鞭毛虫群落优势种和稀有种的分布、对环境和空间因子的响应在近海海区中有何相似或不同?两种亚群落在总群落物种间相互关系中具有怎样的贡献?研究结果可为揭示海洋微型鞭毛虫群落优势种和稀有种的分布格局、建群机制以及生态地位提供理论依据。
1 材料与方法
1.1 采样时间和地点
本研究主要调查了中国近海亚热带-热带的3个海域,分别为东海陆架区、台湾海峡和南海东北部海区(表1),各海区调查时间分别为2019年春季(5月)和秋季(9月)、2018、2019年春季(3—4月)和夏季(7—8月)以及2017年夏季(7月)。东海和台湾海峡每个站位选择表层(海面下3 m)和底层(距海底5~10 m)两个水层进行采样,南海东北部各站位选择真光层以上的3个水层进行采样,分别为表层(海面下5 m)、叶绿素极大值层(Deep Chl a maximum, DCM)和两倍DCM水层(2DCM)。南海DCM层和2DCM层在不同站位所处深度有所区别,但均位于真光层以上。根据地形将50 m等深线以内海域划定为近岸区,50~200 m等深线之间的海域划定为陆架区,200 m以深划定为陆坡-海盆区。

表1 中国近海亚热带-热带3个海区采样站点信息
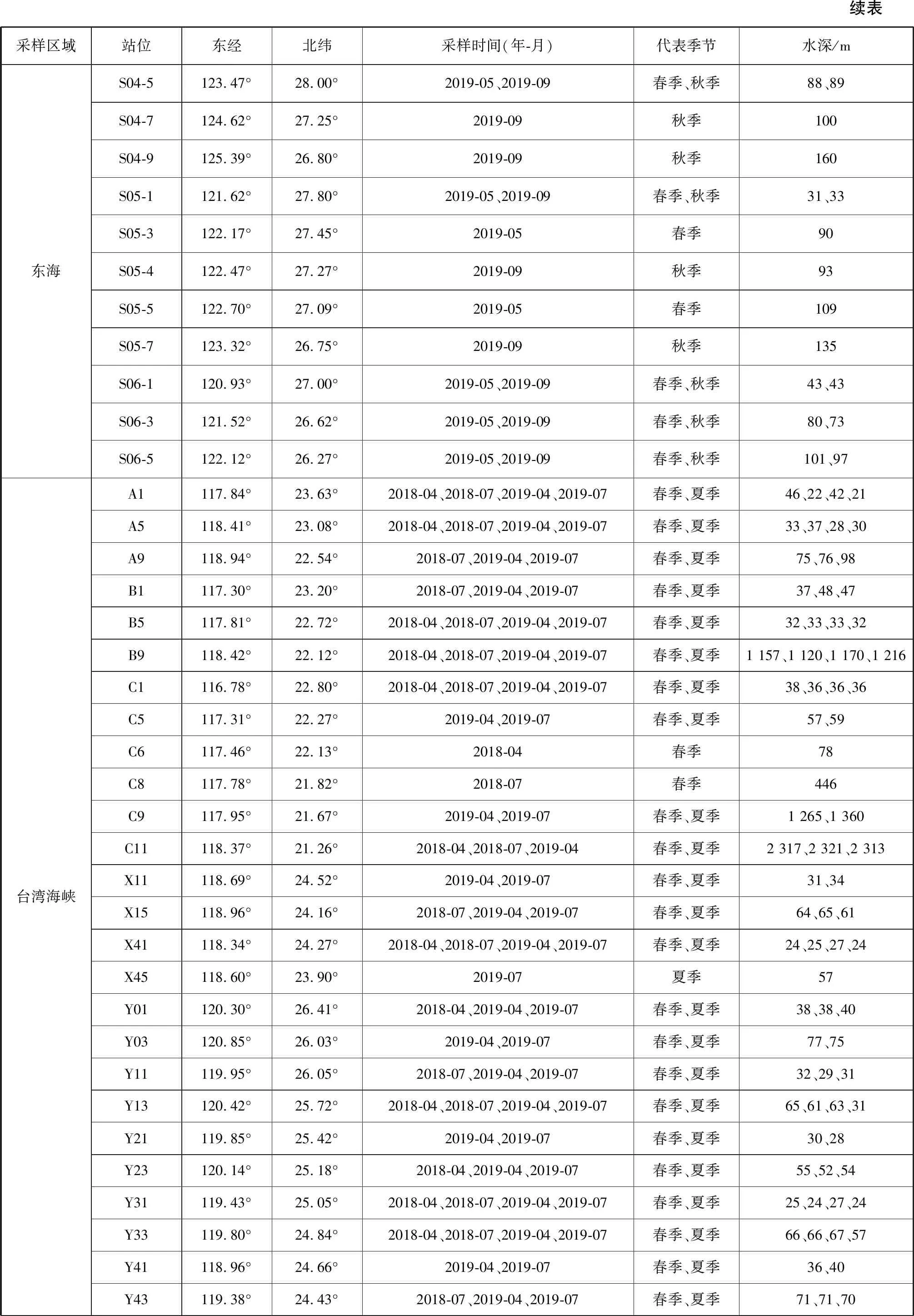
续表采样区域站位东经北纬采样时间(年-月)代表季节水深/m东海S04-5123.47°28.00°2019-05、2019-09春季、秋季88、89S04-7124.62°27.25°2019-09秋季100S04-9125.39°26.80°2019-09秋季160S05-1121.62°27.80°2019-05、2019-09春季、秋季31、33S05-3122.17°27.45°2019-05春季90S05-4122.47°27.27°2019-09秋季93S05-5122.70°27.09°2019-05春季109S05-7123.32°26.75°2019-09秋季135S06-1120.93°27.00°2019-05、2019-09春季、秋季43、43S06-3121.52°26.62°2019-05、2019-09春季、秋季80、73S06-5122.12°26.27°2019-05、2019-09春季、秋季101、97台湾海峡A1117.84°23.63°2018-04、2018-07、2019-04、2019-07春季、夏季46、22、42、21A5118.41°23.08°2018-04、2018-07、2019-04、2019-07春季、夏季33、37、28、30A9118.94°22.54°2018-07、2019-04、2019-07春季、夏季75、76、98B1117.30°23.20°2018-07、2019-04、2019-07春季、夏季37、48、47B5117.81°22.72°2018-04、2018-07、2019-04、2019-07春季、夏季32、33、33、32B9118.42°22.12°2018-04、2018-07、2019-04、2019-07春季、夏季1 157、1 120、1 170、1 216C1116.78°22.80°2018-04、2018-07、2019-04、2019-07春季、夏季38、36、36、36C5117.31°22.27°2019-04、2019-07春季、夏季57、59C6117.46°22.13°2018-04春季78C8117.78°21.82°2018-07春季446C9117.95°21.67°2019-04、2019-07春季、夏季1 265、1 360C11118.37°21.26°2018-04、2018-07、2019-04春季、夏季2 317、2 321、2 313X11118.69°24.52°2019-04、2019-07春季、夏季31、34X15118.96°24.16°2018-07、2019-04、2019-07春季、夏季64、65、61X41118.34°24.27°2018-04、2018-07、2019-04、2019-07春季、夏季24、25、27、24X45118.60°23.90°2019-07夏季57Y01120.30°26.41°2018-04、2019-04、2019-07春季、夏季38、38、40Y03120.85°26.03°2019-04、2019-07春季、夏季77、75Y11119.95°26.05°2018-07、2019-04、2019-07春季、夏季32、29、31Y13120.42°25.72°2018-04、2018-07、2019-04、2019-07春季、夏季65、61、63、31Y21119.85°25.42°2019-04、2019-07春季、夏季30、28Y23120.14°25.18°2018-04、2019-04、2019-07春季、夏季55、52、54Y31119.43°25.05°2018-04、2018-07、2019-04、2019-07春季、夏季25、24、27、24Y33119.80°24.84°2018-04、2018-07、2019-04、2019-07春季、夏季66、66、67、57Y41118.96°24.66°2019-04、2019-07春季、夏季36、40Y43119.38°24.43°2018-07、2019-04、2019-07春季、夏季71、71、70
1.2 环境因子的采集与测定
用Niskin采水器分别采集各层海水。温度、盐度、水深、溶解氧数据用船载CTD (SBE917plus, SeaBird Corp.)现场测得。营养盐包括硝态氮、亚硝态氮、氨氮、活性磷酸盐和活性硅酸盐,来源于各航次共享数据。叶绿素a浓度的测定采用丙酮萃取荧光法[17]。超微型浮游生物包括异养细菌、蓝细菌和微微型真核生物,其丰度采用流式细胞仪进行测定[18],具体方法参考《海洋微型生物生态学》第14章《海洋微型生物流式图像技术》[19]的内容。小型浮游动物(主要包括纤毛虫、腰鞭毛虫等)使用虹吸法进行富集后[20]用FlowCam流式影像仪代替传统显微镜镜检方法测定其丰度,再通过VisualSpreadsheet软件对目标生物颗粒(粒径20~100 μm)进行计数[21]。以上生物因子的测定方法同时参考了《海洋调查规范》的内容[22]。
1.3 微型鞭毛虫群落样本的采集与处理
采集5 L海水经20 μm筛绢预过滤后,依次通过直径47 mm、孔径2.0 μm和0.8 μm的聚碳酸酯核孔膜(Millipore Corp.),得到粒径范围在0.8~2.0 μm和2.0~20.0 μm的微微型和微型浮游生物样本。将核孔膜置于液氮中保存,回到实验室后于-20 ℃储存。采用Qiagen公司的PowerWater© DNA Isolation Kit进行DNA提取。利用真核生物通用引物3NDF(5’-GGCAAGTCTGGTGCCAG-3’)和V4_euk_R2(5’-ACGGTATCTRATCRTCTTCG-3’)[23]对18S rRNA基因的V4高可变区(长度约400 bp)进行PCR扩增。使用1.5%浓度的琼脂糖凝胶电泳对扩增产物进行检测并切胶,保留单一含有目的片段长度的产物后利用快捷型琼脂糖凝胶DNA回收试剂盒(BioTeke Corp.)进行纯化。高通量测序工作交由北京诺禾致源科技股份有限公司完成,测序平台为Illumina Hiseq 2500 (Illumina, Inc.),采用PE250 测序模式,每个样本平均测序深度为30 000~50 000条序列。
1.4 数据处理与统计分析
1.4.1 生物信息学分析 利用Mothur(V.1.40.5)软件[24]对测序序列进行加工处理,包括数据质控过滤、分类操作单元(operation taxonomic unit, OTU)聚类和物种注释等步骤[25]。由于本研究仅考虑原生生物中的鞭毛虫群落,因此还需根据OTU的物种信息,参考鞭毛虫的物种分类系统[1,26-27],剔除掉原生生物中不属于鞭毛虫的OTU(如硅藻、纤毛虫、放射虫、真菌等),生成一个新的只含有鞭毛虫信息的OTU表格。
1.4.2 各海区优势种和稀有种的定义 与以往仅根据相对丰度阈值设定的丰富种和稀有种的研究不同[16,28],本研究还考虑到条件性丰富和稀有的类群,即在不同时空条件下相对丰度发生较大变化的类群[5-6,29]。首先,定义丰富种和稀有种的阈值分别为1%和0.1%,依据OTU的相对丰度把它们划分为6大类群(亚群落)[29]:①序列数在所有样品中都大于1%的“绝对丰富种”;②序列数在所有样品中都大于0.1%、且在有些样品中大于1%的“条件丰富种”;③序列数在所有样品中介于0.1%和1%之间的“中间种”;④序列数在样品中从小于0.1%到大于1%都存在的“条件丰富或稀有种”;⑤序列数在所有样品中都小于1%、且在有些样品中小于0.1%的“条件稀有种”;以及⑥序列数在所有样品中都小于0.1%的“绝对稀有种”。在划分6个类群的基础上,结合Chen等(2017)[30]的方法定义优势种(dominant taxa, DT)为绝对丰富种、条件丰富种和条件丰富或稀有种的总和,稀有种(rare taxa, RT)为绝对稀有种和条件稀有种的总和。
1.4.3 微型鞭毛虫优势种和稀有种的多样性、物种组成和生物地理分布格局 物种丰富度由实际观测到的OTU数目表征,物种均匀度由Pielou均匀度指数表征,Shannon多样性指数反映群落多样性。物种累计曲线(species accumulation curve, SAC)反映物种在环境中的总体分布情况,用来表示在持续抽样(样本量增多)的过程中新OTU(新物种)出现的速率。统计鞭毛虫各超群及以下低分类水平类群(从“门”到“属”)的序列数和OTU数目,并计算各类群的相对物种丰度(read abundance)和相对物种丰富度(OTU richness)。利用相似性分析(analysis of similarities, ANOSIM)对各海区不同时空条件分组下的站位之间的群落结构(基于群落间的Bray-Curtis距离)差异显著性进行检验。计算群落间距离之前,生物群落数据需经过Hellinger转换[31]。利用韦恩(Venn)图来展示不同组别样本中独有和共有的OTU数目,以反映优势种和稀有种在各组样本中的分布情况。最后,各海区总群落和亚群落相似性的“距离-衰减模式(distance-decay patterns)”通过拟合与地理距离和环境距离之间的线性关系来讨论[32-33];群落相似性通过1-Bray-Curtis distance得到,环境和地理距离均由欧几里得距离(Euclidean distances)计算。在分析之前,各环境变量(包括理化因子和生物因子)需经过lg(x+1)转换,并去除方差膨胀因子(variation inflation factor, VIF)大于20的环境因子,以减小共线性的影响[30];地理变量通过主轴邻距法(principal coordinates analysis of neighbour matrices, PCNM)对采样点的经纬度进行转换后获得[34]。
1.4.4 微型鞭毛虫优势种和稀有种亚群落的构建机制 首先,利用Mantel 检验和偏Mantel 检验(Spearman相关系数)[35]计算微型鞭毛虫各群落组成的距离、空间因子距离和环境因子距离之间的相关性;3种距离分别根据上述方法获得。为了描述随机性过程(中性过程)在微型鞭毛虫群落塑造和生物地理分布中的潜在作用,通过群落组成拟合了微型鞭毛虫总群落和亚群落在3个海区中的中性模型(neutral model)[36]。该模型拟合了OTUs的出现频率(检测到各OTU的样本比例)与丰度(在所有样本中的平均相对丰度)之间的相关关系,R2代表拟合度,即群落对中性模型的适合度;Nm值为群落大小(N)与物种迁移率(m)的乘积,可以表征群落的迁移能力。
最后,为了探究微型鞭毛虫各类群生物间的相互作用关系,本研究采用共现性网络分析(co-occurrence network analysis)方法展现了不同海区微型鞭毛虫群落的非随机性共存格局,比较了优势类群和稀有类群在维持群落网络关系中的作用,并对网络中的模块化和影响群落网络拓扑关系的关键种进行了评估[8]。首先计算任意两个OTU之间的Spearman相关性系数,选择具有显著相关性(|r|>0.6,P<0.05)的节点代入后续分析。共现网络使用Gephi 0.9.2交互式平台实现可视化(http://www.gephi.org)。不同的节点(node)代表各OTU(物种),节点之间的连线(edge)代表OTU之间的相互作用[37]。正相关和负相关的连线分别代表物种间的共存和排斥关系[38]。计算单独节点的连接度(degree)和介数中心度(betweenness centralization)来表征不同物种在群落中的权重大小,以此体现物种的重要程度[37];通过网络结构的模块性来表征网络关系的复杂属性[37]。筛选具有高连接度(>100)和低介数中心度(<5 000)的物种作为群落关键种(keystone taxa)[39]。
以上所有统计分析及作图除另有说明之外,均在R(v.3.6.1)软件中完成。
2 结果与讨论
2.1 3个海区微型鞭毛虫群落的分布
2.1.1 总体分布概况 3个海区中,微型鞭毛虫的物种和序列数目均占原生生物的60%以上,部分情况下高达80%(表2),说明鞭毛虫是近海原生生物中的重要组成部分。其中,优势类群的物种数所占比例较少,在10%~20%左右,而序列数所占比例超过80%;稀有类群则以约10%的序列数比例,占据75%以上的物种数比例,呈现出低丰度-高多样性的特征。对于多样性而言,两种粒径鞭毛虫稀有类群的多样性要远高于优势类群,且均匀度较高(表2)。
物种累计曲线的结果(图1)反映了各海区两种粒级微型鞭毛虫群落物种的总体分布情况。对于总群落而言,观测到的物种数目的增加随着样本量的增加而逐渐趋于平缓,这种趋势在优势类群中更为明显,说明对优势类群的观察已接近饱和。但稀有类群物种仍然随着样本量的增加有着明显的上升趋势,说明仍有大量稀有类群未被检测到。

表2 3个海区微型鞭毛虫总群落和亚群落的丰富度和多样性

图1 3个海区微型鞭毛虫总群落和各亚群落的物种累计曲线Fig. 1 Species accumulation curves of microbial flagellate communities in 3 sea areas(a)至(f)为东海;(g)至(l)为台湾海峡;(m)至(r)为南海;(a)、(g)、(m)为微微型总群落;(b)、(h)、(n)为微微型优势亚群落;(c)、(i)、(o)为微微型稀有亚群落;(d)、(j)、( p)为微型总群落;(e)、 (k)、(q)为微型优势亚群落;(f)、(l)、(r)为微型稀有亚群落。
2.1.2 物种组成与分布 根据调查,3个海区微型鞭毛虫优势和稀有亚群落在超群水平和低分类水平上的群落组成如图2、3所示。超群水平下,囊泡虫类(Alveolata)是两种粒级微型鞭毛虫中最主要的类群(图2),其物种相对丰富度和相对丰度在优势类群中(平均为81.2%和91.0%)大于稀有类群(平均为66.3%和70.8%)。Hacrobia类是第二大类群,其物种丰富度在优势类群(8.8%)和稀有类群(10.8%)中所占比例相近,而物种相对丰度在稀有类群中(12.5%)远高于优势类群(4.6%)。有孔虫类(Rhizaria)是第三大类群,其物种相对丰富度和相对丰度在稀有类群中(平均为11.8%和8.0%)远大于优势类群(平均为4.5%和0.5%)。异鞭类(stramenopiles)和后鞭毛类(Opisthokonta)的物种相对丰富度和相对丰度同样在稀有类群中表现出较优势类群中更大的比例,且其相对丰富度大于相对丰度,体现了这几种类群内的高多样性。以上结果说明,不同超群在优势类群和稀有类群中有着不同的相对丰度和相对丰富度,这与之前关于中国近海海水及沉积物中微型真核生物群落优势类群和稀有类群的研究结果相似[13,40]。
进一步的研究发现低分类水平下的各谱系也在优势类群和稀有类群中表现出不同的分布比例(图3)。囊泡类中的MALV-I、MALV-II、甲藻纲(Dinophyceae)以及Hacrobia类中的定鞭藻(Haptophyta)这四个类群在各海区两种粒级微型鞭毛虫的优势和稀有亚群落中均表现出相对较高的丰度和丰富度,这表明这几大类群不仅有作为丰富种存在的优势度和活跃性,同时作为稀有种时在维持群落结构的稳定性中可以起到重要的缓冲作用[25]。Wu等(2016)和Guo等(2020)[13]同样描述了海洋囊泡类、甲藻纲、定鞭藻等在边缘海上层水体中的重要地位。丝足虫(Cercozoa)主要分布于东海和台湾海峡,在南海分布较少,并且在稀有类群中占有更大比例[图3(b)]。另外,不同丰富程度亚群落在各海区中的相对丰度也明显不同(图3)。一方面,各海区不同水层、生境或季节可能拥有不一样的优势种类群,例如甲藻和MALV-I多分布于表层,而MALV-II在下层水体中占据优势(结果未显示);在表层水体中发现属于微微型鞭毛虫的Micromonas具有很高的相对丰度,并且大多为优势类群,之前的研究也发现类似结果[13],表明了微微型光合藻类在表层的优势地位和广泛生态位[41]。另一方面,在特定环境条件下,某些稀有种也可能转变为起重要作用的优势种或关键种[7-8],使一个地区的群落结构和功能发生改变[4,6,42],例如东海春季S00-3站位表层中发现大量可能引发藻华[43-44]的Chlorodendrales (绿藻门)在其他站位中均保持很低的丰度分布,在台湾海峡夏季Y41与Y31两个北部海区近岸站位也同样发现高丰度的绿藻门,这可能与这些区域环境条件如光照、温度、营养盐等有利于该类群的生长繁殖有关。

图2 3个海区微型鞭毛虫亚群落在超群水平上的物种相对丰富度Fig. 2 Community taxonomic compositions (relative OTUs’ richness) of microbial flagellate sub-communities at supergroup level in 3 sea areas不同的超群使用相同颜色但不同的填充方式进行标注;pDT为微微型优势亚群落,pRT为微微型稀有亚群落,nDT为微型优势亚群落,nRT为微型稀有亚群落。

图3 3个海区微型鞭毛虫亚群落在较低分类水平下各谱系类群中的相对丰度Fig. 3 Relative abundance of each branching lineage of microbial flagellate sub-communities at lower taxonomic levels in 3 sea areas(a)为囊泡类,(b)为其他类群;图例括号内小写字母分别代表不同的分类水平(p:门,c:纲,o:目,f:科,g:属);不同超群的谱系使用相同的颜色但不同的填充方式进行标注;pDT为微微型优势亚群落,pRT为微微型稀有亚群落,nDT为微型优势亚群落,nRT为微型稀有亚群落。
2.1.3 生物地理分布格局 对3个海区微型鞭毛虫群落进行ANOSIM相似性分析的结果显示(表3),两种粒级微型鞭毛虫总群落、优势和稀有亚群落均具有一定的时空分布格局。东海群落在季节(春季和秋季)、水层(表层和底层)以及生境(近岸区和陆架区)间均具有显著性差异,差异程度为中低度分离(GlobalR<0.5)。台湾海峡群落在不同年份、季节及南北部海区之间均具有显著性差异,季节间差异程度高于年际差异,南北部海区差异显著性较低,水层及生境间差异较小或不显著,说明台湾海峡微型鞭毛虫群落在时间上的变化更明显,而空间变化较小。南海群落在不同水层之间均具有显著性差异,其中,表层和2DCM层之间差异程度最大,为高度分离(GlobalR>0.5),表层和DCM层以及DCM层和2DCM层的差异较小,说明生物群落的相似性有着明显的水深衰减效应。总群落的组间相似性与优势类群的组间相似性较为接近,而与稀有类群的组间相似性差异较大。

表3 3个海区不同时空特征分组下微型鞭毛虫总群落和各亚群落组成的ANOSIM分析
韦恩图展示了3个海区中各时空特征分组下的特有和共有OTUs的数目(图4),结果发现,不同分组下的共有OTUs在优势类群中所占比例均高于稀有类群,而特有OTUs表现出相反的特征,说明优势类群的时空分布更加广泛,稀有类群的分布较为局限,仅出现某一时空条件下的比例较大。
微微型和微型鞭毛虫群落(包括总体、优势和稀有) 间的相似度随着环境距离和地理距离的增大而减小(图5,P<0.001),说明不同粒级及丰富度的微型鞭毛虫群落对环境因素和空间因素的响应均呈现出相似的“距离衰减效应”。这表明微型鞭毛虫群落受到环境选择和扩散限制的共同影响,环境异质性带来了群落的生态位分化[45],而空间距离的增加强化了扩散限制作用[33],二者都导致微型鞭毛虫群落间的差异增大,即相似性降低。同时,在多数情况下,环境因子距离与地理距离分别表现出与优势类群和稀有类群相似性更高的线性拟合度(R2),这说明优势类群受到环境因子影响的程度更高,而稀有类群更多受到空间因子的限制作用。以上有关群落生物地理分布格局的结果揭示出稀有亚群落与优势亚群落之间相似而又不同的分布格局,说明稀有亚群落的产生并不是物种的随机组合,其分布也不是一个完全随机的过程,而是与优势类群一样会受到环境因子和空间因子共同的驱动作用[16,46],在下一节中会具体讨论这一问题。

图4 3个海区微型鞭毛虫各亚群落在不同时空特征分组下的特有和共有OTUs数目Fig. 4 Venn diagrams showing the unique and shared OTUs of microbial flagellate sub-communities in different spatiotemporal groups in 3 sea areas括号内的数字和百分比分别代表各亚群落的总OTUs数目以及不同分组中共有OTUs数目所占的比例;(a)至(d)为东海;(e)至(h)为台湾海峡;(i)至(l)为南海;(a)、(e)、(i)为微微型优势亚群落;(b)、(f)、(j)为微微型稀有亚群落;(c)、(g)、(k)为微型优势亚群落;(d)、(h)、(l)为微型稀有亚群落。

图5 3个海区微型鞭毛虫的群落相似度与环境因子距离和地理因子距离之间的距离-衰减效应Fig. 5 Distance-decay patterns of the Bray-Curtis similarity of microbial flagellate communities with the Euclidean distances of environmental variables and geographical factors in 3 sea areas R2代表线性拟合程度;All为总群落,DT为优势亚群落,RT为稀有亚群落;(a)至(d)为东海;(e)至(h)为台湾海峡;(i)至(l)为南海;(a)、(e)、(i)为微微型群落与环境因子距离的关系;(b)、(f)、(j)为微微型群落与地理因子距离的关系;(c)、(g)、(k)为微型群落与环境因子距离的关系;(d)、(h)、(l)为微型群落与地理因子距离的关系。
2.2 3个海区微型鞭毛虫群落的建群机制
2.2.1 群落组成与环境、空间因子的关系 本研究采用普通Mantel检验和偏Mantel检验分析了各海区生物群落、环境因子和空间因子之间的关系(表4)。结果发现,环境因子与空间因子之间无显著相关性(P>0.05,数据未显示),表明环境因子分布的随机性较强,因此普通Mantel检验和控制环境或空间变量的偏Mantel检验呈现出一致的结果(表4)。本研究中的3个海区,环境因子与群落之间的相关性均大于空间因子(表4)。
有关微生物群落构建机制的研究一直以来都是微生物生态学的热点问题,受到研究者们的广泛关注[47]。确定性过程(如环境选择)和随机性过程(如扩散、漂变)是影响群落构建的两大因素。一些研究报道了环境过滤在塑造微生物群落中的重要作用,另一些研究则表明随机性过程的影响更大,也有研究指出了两者的联合效应[33]。一方面,物种在环境过滤的作用下会产生生态位的分化,从而形成局域群落[33]。例如Clarke等(2020)[48]在南大洋关于微型真核浮游生物的研究表明,小型和微型真核浮游生物对海冰融化有明显的响应,而叶绿素和营养盐则对微微型群落有更大的解释程度;Lallias等(2015)[49]在两个地理位置接近的河口区发现不同种类的微型真核生物会根据各自的生活史特征对不同的环境因子如沉积物粒度、盐度范围、水流速度等做出响应。另一方面,某些微生物群落由于生态位分化不彻底但存在中性过程的作用仍可保持整体上相对平衡的共存状态[50],特别在水生生态系统中,微型浮游生物的数量庞大、种类繁多,而海水中资源有限、条件较为单一,不可能得到完整的生态位分化的结果[15],这时扩散、漂变等随机性过程就对维持群落结构的稳定起到重要作用[51]。这些结论虽然表面上看并不一致,但由于它们均是在某种特定生态系统、某个时空尺度、针对某类生物群落得到的,实际上并不互相矛盾。本研究的结果也同样如此,3个海区微型鞭毛虫群落的构建机制表现出一定的差异,环境因素(代表确定性过程)和空间因素(代表随机性过程)在不同海区、不同粒径以及不同丰富程度生态类群的微型生物群落构建中均表现出不同的贡献程度(表4)。

表4 3个海区微型鞭毛虫总群落和亚群落组成与环境因子和空间因子之间的Mantel检验
总体上,在3个海区的研究时空尺度下中,环境因素是影响微型鞭毛虫群落结构的较为重要的因子。这种模式符合普遍观察到的情况,即在中等空间尺度(几公里到几百公里)、环境异质性较高的条件下,微生物群落的构建过程往往更大程度上受到环境因素的选择作用,而由空间距离引起的扩散限制作用在季风、水流等影响下表现较弱[33,45]。例如在本研究中,相比南海东北部和东海,环境因素在台湾海峡的生物群落构建过程中表现出更大的优势(表4),这可能与台湾海峡特殊的地理位置、复杂的地形条件、交替的季风作用以及连接几种水流系统等因素密切相关[52]。“狭管效应”加剧了季风、水流等作用的影响,使得台湾海峡的环境条件具有明显的时空变化[53]。空间因素在本研究中利用样本间距离矩阵作为代表,因此可以等同于扩散限制作用,即空间因子与生物群落相关性越大,代表生物群落受到扩散限制的影响越明显。研究表明,空间因素的作用会随着研究尺度的增大而有所增加,即在较大的空间范围内,更容易形成扩散限制[33]。
另外,研究结果发现优势类群与稀有类群在对空间变量以及环境变化的响应上具有不同的特征,多数情况下,优势类群相比于稀有类群与环境因子之间的相关性更大,而稀有类群较优势类群更易受到空间因子(代表扩散限制)的影响(表4)。Xu等(2020)[54]和Chen等(2017)[30]在中国近海微型真核生物群落的优势和稀有亚群落中也发现了相似的模式。Logares等(2014)[16]在欧洲沿海6个采样地点的研究中发现,稀有亚群落结构的形成与样本地点有关,同一采样地点的稀有种有较好的聚类关系,而优势种在不同采样地点中均有分布。不同丰富度的生态类群之所以具有不同的生物地理分布模式,与它们自身对环境的适应性和扩散能力密切相关[55-56]。一方面,优势类群具有较高的生长速率和繁殖能力,能够快速适应环境条件的改变[42,57],在竞争中处于优势地位,因此优势种的进化更趋向于适应环境而生存下来;而稀有类群通常而言生长较为缓慢,具有较低的丰度。有研究认为,稀有种在环境中保持较低丰度可能是一种应对环境变化的策略,或者仅仅是由于随机扩散至某一环境下却无法大量繁殖甚至无法生存下来而导致对环境条件的响应较弱[46]。尽管我们知道,在不同的时空条件下,这些稀有种可能会转变成为丰富种,但这种整体上由于缓慢的细胞分裂速度造成的永久或半永久性的分布模式,可能代表了某些数量较少的海洋原生生物群体在进化上形成的容易躲避竞争、捕食、寄生等的优势,这是与密度决定的自然选择相反的一种进化形式[16]。另一方面,优势类群具有更强的扩散能力,能够随着海流的运输使自身得到更广泛的分布[57],并在扩散过程中受到环境选择的作用;而稀有类群扩散能力较弱,更有可能受到扩散限制的影响而集中分布于少数样本中。这一特征也反映在韦恩图的结果中,即不同时空条件下优势类群中共有OTUs的比例均高于稀有类群(图4),代表了优势类群的广泛分布。
2.2.2 中性模型 在Mantel检验中,空间因子(以地理距离为代表)与微型鞭毛虫群落相似度之间的关系仅代表了随机性过程中的扩散限制在群落构建中的作用,而忽略了随机漂变等过程。为了评估群落自身的随机性变化,本研究通过群落组成拟合了微型鞭毛虫总群落和各亚群落在3个海区中的中性模型(图6)。结果发现,除了微微型鞭毛虫优势亚群落在东海的拟合度R2较低之外[图6(g),R2=0.081],其他群落的中性模型拟合度均达到0.2以上,拟合度最高出现微型鞭毛虫总群落在南海的中性模型中[图6(f),R2=0.748]。这说明中性过程在各海区微型鞭毛虫群落的构建中均起到一定作用。
另外,对优势和稀有亚群落的R2和Nm值进行比较后发现,两种亚群落与中性模型的拟合度R2没有表现出明显的差异规律,中性模型对两种亚群落变化的解释度相近。但在多数情况下,优势亚群落的Nm值较大(图6),反映了相较于稀有亚群落更加显著的随机扩散能力,这也进一步印证了优势种具有的在多数样本中广泛分布的特点(图4)。根据中性理论,群落自身的随机扩散过程及漂变效应(包括生态漂变如出生-死亡、迁入-迁出、定居和灭绝的随机过程以及进化漂变即随机遗传变化)可能会导致纯粹的空间效应和无法解释的变异[33]。因此,中性模型的结果不仅体现了随机过程在两种亚群落中的重要作用,同时反映出两种亚群落的构建可能存在更加复杂的生物地理过程,例如物种间的相互关系。
2.2.3 共现网络分析 为解释两种粒径微型鞭毛虫优势类群和稀有类群的物种间相互关系及其在整体群落中的生态地位,构建了共现网络图。整体上,各海区中几乎所有物种间相关性显著的连接(|R|>0.6,P<0.05)均为正相关关系,负相关性较弱且不显著(图7),因此推测鞭毛虫群落中物种的共存关系比较明显,微生物之间通过相互合作或共存的关系以维持群落结构的稳定[9]。这与Debroas等(2017)[58]对29个淡水生态系统中微型真核浮游生物进行网络分析发现的物种间共存关系明显的结果一致。

图6 微型鞭毛虫总群落和各亚群落在3个海区中的中性模型Fig. 6 Fit of the neutral model of the whole and sub-communities of microbial flagellates in 3 sea areas(a)、(d)、(g)、(j)、(m)、(p)为东海;(b)、(e)、(h)、(k)、(n)、(q)为台湾海峡;(c)、(f)、(i)、(l)、(o)、(r)为南海;(a)至(c)为微微型总群落;(g)至(i)为微微型优势亚群落;(m)至(o)为微微型稀有亚群落;(d)至(f)为微型总群落;(j)至(l)为微型优势亚群落;(p)至(r)为微型稀有亚群落。

图7 3个海区微型鞭毛虫群落的共现网络分析Fig. 7 Co-occurrence networks among OTUs of microbial flagellate communities in 3 sea areas节点的颜色代表不同亚群落类型[(a)至(c)]和不同模块[(d)至(f)];每个节点的大小与该节点所有的连接数(即节点的度)成正比;(a)、(d)为东海,(b)、(e)为台湾海峡,(c)、(f)为南海。
共现性网络分析是对微生物群落构建机制中环境因子模型和空间因子模型无法解释部分的补充,反映了物种间相互关系在塑造群落结构中的重要意义。局域群落的形成和构建可以看作是随机过程及环境选择和生物间相互作用等过程的累积效应[59]。网络中强而复杂的关联可以解释为多种类型的生物间相互作用,例如通过交叉进食或交换代谢产物而形成的共生关系,通过竞争、捕食或寄生而产生的拮抗作用,以及形成功能上的冗余关系[60]。因此,网络结构反映了群落的复杂性和稳定性,以应对环境的变化和干扰[60]。网络分析的结果显示,各海区微型鞭毛虫群落的网络关系结构十分复杂,均具有8个以上的子模块[图7(d)至(f)],代表群落“小世界”或“小生境”现象明显[37]。其中,不同粒级优势种和稀有种之间有着密切的相关性,生态位相近或重叠的种类同时出现于同一模块中,不同模块的种类生态位差别较大,每个模块基本都是由两种粒级不同丰富度类群的鞭毛虫共同构成[图7(a)至(c)],说明不同粒级和丰富度的微型鞭毛虫具有重叠但又相异的生态位,从而在同一环境中形成物种的共存,维持了群落结构的稳定。
以物种连接度这一参数为例,比较了微型鞭毛虫优势种和稀有种在各海区不同时空分布下的网络节点拓扑特征差异[图8(a)至(c)]。结果发现,物种在总体样本中的连接度显著低于各分组样本[图8(a)至(c),P<0.05],表明整体网络中的物种间关系较为松散。稀有类群的连接度在东海各季节不同水层、台湾海峡不同季节以及南海的3个水层的分组中均显著高于优势类群(P<0.05),并且优势种与稀有种之间的连接数要高于与其他优势种的连接数。根据研究,在环境变化程度大甚至遭受干扰时,优势种和稀有种之间的联系可以增强水生微生物群落的抵抗力和恢复力,从而维持群落结构的稳定[9,60]。有研究利用RNA与DNA的比值表征生物细胞活性,发现稀有种较优势种具有更高的生物活性,组成了物种多样性的储存库,可以快速地应对环境的改变[16,61]。因此,稀有类群不仅可以作为“种子库”提供生态缓冲和功能冗余[9],同时也可能具有很大的生物活性,在维持生态系统的稳定中起到不可替代的作用。此外,虽然稀有类群在3个海区各分组条件下比优势类群有更高的连接度,但在总样本中,即不考虑分组情况,优势类群的连接度却高于稀有类群[图8(a)至(c)]。这说明在环境异质性较小的条件下,稀有类群可能由于其分布的局限性,仅在特定生境中对群落结构的维持起到重要作用;而当环境条件的变化较大时(例如空间或时间尺度上的改变),优势类群则凭借其较高的扩散能力和较宽的生态位分布,在不同群落之间起到重要的连接作用。
根据网络节点的拓扑特征——连接度(>100)和介数中心度(<5 000)进行关键种的筛选。结果显示,3个海区的关键种在不同时空条件下具有不同的数目[图8(d)至(f)]。在东海,秋季底层关键种的数目最多(166 OTUs),其次是秋季表层(125 OTUs),春季表层的关键种数量最少,仅为3个OTUs[图8(d)];在台湾海峡,2018年和2019年夏季关键种的数目均高于春季[图8(e)];南海关键种的数目随水深的增加而增大[图8(f)]。此外,3个海区关键种中的稀有类群所占比例均大于优势类群[图8(d)至(f)],这也进一步反映出稀有类群在网络关系中的重要作用。关键种指在群落生物间关系中起到高度连接作用的类群,研究表明,关键种的数目在一定程度上可以反映不同生境中群落结构的稳定程度[8],其类群的演替(消失或出现)和数量的变化会引起微型生物群落结构和功能的巨大变化,从而反映出对环境条件改变的响应,而这种作用相对于其丰度而言可能是非常不成比例的[4,8]。结果显示[图8(d)至(f)],东海底层、台湾海峡夏季以及南海下层水中的微型鞭毛虫群落中的关键种数目高于东海表层、台湾海峡春季以及南海表层水,说明前几种时空条件下的群落结构更加稳定,也就是说,群落分布的随机性和可变性较小,这可能与关键种等微型生物在不同生境下受到环境因子和空间因子的作用不同有关。Yeh等(2015)指出,底层水域的海水流速较低,独立性较高,连通性较差,从而使得微型生物群落更易受到扩散限制的作用而呈现斑块状分布,并维持相对较高的稳定性[55]。对中国近海微微型真核生物在表层和次表层或深层水中分布的研究也显示[13],相比于表层,下层微型生物群落受到明显的扩散限制作用。表层海水则由于受到周围水团、风力的影响,一方面保持有较高的连接性,可能导致微型生物群落在随水流扩散的过程中易发生随机性变化[56,62],另一方面季节性变化的水团也使得表层微型生物群落的分布具有明显的季节性特征。Gilbert等(2012)发现英吉利海峡西侧一个时间序列站位的表层细菌群落具有明显的季节分布特征[62]。对于台湾海峡而言,春季受到来自不同方向不同水团的共同影响,如来自东南方向的黑潮暖水团、西南方向的南海暖水团以及浙闽沿岸流和近岸上升流,而夏季南海水向北侵入并贯穿整个台湾海峡[63],这可能导致春季微型生物群落表现出更大的随机性变化,群落稳定性较差。综上所述,在微型生物群落网络关系中具有重要地位的关键种,可能在环境变化和空间扩散限制作用的影响下,对各海区微型鞭毛虫群落的构建过程起到重要作用。

图8 3个海区微型鞭毛虫优势和稀有亚群落的网络节点拓扑特征(以连接度为代表)以及关键种的分布Fig. 8 Network node-level topological feature (represented by degree) among DT and RT sub-communities of microbial flagellates and distribution of key species in 3 sea areas不同字母表示差异显著(P < 0.05);(a)至(c)为连接度,(d)至(f)为关键种数目,(a)、(d)为东海,(b)、(e)为台湾海峡;(c)、(f)为南海。
在本研究对于优势类群和稀有类群的定义中,不仅考虑了在任何情况下都绝对优势或稀有的种,还重点关注了在不同时空条件下相对丰度发生较大变化的条件丰富和条件稀有类群,进一步深化了我们对优势类群和稀有类群的认识。然而,东海和台湾海峡的样本中均未发现有绝对丰富种、不稀有的条件丰富种和中间种的存在,仅在南海样本中发现了1个绝对丰富种和9个条件丰富种,也就是说,绝大部分优势种都属于条件性丰富或稀有种。首先,这可能与稀有性阈值的定义有关。在生态学研究中,“稀有度”被认为是一个连续变量[30],因此,如何定义“稀有度”的临界点直接影响了对物种属性的判断和确定。其次,由于研究时空尺度的多维性(如不同季节、不同生境、不同水层深度等),几乎不存在在所有时空条件下都表现丰富的物种,不稀有的“条件丰富种”或者“中间种”也较为少见。换句话说,由于环境条件的动态变化,许多物种的丰富度会随着其对环境条件的适应程度和对随机过程的响应状态而发生改变,通过生态位分化、随机漂变以及物种间相互关系等作用,使得群落物种组成在时间和空间上振荡。另外,相关研究发现,保持稀有状态可能是某些稀有种或条件稀有种应对某些环境条件的生存策略[42],因此在本研究未涵盖的其他时空条件下也有可能获得优势。
3 结论
中国亚热带-热带3个海区微型鞭毛虫群落中的优势类群和稀有类群在多样性、物种组成和分布模式上均表现出不同的特征,这与它们对环境条件和空间因素的响应不同有关,代表了这些类群在海区中的生态位分化,同时也受到中性过程的显著影响。本研究还通过共现网络分析发现稀有类群以较高的连接度和更高比例的关键种数目,在群落网络关系中起到重要的连接作用。研究结果揭示了中国近海微型鞭毛虫优势种和稀有种的分布特征和建群机制,为深入认识海洋微型鞭毛虫的群落结构、分布格局以及影响其群落构建的生态过程提供理论依据。
致谢:感谢国家自然科学基金委提供的2019年春季和秋季东海共享调查航次、2018及2019年春季和夏季台湾海峡共享调查航次、2017年南海东北部及吕宋海峡调查航次。感谢自然资源部第一海洋研究所王永刚老师、厦门大学刘志宇老师、厦门大学黄邦钦老师和中国海洋大学赵玮老师分别提供了提供2019年东海、2018年台湾海峡、2019年台湾海峡和2017年南海的CTD共享数据。感谢王永刚老师课题组提供营养盐和叶绿素等共享数据(东海航次),福建省海洋研究所提供营养盐等共享数据(台湾海峡航次),厦门大学戴民汉老师课题组提供营养盐等共享数据(南海航次)。感谢“向阳红18”、“延平2号”和“东方红2”全体船员在现场采样过程中的帮助。

