不同矫治力对口腔正畸患者龈沟液IL-1β、TIMP-2、MMP-2、Cathepsin K表达的影响*
邹晖, 李朝晖, 左园林, 张晔, 吴堪葵
1广州市花都区妇幼保健院(胡忠医院)、广东医科大学附属广州花都医院口腔治疗中心(广东广州 510800); 2暨南大学附属第一医院口腔科(广东广州 510632); 3广州医科大学附属第二医院口腔科(广东广州 510260)
正畸力作用下的正畸牙移动(orthodontic tooth movement,OTM)是基于牙周支持组织中的力所驱动的组织反应。但对于OTM牙周组织中导致最佳机械条件和生物反应的力水平存在争议。当前研究对于将正畸力转化为所需的正畸移动而减少不良反应产生的细胞及分子机制仍然知之甚少[1-2]。牙周组织对正畸力的反应是多种蛋白质之间复杂交互作用的结果,包括趋化因子、生长因子和细胞外基质蛋白等。以整体方式评估蛋白质网络是理解牙周组织对正畸力的大小和持续时间的反应的关键[3]。目前文献中有大量证据表明,龈沟液(gingival crevicular fluid,GCF)反映了OTM期间细胞功能活动的程度,龈沟液中携带大量参与骨和软组织重塑过程的炎症介质,其中细胞因子包括肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(interleukin,IL)和趋化因子等[1]。在OTM早期,急性炎症反应对随后的骨吸收有害,骨吸收似乎受促炎细胞因子控制,这些细胞因子可以激活前列腺素、胶原酶和核因子-κB配体受体激活剂的释放[4]。正畸力的施加可以诱导IL-1的表达,尤其是在正畸治疗的早期阶段。此外,正畸力可以使牙周韧带(periodontal ligament,PDL)重塑,其中基质金属蛋白酶(matrix metalloproteinase,MMP)是在PDL重塑中起核心作用的酶[5],金属蛋白酶组织抑制因子 (tissue inhibitor of metalloproteinases,TIMP)可以抑制其活性。趋化因子与中性粒细胞/单核细胞趋化和破骨细胞分化有关,在OTM过程中骨重塑中起重要作用[6]。尽管证据有限,但一些临床研究表明,组织蛋白酶K(Cathepsin K)是破骨细胞中特征性高表达的溶酶体酶,主要参与骨胶原纤维的降解,在骨组织破坏吸收及重建过程中起着关键作用,它对OTM的激活反应尚未得到广泛研究[7]。本次研究通过ELISA法观察不同矫治力对口腔正畸患者龈沟液中IL-1β、TIMP-2、MMP-2、Cathepsin K表达量的影响。
1 资料与方法
1.1 一般资料 在2019 年12月至2020年12月期间,从广州市花都区妇幼保健院(胡忠医院)口腔正畸科门诊患者中选择自愿参加本研究的口腔正畸患者90例,男38例,女 52例,年龄 12~18岁,平均(15.01±2.10)岁,随机分为A、B、C三组,施加矫治力分别为0 g、100 g、150 g。
排除标准:(1)牙周炎患者;(2)在研究近1个月和研究过程中使用抗生素或抗炎药物;(3)患全身系统性疾病者。
本项研究经广州市花都区妇幼保健院(胡忠医院)伦理委员会批准(2019-010)。
1.2 方法
1.2.1 正畸治疗 在拔除上下颌第一前磨牙后,所有受试者都接受了口腔卫生指导,并被建议在实验前1个月和整个研究期间进行软食饮食和双侧咀嚼。为了防止牙菌斑形成和牙周疾病的发生,所有受试者每天用复方氯已定含漱液(江苏晨牌邦德药业有限公司)漱口2次,直至研究结束。
所有入组该研究的患者均采用0.022×0.028英寸系统的Damon Q直丝弓托槽(Ormco公司, 美国),使用0.017×0.025英寸不锈钢矩形方丝(埃蒙迪公司,中国),确保在片段弓丝放人时两侧尖牙均不受力;随机进入B、C组的患者其右侧上颌尖牙用镍钛螺旋弹簧(AWCS10506D,埃蒙迪公司,中国),镍钛螺旋弹簧两端均用0.011英寸结扎丝(Masel公司,美国)分别固定于实验侧上颌尖牙和上颌第一磨牙上,通过近中结扎丝的长短的调整控制牵引力的大小,用杆式测力计(杭州奥杰医疗器械有限公司)测量分别施加100 g或150 g的连续力,进入A组的患者施加0 g的初始力。
1.2.2 龈沟液的收集 采集时间点如下:施加矫治力前0 d (T0),施加矫治力后的1 d(T1)、3 d(T2)、7 d(T3)、14 d(T4)。清洁上颌右侧尖牙牙面,使用棉卷隔湿以免除唾液污染,使用气枪轻吹干牙面及周围牙龈。在上颌右侧尖牙远中龈沟处轻轻插入长8 mm宽2 mm滤纸条(whatman)直至有阻力后静置60 s获得的GCF样本。重复收集3次以获得足量GCF,将其放入1.5 mL离心管中,随后将样本放入-70℃冰箱中保存。
1.2.3 IL-1β、TIMP-2、MMP-2、Cathepsin K含量测定 取出GCF样本在室温下完全解冻,在离心管中加入150 μL PBS磷酸缓冲液,震荡2次,2 min/次,随后离心10 min(3 000 r/min)。通过酶联免疫吸附实验(ELISA)检测样本中IL-1β、TIMP-2、MMPs-2、Cathepsin K含量。试剂盒购自伊艾博医疗有限公司,操作步骤按试剂盒说明书进行。
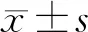
2 结果
2.1 不同矫正力对龈沟液IL-1β的影响 A组为对照组,患者龈沟液中IL-1β浓度保持在稳定的基线水平,在各时间点IL-1β浓度差异无统计学意义(P>0.05),见表1。B组和C组患者龈沟液中IL-1β含量变化趋势相似,两组加力后IL-1β浓度开始缓慢升高,T2时达到高峰,之后又缓慢下降,T4时恢复至加力前水平。与A组比较,B组、C组T1~T3时IL-1β浓度差异有统计学意义(P<0.05)。在同组中与加力之前比较,T1~T3时IL-1β浓度差异有统计学意义(P<0.05);见表1。

表1 龈沟液中IL-1β的含量变化
2.2 不同矫正力对龈沟液TIMP-2的影响 A组为对照组,患者龈沟液中TIMP-2浓度保持在稳定的基线水平,TIMP-2浓度在各时间点的差异无统计学意义(P>0.05),见表2。B组和C组患者龈沟液中TIMP-2含量变化趋势相似,加力后至T2时龈沟液中 TIMP-2浓度缓慢升高,T2~T3 TIMP-2浓度迅速升高,T3时达到峰值,之后又迅速下降,T4时虽然下降幅度明显,但仍高于T0水平。与A组比较,B组、C组T1~T4时TIMP-2浓度差异有统计学意义(P<0.05);在同组中与T0时比较,加力后T1~T4时TIMP-2浓度差异有统计学意义(P<0.05),且浓度均高于T0时(P<0.05),见表2。
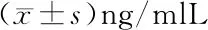
表2 龈沟液中TIMP-2的含量变化
2.3 不同矫正力对龈沟液MMP-2的影响 A组为对照组,患者龈沟液中MMP-2浓度保持在稳定的基线水平,MMP-2浓度在各时间点差异无统计学意义(P>0.05),见表3。B组和C组患者龈沟液中MMP-2含量变化趋势相似,在加力后至T2时龈沟液中MMP-2浓度开始缓慢升高,T3时达到高峰,之后迅速下降,T4时MMP-2浓度仍高于T0时水平(P<0.05)。与A组比较,B组、C组T1~T4时MMP-2浓度差异有统计学意义(P<0.05);在同组中与T0时比较,T1~T4时MMP-2浓度差异有统计学意义(P<0.05),且浓度均高于T0时(P<0.05),见表3。

表3 龈沟液中MMP-2的含量变化
2.4 不同矫正力对龈沟液Cathepsin K的影响 A组为对照组,患者龈沟液中Cathepsin K浓度保持在稳定的基线水平,Cathepsin K浓度在各时间点差异无统计学意义(P>0.05),见表4。B组和C组患者龈沟液中Cathepsin K含量变化趋势相似,在加力后至T3时龈沟液中Cathepsin K升高达到高峰,之后开始下降,T4时仍然高于加力前水平(P<0.05)。与A比较,B组、C组T1~T4时Cathepsin K浓度差异有统计学意义(P<0.05);在同组中与T0时比较,加力后T1~T4时Cathepsin K浓度差异有统计学意义(P<0.05),且浓度均高于T0时(P<0.05),见表4。
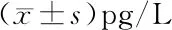
表4 龈沟液中Cathepsin K的含量变化
3 讨论
由于组织或细胞对机械刺激的反应,正畸力诱导牙周组织重塑。目前已有多项研究以确定正畸牙齿移动中的最佳力值范围。据报道,人类牙齿移动的最佳力的范围轻至18 g重至1 515 g,但在临床正畸治疗中并没有循证医学的最佳力值可推荐。在临床治疗中除了对牙齿移动速度最佳的力之外,还需关注施加正畸力后的炎症反应发生[8]。龈沟液是一种生理性液体,同时也是炎性渗出物,含有炎症标志物、生长因子和其他蛋白质,这些物质对于骨重塑过程均有影响[9]。在此前提下,本次研究主要观察不同矫治力对口腔正畸患者龈沟液IL-1β、TIMP-2、MMP-2、Cathepsin K的表达影响。
IL-1β已被证明是激活破骨细胞活性并趋化白细胞和其他细胞介质来处理骨重塑的最有效的细胞因子[10]。它是第一个通过机械应力调节骨吸收和骨形成的免疫细胞功能的多肽介质。此外,IL-1β是炎症介质之一,其诱导产痛物质的分泌。更重要的是,IL-1β可由牙周韧带(PDL)产生,其量足以扩散到龈沟液中,并且已经被鉴定为正畸牙移动的生物标志物。当正畸力施加到牙齿上时,来自矫治力的机械应力引起牙骨质中和牙周支持组织中的许多细胞种类、结构、生化反应发生变化,并导致早期正畸牙移动期间的急性炎症反应[11-12]。本次研究发现同时间段,施加矫治力后IL-1β较对照组显著升高,且相比本组施加矫治力前,第3天达到峰值,提示不同矫治力对于IL-1β影响较明显,且施加作用力越大,患者龈沟液IL-1β分泌量越多,炎症反应越大。
正畸牙移动过程中,周围组织中胶原酶会发生变化,其中包括MMP-2以及MMP 的特异性抑制因子TIMPs。MMP是锌依赖性内肽酶家族,包含超过25种酶,可调节许多生物过程,在PDL重塑中起核心作用的酶[13]。MMP是炎症介质之一,有研究显示,MMP-2和TIMP-2的表达在正畸过程中的压力和张力部位均上调[14]。本研究发现,TIMP-2在不同矫治力作用下,浓度不同程度提高,与同时间点对照组相比,差异有统计学意义,且高于本组矫治前。TIMP-2、MMP-2的变化趋势具有一致性,提示MMP 和 TIMP 协同产生,且与施加力呈正相关性。
蛋白水解过程是破骨细胞骨吸收的关键,骨基质蛋白的降解是由破骨细胞分泌到骨吸收腔隙中的酸性溶酶体蛋白酶启动的,然后在细胞内溶酶体系统中继续并完成[15]。到目前为止,已经在吸收活跃的破骨细胞的腔隙和溶酶体样细胞器中鉴定出多种溶酶体蛋白酶。在溶酶体蛋白酶中,Cathepsin K尤为特殊,因为该酶主要在破骨细胞中表达,并能在酸性条件下有效降解骨基质蛋白[16]。Cathepsin K可视为牙周炎牙槽骨吸收的重要标记物,研究发现其在龈沟液中的含量随着牙周炎的加重而增加[17]。相关大鼠实验发现施加正畸力12 h后Cathepsin K在破骨细胞中的表达逐渐增加,在第3天达到高峰,随后逐渐下降,几乎恢复到加力前[18]。本次研究发现Cathepsin K在各时间点相较对照组,均不同程度升高,且在第7天达到峰值,之后逐渐下降,第14天仍然高于加力前水平;且与本组施加矫治力前相比,差异有统计学意义。提示不同矫治力可导致Cathepsin K表达增加,其表达量与力值呈相关性。
本次研究结果证实,在不同矫治力作用下,IL-1β、TIMP-2、MMP-2、Cathepsin K的表达随时间延长呈现规律性的增减变化。检测龈沟液中IL-1β、TIMP-2、MMP-2、Cathepsin K的动态变化有助于研究正畸过程中正畸力值及加力时间是否适宜,一定程度上也说明施加正畸力后牙周组织会发生改建,这种改建活动在单次加力后出现先逐渐增强,后逐渐减弱的变化趋势,至14 d 时基本稳定。因此检测龈沟液中IL-1β、TIMP-2、MMP-2、Cathepsin K的浓度能够帮助正畸医师使用正畸力获得最佳的牙齿移动,正畸医师可利用IL-1β、TIMP-2、MMP-2、Cathepsin K作为检测最佳牙齿移动持续时间的指标,以避免发生病理性的牙槽骨吸收、牙根吸收。但是本次研究过程中未研究大于150 g的正畸力,牙齿移动骨再建是一个复杂而连续的过程,要探究最适合牙齿移动的最佳力,不同矫治力作用下牙周组织改建过程中IL-1β、TIMP-2、MMP-2、Cathepsin K 的相互作用仍需进一步研究。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:邹晖直接参与酝酿和设计实验,实施研究,采集数据,分析解释数据;起草论文,统计分析。李朝晖对论文的知识性内容作批评性审阅,指导、支持该项工作。左园林实施研究,采集数据。张晔直接参与酝酿和设计实验;获取研究经费,支持该项工作。吴堪葵直接参与酝酿和设计实验,实施研究。

