锥形束CT离线校正在乳腺癌放疗摆位中的应用*
陈雪梅, 黄晓彤, 蔡维洵, 刁文超, 朱金汉, 何振宇, 姜晓勃
中山大学肿瘤防治中心放疗科(广东广州 510060)
乳腺癌保乳术加上全乳根治性放疗,可获得与根治术相当的长期局部控制率与生存率[1-2]。现有研究显示,乳腺癌患者5年生存率已高达90%[3]。目前乳腺癌保乳术后放疗使用调强技术,靶区分布相比常规放疗均匀度更高,可有效降低远处转移率,皮肤反应低,乳房美观度好[4]。乳腺癌放疗结合锥形束CT,与定位CT进行配准,可在线或离线校正摆位误差[5]。在图像配准区域选择时,可采用患侧胸壁(局部配准)、锁骨头区域(局部配准)和靶区(整体配准)3种方式。本研究收集我中心30例乳腺癌保乳术后患者,前3次治疗应用锥形束CT扫描,通过离线校正的方法重新调整治疗等中心,回顾性分析3种配准范围的摆位误差数据,用于研究并改善乳腺癌放疗精度,现报告如下。
1 资料与方法
1.1 一般资料 选取2020年12月至2021年8月在中山大学肿瘤防治中心行乳腺癌保乳术后放疗的女性患者,共30例。其中,左、右乳腺癌分别为17、13例。
纳入标准:经病理、影像学检查确诊为乳腺癌,行保乳术后分期为Tis2N02M0;女性,年龄25~50岁;KPS>50分;患侧上臂上举外展自如;患者接受KV-CBCT图像引导放疗装置并自愿签订知情同意书;言语沟通无障碍。
排除标准:同时双侧乳腺癌;既往或治疗时合并有其他恶性肿瘤(皮肤癌、甲状腺乳头状癌等);既往接受过乳腺癌放疗;存在乳腺癌放疗禁忌证;严重心功能不全;无法配合完成摆位者。
本研究已获得伦理委员会批准(B2020-379-01)。
1.2 实验设备 瑞典医科达直线加速器ELEKTA infinity、Philips 16排螺旋CT模拟定位机,monaco放疗计划系统(treatment planning system,TPS)、锥形束CT(cone beam CT,CBCT)、碳纤维头颈肩架(广州科莱瑞迪医疗器材有限公司生产)、医用发泡胶等。
1.3 放疗方法
1.3.1 体位固定与CT定位 30例患者均采用手抓袋式发泡胶进行体位固定,将发泡胶放在颈肩体位固定架上,患者仰卧体位躺其上,利用激光灯使患者体位端直,人体正中矢状面平行于床中线并垂直于床水平面。患者双手上举,保证胸部和颈部得到充分暴露,将发泡胶倒入固定袋中进行塑形。发泡胶是根据每例患者的体型轮廓独立制作,患者躯干、头部、手臂和肩胛骨等部位均留有明显的凹槽,卡位好、适形度高,十分贴合患者轮廓,治疗时可很好地保持体位的重复性。使用Philips 16排螺旋大孔径CT模拟定位机采集图像,扫描层厚为5 mm,管电压为120 kV,扫描范围为第二颈椎上缘到第二腰椎下缘。
1.3.2 计划设计与验证 CT定位扫描后,将图像导入TPS服务器,医生勾画靶区及危及器官并确定治疗方案(总剂量50 Gy,分次25次),剂量师针对患者不同情况制订放射治疗计划。物理师在加速器上通过计划验证,患者在模拟机复位后至加速器机房进行放疗。所有患者治疗方法均为调强放疗。
1.3.3 图像获取 治疗均使用直线加速器ELEKTA infinity自带的CBCT系统(XVI成像系统)进行KV级的图像扫描。扫描电压120 kV,机架转速360°/min,KV准直器参数设置为M20,KV滤线器参数设置为F1,采集图像330帧/min,FOV成像范围为276.7 mm×409.6 mm,扫描时机架逆时针旋转,角度为180°至180°。患者整个治疗流程共有7次CBCT扫描,前3次治疗均需要进行扫描,此后每周1次。
1.3.4 图像配准 图像配准采取先自动配准再手动配准微调的方式。每例患者治疗前以定位CT为基准,配准范围包括患侧胸壁区域和锁骨上下淋巴结区域以内的PTV感兴趣区(GROI)。由于乳腺是软组织,匹配方式选择灰度匹配(GreyT)。首次治疗医师到场,图像自动匹配后,再以靶区大小、胸廓结构、胸骨柄、乳腺轮廓等为参考点,进行手动微调X轴方向(左右)、Y轴方向(头脚)及Z轴方向(前后)的匹配数据,通过水平移动分别在横断面、矢状面和冠状面判断定位CT上的肿瘤靶区是否与CBCT图像吻合。
1.4 离线校正治疗等中心 所有患者均由同一组治疗师(2位)进行摆位,保持技术操作上的一致性。前3次治疗均按照在模拟机复位的标记点(A)进行摆位获取图像,并由同一位治疗师进行GreyT配准,分别记录每次摆位X轴(左右)、Y轴(头脚)及Z轴(前后)的平移误差。第3次治疗时,根据前2次以及当前摆位的X、Y、Z轴方向上的误差离线计算均值作为移床参数调整新的治疗等中心点(B),移床后根据激光重新在患者的发泡胶真空垫或皮肤表面进行标记,后续的治疗按照B点进行摆位,每周行1次CT扫描记录误差,并与患者前3次的摆位数据分别进行X、Y、Z轴方向分次间误差比较,计算计划靶区(planning target volume,PTV)外扩值(M)。摆位误差可分为系统误差和随机误差,系统误差用每例患者误差均值的标准差Σ表示,随机误差用误差标准差的均方根σ表示。Van Herk提出:为确保90%患者临床靶区(clinical target volume,CTV)至少接受95%的处方剂量,CTV-PTV外放公式MPTV(外放)=2.5Σ+0.7σ[6]。
1.5 图像配准结果回顾评估 对30例患者在7次CBCT扫描的图像重新进行回顾性配准分析,其中前3次基于A点摆位,后4次基于B点进行摆位,30例患者共采集210套CBCT图像。采用六维的灰度自动匹配(GreyT+R)加手动微调的模式,以每例患者治疗前以定位CT为基准,采用3种不同配准范围(图1):(1)患侧胸壁区域(CROI):纵向从胸骨柄至PTV,横向以体中线至胸壁外侧1 cm;(2)患侧锁骨头区域(SROI):纵向从环状软骨至锁骨头下缘,横向以颈椎至肱骨头;(3)整体区域(GROI):包括患侧胸壁区域和锁骨上下淋巴结区域以内的PTV感兴趣区。数据收集为离线模式,分别统计及评估3种配准方法X、Y、Z轴方向上的平移以及旋转误差。
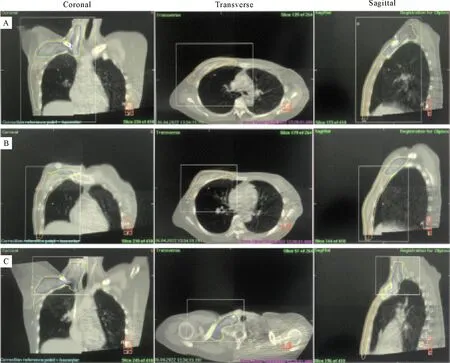
注:A:GROI;B:患侧CROI;C:患侧SROI
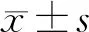
2 结果
2.1 治疗等中心修正前后摆位误差频率及分布分析 修正治疗等中心后的系统误差和随机误差值均明显小于修正前。见表1。
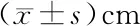
表1 患者治疗等中心校正前后误差比较
2.2 治疗等中心修正前后外扩边界变化 在左右、头脚、前后方向上的M值分别由调整前的0.54、0.76、0.62 cm变成了修正后的0.17、0.17、0.19 cm。见表2。
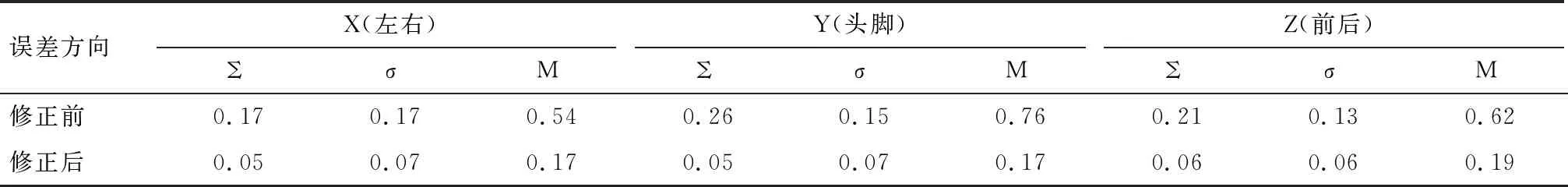
表2 摆位误差计算不同方向的外放值 cm
2.3 治疗等中心修正前后的摆位误差回顾性统计检验 经修正,X、Y、Z轴方向上的平移误差中位数值显著减少,X轴方向上的旋转角度中位数值由(0.50~1.10)°减少到(0.40~0.65)°,Y轴方向上由(0.80~1.40)°减少到(0.60~0.85)°。不同配准区域误差分析的结果分析发现,修正治疗等中心后,GROI、CROI和SROI在X轴平移误差和Y轴旋转误差差异无统计学意义(P>0.05),其他方向和旋转角度上差异有统计学意义(P<0.05)。见表3~4。
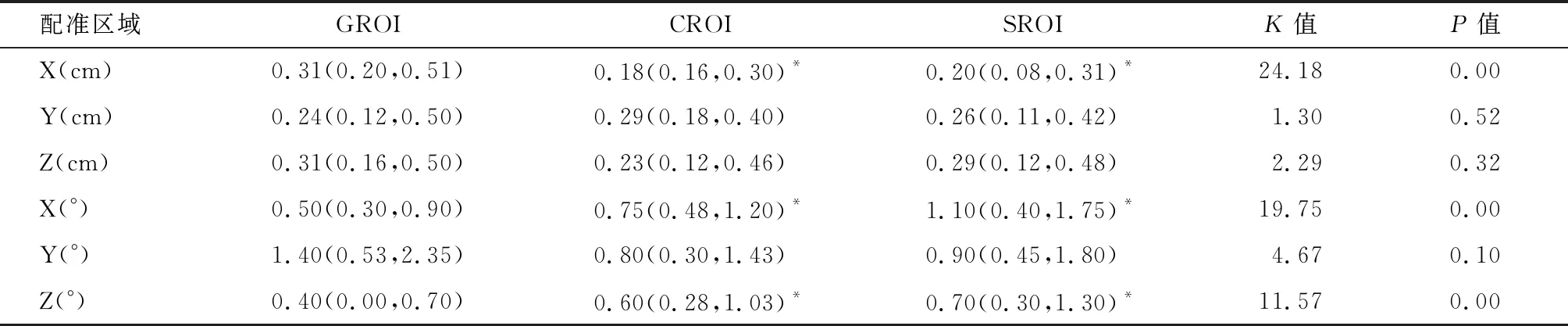
表3 治疗等中心修正前的配准区域误差分析 M(P25,P75)
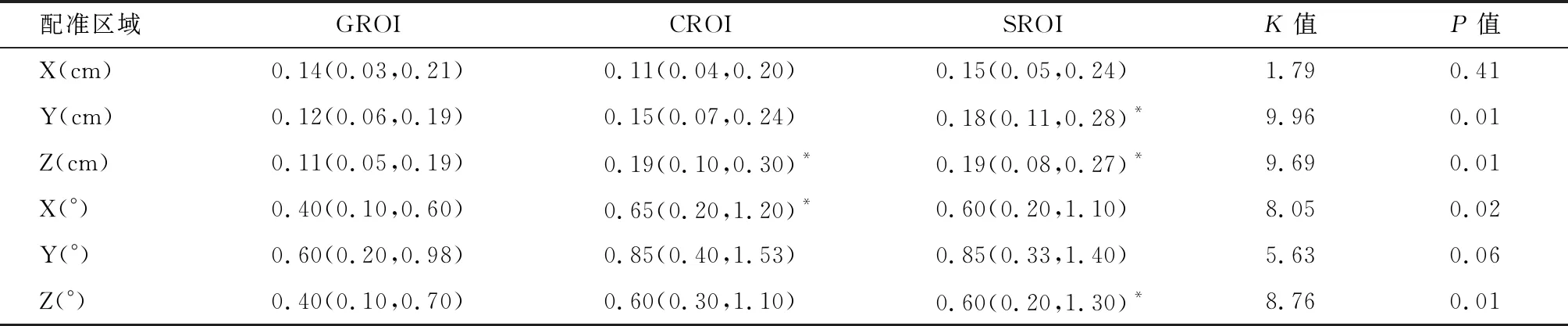
表4 治疗等中心修正后的配准区域误差分析 M(P25,P75)
3 讨论
本研究应用锥形束CT离线较正系统性误差重新设置新的治疗等中心,是在模拟机复位的前提下,前2次治疗均进行锥形束CT扫描并在线移床校准误差,第3次CT扫描后离线计算前3次误差平均值,再根据激光线移床,重新调整新的治疗等中心点。采用该方法有效地提高了后续治疗摆位的重复性,降低了在X(左右)、Y(头脚)及Z(前后)方向上的的平移误差,相比乳腺癌传统的复位方法有更精准的结果。模拟机复位主要以骨性标志为参考进行刚性配准,无法对患者体位的旋转角度进行纠正,有研究发现由于呼吸运动的因素,胸部肿瘤患者模拟机复位重复性较差,误差较大[7-8]。CT-sim复位在三维方向上的平均精度高于模拟定位机,但实验数据显示只有40%的患者位移精度在1 mm以内[9]。加速器复位是通过电子射野影像装置(EPID)进行双曝光获取图像,可快速地自动探测体位误差或准直器系统误差引起的照射野形状和几何位置变化[10-11]。但EPID也只能提供二维影像,不能完全纠正患者体位和靶区位置的误差。
在治疗期间患者体位重复性高,对提高治疗效果、实现精准放疗具有实际的临床意义[12]。乳腺癌治疗使用的调强技术与锥形束CT相结合,可明显减少放疗分次间的误差,精准打靶,减少放疗并发症[13]。大量研究结果表明,以CBCT为手段的乳腺癌调强可以极大地提高乳腺癌的放疗摆位精度[14-17]。锥形束CT校正摆位误差有两种方式:在线校正和离线校正。在线校正是每次治疗前进行CBCT扫描引导乳腺癌放疗摆位,可保证治疗位置准确但患者会额外受到更多的辐射[18]。离线校正是对患者的第1次或前几次CT扫描的摆位误差进行校正,通过对数据的离线分析设置新的治疗等中心。吴志勤等[19]对接受乳腺癌保乳术后放疗的患者应用离线匹配,发现Z轴方向误差最大,均值为0.28 cm;Wang等[5]可将全乳房照射的残余误差减少到0.15 cm,与本研究结果相似。本研究中的患者是采用CBCT离线校正的方式重新调整治疗等中心,结果显示,调整等中心后在X、Y、Z轴方向上的平移误差从0.38~0.42 cm显著降低至0.11~0.14 cm(P<0.05)。说明离线校正的方法可以提高乳腺癌患者治疗的准确性,可有效减少分次间摆位误差。申正文等[20]通过模拟摆位误差来计算乳腺癌放疗靶区PTV外放边界范围,证实了当摆位误差超过3 mm时,PTV剂量分布影响显著,可能使靶区边界超出计划范围。本中心的PTV外扩边界标准是0.5 cm,治疗等中心修正后左右、头脚、前后方向上的PTV外扩范围由0.54、0.76、0.62 cm变成了0.17、0.17、0.19 cm,完全符合质控要求。
Zhou等[21]探讨乳腺癌根治术后放疗配准区域误差分析发现,GROI的整体误差范围是3.21~4.67 mm,Shen等[22]的结果显示GROI的整体误差范围是3.26~3.92 mm,两者的研究结果均与本研究未调整治疗等中心前相似。修正治疗等中心前,GROI的整体误差范围是0.24~0.31 cm,修正等中心后,整体范围的平移误差减少至0.11~0.14 cm。同时,Zhou等[21]在考虑局部残余误差时还将脊椎区域作为感兴趣区,Shen等[22]将患侧手臂区域作为感兴趣区,发现脊椎区域和手臂区域的局部误差远大于整体区域误差。他们还对患者胸壁的呼吸运动幅度进行了量化,发现在所有平移方向上的运动误差均值为1 mm,这点与Yue等[23]的结果相似。根据这些发现,本研究中并未考虑胸壁呼吸运动的影响,且因椎体和手臂并不在靶区范围内,没有计算两个感兴趣区的局部误差。对于局部残余误差SROI和CROI而言,虽然两者的平移误差均值也有一定减少,但减少的幅度并不大(0.04~0.14 cm)。GROI的旋转误差均小于SROI和CROI,各方向旋转角度误差均值<1°,可以满足临床需求。因此,当我们使用锥形束CT引导调强放疗时,在线校正有助于减少局部残余误差和PTV外扩范围。值得注意的是,PTV外扩边界的增加虽然可以保证肿瘤靶区的精准覆盖,与此同时也会增加正常组织器官的辐射剂量[24]。
在乳腺癌放疗复位方面,本研究通过锥形束CT离线校正治疗等中心有效提升并补充了仅依赖二维DRR图像在胸部患者的复位精度,但也有不足之处。例如病例数较少,数据具有局限性;离线纠正治疗等中心的方法对整体误差有一定的帮助,但是当考虑到局部残余误差时,可能需要采取其他措施。本文没有计算局部感兴趣区的PTV外扩边界,在日后的研究中可以进行进一步的计算。可通过其他辅助装置如光学体表成像系统来摆位、监控放疗过程中的呼吸运动以达到减少残余误差的目的。
综上所述,在乳腺癌放疗复位验证中,仅依靠传统模式、仅依据模拟机二维DRR图像的复位是不足够的,我们根据模拟机复位或CT-sim复位后的治疗点,在加速器上应用前3次放疗扫描锥形束CT并离线调整治疗等中心,配准范围选择GROI,可明显减少后期治疗摆位误差,从而提高调强放疗的精确度,值得临床推广。
利益相关声明:本研究由署名作者按以下贡献声明独立开展,排名无争议。论文不涉及任何利益冲突。
作者贡献说明:陈雪梅负责提出研究方向、设计论文框架、设计研究思路、实施研究过程并撰写论文;黄晓彤负责进行实验、收集数据;姜晓勃、朱金汉参与修订论文、审核论文;刁文超负责收集数据;蔡维洵参与文献调研与整理、收集数据;何振宇负责实验过程中难题解惑、参与论文修订。

