乳腺浸润性导管癌中lncRNA-miRNA-mRNA ceRNA网络的整合分析*
高建, 金亦, 林洁, 林圣, 段山△
1南方医科大学附属深圳妇幼保健院妇幼医学研究所实验室(广东深圳 518040); 2中山大学附属第三医院病理科(广东广州 510630); 3深圳市卫生健康发展研究和数据管理中心分子医学实验室(广东深圳 518028)
乳腺癌(breast neoplasms)是威胁全球女性健康的最常见的恶性肿瘤之一,也是导致女性死亡的主要恶性肿瘤之一[1]。有数据表明,全球新确诊的每100例乳腺癌患者中,有12例来自中国,新发病例增长的速度是世界平均水平的2倍;另外,中国乳腺癌的平均诊断年龄为45~55岁,平均发病年龄亦比西方国家早10~15年[2-3]。由于乳腺癌是一种高度异质性疾病,具有独特且复杂的组织病理学模式和临床行为,尽管有很多的研究成果,但其发生机制仍不完全清楚。非编码RNA(non-coding RNA, ncRNA)是人类基因转录组的主要组成部分,在细胞过程中发挥着重要作用,且与许多病理状况特别是癌症有关[4-5]。ncRNA的亚类包括microRNA(miRNA)和多种长链非编码RNA(long non-coding RNA, lncRNA),如lincRNA、反义RNA、假基因和环状RNA等;miRNA长约22个核苷酸,通过与靶标转录物的特定位点结合而执行转录后调控作用,从而导致转录物降解或翻译抑制[6-7]。lncRNA为大于200个核苷酸的转录物,由RNA聚合酶Ⅱ转录,但不翻译成蛋白质,在哺乳动物基因组中的数量最多[8]。竞争性内源性RNA(competing endogenous RNA, ceRNA)的机制表明,lncRNA可以通过竞争性结合靶mRNA上的miRNA反应元件(microRNA response elements, MRE)来抑制其功能,从而充当天然miRNA的诱饵来调节基因表达;这些相互作用通常是相互关联的,任何网络组件的异常表达都可能破坏复杂的调节通路,最终导致癌症的发展和进展[9-11]。已有研究表明,ceRNA机制在乳腺癌中的作用是多样的。Chi等[12]发现lncRNA SNHG5可削弱miR-154-5p对靶基因PCNA的抑制作用,进一步增强了乳腺癌细胞的增殖;Yang等[13]的研究结果表明,miR-204能够与参与乳腺癌上皮细胞-间充质转化的Sox4结合,而雌激素受体阴性患者体内诱导的lncRNA ARNILA可作为miR-204的ceRNA来增强Sox4的表达,进而参与了乳腺癌的侵袭、转移和上皮细胞-间充质转化过程。Dong等[14]发现lncRNA TINCR在耐曲妥珠单抗乳腺癌患者中高表达,它可作为miR-125b调节HER2表达的“分子海绵”,敲低TINCR后,miR-125b表达增加,HER2表达降低,反之亦然,表明TINCR可能是预测和治疗HER2阳性乳腺癌的潜在靶点。为此,我们采用人类全转录组基因表达谱芯片和miRNA芯片来筛选异常表达的lncRNA、miRNA和mRNA,进而构建乳腺浸润性导管癌的特异性ceRNA相互作用网络,进而为深入了解该病的发病机制提供新的研究思路。
1 资料与方法
1.1 标本来源 收集2016年3月至2018年3月在中山大学附属第三医院就诊,行手术切除且经病理确诊的乳腺浸润性导管癌组织标本68例,所选乳腺癌患者全部为女性,中位年龄50.5岁,年龄范围24~81岁;癌组织的分子分型标准参考圣加仑国际专家共识[13]和中国抗癌协会乳腺癌诊疗指南和规范(2013版)。
入组标准:(1)所有病例均由两名副主任医师及以上级别的医师核实确认;(2)乳腺癌病理学分型及组织学分级参照乳腺肿瘤世界卫生组织分类(2012版)进行,所有标本均为乳腺浸润性导管癌(Ⅰ级~Ⅲ级);(3)术前均未行放疗和化疗;(4)获得患者及家属的知情同意。
排除标准:(1)确诊为非乳腺浸润性导管癌患者;(2)术前已进行乳腺癌相关治疗的患者;(3)相关资料不完整者;(4)合并有其他部位恶性肿瘤或其他严重疾病的患者。
同时收集同期乳腺良性组织标本14例。标本离体30分钟内置超低温冰箱保存。该研究已获得深圳市卫生健康发展研究中心伦理委员会批准(批号:2019-004)。
1.2 主要试剂和仪器 GeneChipTMHuman Transcriptome Assay 2.0、GeneChipTMWT PLUS Reagent Kit、GeneChipTMHybridization, Wash, and Stain Kit、GeneChipTMmiRNA4.0 Aaary、FlashTagTMBiotin HSR RNA Labeling Kit以及基因芯片杂交、洗涤和扫描系统均购自美国Thermo Fisher公司;AllPrep DNA/RNA/miRNA Universal Kit和IPA(Ingenuity Pathway Analysis)应用软件购自德国Qiagen公司。
1.3 芯片操作和差异表达分析 组织总RNA的提取根据AllPrep DNA/RNA Mini Kit说明书操作。对于HTA2.0芯片,采用WT PLUS Reagent Kit对总RNA依次反转录合成cDNA、体外转录合成cRNA、生物素标记和cRNA片段化后,与HTA2.0芯片进行杂交;对于miRNA4.0芯片,采用Biotin HSR RNA Labeling Kit对总RNA中的miRNA进行加尾和生物素标记后,与miRNA 4.0芯片进行杂交。杂交后的芯片经洗涤工作站洗涤、染色后,置于芯片扫描仪扫描,采用配套软件TAC4.0对芯片质量和数据进行检测和分析,当同时满足ANOVAP<0.05且|Fold Change (linear)|>2时认为RNA分子存在差异表达。
1.4 数据预处理和ceRNA调控网络的构建 从Affymetrix官网获得HTA-2.0芯片的注释文件,找到对应的基因组位置信息,然后在NONCODE数据库中搜索对应基因组位置的lncRNA转录本作为探针对应的转录本,如果一个探针对应多个转录本,则选择最长的转录本。利用R软件中的“DCRNATools”包[14]构建ceRNA网络,该包中整合了SpongeScan、StarBase v.2.0、mirTarBase以及 miRcode四个数据库中miRNA与lncRNA、mRNA的互作关系,其中StarBase v.2.0数据库具有更多和更全面的lncRNA-miRNA和mRNA-miRNA的关系对。ceRNA网络构建标准如下:(1)lncRNA与mRNA表达呈正相关,判断标准为相关系数>0.3和P<0.05;(2)lncRNA和mRNA具有与某个miRNA结合的相同MRE;(3)从构建好的ceRNA网络中筛选受到同一个miRNA调控的mRNA和lncRNA,作为特异性ceRNA的子网络,用Cytoscape软件进行可视化。
1.5 利用IPA软件分析失调表达mRNA的生物学功能 IPA是一个基于云计算的一体化的商业应用软件,其所有解决方案都依赖Ingenuity Knowledge Base,它是一个由专家编译的生物学相互作用以及功能注释的知识库,来源于蛋白、基因、复合物、细胞、组织、药物以及疾病间独立的建模关系,还包括人工阅读提取的几百万条公开发表的科研成果和报告。本文利用该软件来分析上调和下调表达mRNA所参与的经典通路、生物学功能以及疾病关联情况。
2 结果
2.1 受试者临床资料 本研究所收集到的68例女性乳腺浸润性导管癌样本中,涵盖了乳腺癌常见的分子分型,典型的免疫组织化学染色结果见图1,其中Luminal A型有17例(图1-A)、Luminal B型有32例(图1-B)、HER2过表达型有9例(图1-C)和三阴性乳腺癌有10例(图1-D)。组织学分级Ⅰ级有24例,Ⅱ级有25例,Ⅲ级有19例。

注:A:Luminal A型;B:Luminal B型;C:HER2过表达型;D:三阴性乳腺癌
2.2 差异表达分析 数据经过验证和去重复处理后,乳腺浸润性导管癌组织与乳腺良性组织相比,差异表达的mRNAs有513个,其中上调的有353个,下调的有160个(图2-A);差异lncRNAs有293个,其中上调的有156个,下调的有137个(图2-B);差异表达的miRNAs有165个,其中上调的有29个,下调的有136个(2-C);其中差异表达最显著的上调和下调的mRNA、lncRNA和miRNA各10个的列表见表1。
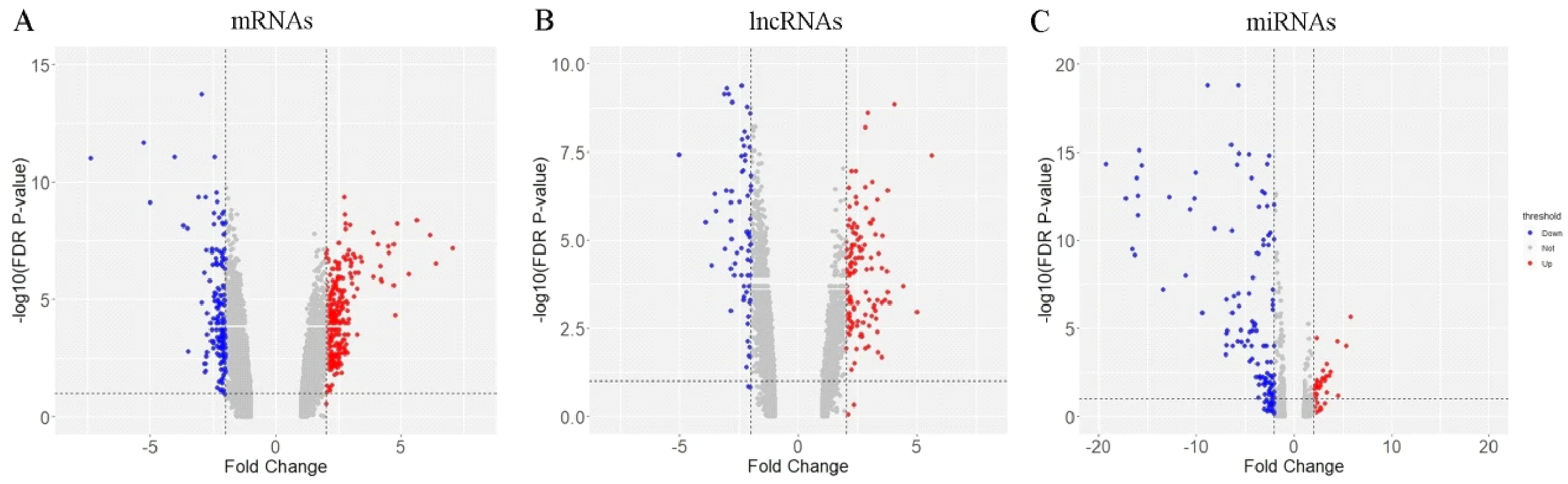
注:A为差异表达mRNAs火山图;B为差异表达lncRNAs火山图;C为差异表达miRNAs火山图。蓝点标记为下调的RNA分子,红点标记为上调的RNA分子。|Fold Change (linear)|>2且P<0.05的RNA分子被认为存在差异表达。
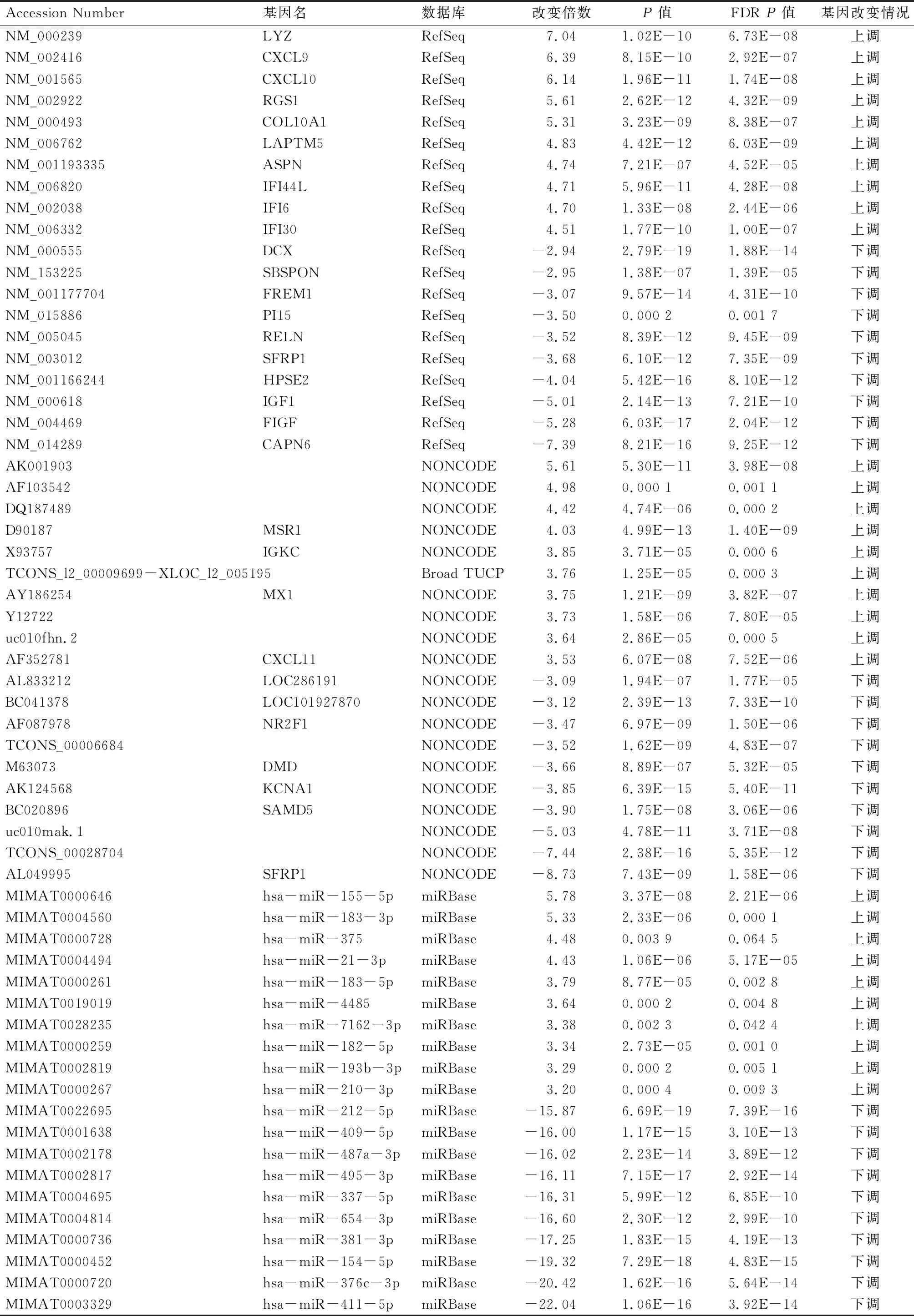
表1 差异表达最显著的上调和下调mRNAs、lncRNAs和miRNAs各10个列表
2.3 差异表达mRNAs的生物学功能分析 利用IPA分析预测差异表达mRNAs所参与的经典通路和已知疾病以及生物学过程,上调表达的代表性mRNAs有STAT1、TGFB3、EDN1、FN1、TLR9、SOCS和PRL等,主要参与的经典通路有树突状细胞成熟、先天性和适应性免疫细胞之间的通讯、同种异体排斥信号、B细胞发育和T辅助细胞分化等,其中树突状细胞成熟处于激活状态;细胞学功能主要涉及肿瘤细胞运动、细胞损害、细胞迁移、侵袭和转移、细胞生长和增殖、晚期恶性肿瘤、细胞间信号和相互作用等(图3-A和3-C)。下调表达的代表性mRNA有STST3、SP1、RELA、ERBB2、EGF、SP1和SMARC4等,主要参与的经典通路有肿瘤微环境通路、HIF1α通路、HOTAIR调控通路、轴突导向信号和基质金属蛋白酶抑制通路等,其中前3个通路处于抑制状态,基质金属蛋白酶的抑制作用处于激活状态;细胞学功能主要涉及细胞运动、有丝分裂、细胞骨架生长、细胞周期、细胞发育、细胞生长和增殖和翻译后修饰等(图3-B和3-D)。
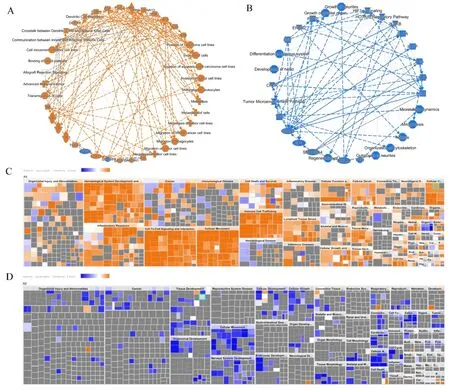
注: A为表达上调mRNAs在通路和分子过程中的相互关系;B为表达下调mRNAs在通路和分子过程中的相互关系;C为表达上调mRNAs对疾病和功能的影响; D为表达下调mRNAs对疾病和功能的影响。红色表示激活,蓝色表示抑制。
2.4 乳腺浸润性导管癌中ceRNA网络及特异性子网络的构建 通过R软件中的“GDCRNATools”包和Cytoscape软件构建了差异表达lncRNA-miRNA-mRNA的ceRNA网络(图4-A)。受到同一个miRNA调控的mRNA和lncRNA的特异性ceRNA子网络结果表明,4个lncRNAs,即TC16001656.hg.1、TC15002548.hg.1、TC22001008.hg.1和TC22001009.hg.1,分别通过与hsa-miR-152-3p、hsa-miR-758-3p和hsa-miR-378d结合,进而调控61个mRNAs的表达(图4-B)。
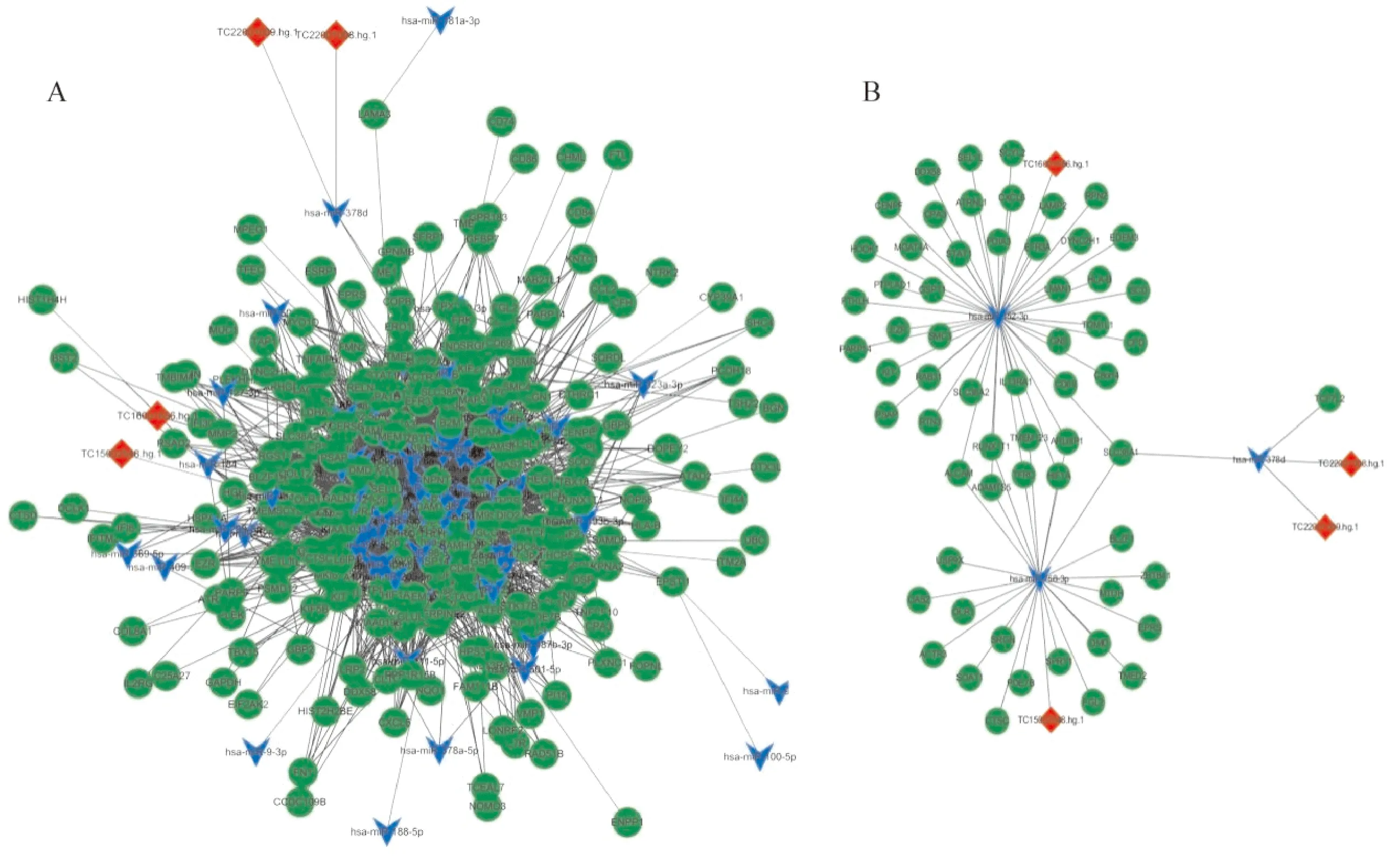
注: A为乳腺浸润性导管癌差异表达的ceRNA网络;B为差异表达特异性ceRNA子网络。红色菱形代表差异lncRNA,绿色圆形代表差异mRNA,蓝色箭头代表差异miRNA
3 讨论
不同类型RNA分子之间的相互作用对转录组的稳定、维持和调控至关重要[15]。在病理状态下,很多基因的表达水平会发生显著的改变,进而导致转录组的表达异常。因此,筛选和鉴定转录组中异常表达的RNA分子是阐明疾病分子机制的有效途径之一[16]。近年来,全基因组表达分析已经成为一种常规的分析工具,尤其是为研究和理解关键基因在癌症进展中的功能提供了一个很好的解决方案[17-18]。在本研究中,采用人类全转录组基因表达芯片和miRNA芯片来检测乳腺浸润性导管癌中表达异常的RNA分子,不但可以一次性检测所有已知基因(包括编码基因和非编码基因)水平的表达谱,而且可以准确分析几乎所有已知的转录本异构体,检测效率和准确度都非常高。另外,本研究所纳入的样本组织特性均一、代表性强,基本涵盖了浸润性乳腺癌的所有分子分型,使得差异表达的结果可靠性较强。
竞争性内源ceRNA学说揭示了RNA分子间相互作用的新机制。在生理和病理条件下,各种相关基因和ceRNA网络紧密交织在一起。不同类别的ncRNA的功能多样性及其相互作用的可塑性增加了可能在恶性肿瘤中脱轨的多层调控通路,最终导致了癌症的发展和进展[19]。多项研究表明,ceRNA网络可调控乳腺癌的方方面面。Linc-ROR通过miR-194-3p靶向MECP2促进乳腺癌的进展并降低对雷帕霉素的敏感性[20];长非编码RNA LINC00511通过诱导miR-185-3p/E2F1/Nanog轴参与乳腺癌的发生和茎化[21];LncRNA-CDC6通过miRNA-215作为靶向CDC6的ceRNA促进乳腺癌的进程[22];LINC00673被YY1激活后通过miR-515-5p/MARK4/Hippo信号通路促进乳腺癌细胞的增殖[23];最近的一项在乳腺浸润性癌中的研究表明,两个NEAT1相关ceRNA的异常表达可能导致TP53突变患者对他莫昔芬治疗的不良反应,提示ceRNA网络可以作为预测不同癌症药物反应的工具[24]。在本研究所构建的ceRNA网络中,位于关键节点的3个miRNAs在乳腺浸润性导管癌组织中均下调表达,与多篇文献报道一致。miR-152作为肿瘤抑制因子在乳腺癌中下调表达,可通过靶向PIK3CA来抑制AKT和RPS6的激活,进而抑制乳腺癌细胞系HCC1806的增殖,也可通过负调控褪黑素来抑制三阴性乳腺癌血管生成因子,还可靶向SPIN1通过上调药物代谢酶和药物转运体的表达增强乳腺癌的阿霉素耐药性[25-27]。miR-378d可经化疗产生,通过激活 EZH2/STAT3 信号通路促进乳腺癌的干性和耐药性, 因此,在化疗期间阻断这种适应机制可能会减少化疗耐药性的发展并最大限度地提高乳腺癌的治疗效果[28]。miR-758-3p以lncRNA DANCR-miR-758-3p-PAX6的ceRNA分子网络形式调控乳腺癌细胞的凋亡和自噬[29]。ceRNA的作用机制提示,本文所构建的特异性ceRNA网络中的重要节点RNAs,很有可能是参与乳腺浸润性导管癌发生和进展的关键因子。
综上所述,lncRNA可以调节各种细胞过程,它们作为竞争性miRNA的诱饵作用,通过ceRNA网络来调节各种癌症中的基因表达。本研究成功构建了乳腺浸润性导管癌中关键lncRNA相关的ceRNA特异性网络,这些发现有利于为进一步研究乳腺癌基因间的调控机制提供了新的思路和研究方向。下一步,我们将继续探索与这4个lncRNAs分别发生作用的miRNAs以及mRNAs,采用体内体外实验来验证它们在乳腺癌的功能。
利益相关声明:全体作者都阅读并同意最终的文本,所有作者均没有利益冲突。
作者贡献说明:高建是本研究的实验设计者和负责人,完成数据分析和论文初稿的写作,金亦负责标本的收集、临床诊断和临床表型分析以及临床资料的整理和随访,林洁负责芯片实验的操作,林圣完成数据的挖掘分析,段山指导实验设计并参与论文的校对和定稿等。中山大学第三附属医院是本研究的合作单位,主要负责样本的提供。

