DCE-MRI及阴道超声在宫颈癌诊断中的临床价值
龚志平 刘儒雅 王琳琳
宫颈癌在全世界发病率占女性肿瘤第2位[1]。宫颈浸润癌好发于45~60岁中老年女性,现已成为该年龄段女性重要致死原因[2]。既往宫颈癌的确诊及临床分期主要依赖于手术病理[3]。临床常规查体以及宫颈细胞学对宫颈癌的术前诊断提供一定帮助,但对于肿瘤浸润范围、侵犯周边组织情况及淋巴结转移无法提供相应信息,而这部分信息的正确评估对于宫颈癌治疗方案的选择和预后评估极具价值[4]。随着影像学技术的不断提高,阴道超声和动态增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging,DCE-MRI)技术被逐步应用于临床,其能较好地反映病灶与周边组织结构的关系[5-6]。但比较阴道超声及DCE-MRI在宫颈癌诊断中的应用研究鲜有报道,因此,本研究旨在探讨阴道超声及DCE-MRI在宫颈癌诊断中的临床价值。
1 资料与方法
1.1 病例选取
选择2018年3月至2021年2月本院收治的疑似罹患宫颈癌的女性患者。所有患者在手术病理确诊前均接受阴道超声及DCE-MRI检查。纳入标准:①疑似宫颈癌症状女性患者;②最终诊断依据病理证实;③主观接受阴道超声及DCE-MRI检查并于手术前3日完成两种检查。排除标准:①存在MRI检查禁忌证(患者体内存在铁磁等金属植入物、患者体内存在心脏起搏器或幽闭恐惧症的患者);②无法耐受阴道超声及DCE-MRI检查的患者;③主观拒绝接受阴道超声及DCE-MRI检查的患者。所有患者在接受阴道超声及DCE-MRI检查前均已了解并签署知情同意书,并经我院伦理委员会批准。
1.2 方法
1.2.1 阴道彩超检查 使用GEVolusonP5超声检查仪器和ACCUVIX A30彩超仪,仪器探头的频率为5~9 MHz,检查前让患者排空膀胱,取仰卧,膀胱截石位进行检查,若患者检查期间发生阴道出血,则需要先对外阴消毒处理,再将仪器探头轻轻插入阴道穹窿位置,再摆动探头实施全方面的检查,观察患者子宫的形态、大小、血流分布,宫颈内膜线是否出现弥漫性、局限性增厚,宫颈管和肌层内是否有异常回声等情况,结束后轻轻退出探头,记录下病灶数目、回声等信息,宫颈内膜线,然后应用彩色多普勒观察血流情况。
1.2.2 DCE-MRI检查 所有患者均在飞利浦Ingenia 3.0T CX极速磁共振成像仪接受盆腔DCE-MRI检查。所有患者在检查前均需憋尿以适当充盈膀胱。嘱患者保持平卧状态,由操作技师对其佩戴检查线圈,确认线圈连接状态后,上抬双臂,以头先进模式行盆腔DCE-MRI检查。具体参数如下:(1)横轴位和矢状位高分辨率T2WI:TR=4600 ms,TE=130 ms,矩阵为384×256,层厚为3 mm,层间距为0.3 mm,扫描激励次数为4次;(2)脂肪抑制横轴位和冠状位T2WI:TR=540 ms,TE=4 ms,层厚为4 mm,层间距为0.4 mm;(3)横轴位T1WI:TR=540 ms,TE 13 ms,层厚为4 mm,层间距为0.4 mm;(4)横轴位DWI:TR=3800 ms,TE=95 ms,b值分别取0和1000 s/mm2完成扫描;(5)DCE-MRI:TR=4.0 ms,TE=1.5 ms,层厚为4 mm,层间距为1.0 mm,使用三维容积超快速多期动态增强扫描序列,以2.5 ml/s流率、0.2 mmol/kg剂量单位经肘静脉注入对比剂钆喷酸葡胺后进行图像采集,扫描8个时相。检查完毕后,将扫描所得原始图像导入后处理工作站,由2名放射科医师采取双盲法对DCE-MRI图像进行评估,记录病变大小、累计范围、周边淋巴结位置、大小、数目、形态、长/短径、周围脂肪间隙清晰程度和增强特点等,当存在不同诊断意见时,则向上级医师反馈,经讨论后达成一致诊断意见。并选派一名医师对图像质量满足诊断要求的病变行数据勾画:对病变中央部位进行感兴趣区域的ROI勾画,单次勾画面积>10 mm2。选取连续3个层面进行ADC值测量,测量3次,记录平均值。
1.3 统计学方法
采用SPSS 21.0软件进行统计分析。正态分布的资料以均数±标准差表示,非正态分布资料以中位数±四分位数间距表示,计数资料以频数表示。以病理结果为金标准,分别评价阴道超声及DCE-MRI对宫颈癌诊断的一致率、灵敏度、特异度、阳性预测值及阴性预测值。构建ROC曲线,评估阴道超声及DCE-MRI检查诊断宫颈癌的诊断效能。P<0.05认为差异存在统计学意义。
2 结果
2.1 一般资料
共计94例疑似宫颈癌的中老年患者纳入本项研究,所有患者的阴道超声及DCE-MRI图像质量均满足诊断要求,患者平均年龄为(53.4±7.8)岁。病理确诊为宫颈癌的中老年女性患者86例,非宫颈癌患者8例(5例为子宫内膜癌,3例为卵巢癌)。86例宫颈癌患者中,宫颈腺癌患者23例,宫颈鳞癌患者63例;其中合并淋巴结转移37例,盆腔转移29例,子宫体浸润46例,阴道浸润49例。
2.2 阴道超声及DCE-MRI诊断结果
94例疑似宫颈癌的中老年女性患者中,阴道超声诊断为宫颈癌的患者81例,DCE-MRI诊断为宫颈癌的患者83例。以病理结果为金标准,阴道超声诊断宫颈癌的一致率为89.53%(77/86),灵敏度为87.21%(75/86),特异度为25.00%(2/8),阳性预测值为92.59%(75/81),阴性预测值16.67%(2/12);以病理结果为金标准,DCE-MRI诊断宫颈癌的一致率为98.84%(85/86),灵敏度为93.02%(80/86),特异度为62.50%(5/8),阳性预测值为96.39%(80/83),阴性预测值为45.5%(5/11)。阴道超声及DCE-MRI诊断中老年女性宫颈癌的灵敏度、特异度无统计学差异(χ2=1.632、2.286,P均>0.05)。
2.3 阴道超声及DCE-MRI检查对淋巴结转移、盆腔转移、子宫体浸润和阴道浸润诊断的效能
DCE-MRI检查对淋巴结转移、盆腔转移、子宫体浸润和阴道浸润的诊断灵敏度、特异度明显高于阴道超声,差异具有统计学意义(P<0.05)。如表1所示。
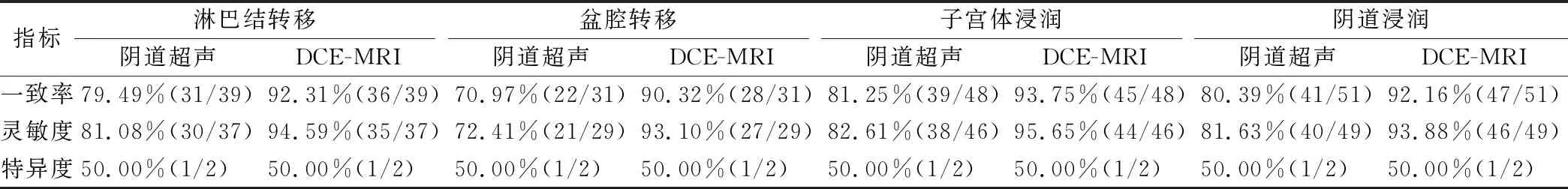
表1 两种检查对淋巴结转移、盆腔转移、子宫体浸润和阴道浸润的诊断价值
2.4 阴道超声及DCE-MRI诊断中老年女性宫颈癌的ROC曲线
如图1所示,阴道超声、DCE-MRI诊断宫颈癌的ROC曲线下面积分别为0.724、0.947 ,差异有统计学意义(P=0.03) 。
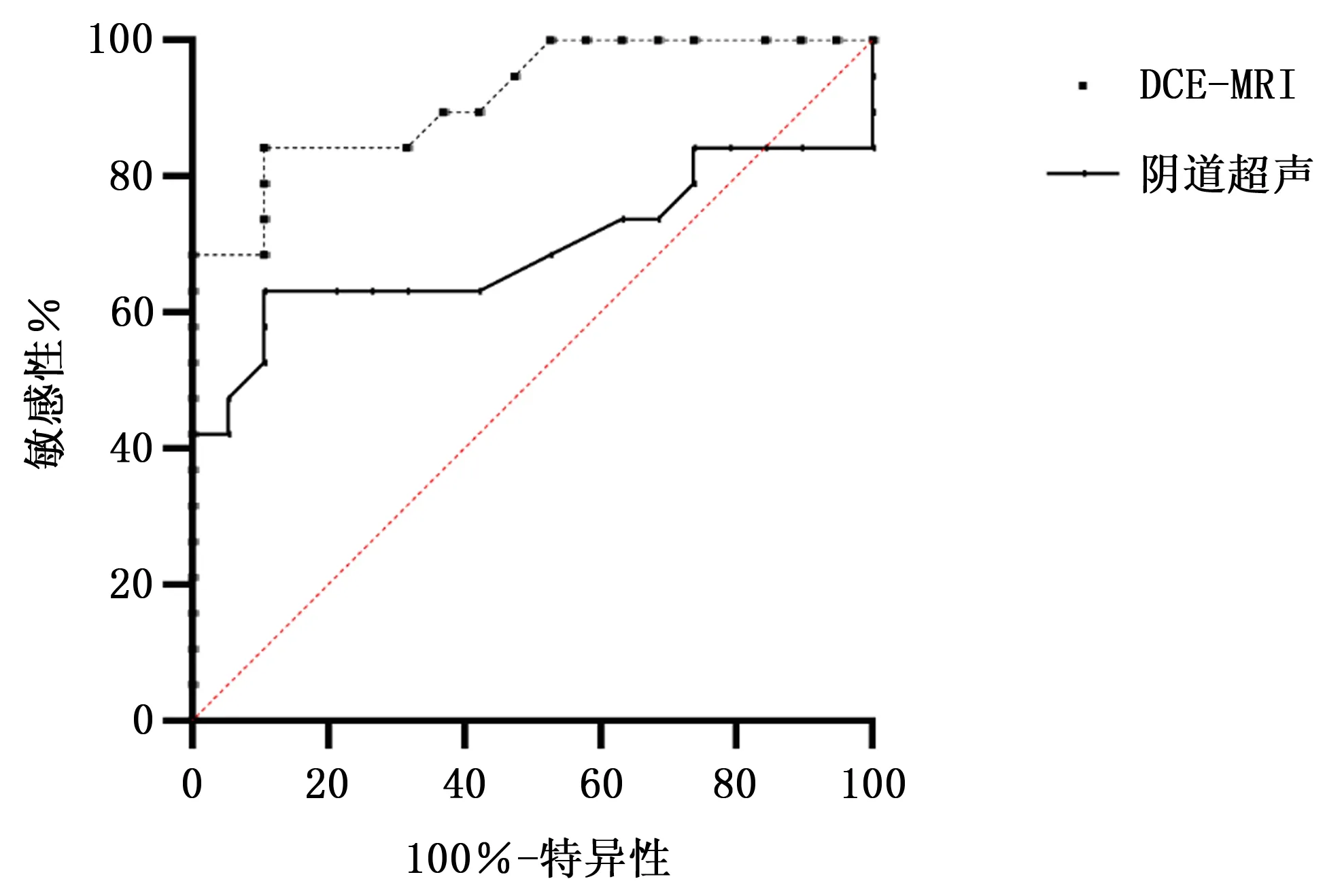
图1 阴道超声及DCE-MRI诊断宫颈癌的ROC曲线
3 讨论
宫颈癌恶性程度高、临床预后差[7],是我国女性最常见的致死原因之一[8]。早发现、早诊断、早治疗是预后的保证[9]。目前宫颈癌的常规治疗方案为手术结合放化疗。由于宫颈腺癌患者在疾病早期阶段即可发生淋巴道转移,转移发生后5年生存率明显降低[10]。因此,精确、早期地对宫颈癌进行临床分期评估极具价值。妇科查体是临床上常用宫颈癌分期方法,但该检查主观评判性强,严重干扰治疗方案的正确实施[11]。本研究证实DCE-MRI对淋巴结转移、盆腔转移、子宫体浸润和阴道浸润诊断效能明显高于阴道超声,主要原因MRI具有高软组织分辨率,空间层面内能更好地展示病灶细节,能够较好地分辨宫体和邻近组织结构,同时增强扫描更有助于对淋巴结转移及宫旁浸润的判读。虽然阴道超声检查重复性强、方法简便,作为诊断宫颈病变的筛查手段,但是超声技术需要充盈膀胱,容易被肠气、肥胖等因素干扰,即使三维的彩超可清楚地展现宫颈管内的具体结构,通过分析其血流分布、宫颈内膜厚度改变可及时做出诊断,然而,受到探头分辨率的影响,阴道超声对血流分布不明显异常以及宫颈癌前病变的确诊率较低[12]。DCE-MRI对肿瘤组织和邻近组织结构具有较好显示能力[13],对肿瘤病变的良恶性鉴别诊断具有较高的价值[14]。本研究以手术病理结果为金标准,分别评估阴道超声及DCE-MRI对宫颈癌的诊断价值,ROC曲线提示DCE-MRI对于宫颈癌病变均具有较高的诊断效能,优于阴道超声。
相较于阴道超声,DCE-MRI检查在盆腔转移、子宫体浸润和阴道浸润方面展现出更好的诊断效能,灵敏度和特异度更高,可能的原因有:DCE-MRI检查具有高软组织分辨率,空间层面内能更好显示病灶细节,能够较好地分辨宫体和邻近组织结构[15]。不论是宫颈腺癌还是宫颈鳞癌均具有恶性肿瘤的典型征象,其内部存在大量不成熟新生血管,相较于正常血管壁的三层结构,肿瘤供血血管发育不成熟,血管壁通透性强,在DCE-MRI扫描下呈现特殊的明显强化特征,对比剂注入同时即可迅速达到强化峰值,而在扫描后期,肿瘤组织内对比剂快速廓清,相较于明显强化的正常周边组织,病灶强化程度快速降低,与周边正常的高信号组织形成鲜明对比。DCE-MRI采用的是三维容积扫描序列,大FOV,不受患者体位和膀胱充盈度等因素限制,对病变可以进行任意角度的重建标准解剖位分析,对细节病变显示更为清晰[16]。而阴道超声由于受检查医师经验、图像分辨率、患者体位、膀胱充盈度等因素影响对盆腔淋巴道转移、子宫体浸润和阴道浸润的诊断能力欠佳,但对于存在磁共振检查禁忌证的宫颈癌患者,阴道超声检查可作为补充方案。
综上所述,DCE-MRI检查对宫颈癌的诊断价值高,灵敏度及特异度强,且DCE-MRI检查在盆腔转移、子宫体浸润和阴道浸润等识别中能力更强,诊断价值高于阴道超声。但是,对于MRI存在禁忌证的患者,阴道超声可作为宫颈癌患者术前分期诊断的补充方案。

