基于NLRP3炎症小体通路探讨对氨基水杨酸钠对锰所致认知障碍的干预作用
温平镜,易 丹,梁桂强,覃光球,高玉秋,吴琪俊*
(1.广西中医药大学,广西 南宁 530200;2.广西医科大学,广西 南宁 530021)
锰是人体必需微量元素之一,对人体脑发育、骨骼和肌肉生长等均有重要作用[1]。广西为锰矿资源最丰富的地区之一,锰矿、锰冶炼及焊接作业等职业暴露人群会出现不同程度锰中毒表现,长期过量的锰暴露还可导致儿童学习记忆力下降[2-3]。海马是锰蓄积的主要脑区,该部位锰蓄积可导致机体认知能力下降[4]。
NOD 样受体蛋白3(NLRP3)炎性小体神经炎症可能是锰神经毒性的重要机制。大脑中NLRP3 炎症小体主要来源于小胶质细胞,其被活性氧族(ROS)、核转录因子κB(NF-κB)、细胞内外Ca2+和K+稳态失衡等多种信号刺激后发生寡聚化,募集接头蛋白ASC,通过CARD 结构域与PYD 结构域相互作用,进一步激活半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1),进而加工白细胞介素1β 前体(pro-IL-1β)和白细胞介素18前体(pro-IL-18),释放白细胞介素1β(IL-1β)和白细胞介素18(IL-18),并释放于细胞外发挥作用[5]。锰可激活小鼠海马小胶质细胞及BV2 细胞NLRP3 炎症小体,导致IL-1β 表达升高[5]。锰诱导小胶质细胞炎性因子释放依赖于NLRP3 炎症小体的途径[6]。据报道,锰作业工人血液肿瘤坏死因子α(TNF-α)、IL-1β、白细胞介素6(IL-6)的水平随着工龄延长而升高,其神经相关疾病检出率也增加[7];锰暴露无防护工人的TNF-α、IL-1β、IL-6 的表达水平高于有防护工人,神经中毒表现也更突出[8]。
对氨基水杨酸钠(sodium para-aminosalicylate,PAS-Na)是一种非甾体类抗炎药,此类药物通过抑制小胶质细胞活化和阻断炎症反应来拮抗多巴胺能神经退行性改变[9-10]。锰中毒患者经PAS-Na 治疗后尿锰排出量增加,记忆力下降、头痛、失眠、多梦、疲乏、情绪不稳等学习记忆表现及舌颤、意向震颤、单足站立不稳等临床症状有所改善,甚至恢复正常[11]。因此,本研究拟基于NLRP3 神经炎症小体通路探讨PAS-Na 对锰所致认知障碍的干预作用,为锰中毒防治提供科学依据。
1 实验材料
1.1 动物 45只雄性SPF级SD 大鼠购自湖南斯莱克景达实验动物公司,体质量(140±20)g,实验动物使用许可证号:SYXK桂2019-0001。动物饲养于广西中医药大学SPF 动物房,室温(23±2)℃,湿度(55±5)%,每天明暗交替光照12 h。本研究已获得广西中医药大学伦理委员会批准。
1.2 主要试剂 MnCl2·4H2O(货号:V900197-500G,购于美国Sigma公司);PAS-Na(国药准字H23021719,购于哈药集团有限公司);NLRP3(货号:ab210494)、β-actin 抗体(货号:ab8245)均购自Abcam 公司;大鼠IL-1β(货号:12/2020)、IL-18 ELISA 批试剂盒(货号:12/2020)均购自上海酶联生物科技有限公司;Go Script ™Reverse Transcription Mix 试 剂 盒(批 号:A5003)、Go Taq®q PCR Master Mix 试剂盒(批号:A6001)均购于美国Promega公司。
1.3 仪器 DMS-2型Morris水迷宫(中国医学科学院药物研究所);Infinite M1000 全波长酶标仪(美国TECAN 公司);Fluor Chem R 多功能成像分析系统(美国Protein Simple 公司);1658033型号小型垂直电泳槽及其转印系统(美国Bio-Rad 公司);ABI StepOnePlus PCR 仪(美国ABI公司);Nexion 300D 电感耦合等离子体质谱仪(美国PerkinElmer公司)。
2 方 法
2.1 分组及给药 大鼠适应性喂养1 周后,按体质量随机分为对照组、染锰组及低、中、高剂量PAS-Na 组(L-PAS-Na 组、M-PAS-Na 组、H-PAS-Na 组),每组9只。前8 周对照组大鼠注射生理盐水,给药体积为1.5 ml/kg,其余组大鼠均腹腔注射MnCl2·4H2O2,剂量为20 mg/kg,给药体积为1.5 ml/kg,1 次/天,5 天/周;后6 周对照组和染锰组腹腔注射生理盐水,L-PASNa 组、M-PAS-Na 组、H-PAS-Na 组分别背部皮下注射PAS-Na 100 mg/kg、200 mg/kg、300 mg/kg,给药体积为1.5 ml/kg,1 次/天,5 天/周。观察记录大鼠进食量、行为、毛发、大便、小便、注射部位有无感染等情况。
2.2 Morris水迷宫检测大鼠学习记忆能力 给予PASNa 治疗结束后,用Morris 水迷宫检测大鼠学习记忆水平。在定位航行试验中,将每只大鼠依次从圆形泳池4 个象限中的固定位置放入水中,观察大鼠找到Ⅳ象限的平台耗时,即逃避潜伏期。若大鼠90 s 未找到平台,则其逃避潜伏期记为90 s,并将其引至平台休息60 s。试验持续5天以评价大鼠学习能力。测试第6 天撤掉第Ⅳ象限平台进行空间探索试验,让大鼠从第Ⅱ象限入水,记录其在120 s 内首次穿越原平台所在位置的游泳距离、穿越平台总次数,以此评价大鼠记忆能力。
2.3 海马分离及炎症因子检测 将大鼠麻醉后于冰上快速分离大鼠海马,保存至-80 ℃冰箱备用。称取20 mg 海马,加入180 μl 预冷PBS 制备匀浆液,5 000 g 离心5 min 并收集上清液。按ELISA 试剂盒说明书分别检测IL-18、IL-1β的含量。在酶标板空白孔和标准孔分别加入50 μl PBS和50 μl标准品,样本孔先加40 μl PBS再加10 μl样本。37 ℃孵育30 min后洗板5 次,除空白孔外其余孔均加50 μl 酶标试剂。继续孵育30 min,洗板,先后加入A、B 显色液,避光孵育15 min 后用50 μl 终止液终止反应,以450 nm 波长检测各孔OD值。
2.4 海马锰含量测定 取约50 mg 海马,转移至高压密闭消解罐内,加入4 ml HNO3于60~90 ℃条件下预消解2 h。然后加入1 ml H2O2,在120~170 ℃消化4 h。样本室温冷却后放在140~160 ℃电热板上赶酸,待溶液剩约1 ml 时停止赶酸,将液体转移到EP 管中并定容至5 ml,混匀备用。采用电感耦合等离子体质谱仪(ICP-MS)测定脑海马浓度,以5 %HNO3作为溶液配制锰的混合标准溶液系列,建立标准曲线。若标准曲线R2>0.999,则进行样本测定,最后根据实测值算出元素浓度。浓度=(C-C0)×5.0/m,C:仪器实测样本浓度;C0:空白对照测定值;m:样本质量。
2.5 蛋白表达检测 用Wertern blotting法检测NLRP3蛋白表达量。检测海马总蛋白浓度,用30%丙烯酰胺及10%过硫酸铵制成胶电泳分离蛋白,再将蛋白转移到PVDF 膜上。用5%脱脂奶粉封闭后,再与NLRP3及β-actin 抗体孵育过夜,经TBST 冲洗后再与抗兔二抗孵育,最后用增强型化学发光系统显影,获得照片并分析其灰度值。
2.6 荧光定量PCR(聚合酶链反应)
2.6.1 引物序列 Bax、Bcl2 引物序列均由生工生物工程(上海)股份有限公司合成,见表1。
2.6.2 RNA 提取 称20 mg 海马用研钵完全磨碎,加入1 ml TRIzol,并将液体转移到无核酸酶EP 管中,匀浆1 min。匀浆液静置5 min后以10 000 g离心15 min,吸取上层水相约0.5 ml 转移至另一EP 管,每管加入0.5 ml 异丙醇,缓慢颠倒数次混匀后静置10 min。弃上清液后,自然晾5~10 min,加入50 μl DEPC 溶解RNA。用多功能酶标仪测定RNA 样本浓度及质量。
2.6.3 总RNA 逆转录 根据测得的RNA 浓度配制反应体系(表2),体系中RNA 模板最终上样量为1 μg。逆转录条件:42 ℃延伸20 min,95 ℃失活5 min,后置于冰上即得到c DNA。

表2 逆转录反应体系
2.6.4 qPCR 反应 采用20 μl 反应体系(表3),反应程序:Stage 1:95 ℃10 min;Stage 2:95 ℃15 s,60 ℃1 min,40 个循环;Dissociation Stage:95 ℃15 s,60℃15 s,95℃15 s。计算出各复孔的均值,用2-ΔΔCt计算各基因表达的相对值:
实验组ΔCt=实验组目的基因Ct 值-实验组内参基因Ct值
对照组ΔCt=对照组目的基因Ct 值-对照组内参基因Ct值
ΔΔCt=实 验 组ΔCt-对 照 组ΔCt;基 因 相 对 表 达量=2-ΔΔCt

表3 qPCR逆转录反应体系
2.7 统计分析 采用SPSS 26.0 软件进行数据统计分析,计量资料以均数±标准差(±s)进行统计描述,若数据服从正态分布且方差齐性,用单因素方差分析,采用LSD 检验进行两两比较。P<0.05 表示差异具有显著性意义。
3 结 果
3.1 PAS-Na对染锰大鼠生长发育的影响 染锰组和PAS-Na各剂量组大鼠在第1周就出现了不同程度的腹泻、食欲不振、饮水减少、易激惹等现象。第2周开始,部分大鼠毛发脏乱蓬松,有少量动物脱毛,活动减少,对照组未见异常。第9~14周为PAS-Na治疗期,随治疗时间增加大鼠腹泻及易激惹症状减少,但染锰组还存在此症状。第2~8周染锰组和L-PAS-Na组、M-PASNa组、H-PAS-Na组大鼠体重均低于对照组(P<0.05或P<0.01),给予PAS-Na治疗后,第9周后大鼠体重逐渐恢复,并接近对照组体重(P>0.05)。而第9、10、11周染锰组体重仍低于对照组(P<0.05)。见图1、表4。
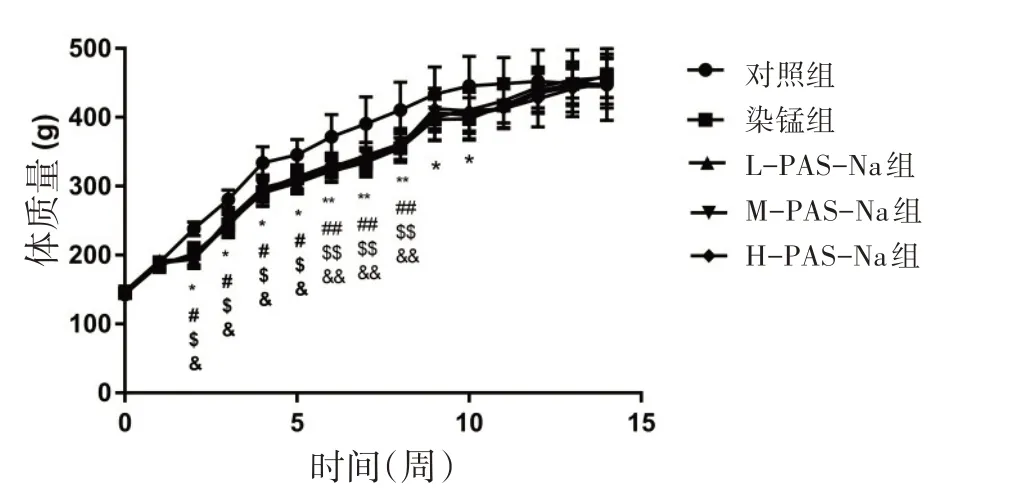
图1 各组大鼠体质量变化
表4 各组大鼠体质量变化 (n=9,g,±s)

表4 各组大鼠体质量变化 (n=9,g,±s)
时间点初重第1周对照组142.5±5.1 189.5±8.3染锰组144.7±6.9 185.9±11.4 L-PAS-Na组147.7±5.9 192.0±8.7 M-PAS-Na组147.1±8.3 188.6±9.6 H-PAS-Na组143.4±8.3 186.2±9.3

续表4
3.2 PAS-Na 对染锰大鼠海马锰浓度的影响 见图2及表5。染锰组海马锰浓度高于对照组(P<0.05),LPAS-Na、M-PAS-Na、H-PAS-Na 组治疗后均可降低

图2 各组大鼠海马锰水平比较
3.3 PAS-Na对染锰大鼠学习记忆的干预作用 随测试天数增加,各组大鼠平均游泳路程、逃避潜伏期均逐渐下降,其中,测试第2天染锰组游泳路程大于对照组(P<0.05)。与染锰组比较,第5 天M-PAS-Na 组、HPAS-Na组逃避潜伏期均明显降低(均P<0.05);与染锰海马锰浓度(均P<0.05)。结果提示,PAS-Na 具有促排锰作用。组比较,L-PAS-Na 组、M-PAS-Na 组、H-PAS-Na 组第3~5 天游泳路程缩短,M- PAS-Na 组、H-PAS-Na组穿越平台次数增加,但差异均无显著性(P>0.05)。见图3~图5及表6~表7。结果提示,PAS-Na治疗可在一定程度上改善锰所致的认知障碍。
表5 PAS-Na治疗对染锰大鼠海马锰水平的影响 (n=9,±s)

表5 PAS-Na治疗对染锰大鼠海马锰水平的影响 (n=9,±s)
注:与对照组比较,①P<0.05;与染锰组比较,②P<0.05
组 别对照组染锰组L-PAS-Na组M-PAS-Na组H-PAS-Na组锰浓度(mg/kg)0.532±0.321 1.007±0.389①0.612±0.295②0.615±0.204②0.595±0.241②

图3 各组大鼠游泳路程比较

图4 各组大鼠逃避潜伏期比较

图5 各组大鼠穿越平台次数比较
表7 PAS-Na治疗对染锰大鼠逃避潜伏期及平台穿越次数的影响 (±s)

表7 PAS-Na治疗对染锰大鼠逃避潜伏期及平台穿越次数的影响 (±s)
注:与染锰组比较,①P<0.05
组 别对照组染锰组L-PAS-Na组M-PAS-Na组H-PAS-Na组n 9 9 9 9 9逃避潜伏期(s)第1天41.1±14.9 45.7±7.4 44.4±11.1 44.4±9.4 41.5±8.9第2天31.5±9.4 27.5±4.6 21.3±7.6 18.0±7.9 23.9±17.5第3天24.9±14.3 26.4±12.4 17.3±10.2 15.4±6.6 17.8±9.0第4天14.0±5.7 15.9±5.4 21.7±11.6 11.5±3.7 14.0±7.8第5天14.4±4.4 17.0±3.3 14.2±7.8 10.0±2.9①10.4±2.4①平台穿越次数(次)5.5±1.5 5.3±2.2 5.4±2.8 7.0±2.4 5.8±1.5
表6 PAS-Na治疗对染锰大鼠游泳距离的影响 (cm,±s)

表6 PAS-Na治疗对染锰大鼠游泳距离的影响 (cm,±s)
注:与对照组比较,①P<0.05
组 别对照组染锰组L-PAS-Na组M-PAS-Na组H-PAS-Na组n 9 9 9 9 9第1天941.6±339.9 891.2±123.8 1 126.2±263.1 1 015.6±281.8 1 181.8±229.3第2天579.2±113.6 822.9±231.9①620.2±193.4 524.2±232.8 598.4±382.6第3天659.2±356.9 607.0±282.4 572.9±255.6 458.7±194.4 531.2±252.3第4天396.4±172.4 493.4±176.5 482.7±182.2 364.4±120.0 363.6±170.6第5天539.5±218.6 447.5±133.2 422.6±216.6 307.8±148.0 358.1±167.2
3.4 PAS-Na对染锰大鼠海马凋亡基因表达的影响 见图6 及表8。染锰组Bax mRNA 高于对照组,而Bcl2 mRNA 低于对照组(P<0.01或P<0.05);L-PAS-Na 组、M-PAS-Na 组、H-PAS-Na 组Bax mRNA 表达均低于染锰组(均P<0.01),Bcl2 mRNA升高,但与染锰组比较无显著性差异(P>0.05)。Bax/Bcl2比例决定细胞的凋亡过程,染锰组Bax/Bcl2 mRNA比率明显高于对照组,经PAS-Na 治疗后Bax/Bcl2 的比率较染锰组明显降低(均P<0.01)。结果提示,PAS-Na对锰暴露所致的神经细胞凋亡相关基因异常表达有拮抗作用。

图6 PAS-Na对染锰大鼠海马凋亡相关基因表达的影响
表8 PAS-Na治疗对染锰大鼠海马凋亡相关基因表达的影响 (±s)

表8 PAS-Na治疗对染锰大鼠海马凋亡相关基因表达的影响 (±s)
注:与对照组比较,①P<0.05,②P<0.01;与染锰组比较,③P<0.01
组 别对照组染锰组L-PAS-Na组M-PAS-Na组H-PAS-Na组n 9 9 9 9 9 Bax相对表达量(倍)1.13±0.07 1.38±0.08②0.38±0.08③0.51±0.14③0.29±0.04③Bcl2相对表达量(倍)1.08±0.03 0.88±0.03①0.83±0.05 0.94±0.04 0.97±0.02 Bax/Bcl2相对表达量(倍)1.05±0.08 1.57±0.13②0.45±0.07③0.54±0.16③0.30±0.03③
3.5 PAS-Na 对染锰大鼠海马NLRP3 及相关炎症因子的影响 见图7 及表9。染锰组NLRP3 蛋白表达量及IL-18、IL-1β 炎症因子含量显著高于对照组(P<0.05 或P<0.01);经PAS-Na 治疗后,H-PAS-Na 组NLRP3 蛋白表 达 量及M-PAS-Na 组、H-PAS-Na 组IL-18 和IL-1β 的含量均下降(均P<0.01 或P<0.05)。结果提示,PAS-Na 对锰所致的NLRP3 神经炎症有抑制作用。

图7 PAS-Na对染锰大鼠海马NLRP3炎症表达的影响
表9 PAS-Na治疗对染锰大鼠海马NLRP3、IL-1β、IL-18表达的影响 (±s)

表9 PAS-Na治疗对染锰大鼠海马NLRP3、IL-1β、IL-18表达的影响 (±s)
注:与对照组比较,①P<0.05,②P<0.01;与染锰组比较,③P<0.05,④P<0.01
组 别对照组染锰组L-PAS-Na组M-PAS-Na组H-PAS-Na组n 3 3 3 3 3 NLRP3相对表达量(倍)0.557±0.071 1.163±0.182②0.966±0.087 1.140±0.124 0.763±0.069④IL-1β(pg/g)665.1±53.1 816.7±72.8①841.5±59.6 591.4±121.3③604.2±137.4③IL-18(pg/g)2 135.3±288.4 3 101.8±323.2②2 680.5±190.4 1 886.5±424.3④1 801.7±579.6④
4 讨 论
锰既是机体必需微量元素之一,也是一种常见的环境污染物,其来源主要有焊接、锰矿开采及锰冶炼、杀菌农药、汽油防爆剂等[12]。体质量作为生长发育较直观的指标,一定程度上可以反映机体的中毒情况。研究显示,锰暴露可导致动物出现食欲不振、腹泻、生长发育迟缓等症状,持续染锰动物体重明显降低[13]。本研究中,造模大鼠在第1周就出现胃肠功能紊乱、食欲不振、饮水减少、易激惹等疑似中毒症状。从第2周起造模大鼠体质量出现剂量依赖性下降,提示锰可致机体中毒。临床研究发现,慢性锰中毒患者经PAS-Na治疗,尿锰大幅增加,是治疗前的3~9 倍[14];对比PAS-Na 和依地酸二钠钙两种药物治疗锰中毒的疗效,发现PAS-Na 可更好地排锰保锌,利于锰中毒治疗[15]。本研究发现,大鼠经PAS-Na 治疗后异常症状基本消失,之后大鼠体质量逐渐恢复至对照组水平。PAS-Na治疗可使大鼠海马锰浓显著下降,提示PAS-Na具有排锰作用且对锰所致的大鼠体质量降低有改善作用。
研究发现,用PAS-Na 对30 例慢性锰中毒患者进行4~12 个不同疗程治疗后,患者神经衰弱症状改善程度达到90%,情绪不稳、腱反射亢进、手指震颤等症状改善大于80%,指鼻不准、单足站立不稳、步态不稳等症状改善大于90%[16],表明PAS-Na 对锰所致认知障碍及类帕金森症均有较好的改善作用。体内研究亦显示,PAS-Na 治疗对锰中毒大鼠的学习记忆力下降有明显拮抗作用[17]。本研究中,治疗后PAS-Na高、中剂量组第4~5天逃避潜伏期均下降,且第3~5天游泳路程缩短,穿越平台次数亦高于染锰组。结果提示,PAS-Na 治疗可在一定程度上改善锰所致的学习记忆力下降,但效果不是很明显,这可能跟PAS-Na排锰的个体差异有关,延长治疗时间效果可能更显著。
Bax和Bcl2是体内主要的促凋亡基因和抗凋亡基因,其表达水平直接关系到细胞凋亡。韦福[18]给予小鼠染锰后发现海马Bax 蛋白表达上升而Bcl2 蛋白表达降低。体内研究显示,PAS-Na 治疗或预防对锰暴露导致的大鼠基底核神经元和海马细胞凋亡有一定的拮抗作用[19]。本研究发现,染锰组Bax mRNA 及决定凋亡过程的Bax/Bcl2 mRNA 表达升高,经PAS-Na治疗后,Bax mRNA 及Bax/Bcl2 mRNA 表达均下降。结果提示,PAS-Na 可抑制锰所致的海马神经细胞凋亡。
NLRP3 神经炎症可能是锰所致神经毒性的重要机制,其与神经细胞凋亡关系密切。王迪雅[20]发现,锰暴露可致小鼠学习记忆能力恶化,其海马区小胶质细胞活化,NLRP3、cleaved Caspase-1 蛋白表达升高,炎性因子IL-1β、IL-18和TNF-α 释放量增加,IL-1β、IL-18 mRNA 表达也增加,在BV2 细胞中也观察到了类似的结果。锰对于与小胶质细胞混合培养的神经元损伤作用强于单独培养的神经元,激活状态下的小胶质细胞可快速释放TNF-α、IL-1β、IL-18 等炎症因子,其介导神经元凋亡或变性坏死[21-22]。本研究发现,染锰组NLRP3 蛋白表达升高,IL-1β 和IL-18 水平亦升高。PAS-Na 治疗锰中毒的机制包括抗氧化作用和螯合作用,此外还有抗炎作用[16,23-25]。体内研究显示,锰暴露可致海马、丘脑及皮层PGE2、IL-1β、IL-6和TNF-α 含量升高,而PAS-Na 可以逆转这种情况,尤其在海马和丘脑最为明显[22]。本研究显示,PAS-Na治疗后NLRP3蛋白表达下降,IL-1β、IL-18水平下降。结果提示,PAS-Na 对锰介导的NLRP3 炎症具有拮抗作用,但其确切机制尚需研究。
综上所述,锰暴露可能通过激活大鼠海马NLRP3炎症小体通路介导海马细胞凋亡,诱导认知障碍,PAS-Na可通过抑制NLRP3炎症小体通路介导的海马细胞凋亡改善锰所致认知障碍。

