南蛇藤醇对小鼠非酒精性脂肪性肝炎的抑制作用*
李登科,宋铃榆,何锡东,胡越,杨红,刘琦
(1.贵州医科大学临床医学院,贵阳 550004;2.贵州医科大学附属医院消化内科,贵阳 550004)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝脏疾病,该病包括从单纯非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)再演变为脂肪性肝硬化的整个过程。NASH是NAFLD发展为肝硬化、原发性肝癌及肝衰竭的主要原因[1]。NASH以肝细胞损伤、肝脏脂肪变、炎症、伴或不伴肝脏纤维化为主要病理特征。近20年来,随着人们生活水平的提高、肥胖发生率的升高,全球NASH发病率不断攀升。流行病学研究显示,我国普通成人NAFLD患病率6.3%~45%,其中10%~30%为NASH[2]。预计不久的将来,NASH所致肝硬化可能成为全球肝移植最常见的原因[3]。然而,目前尚无被推荐用于治疗NASH的药物。因此,寻找有效的干预措施对NASH有重要意义。
南蛇藤醇(celastrol,cel)又称雷公藤红素,是从中药雷公藤中分离出的一种三萜类生物活性物质[4]。既往研究表明,南蛇藤醇在改善肝脏代谢损伤方面具有重要作用,该药还可改善高脂饮食所致肝脏损伤[5]。南蛇藤醇还可以通过激活磷酸腺苷激活的蛋白激酶和沉默信息调节因子2相关酶1(adenosine phosphate-activated protein kinase-sirtuin 1,AMPK-SIRT1)信号传导来抑制炎症反应,从而减轻肝纤维化,而肝纤维化是NASH主要病理表现之一[6]。此外,南蛇藤醇能改善氧化应激[7],氧化应激通过诱导脂质过氧化发生,在NASH发生及进展中发挥重要作用[8]。然而,南蛇藤醇能否改善NASH目前尚不清楚。笔者在本实验观察南蛇藤醇对小鼠NASH的治疗作用,以期为NASH的治疗提供新思路与实验依据。
1 材料与方法
1.1材料 南蛇藤醇购自Aladdin公司(含量:98%,批号:C107672);苏木精-伊红(HE)染色试剂盒购自上海碧云天生物技术有限公司(批号:C0105);Masson's染色试剂盒购自北京索莱宝科技有限公司(批号:G1340);兔抗小鼠Ⅰ型胶原蛋白α1(COL1A1)抗体购自Abcam公司(批号:ab34710);组织细胞三酰甘油(TG)酶法测定试剂盒(批号:E1013)、天冬氨酸氨基转移酶(AST)测试盒(批号:C010-3-1)均购自北京普利莱基因技术有限公司;丙氨酸氨基转移酶(ALT)测试盒购自南京建成生物工程研究所有限公司(批号:C009-3-1);巨噬细胞特异性表面抗原F4/80、白细胞介素1β(IL-1β)引物设计并购买于生工生物工程(上海)股份有限公司。
1.2动物的饲养、分组及处理 6周龄C57BL/6雄性小鼠,购自贵州医科大学动物实验中心,实验动物生产许可证号:SYXK(黔)2018-0001。分笼饲养于相对湿度40%、温度约28 ℃清洁级动物房,自由进食、进水。本研究动物实验流程经贵州医科大学动物伦理委员会审查批准。
将小鼠适应性喂养2周,按随机数表法分为正常对照组、模型对照组及南蛇藤醇组,每组6只。正常对照组喂养蛋氨酸-胆碱充足(methionine-choline-sufficient,MCS)饮食,模型对照组喂养蛋氨酸-胆碱缺乏(methionine-choline-deficiency,MCD)饮食,南蛇藤醇组给予MCD饮食喂养+南蛇藤醇腹腔注射(1 mg·kg-1,隔天1次)[9-10]。均持续喂养5周,每周记录小鼠体质量变化。戊巴比妥钠麻醉小鼠,取血后处死。记录肝质量,收集组织进行后续实验。
1.3检测指标与检测方法
1.3.1HE染色及NAFLD活动度评分(NAFLD activity score,NAS) 处死小鼠,取肝组织,4%多聚甲醛固定,石蜡包埋,制成厚4 μm石蜡切片,H&E染色试剂盒染色;根据Kleiner/Brunt标准[11]进行组织学NAS评分。肝细胞脂肪变程度0~3分,肝细胞气球样变程度0~2分,小叶内炎症程度0~3分,合计值为最终NAS得分。NAS总分0~8分,>4分诊断为NASH。
1.3.2油红染色 称取油红粉末0.5 g,溶于异丙醇100 mL,搅拌至完全溶解,得油红饱和溶液,4 ℃长期保存。使用前,油红饱和溶液与超纯水以3:2配比,混匀后中性滤纸过滤,2 h内使用。油红染色:将小鼠肝脏取出后迅速以最佳切削温度(optimum cutting temperature,OCT)包埋,液氮冷冻,制成冰冻切片厚5 μm,油红染色前取出复温,再用配好的油红染液进行组织染色。
1.3.3生化检测 肝脏TG、血清ALT、血清AST水平分别采用试剂盒检测。
1.3.4实时荧光定量聚合酶链反应(quantitative real-time PCR,qPCR) 根据本课题组既往研究步骤[12]。取少量上述处理后冻存于-80 ℃的小鼠肝组织,研磨后提取总RNA,逆转录试剂盒逆转录为cDNA,qPCR 扩增,检测F4/80、IL-1β表达,并计算目的基因mRNA相对表达量。目的基因及引物序列见表1。
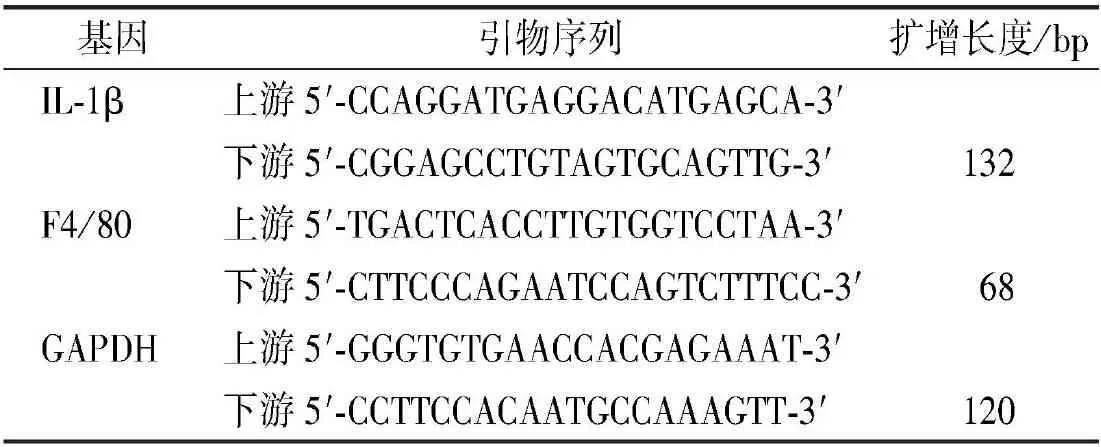
表1 qPCR目的基因及引物序列
1.3.5Masson's染色 ①石蜡切片常规脱蜡至水;②Weigert铁苏木素染色液染色9 min,纯化水冲洗;③酸性乙醇分化液分化15 s,水洗;④Masson蓝化液返蓝5 min,水洗;⑤纯化水洗1 min;⑥丽春红品红染色液染色10 min;⑦用配制的弱酸工作液洗1 min(比例为纯化水:弱酸溶液=2:1);⑧磷钼酸水溶液洗2 min;⑨用已配制的弱酸工作液洗1 min;⑩放入苯胺蓝染色液染色2 min,弱酸工作液洗1 min;95%乙醇、无水乙醇脱水;二甲苯透明,中性树胶封片。
1.3.6免疫组化 小鼠肝组织石蜡切片,经烤片、脱蜡、水化,3%过氧化氢(H2O2)消除内源性过氧化物酶活性,柠檬酸盐溶液抗原修复,血清封闭,分别滴加兔抗小鼠COL1A1抗体(1:100),4 ℃孵育过夜,二抗孵育1 h,3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色,苏木精复染,晾干,封片,光学显微镜观察,随机选取5个200倍视野进行图片采集。
2 结果
2.1南蛇藤醇对小鼠肝脏脂质沉积的影响 与正常对照组比较,模型对照组小鼠干预后体质量及肝质量均显著降低(P<0.01),肝质量/体质量差异无统计学意义;与模型对照组比较,南蛇藤醇组小鼠干预后体质量、肝质量及肝质量/体质量均差异无统计学意义。见表2。
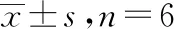
表2 3组小鼠体质量、肝质量、肝质量/体质量测定结果
与正常对照组比较,模型对照组小鼠肝细胞大量脂肪变;与模型对照组比较,南蛇藤醇组小鼠肝脏脂肪变明显改善。见图1。
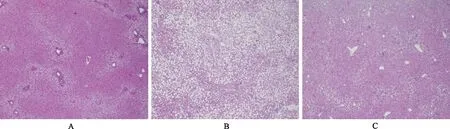
A.正常对照组;B.模型对照组;C.南蛇藤醇组。
与正常对照组比较,模型对照组小鼠肝脏NAS评分明显升高(P<0.01);与模型对照组比较,南蛇藤醇组小鼠肝脏NAS评分显著降低(P<0.01)。见图2。
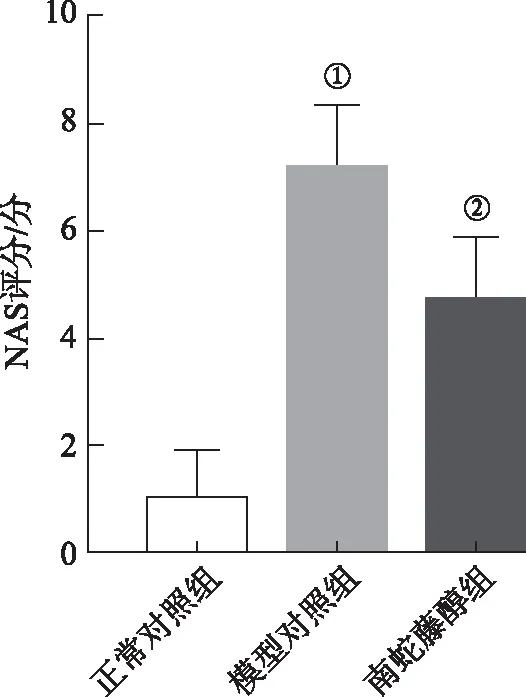
①与正常对照组比较,t=10.26,P<0.01;②与模型对照组比较,t=3.64,P<0.01。
与正常对照组比较,模型对照组小鼠肝脏脂滴及TG沉积显著增加(P<0.01);与模型对照组比较,南蛇藤醇组肝脏脂滴及TG含量明显降低(P<0.05)。见图3、图4。
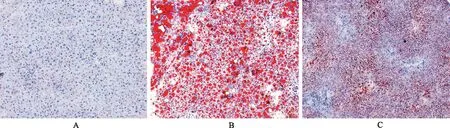
A.正常对照组;B.模型对照组;C.南蛇藤醇组。
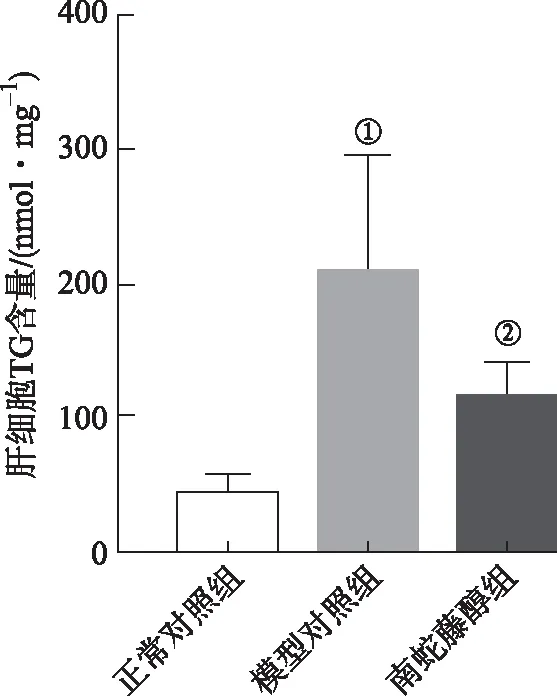
①与正常对照组比较,t=4.64,P<0.01;②与模型对照组比较,t=2.57,P<0.05。
2.2南蛇藤醇对小鼠肝脏炎症反应的影响 与正常对照组比较,模型对照组小鼠F4/80、IL-1β水平升高(P<0.01);与模型对照组比较,南蛇藤醇组小鼠F4/80、IL-1β水平降低(P<0.05)。提示南蛇藤醇能减轻模型小鼠肝脏炎症反应(图5)。
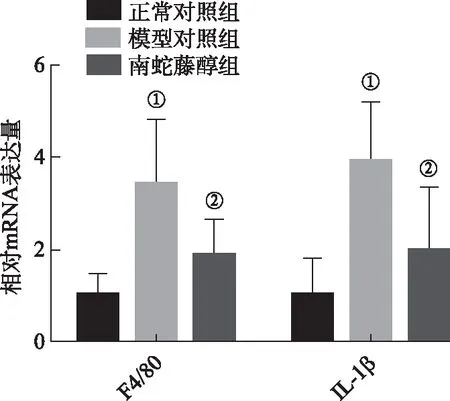
①正常对照组比较,t=3.93,P<0.01;②与模型对照组比较,t=2.29,P<0.05。
2.3南蛇藤醇对小鼠肝细胞损伤的影响 与正常对照组比较,模型对照组小鼠血清ALT、AST水平均升高(P<0.01);与模型对照组比较,南蛇藤醇组小鼠血清ALT、AST水平均降低(P<0.05)。提示南蛇藤醇能减轻模型小鼠肝细胞损害(表3)。
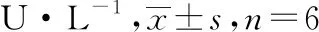
表3 3组小鼠血清ALT与AST水平
2.4南蛇藤醇对小鼠肝脏纤维化的影响 与正常对照组比较,模型对照组小鼠肝脏窦周和静脉周围出现较多纤维组织增生;与模型对照组比较,南蛇藤醇组小鼠上述表现明显减轻。见图6。
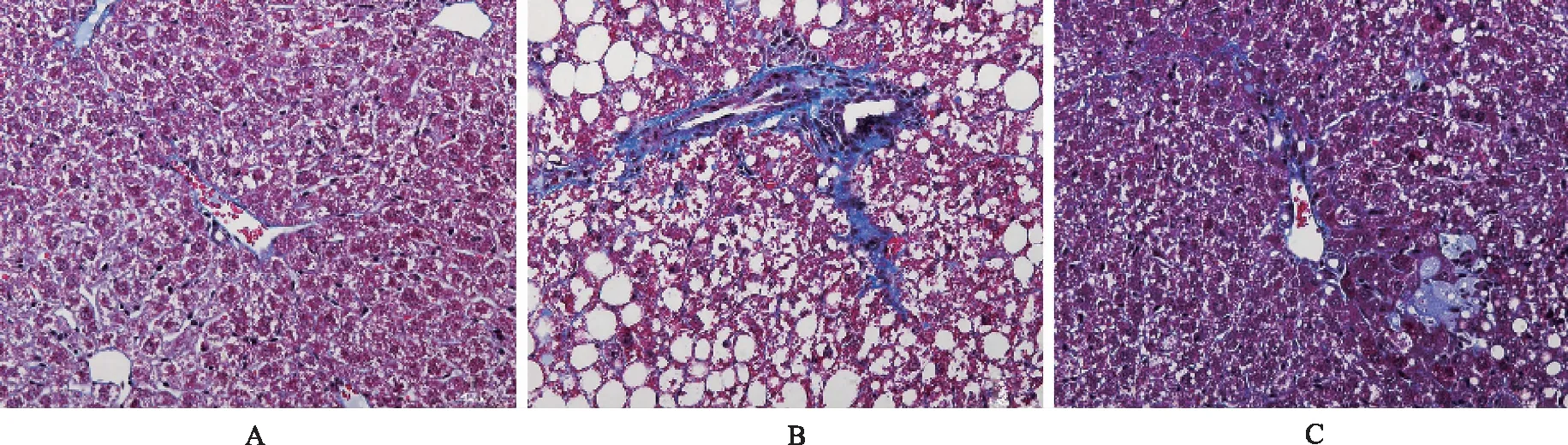
A.正常对照组;B.模型对照组;C.南蛇藤醇组。
与正常对照组比较,模型对照组小鼠肝细胞COL1A1阳性细胞明显增加(P<0.01);与模型对照组比较,南蛇藤醇组小鼠上述阳性细胞数明显减少(P<0.01)。提示南蛇藤醇能减轻模型小鼠肝细胞纤维化。结果见图7、图8。

A.正常对照组;B.模型对照组;C.南蛇藤醇组。
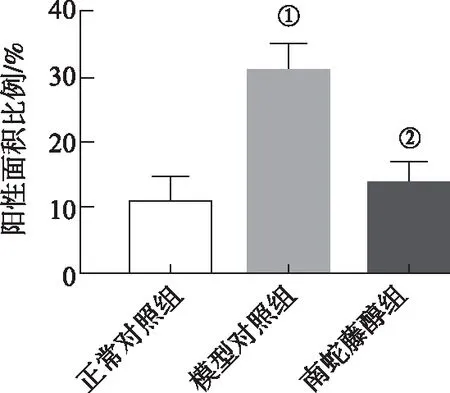
①与正常对照组比较,t=8.80,P<0.01;②与模型对照组比较,t=8.34,P<0.01。
3 讨论
NASH是NALFD进展为肝硬化甚至肝癌的关键环节,NASH主要以肝脂肪变、肝细胞损伤、炎症、纤维化为病理特征。然而,目前该病尚无较好治疗措施。虽然已有研究表明,南蛇藤醇可通过减少脂质合成并改善抗氧化和抗炎状态来改善NAFLD[5],但其对于NASH的改善及治疗作用鲜见报道。南蛇藤醇对于MCD饲料诱导的小鼠NASH模型作用的研究亦不多见。笔者在本研究初步发现南蛇藤醇能减轻MCD诱导的小鼠肝脏脂肪变、肝细胞损伤、炎症及纤维化,提示南蛇藤醇具有潜在治疗NASH作用。为开发有效治疗及延缓NASH向肝硬化和肝癌进展的药物提供了新的思路与实验依据。
20世纪90年代,DAY等[13]提出的“二次打击”学说认为,肝脏中的TG沉积可导致脂肪变性,最终引起肝脏炎症、纤维化和癌症。肝细胞内脂质尤其是TG沉积,是形成NASH的前提[14]。在NASH发病过程中,大量游离脂肪酸(free fatty acid,FFA)介导脂质过氧化反应,导致肝细胞发生凋亡坏死[15],肝细胞凋亡与坏死也是NASH的重要病理变化[16]。本研究发现,南蛇藤醇不仅可减轻MCD诱导的小鼠肝脏脂质沉积,还能减轻肝细胞损伤,提示南蛇藤醇在缓解NASH中具有重要作用。
此外,TG过量蓄积导致肝脏炎症反应,进而导致肝细胞损伤,促进肝脏纤维化,炎症还能进一步加重肝脏脂质沉积,形成恶性循环[17]。IL-1β是一种重要的炎症因子,在NASH中发挥重要作用[18],IL-1β可引起Kupffer细胞(肝内巨噬细胞)聚集和激活,促进 NASH发展[19]。F4/80是巨噬细胞特异性抗原,是其常见标记物,参与标记巨噬细胞成熟和活化过程。在NASH发生发展过程中,各种促炎因子及炎性细胞激活具有重要作用[20]。为进一步研究炎症反应,笔者在本实验检测炎症因子和巨噬细胞标志物在小鼠肝脏的表达。研究发现,南蛇藤醇能减轻小鼠肝脏IL-1β及F4/80表达,提示南蛇藤醇对肝脏炎症具有抑制作用。同时,肝纤维化是NASH发展到终末期的主要病理表型之一。COL1A1是肝纤维化重要标志物[21]。本研究发现,南蛇藤醇可使小鼠肝脏COL1A1表达明显降低,进一步证明南蛇藤醇在NASH中的潜在治疗作用。
本研究结果表明,南蛇藤醇具有明显改善NASH的药效学效应,这为南蛇藤醇在NASH治疗中的应用提供了实验依据。其具体作用机制有待进一步研究。

