基于FAERS的抗体药物偶联物相关周围神经病类事件数据挖掘研究*
杨静,杨瑶,吴斌,徐珽
(1.四川大学华西医院临床药学部,成都 610041;2.成都市公共卫生临床医疗中心,成都 610061)
抗体药物偶联物(antibody-drug conjugate,ADC)是一类新型靶向生物药剂,是通过化学键将细胞毒性小分子与单克隆抗体偶联的靶向抗肿瘤药物,该类药物充分利用抗体特异性和毒性小分子高抗肿瘤活性,选择性地将超毒性有效载荷直接输送至目标癌细胞,以达到提高抗肿瘤疗效和降低细胞毒性药物不良事件的目的[1]。
随着非免疫原性单克隆抗体的研发,ADC药物研究近年来飞速进展,符合“精准医疗”的理念。国内外ADC药物的研发已经进入高潮期,迄今在临床研究阶段的ADC药物已有200余种,获得批准用于临床的ADC药物有8种,主要涉及实体瘤和血液系统肿瘤领域[2-3]。随着临床使用经验的积累,ADC药物也导致多种不良事件,其中周围神经病变(peripheral neuropathy,PN)对患者预后及生活质量影响较大。ADC药物可导致神经痛、麻木、四肢无力等周围神经症状,影响肿瘤患者生活质量。一旦出现严重的神经性病变事件,可能需要调整治疗方案、改变ADC药物剂量或提前终止ADC治疗,从而可能对肿瘤结局产生不良影响[4]。部分ADC药物的药品说明书中虽然已经提及该类不良事件,但笔者目前尚未见同类药品横向对比研究的报道。因此,全面关注目前临床使用的8种ADC药物对周围神经病类事件的影响及特征具有积极意义。
美国食品药品管理局(FDA)药品不良事件报告系统(FDA adverse events reporting system,FAERS)是目前开展药品不良事件数据挖掘研究应用最广泛的数据库之一[5-6]。FAERS具有数据量大和对公众免费开放的特点。本研究拟基于FAERS数据库,开展基于大数据的ADC药物相关PN类事件数据挖掘研究,以期为ADC药物的临床安全使用提供参考。
1 资料与方法
1.1资料来源与预处理 本研究药品不良事件数据来源于FAERS,下载2011年第1季度至2020年第4季度共40个季度的报告数据,导入本地数据库,根据数据说明文件,去除重复数据,剔除删失病例,以备后续分析[7]。选择患者信息记录(DEMO)、不良事件(REAC)、药品使用记录(DRUG)、不良事件结果(OUTC)和药物治疗时间(THER)记录表进行数据挖掘与分析。
选择临床使用的8种ADC药物作为目标药物,包括维布妥昔单抗(brentuximab vedotin,BV)、恩美曲妥珠单抗(ado-trastuzumab emtansine,TDM-1)、维汀-珀拉妥珠单抗(polatuzumab vedotin,PV)、维汀-恩弗妥单抗(enfortumab vedotin,EV)、德曲妥珠单抗(trastuzumab deruxtecan,TD)、戈沙妥组单抗(sacituzumab govitecan,SG)、奥星-吉妥珠单抗(gemtuzumab ozogamicin,GO)和奥星-艾诺妥珠单抗(inotuzumab ozogamicin,IO)。检索限定目标药物为首要怀疑(primary suspected,PS)药品。
FAERS不良反应事件/数据采用《国际人用药品注册技术协调会(The International Council for Harmo-nization of Technical Requirements for Pharmaceuticals for Human Use,ICH)国际医学用语词典》(MedDRA)的首选语(preferred terms,PT)进行编码。本研究采用标准MedDRA查询(Standard MedDRA Query,SMQ)中的狭义检索方式获取周围神经病类事件,检索编码SMQ=20 000 034,共包含PT43个。
1.2数据分析 本研究采用比例失衡法进行信号分析,包括一种频数法:报告比值比法(reporting odds ratio,ROR)和一种贝叶斯法:信息成分法(information component,IC)。药物-事件信号算法基于比值失衡法的四格表(表1),信号检测阈值为:报告病例数≥3;ROR法双侧检验95%CI下限>1;IC法IC>0,且95%CI下限>0[8]。本研究定义当ROR法和IC法同时生成信号时确定为检出信号,提示ADC药物和PN类事件之间存在关联。

表1 比值失衡法的四格表
ROR=(a/c)/(b/d)
计数资料采用例数(构成比)描述、计量资料同时采用均数±标准差和中位数(四分位间距)描述。统计分析采用SPSS 20.0版软件和Microsoft Excel 2016版软件。
2 结果
2.1不良事件报告情况 经过数据清洗,共收集到不良事件报告10 810 921例,检索得到以8种ADC药物为PS药品的不良事件报告15 245例,ADC相关PN类事件报告935例,报告始于2011年。其中4种ADC药物(共912例)与PN事件检出信号,其所有事件报告数(目标事件报告数,构成比)分别为:BV 5 522例(576例,10.43%)、TDM-1 4471例(257例,5.75%)、PV 736例(63例,8.56%)和EV 270例(16例,5.93%)。另外4种ADC药物(共23例)GO(11例)、IO(7例)、TD(4例)和SG(1例)未检出信号。报告基本信息见表2。

表2 4种ADC药物相关PN事件报告基本信息
本研究中的4种ADC药物报告适应证情况如下:BV报告有明确适应证489例(84.90%),其中霍奇金淋巴瘤369例(64.06%)、间变性大细胞淋巴瘤70例(12.15%)、非霍奇金淋巴瘤35例(6.08%)以及蕈样真菌病15例(2.60%);TDM-1报告适应证为乳腺癌212例(82.49%),其中注明HER2 阳性乳腺癌79例(30.74%)、局部晚期或转移性乳腺癌65例(25.29%);PV报告有明确适应证59例(93.65%),确定分型为难治性弥漫大B细胞淋巴瘤56例(88.89%);EV适应证报告明确10例(62.50%),其中转移性尿路上皮癌7例(43.75%)、膀胱癌3例(18.75%)。
2.2SMQ信号检测结果 经ROR法和IC法信号检验,8种ADC药物中的4种检出与周围神经病类事件存在关联,涉及报告病例912例(表3),其中关联性强度依次为BV、PV、EV和TMD-1。

表3 4种ADC药物相关PN类事件SMQ信号检测结果
2.3PT信号检测结果 进一步基于各报告不良事件名称,即PT,进行不良事件信号检测,共检出以下4种ADC药物的7种PT信号(表4),4种ADC分别为BV 368例(63.89%)、TDM-1 196例(76.26%)、PV 31例(49.21%)、EV 13例(81.25%)。其中PN事件报告病例数最多,其次为多发神经病和外周感觉神经病。

表4 4种ADC药物相关PN类事件PT信号检测结果
2.4药物使用剂量分析 本研究报告232例有详细日剂量数据,4种ADC药物中位日剂量与其各自说明书推荐剂量一致;BV、TDM-1、EV平均日剂量均低于说明书推荐剂量;PV平均日剂量稍高于推荐剂量,但有1 例给药剂量4.34 mg·kg-1·d-1报告,见表5。

表5 PN类事件中4种ADC药物使用剂量分析
2.5不良事件发生时间分析 对筛检信号阳性的4种ADC药物相关PN类事件的发生时间进行分析。结果显示,BV、PV和EV用药首日事件发生数占总例数≥20%;BV、TDM-1和PV发生PN类事件中位时间在1~3个给药疗程(21~63 d)之间(表6)。

表6 4种ADC药物相关PN类事件发生时间情况
2.6不良事件结局分析 为确定ADC药物使用发生PN类事件的患者预后,对同一患者报告的多个事件结果选取最严重作为最后结果(图1)。4种ADC药物相关死亡报告病例为BV86例(15.81%),TDM-1 11例(5.21%),PV6例(9.68%)。
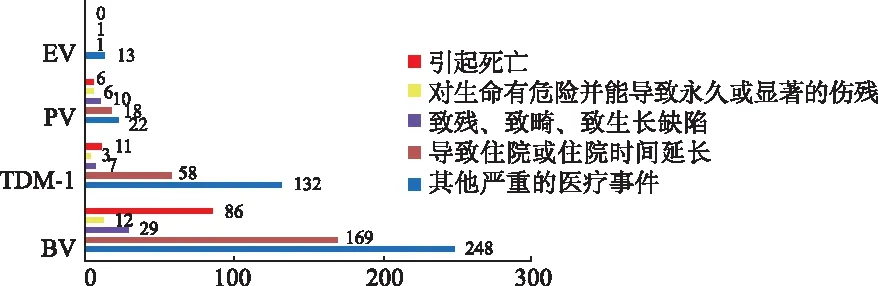
图1 4种ADCs相关PN类事件结局
3 讨论
3.1报告病例信息 本研究共纳入8种已获批上市的ADC药物进行研究,其中EV、TDM-1、PV和EV检出阳性信号。BV和PV纳入研究的主要适应证分别为霍奇金淋巴瘤与难治性弥漫大B细胞淋巴瘤,符合药品说明书批准的适应证;使用以上两种药物的患者性别比例接近1:1,无明显性别差异。TDM-1报告的适应证大部分为HER2阳性乳腺癌、局部晚期或转移性乳腺癌,女性患者数量明显多于男性,257例报告中男性患者仅4例。PV报告的半数以上适应证为晚期或转移性尿路上皮癌,报告结果里的16例患者均为男性。可见,本研究纳入的病例报告基本符合ADC药物的临床使用特征。
抗肿瘤药物为具有细胞毒性的高危药品,需要在医学专业人士指导下使用。从报告者角度分析,以健康专家报告为主既符合临床实际情况,也增加了不良事件报告的可信度。BV、TDM-1先后于2011年、2013年获得FDA批准上市,PV和EV均于2019年获得FDA批准上市,从年度不良事件报告数量可见,2018—2020年ADC相关PN报告超过60%,主要来源于美国,这与药物研发进程、临床适应证获得批准情况基本一致。自2010年以来,ADC药物不论是专利申请量还是进入临床试验的数量均快速增加,且在2019—2020年,经FDA批准上市的ADC数量较之前20年增加了1倍[9],随着越来越多的ADC药物投入临床应用,其安全性也值得持续关注。
3.2ADC与PN类事件 因FAERS数据库中的不良事件名称以MedDRA PT的方式记录,同一个不良事件可能存在多个意思相近的PT。为降低漏检率,本研究首先基于SMQ检索PN类事件,再基于所有纳入PT进行二次分析。最终4种ADC药物检出与PN类事件存在关联,并且从43个PN类事件相关PT中检出7个PT信号阳性,其中BV在7个PT中检出信号,TDM-1在3个PT中检出信号,PV在2个PT中检出信号,EV在1个PT中检出信号。
化疗所致周围神经病变(chemotherapy induced peripheral neuropathy,CIPN)是某些化疗药物的剂量限制性毒性[10],其中ADC药物中偶联的微管蛋白抑制剂亦是常见导致PN的化疗药物,但由于ADC高度个体化使用和广泛剂量范围,如对于中性粒细胞减少、肝肾功能损害等患者需进行剂量调整。ADC药物尚未确定用药频度(WHO-DDD值),主要原因是肿瘤疾病的类型和严重程度不同,以及广泛使用联合疗法,使用的剂量有所差别,说明书常规抗肿瘤方案推荐为每3周1次。本研究有明确剂量报告结果显示,4种ADC药物的中位日剂量与平均日剂量均与说明书推荐值相近,均在安全给药剂量范围。研究发现,BV、PV和EV用药首日就发生PN类不良事件,且事件例数占总例数≥20%。结果提示医师在制定初始治疗方案时,需选择适用于中国癌症患者CIPN评估工具进行有效评估[11]。
《抗体药物偶联物治疗恶性肿瘤临床应用专家共识(2020版)》提到,BV、TDM-1、PV和EV均有导致PN的风险,不同严重程度PN的发生率在不同报道中有所差异[3]。国内外有文献报道,使用BV的患者有33.3%发生非危重型PN[12];21.9%TDM-1用药患者出现任何级别的PN[13];使用PV患者有43.6%出现1或2级PN,大多数可自行缓解[14];EV可导致50%PN发生[15]。本研究报告的目标事件报告数在所有事件报告数中比例为:BV(10.43%)、TDM-1(5.75%)、PV(8.56%)和EV(5.93%)。另外,文献报道不良反应/事件结局较轻,以1或2级PN为主。本研究检出3种ADC药物相关PN类事件有死亡结局报告:BV 86例(15.81%)、TDM-1 11例(5.21%)、PV 6例(9.68%)。值得注意的是[16],本研究结果是病死率而不是发病率,因为本研究数据来自有不良事件的患者,而不是所有的药物使用者。此外,肿瘤患者的死亡结果与本身疾病进展亦有相关性。虽不排除肿瘤的疾病进展或其他药物因素,但对于有严重PN的患者,临床应用ADC药物时应更加警惕。
3.3研究局限 本研究对目前临床使用的8种ADC药物相关PN类事件进行信号分析,探索ADC药物在真实医疗环境应用的安全性。但本研究也存在一定局限性。首先,分析数据来源于药品不良事件自发呈报系统,可能存在漏报、错报、报告信息不全等问题,例如用药开始时间与不良事件发生时间信息缺失,对于判断用药与不良反应的出现有无合理的时间关系有一定影响。其次,部分ADC药物上市时间较短,报告数量有限,暂未检出信号,但不能排除与PN事件的相关性。最后,虽然本研究结果提示ADC药物与PN类事件有相关性,但限于研究设计,其因果关系仍需进一步研究证实。
综上所述,本研究首次对8种ADC药物相关PN类事件进行信号分析,结果显示BV、TDM-1、PV和EV和PN类事件存在关联,事件可在用药首日发生,亦可导致严重后果。因此,建议临床进行ADC治疗前先对患者进行PN评价,使用过程中加强监护,以促进ADC药物安全使用。

