桑葚花色苷提取物对乙醇诱导的小鼠肝损伤和死亡率的影响
除了限制饮酒外, 目前, 对于酒精性肝病(ALD)的治疗尚无特效药。 特别是进展到后期, 更多是采取对症治疗的方法。 肝脏作为酒精代谢的主要器官, 过量酒精摄入会给肝脏带来巨大负担, 选择一种安全有效副作用小的防治策略势在必行。 来自于食物中的生物活性成分有望成为防治酒精性肝病的潜在疗法。 矢车菊素-3-O-葡萄糖苷(Cy-3-G) 广泛存在于深色蔬菜及水果中, 是膳食花青素中最具代表性及含量最丰富的一种食物活性成分, 具有强效的抗炎、 抗氧化作用。 Cy-3-G 对非酒精性脂肪肝、 肥胖、 动脉粥样硬化及高血糖等代谢性疾病均具有保护作用
。 本课题组既往研究也发现, 在8w的酒精性肝炎及12w 的酒精性肝纤维化模型中, Cy-3-G补充可以改善高脂及酒精长期联合喂养导致的小鼠肝损伤
, 但是Cy-3-G 对于急性酒精性肝损伤的保护作用仍不明确。 本研究通过构建短期及长期NIAAA 模型(又称Gao-Binge 模型) 来全面探讨桑葚花色苷提取物Cy-3-G 对短期或长期过量饮酒小鼠的健康保护效应, 为酒精性肝病的防治提供一个新思路。 此模型将慢性乙醇喂养与单次或多次大剂量乙醇灌胃相结合, 更好的模仿了大多数酒精性肝病患者的饮酒模式, 也是目前研究酒精性肝病较为公认且应用较广泛的动物模型。
1 材料与方法
1.1 试剂
Cy-3-G, 从桑葚中提取, 具体提取步骤参照[7];95%乙醇(中国, 阿拉丁); Lieber-DeCarli 标准型酒精液体饲料、 Lieber-DeCarli 对照液体饲料, 中国, 南通特洛菲; 总胆固醇(TC) 检测试剂盒, 中国, 普利来;天门冬氨酸氨基转移酶( AST) 、 丙氨酸氨基转移酶(ALT) 检测试剂盒, 中国, 南京建成; 内毒素检测鲎试剂盒(中国, 厦门鲎试剂); Trizol, 美国, Invitrogen;cDNA 合成试剂盒、 SYBR Green Supermix 试剂盒, 日本, Takara。
1.2 动物分组与造模
所有动物实验均获得中山大学动物伦理委员会批准(2012-0080)。 SPF 级4W 龄雄性C57BL/6J 小鼠购自广东省实验动物中心, 饲养于在中山大学公共卫生学院的SPF 级动物房。 环境温度维持在25℃, 每天接受照明时间为12 h。
1.2.1 短期NIAAA 模型 将8w 龄小鼠随机分为3 组:对照液体饲料喂养组(CTRL 组, n =8)、 酒精液体饲料喂养组(EtOH 组, n =8)、 酒精液体饲料喂养加Cy-3-G 干预(EtOH+Cy-3-G 组, n =8)。 EtOH 组和EtOH+Cy-3-G 组给予Lieber-DeCarli 标准型酒精液体模型饲料(5%
乙醇), CTRL 组给予Lieber-DeCarli 对照液体饲料
。 使用液体饲料喂养3 组小鼠10d; 并于第11天清晨对EtOH 组和EtOH +Cy-3-G 组给予一次大剂量乙醇(5 g/kg BW) 灌胃, CTRL 组给予等热量麦芽糊精灌胃, 8 h 后处死。 Cy-3-G 每天以200 mg/kg BW 进行灌胃, EtOH 组和CTRL 组用等体积生理盐水进行灌胃。各组小鼠干预期间实行等热量喂养, 依据EtOH 组进食情况来控制CTRL 组饲料给予量。
1.2.2 长期NIAAA 模型 将8w 龄小鼠随机分为3 组:对照液体饲料喂养组(CTRL 组, n =9)、 酒精液体饲料喂养组(EtOH 组, n =12)、 酒精液体饲料喂养加Cy-3-G 干预(EtOH+Cy-3-G 组, n =12)。 EtOH 组和EtOH+Cy-3-G 组提供Lieber-DeCarli 标准型酒精液体模型饲料(5%
乙醇), CTRL 组给予Lieber-DeCarli 对照液体饲料
。 使用液体饲料喂养3 组小鼠共4w, 并于第7、 14、 21、 28 天清晨对EtOH 组和EtOH+Cy-3-G 组给予一次大剂量乙醇(5 g/kg BW) 灌胃, CTRL 组以灌胃方式给予等热量麦芽糊精, 并于第28 天大剂量乙醇灌胃8h 后处死小鼠。 Cy-3-G 每天以200 mg/kg BW 通过灌胃方式给予EtOH+Cy-3-G 组小鼠, EtOH 组和CTRL 组小鼠用等体积生理盐水进行灌胃。 各组小鼠干预期间实行等热量喂养, 依据EtOH 组进食情况控制CTRL 组饲料给予量。
1.3 肝脏切片H&E 染色
本研究通过综合应用短期和长期NIAAA 酒精模型来探讨Cy-3-G 对乙醇诱导的小鼠酒精性肝损伤及死亡率的影响, 结果发现, 补充Cy-3-G 可缓解短期过量乙醇摄入引起的小鼠肝脏脂肪变性及肝功能损伤, 减轻肝脏炎症反应, 并且可以有效预防长期过量乙醇摄入导致的小鼠死亡, 保护小鼠健康。
1.4 肝脏总胆固醇(TC) 检测
小鼠使用戊巴比妥钠麻醉后, 经眼眶取血, 对小鼠实施脱臼处死后进行解剖, 收集肝脏样本, 分装并保存于-80℃冰箱中。 取分装好的肝脏约30 mg, 按1 mg 组织20 μL 组织裂解液的比例加入试剂盒提供的专用裂解液,使用高通量组织研磨仪制备肝匀浆。 取肝匀浆严格按照普利来试剂说明对肝脏甘油三酯(TG)、 总胆固醇(TC) 进行检测。
1.5 血清天冬氨酸转氨酶(AST)、 丙氨酸转氨酶(ALT) 检测
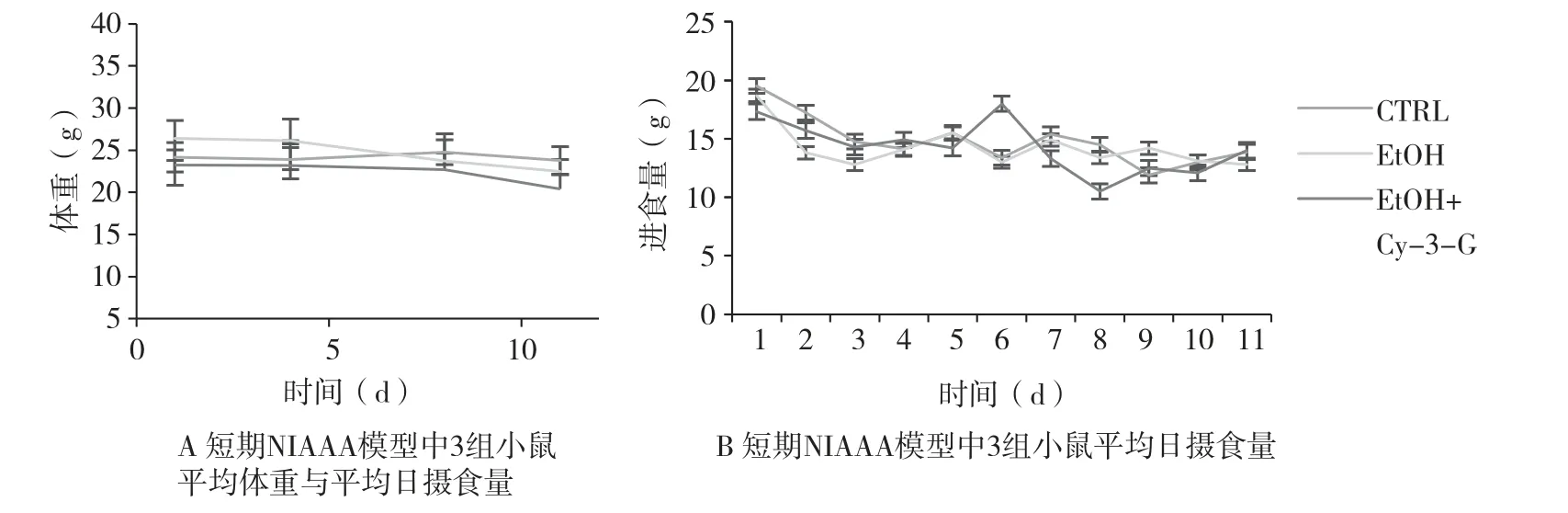
在11d 的短期NIAAA 模型中, 3 组小鼠的平均体重与平均日摄食量在喂养期间没有统计学差异(
>0.05)(图1A、 B), 表明实验过程中在3 组小鼠间严格执行了等热量喂养。
1.6 血清内毒素(LPS) 检测
小鼠用戊巴比妥钠麻醉后, 经眼眶取血, 用无菌EP 管收集血液, 室温放置1 h 后于4 ℃, 3 000 r/min 条件下离心30 min, 取上清进行检测。 具体检测步骤严格按照厦门鲎试剂内毒素检测鲎试剂盒说明进行操作。
1.7 肝脏炎症因子检测
血清中ALT 和AST 活性是反映肝功能的可靠性指标, 在正常情况下, ALT 和AST 主要分布在肝细胞的线粒体中。 当受到外源性毒物的损害时, 这两种转氨酶会透过受损的肝细胞膜进入血液, 引起血清酶水平的升高
。 本实验中血清ALT 和AST 水平增加提示肝功能受损。 然而, 补充Cy-3-G 可以预防乙醇喂养引起的肝脏脂质蓄积及血清ALT 和AST 水平升高, 有效改善肝功能。 Cy-3-G 对于肝脏的保护作用在既往研究中已有报道, 其可以减轻高脂膳食诱导的小鼠肝脏氧化应激和脂肪变性, 预防非酒精性脂肪肝的发生
。

1.8 统计分析
这节课的主题是“WHAT MAKES A GOOD QUESTION?”(怎样能提出一个好问题?)。问题一出,同行的老师禁不住悄悄问:“这是历史课吗?”这时,老师假设情境:假如你遇到一位多年前来自中国的移民,你想问他些什么问题?什么样的问题是一个好问题?老师要求每个学生写出五个问题。写完后,两三人一组交流,再进行班级交流,学生踊跃举手发言。至此,我们才反应过来,原来这位老师是把历史知识当成了问题探究的素材,我们不禁暗自叫好。
2 结果与分析
2.1 短期NIAAA 模型中3 组小鼠体重及日摄食量
小鼠用戊巴比妥钠麻醉后, 经眼眶取血, 用无菌EP 管收集血液, 室温放置1 h 后于4 ℃, 3 000 r/min 条件下离心30 min, 取上清严格按照南京建成试剂盒说明对血清中天冬氨酸转氨酶(AST)、 丙氨酸转氨酶(ALT) 的活性进行检测。
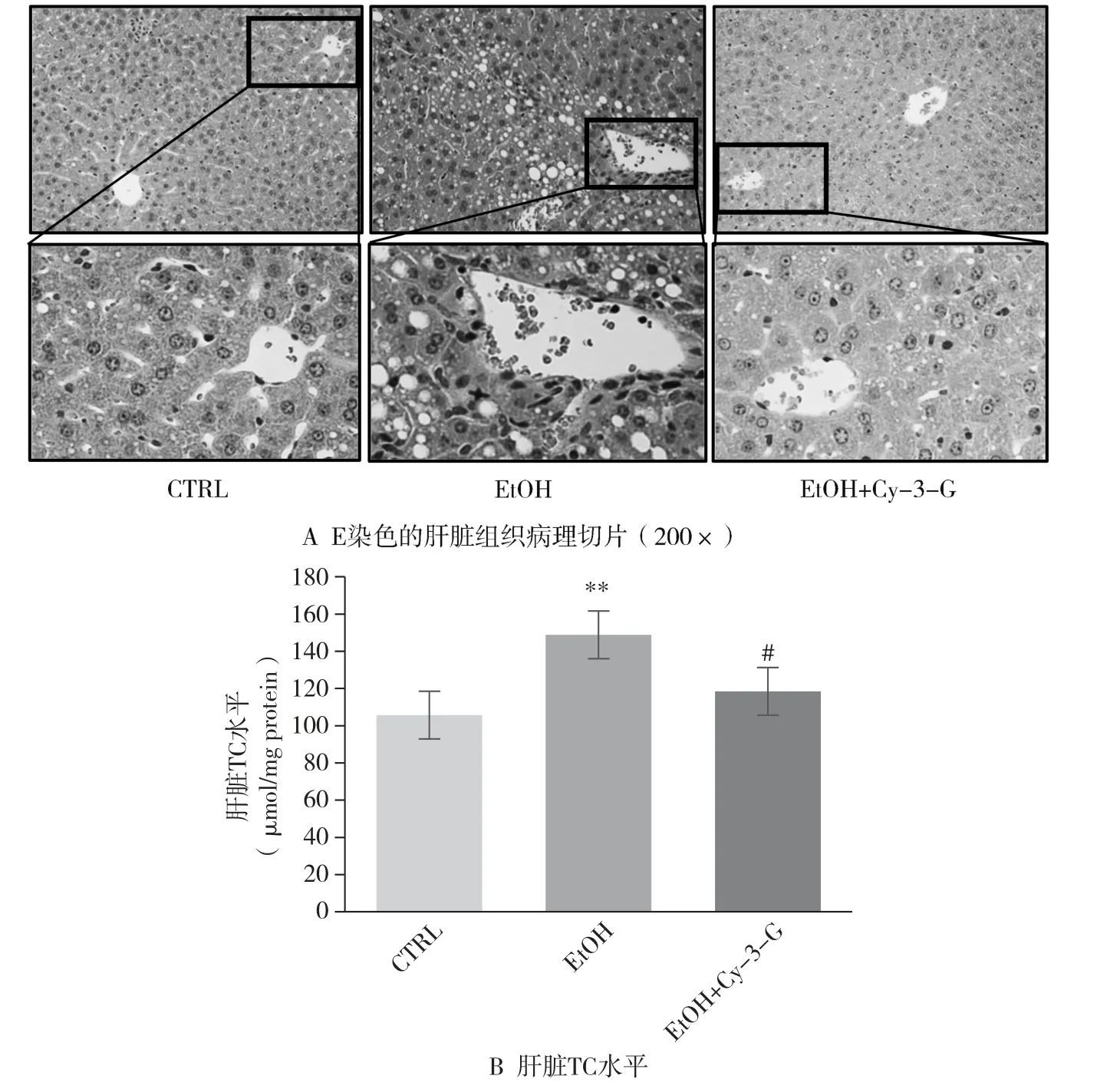
2.2 短期NIAAA 模型中Cy-3-G 对小鼠肝脏组织的影响
肝脏组织病理切片的H&E 染色结果显示, 与CTRL组相比, EtOH 组小鼠的肝细胞表现出弥漫性脂肪变,内部可见大小不等、 数量不一的脂滴, 并且肝细胞排列紊乱、 肝索纹理不清, 肝脏出现明显的炎性细胞浸润;而EtOH+Cy-3-G 组肝细胞内脂滴数量显著减少, 肝索纹理清晰呈放射状排列, 肝脏炎性细胞浸润明显减轻,与CTRL 组结构类似(图2A)。 进一步对肝脏总胆固醇(TC) 水平进行检测, 结果显示, 同CTRL 组比, EtOH组小鼠肝脏TC 水平升高(
<0.01), 而EtOH+Cy-3-G组肝脏TC 水平较EtOH 组降低(
<0.05) (图2B),表明补充Cy-3-G 对短期过量乙醇摄入引起的酒精性脂肪肝具有保护作用。
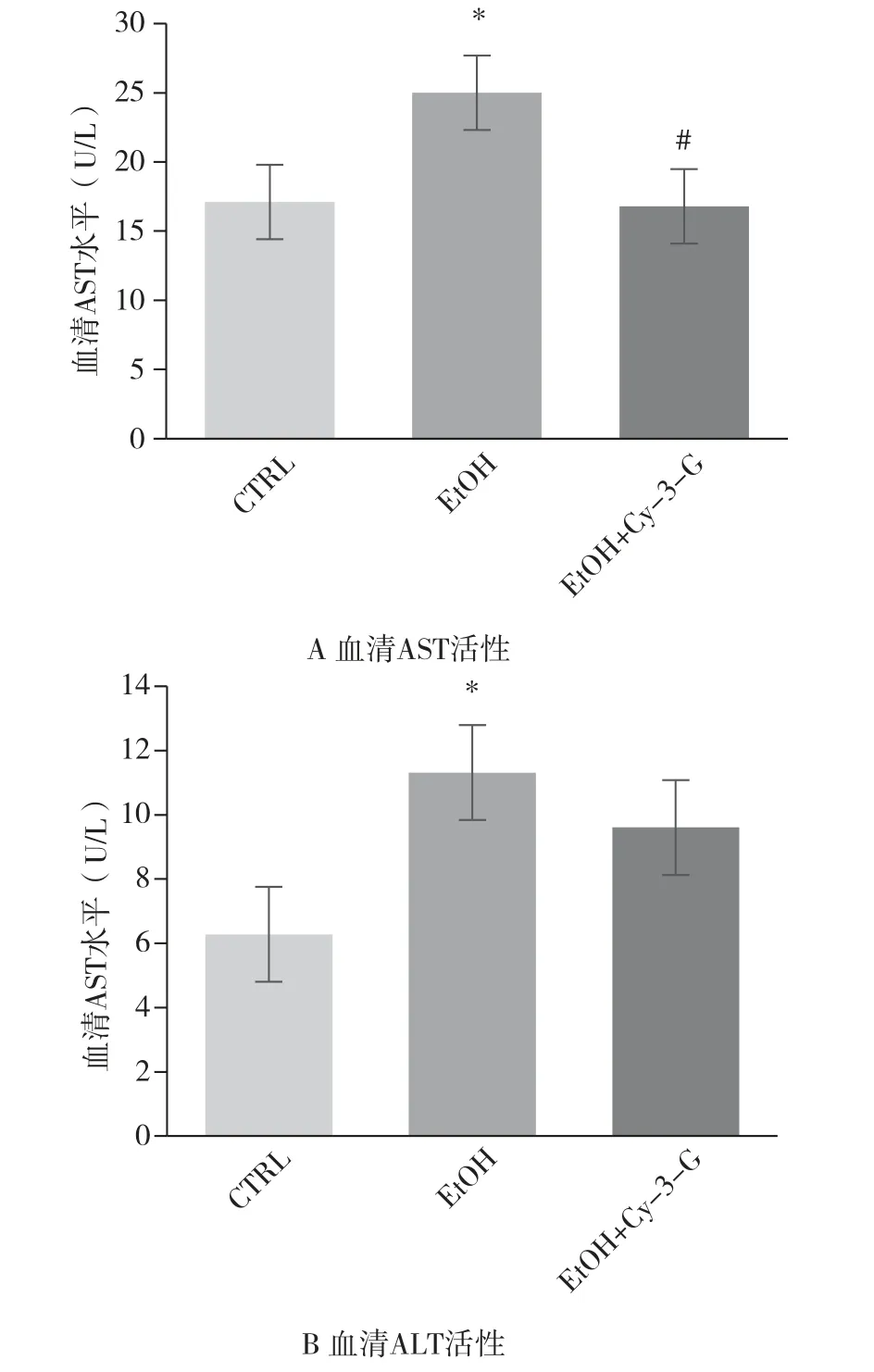
2.3 短期NIAAA 模型中Cy-3-G 对小鼠血清中AST、ALT 活性的影响
EtOH 组小鼠血清中AST 活性高于CTRL 组(
<0.05), 而EtOH+Cy-3-G 组血清中AST 活性较EtOH 组降低(
<0.01) (图3A)。 同样, 乙醇喂养使得小鼠血清中ALT 活性增加(
<0.05), 而Cy-3-G 有预防乙醇喂养引起的血清ALT 活性增加的趋势, 但差异无统计学意义(
>0.05) (图3B)。 以上结果提示, 补充Cy-3-G在一定程度上可以预防急性酒精性肝功能损伤。
通过对歌词内容提问,让学生在脑子里初步形成感知。通过实践体验给每一位体验者大脑皮层留下深刻的印象。在体验中,学生心灵更加放松,感悟也会在大脑中越来越清晰。层层递进的问题引得学生对主题的感悟一步步深入、明晰。诗歌的跟进使班会达到了高潮,学生们内心燃起了共鸣,达到了老师预期的教育效果!
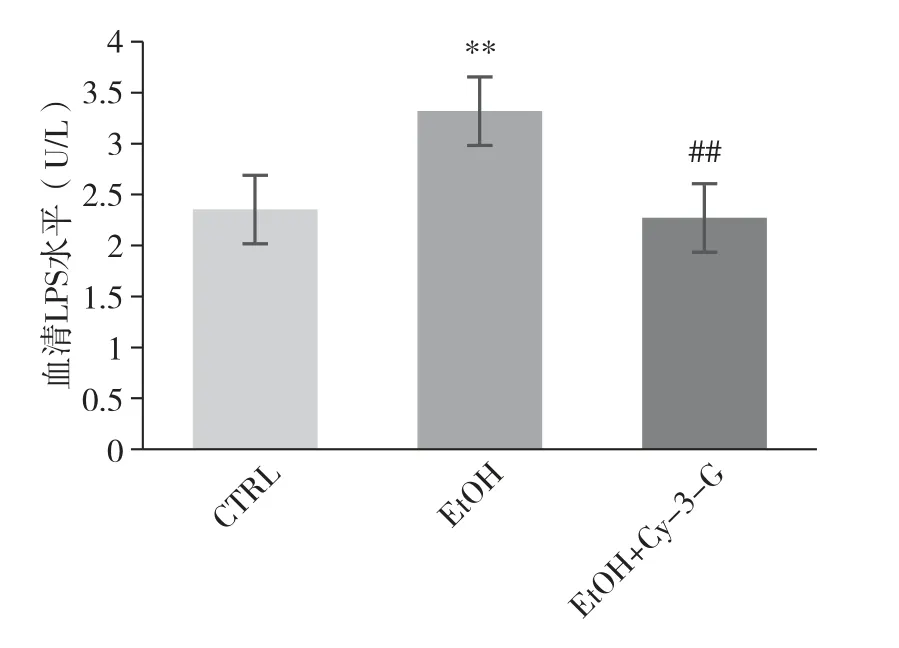
2.4 短期NIAAA 模型中Cy-3-G 对小鼠血清LPS 的影响
过量饮酒会引起肠道功能损伤, 一方面导致肠道菌群紊乱, 另一方面使得肠道通透性增加, 促使LPS 等菌群副产物透过肠道屏障进入门静脉, 加剧对肝脏的损伤
。 因此, 进一步对血清LPS 水平进行检测。 对比CTRL 组, EtOH 组小鼠血清LPS 水平升高(
<0.01),EtOH+Cy-3-G 组小鼠的血清LPS 水平较EtOH 组降低(
<0.01) (图4)。
随着恶性肿瘤治疗手段的不断发展,肿瘤患者的生存期逐渐延长,随之转移瘤的检出率也越来越高。据统计,约有20%~54%的恶性肿瘤会在疾病的演变过程中发生肺部转移[1]。因为肺存在庞大的毛细血管网且位于循环系统中枢,所以肺成为恶性肿瘤转移最常见的器官之一[2]。肺转移瘤发生转移的时间早晚不一,无规律可循。肺转移瘤是恶性肿瘤的晚期表现,外科治疗是否可以提高患者生存率及生活质量仍存在一定争议。本文回顾性分析2007年1月至2017年1月大连医科大学附属第一医院胸外科收治行肺转移瘤手术患者的临床资料,拟探讨肺转移瘤手术切除适应证及术式、肺转移瘤诊断、术后疗效及影响预后的相关因素。
对于航空制造业领域知识的分类,是通过对技术内容的概括及某些特征的概念进行逻辑分类和系统排列而构成,构建航空技术分类模型,为使用者提供设计准则、技术支持及决策依据,能够最大化利用航空制造业领域知识。对于航空技术多领域知识的分类,从航空技术的属性、用途、学科及主题着手,需要多层次多维度的进行分类归纳,构建描述预先定义好的属性、学科或概念的分类规则,按照航空制造业领域知识的适用范围和来源、原理和功能、描述对象等多个方向进行划分,建立如图1的航空制造业领域知识分类模型。
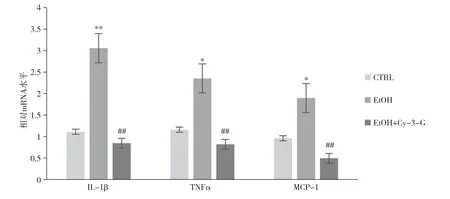
2.5 短期NIAAA 模型中Cy-3-G 对小鼠肝脏炎症因子的影响
LPS 与Toll 样受体4 (TLR4) 结合进一步激活Kupffer 细胞产生各种炎症因子和趋化因子, 引起肝脏炎症反应。 EtOH 组小鼠肝脏
1
、
、
1 mRNA水平较对照组明显升高(
<0.05), 而Cy-3-G 可以有效预防乙醇喂养引起的炎症因子
1
、
、
1 mRNA 水平的升高(
<0.05)。 图5 结果表明, Cy-3-G补充可以明显改善乙醇喂养引起的小鼠肝脏的炎症反应。
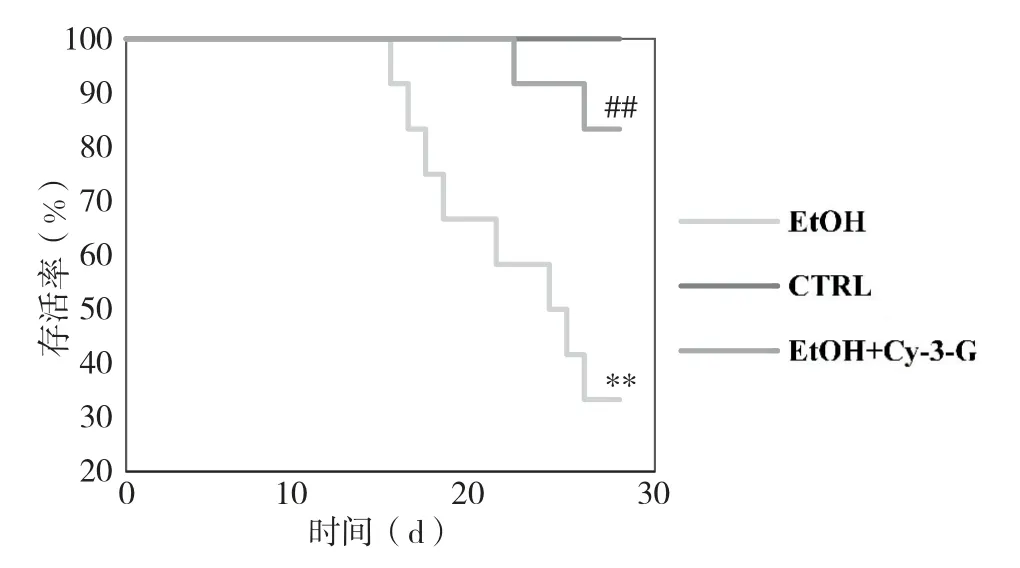
2.6 长期NIAAA 模型中Cy-3-G 对小鼠死亡率的影响
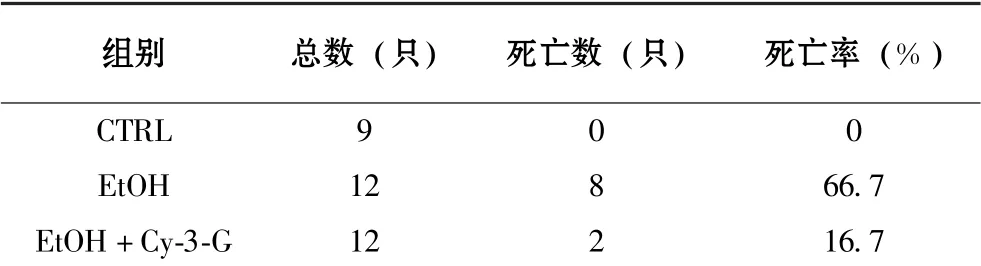
与CTRL 组相比, 长期过量乙醇摄入使得小鼠死亡率显著增加, 而EtOH+Cy-3-G 组小鼠的死亡率明显低于EtOH 组(表2)。 如图6 所示, 经log-rank 检验差异具有统计学意义(
<0.01)。 结果提示, 通过补充Cy-3-G 可以预防长期过量乙醇摄入导致的小鼠死亡。
怎么,竹韵结婚八年还是处女?此证一出,全场哗然,旁听席上的观众交头接耳议论起来,审判台上,包括原告、被告、审判人员都愕然了,过了好一会,审判长才说了声安静,接着宣布此鉴定有效,可以作为证据采信,请原告继续陈述。
3 讨论
小鼠使用戊巴比妥钠麻醉后, 脱臼处死, 解剖取肝脏组织, 切取一小块肝脏组织迅速放入装有4% 多聚甲醛的EP 管中, 室温保存。 对肝脏组织进行石蜡包埋后,切成5~8 μm 厚度均匀的薄片。 脱蜡后将切片浸泡入苏木素染液中3 ~8 min 对细胞核进行染色, 清水冲洗15min。 接下来将石蜡切片浸泡到伊红染液中1 ~3 min对细胞质进行染色, 清水冲洗15 min。 脱水处理后, 在通风橱中使用中性树胶进行封片。 使用显微镜进行切片观察并拍照保存。
使用GraphPad Prism 8.3.0 和SPSS 26.0 进行统计分析和绘图。 采用单因素方差分析分析各组间定量数据的统计差异。 使用卡方检验分析各组间定性数据的统计差异。 数据表示为均数±标准误,
<0.05 被认为具有统计学意义。
称取20 mg 肝脏, 使用Trizol 从肝脏中提取总RNA。对提取的总RNA 浓度及纯度进行检测后, 使用cDNA 合成试剂盒将1 μg RNA 逆转录为cDNA。 以
为内参, 采用SYBR Green Supermix 试剂盒配置反应体系进行实时荧光定量PCR, 检测白介素-1β (
1
)、 肿瘤坏死因子-α (
) 和巨噬细胞趋化蛋白-1 (
1)的相对表达量, 并使用比较阈值周期(ΔΔCt) 方法量化相对倍数变化。 实验所用引物见表1。
炎症反应在ALD 的发生发展过程中发挥重要作用,减轻肝脏炎症反应可以显著延缓ALD 进程。 Aditya等
发现, 使用cenicriviroc (CCR2/5 阻断剂) 对乙醇喂养小鼠进行干预, 可以抑制肝脏巨噬细胞浸润, 减轻炎症反应, 从而对酒精性肝损伤起到保护作用。 Jayachitra 等
认为, 柚皮苷通过降低促炎细胞因子表达减轻肝脏炎症反应对乙醇诱导的大鼠肝损伤起保护作用。Cy-3-G 作为花青素中最普遍且性质稳定的一种形式, 具有同花青素一样高效的抗炎、 抗氧化的作用
。 本课题组先前的研究中也有报道, 在8w 的高脂加乙醇诱导的小鼠酒精性肝炎模型中, Cy-3-G 可以抑制NLRP3 炎症小体活化和炎症细胞因子在肝脏中的表达
, 保护肝脏健康。 本研究结果也显示, Cy-3-G 补充显著改善了肝脏炎细胞浸润并降低促炎细胞因子
1
、
、
1 的表达, 减轻肝脏炎症。 结果表明, Cy-3-G 的保肝作用可能与其降低酒精喂养小鼠肝脏炎症水平有关。
越来越多的证据表明, 酒精性肝病的发病机制与肠-肝轴密切相关
。 饮酒会导致肠道菌群失调, 破坏肠道屏障, 从而导致LPS 透过肠道由门静脉到达肝脏
。 LPS 与TLR4 结合激活Kupffer 细胞产生各种促炎细胞因子和趋化因子, 例如
1
、
、
6、
8、 巨噬细胞趋化蛋白-1 (
1) 等, 促进ALD 的发生发展
。 研究发现, 通过补充益生菌或维生素D 可以减少酒精诱导的LPS 释放入血, 进而减缓ALD 的进程
。 因此, 保护肠道健康防止LPS 释放入血对预防肝损伤具有十分重要的意义。 Cy-3-G 对肠道菌群的调节和肠道屏障的保护作用在先前的研究中已有报道
。本实验中我们也观察到, 乙醇喂养使得小鼠血清中LPS水平增加, 而Cy-3-G 可以预防乙醇喂养引起的小鼠血清LPS 水平增加, 表明Cy-3-G 对酒精性肝损伤小鼠肠道功能损伤具有一定修复作用, 从而减少了LPS 的渗漏, 这可能是其减轻肝脏炎症反应改善肝功能的作用机制之一。
3.离子交换法。用无机或有机物组成一混合凝胶,形成交换剂核,四周包围两层不同电荷的双电层,水通过后可发生离子交换。阳离子交换剂:含H+、Na+固体与Ca2+、Mg2+交换;阴离子交换剂:含碱性基因,能与水中阴离子交换。经过离子交换后,硬水得到软化。
进一步使用4w 的长期NIAAA 模型构建更严重的酒精性肝损伤模型来进一步探讨Cy-3-G 的保护作用, 结果发现, 在长期NIAAA 模型中EtOH 组小鼠的死亡率明显增加。 这一现象与H.W.等
的研究结果一致。 然而Cy-3-G 补充可以有效预防长期乙醇摄入引起的小鼠死亡, 但其保护机制是否与肝损伤有关尚不可知。 因此,在未来, 我们将选择更合适的模型来进一步探讨Cy-3-G对长期过量乙醇摄入小鼠的肝损伤的影响。
本研究选用日常乙醇喂养加单次或多次大剂量乙醇灌胃的NIAAA 模型, 更好地模拟了大多数酒精性肝病患者的饮酒模式, 这些患者一般具有多年长期饮酒和近期过度饮酒的病史
, 并通过结合短期和长期模型来综合探讨Cy-3-G 对酒精性肝损伤和小鼠健康的保护作用。 本研究首次报道了Cy-3-G 能显著改善短期过量乙醇摄入引起的小鼠肝损伤并且可以有效预防长期过量乙醇摄入造成的小鼠死亡。 但本研究也存在一定的缺点,本研究观察到Cy-3-G 补充可以有效预防长期乙醇摄入引起的小鼠死亡, 但未进一步其相关机制进行探讨。
将该养殖场病死的5只羊全部解剖,发现5只羊身体严重消瘦,皮下脂肪消失,出现严重贫血症状;病死羊体内血液稀薄如水,呈现粉红色,但能正常凝固;肠系膜病变严重,高度充血水肿,肠系膜淋巴结外观呈现灰色,各个脏器普遍存在贫血症状;打开病死羊的真胃和小肠,发现内部存在长度1.5~3 cm的线虫,外观呈现淡红色;在病死羊的肠壁粘膜上,还能发现存在大量白色的结节,结节内部存在干酪状的物质。
综上所述, 桑葚花色苷提取物Cy-3-G 对短期过量乙醇摄入造成的小鼠肝损伤具有保护作用, 其保护机制可能是通过抑制LPS 释放从而减轻肝脏炎症反应实现的。 此外Cy-3-G 可以有效预防长期过量乙醇摄入导致的小鼠死亡。 研究结果提示, 桑葚花色苷提取物Cy-3-G有望作为膳食补充剂应用于防治酒精性健康损害。
[1]Wei X, Wang D, Yang Y, et al.Cyanidin-3-O-beta-glucoside improves obesity and triglyceride metabolism in KK-Ay mice by regulating lipoprotein lipase activity [J].J Sci Food Agric, 2011,91(6):1006-1013.
[2]Speciale A, Canali R, Chirafisi J, et al.Cyanidin-3-O-glucoside protection against TNF-alpha-induced endothelial dysfunction: involvement of nuclear factor-kappaB signaling[J].J Agric Food Chem, 2010,58(22):12048-12054.
[3]Valenti L, Riso P, Mazzocchi A, et al.Dietary anthocyanins as nutritional therapy for nonalcoholic fatty liver disease[J].Oxid Med Cell Longev, 2013,2013:145421.
[4]Jia Y, Wu C, Kim Y S, et al.A dietary anthocyanin cyanidin-3-O-glucoside binds to PPARs to regulate glucose metabolism and insulin sensitivity in mice [J].Commun Biol,2020,3(1):514.
[5]Zhou Y, Wang S, Wan T, et al.Cyanidin-3-O-beta-glucoside inactivates NLRP3 inflammasome and alleviates alcoholic steatohepatitis via SirT1/NF-kappaB signaling pathway [J].Free Radic Biol Med, 2020,160:334-341.
[6]Wan T, Wang S F, Ye M T, et al.Cyanidin-3-O-beta-glucoside protects against liver fibrosis induced by alcohol via regulating energy homeostasis and AMPK/autophagy signaling pathway [J].Journal Of Functional Foods, 2017,37:16-24.
[7]Guo H, Ling W, Wang Q, et al.Effect of anthocyanin-rich extract from black rice (
L.
) on hyperlipidemia and insulin resistance in fructose-fed rats [J].Plant Foods Hum Nutr, 2007,62(1):1-6.
[8]Bertola A, Mathews S, Ki S H, et al.Mouse model of chronic and binge ethanol feeding (the NIAAA model) [J].Nat Protoc, 2013,8(3):627-637.
[9]Meroni M, Longo M, Dongiovanni P.Alcohol or gut microbiota: Who is the guilty? [J].Int J Mol Sci, 2019,20(18):4568.
[10]Conigrave K M, Davies P, Haber P, et al.Traditional markers of excessive alcohol use [J].Addiction, 2003,98(Suppl 2):31-43.
[11]Li X, Shi Z, Zhu Y, et al.Cyanidin-3-O-glucoside improves non-alcoholic fatty liver disease by promoting PINK1-mediated mitophagy in mice [J].Br J Pharmacol, 2020,177(15):3591-3607.
[12]Ambade A, Lowe P, Kodys K, et al.Pharmacological inhibition of CCR2/5 signaling prevents and reverses alcoholinduced liver damage, steatosis, and inflammation in mice[J].Hepatology, 2019,69(3):1105-1121.
[13]Jayaraman J, Jesudoss V A, Menon V P, et al.Anti-inflammatory role of naringenin in rats with ethanol induced liver injury [J].Toxicol Mech Methods, 2012,22(7):568-576.
[14]Li X, Yao Z, Yang D, et al.Cyanidin-3-O-glucoside restores spermatogenic dysfunction in cadmium-exposed pubertal mice via histone ubiquitination and mitigating oxidative damage [J].J Hazard Mater, 2020,387:121706.
[15]Szabo G, Petrasek J.Gut-liver axis and sterile signals in the development of alcoholic liver disease [J].Alcohol Alcohol, 2017,52(4):414-424.
[16]Shao T, Zhao C, Li F, et al.Intestinal HIF-1alpha deletion exacerbates alcoholic liver disease by inducing intestinal dysbiosis and barrier dysfunction [J].J Hepatol, 2018,69(4):886-895.
[17]Rao R.Endotoxemia and gut barrier dysfunction in alcoholic liver disease [J].Hepatology, 2009,50(2):638-644.
[18]Tu Y, Zhu S, Wang J, et al.Natural compounds in the chemoprevention of alcoholic liver disease [J].Phytother Res, 2019,33(9):2192-2212.
[19]Robinson K E, Shah V H.Pathogenesis and pathways:nonalcoholic fatty liver disease & alcoholic liver disease [J].Transl Gastroenterol Hepatol, 2020,5:49.
[20]Szabo G.Gut-liver axis in alcoholic liver disease [J].Gastroenterology, 2015,148(1):30-36.
[21]韩建敏, 刘颖, 郭晓飞, 等.维生素D 对酒精暴露大鼠肝功能及肠道菌群的保护作用[J].营养学报, 2021,43(3):247-254.
[22]梁惠, 吕锐, 傅泳, 等.益生菌对大鼠酒精性肝损伤的保护作用及机制研究[J].中国药理学通报, 2016,32(7):991-997.
[23]Chen G, Wang G, Zhu C, et al.Effects of cyanidin-3-Oglucoside on 3-chloro-1, 2-propanediol induced intestinal microbiota dysbiosis in rats [J].Food Chem Toxicol,2019,133:110767.
[24]Tan J, Li Y, Hou D X, et al.The effects and mechanisms of Cyanidin-3-Glucoside and its phenolic metabolites in maintaining intestinal integrity [J].Antioxidants (Basel),2019,8(10):479.
[25]Li B, Cheng Z, Sun X, et al.
L.polyphenols alleviate oxidative stress-induced intestinal environment imbalance and lipopolysaccharide-induced liver injury in HFD-fed rats by regulating the Nrf2/HO-1/NQO1 and MAPK pathways [J].Mol Nutr Food Res, 2020,64(10):e1901315.
[26]Cheng Z, Si X, Tan H, et al.Cyanidin-3-O-glucoside and its phenolic metabolites ameliorate intestinal diseases via modulating intestinal mucosal immune system: potential mechanisms and therapeutic strategies [J].Crit Rev Food Sci Nutr, 2021:1-19.
[27]Bertola A, Mathews S, Ki S H, et al.Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J].Nat Protoc, 2013,8(3):627-637.
[28]Mathurin P, Lucey M R.Management of alcoholic hepatitis[J].J Hepatol, 2012,56(Suppl 1):S39-S45.
[29]Altamirano J, Bataller R.Alcoholic liver disease: pathogenesis and new targets for therapy [J].Nat Rev Gastroenterol Hepatol, 2011,8(9):491-501.

